Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
RNAi-aracılı Gene Nakavt ve
Bu Makalede
Özet
Bu protokolü biz bir ile RNAi-aracılı gen susturulması birleştirmek In vivo diürez testi sivrisinek sıvı atılımı vardır.
Özet
Bu video protokolü bir böcek belirli bir gen devirme ve atılım hızı ölçmek için yeni bir biyoassay yapmak için etkili bir teknik gösterilmiştir. Bu yöntem, böceklerin diürez işlemi daha iyi anlaşılmasını sağlamak için kullanılan ve tek bir kan unu sıvı büyük miktarlarda kadar alabilmesi için olan bir kan-besleme eklem bacaklıların in diürez çalışmada özellikle yararlıdır edilebilir.
In vivo diürez tayininde birlikte bu RNAi-aracılı gen Knockdown Aedes aegypti sivrisinek diürez 1 aquaporin genlerin RNAi aracılı Knockdown etkilerini incelemek için Hansen laboratuar tarafından geliştirilmiştir.
Protokol iki bölüm halinde kurulum: ilk gösteri basit bir sivrisinek enjeksiyon cihazı nasıl oluşturacağını ve RNAi-aracılı gen devirme için sivrisinek toraks içine dsRNA hazırlamak ve enjekte nasıl göstermektedir. İkinci gösteri nasıl belirleneceği gösterilmektedirin vivo biyoassay bir kullanarak sivrisinekler atılımı oranları.
Protokol
Bölüm I - yetişkin Aedes aegypti sivrisinekler RNAi-aracılı gen devirme. Deney genel bakış için Şekil 1'e bakınız.
1. dsRNA Sentezi
- Ilgi ve kontrol dsRNAs genler karşı spesifik dsRNAs sentezlerler. Not: 3 'özgü cDNA 2 sonu ve 5 de ekli T7 primer sekans ile' de uç (5'-GAC TAA TAC TCA CTA bulunan 300-500 baz çifti aralığında PCR parçaları için gelişmekte olan primerler önermektedir TAG GG-3 '). Parçalarının tekliği BLASTN analizi 3 tarafından teyit edilmelidir.
- DsRNA sentezlemek için transkripsiyon reaksiyonu için T7 RNA polimeraz kullanır Ambion Megascript T7 Yüksek Kapasiteli Transkripsiyon Seti (Ambion, reaktiflerin tablo) kullanın. Not: Benzer reaktifler ve kitler yerde mevcuttur.
- DsRNA arındırmak için, Megascript kiti ile yönergeleri izleyerek lityum klorür ile hızlandırabilir.
- Purificat sonraiyon, steril su içinde dsRNA pelet çözülür. Mikroenjeksiyon için yeterli viskozite sağlamak için, dsRNA konsantrasyonu 2 mg / ml geçmemelidir.
2. Enjeksiyon Hazırlık
- Basit bir mikro enjektör boruları, makas, metal bir iğne, bir 1 ml şırınga ve 1 ml'lik plastik pipet (bkz. Şekil 2) kullanılarak inşa edilebilir. Boru uzunluğu ~ 40 cm kesilmelidir. Alternatif olarak, bir otomatik mikro enjektör gibi Drummond Nanojet II 4 olarak kullanılabilir.
- 2 ml ölçek işaretine şırınga ucu (iğne hub) kesin ve piston gelen lastik pistonu kaldırın.
- Lastik pistonu ve yerine geri iğne hub kauçuk piston kafasına metal bir iğne kullanarak Punch bir delik.
- Tüpün her bir ucunda bulunan iğne göbeği yerleştirin ve ağız parçası (alternatif olarak, bir 10 ml sy olarak kullanılacak diğer ucu bir 1 ml plastik bir pipet ucu, yerleştirmekRinge) enjeksiyon için gerekli hava basıncı üretmek için kullanılabilir.
- Lastik pistonu deliğe bir cam kılcal iğne yerleştirin ve genişliği sıvı akmaya için yeterince büyük olduğunu bu nedenle iğne ucunu kırın. Not: iğne ucu optimal büyüklüğü ampirik olarak belirlenmelidir - iğne genişliği çok küçük ise iğne genişliği bu travma ve yüksek bir sivrisinek ölüm oranı ile sonuçlanacaktır çok büyük ise, bu nüfuz mümkün olacak sivrisinek dış iskelet.
- Hazırlanan dsRNA numunedeki Submerge enjeksiyon iğne ve ağız parçası (ya da bir şırınga) ile sıvı kadar emerek bir iğne içine sıvı numune çizer. Not: Bu aşama (bkz. aşağıda) in vivo test protokolü diürez içinde kullanılan PBS tamponu, dahil olmak üzere, sivrisinekler içine enjekte edilir tüm sıvı reaktifler için aynıdır.
3. Sivrisinekler toplayın ve uyuştur
- Collecbir koleksiyon şişeye bir pille çalışan aspiratör ile t sivrisinekler. Toplama flakon üzerinde bir kap koyun ve sivrisinek uyutmak için temiz bir CO 2 ped şişe yerleştirin. Not: Alternatif sivrisinekler buz üzerinde anestezi olabilir.
4. Sivrisinek Enjeksiyon
- Toplama flakon açın ve doğrudan CO 2 pad üzerinde sivrisinekler yerleştirin ve sivrisinek anestezi kadar bekleyin.
- Bütün erkek atın.
- Enjeksiyon için daha kolay erişim için izin tarafında sivrisinek hizaya.
- Yaralanmayı önlemek için bacak veya kanat tarafından sivrisinekler tut. Ayrıca ince bir fırça veya sivrisinek işlemek için tüy kullanabilirsiniz.
- Ilk sivrisinek enjekte Hazır olduğunda, yavaşça forseps ile toraks bir tarafı desteklemek ve toraksın diğer tarafında (Şekil 2) içine iğne ucu takın. Bu kütikül ince bir bölümünü içine enjekte ve iğne bastırıyor önlemek için daha iyidirtoraks içine derin o.
- Iğne yerleştirildikten sonra, sivrisineğin içine sıvı darbe. İstenen miktar, iğne içindeki sıvının menisküs gözlenerek belirlenebilir. Belirli bir birim için gerekli milimetre numarası cam kılcal iğne (πr 2 saat) ve silindir hesaplayarak hacmi tespit edilebilir. Tipik olarak enjeksiyon için kullanılan dsRNA arasında etkili bir miktarda 1 ug olup.
- Sıvı sivrisinek enjekte edildikten sonra, iğne dikkatli bir şekilde geri çekilmesi. Göğüs dış kısmında büyük bir sıvı damla formları halinde, sivrisinek atılmalıdır. Ardından, sonraki sivrisinek ile bu işlemi tekrarlayın.
5.. Sivrisinek Kurtarma ve Depolama
- Enjeksiyon sonrası, depolama için bir konteyner içinde sivrisinekler yerleştirin. Örneğin, bir bira bardağı balmumu örgü karton kapak ile emniyete kaplama ile karton bardak (fincan çorba) dizildi. Kapak maruz kapsayan mesh için biçilmiş kaftan bir paya sahiptir. Bir kez tüm mosquitoes kaba konur, kuluçka için çevresel olarak kontrollü bir odaya kap ve bu tür örgü kaplama üstüne yerleştirilir% 20 sukroz batırılmış pamuk topları gibi bir besin kaynağı ile sivrisinekler sağlamaktır. In vivo diürez tayininde gerçekleştirmeden önce, her sivrisinek hidrasyon durumunu standardize etmek için 12 saat için bir su kaynağının dsRNA enjeksiyonlu sivrisinekler mahrum.
- DsRNA-aracılı gen demonte bir verimlilik değişken olabilir. Gen suskunluğu enjeksiyon sonrası 1 gün başlayabilir ve enjeksiyon 4 sonra 6 gün öncesine kadar son verebilir. Maksimum geni elde etmek için portatif Optimal süre kullanılan her gen için deneysel olarak tespit edilmelidir. Biz devam etmeden önce Genel olarak, biz dsRNA enjeksiyonundan sonra 3 gün bekleyin.
Bölüm II - vivo diürez deneyde yetişkin Aedes aegypti sivrisinekler
Not: Bu protokol yazarlar tarafından geliştirilmiş vesarı humma da sivrisinek aquaporin proteinlerin RNAi aracılı devirme için kullanılan aegypti 1 Aedes. Bireysel sivrisinekler arasındaki değişkenliği önlemek için, sivrisinek gruplar olarak analiz edilmelidir. Teknik nedenlerden dolayı, biz tedavi başına 5 sivrisinek grupları tavsiye - sivrisinekler enjeksiyonundan sonra idrar salgılanmasını başlamadan önce ilk ağırlık ölçümü gerçekleştirmek için zaman sınırlı bir miktarda bulunmaktadır.
6. Sivrisinekler toplayın ve uyuştur
- Sivrisinekler toplama önce, analitik bir hassas terazi kullanılarak bir kap ile boş bir koleksiyon şişe ağırlığı kaydetmek. Bu, daha sonraki tüm şişeye ölçümler için kullanılacaktır.
- Bir aspiratör ile tartılır toplama şişeye 5 dişi sivrisinekler toplayın. Toplama flakon üzerine kap yerleştirin ve sivrisinek uyutmak için birkaç saniye için CO 2 pad üzerinde bekletin.
7. İlk Ağırlık Ölçüm
- T alhassas dengesi kapaklı sivrisinekler içeren koleksiyon şişe koyarak 5 sivrisineklerin o başlangıç ağırlığı ölçümü.
- Sivrisineklerin ağırlığı ve kap ile birlikte şişeye toplama alarak ve kap ile boş bir koleksiyon şişeden ağırlığı çıkarılarak 5 sivrisineklerin grubunun kilo hesaplamak.
- Toplama flakon açın ve sivrisinek ağırlığı kaydettikten sonra doğrudan CO 2 pad üzerinde sivrisinekler yerleştirin. Sivrisinekler kilo ölçümleri sırasında uyanmaya başlıyor, bu açılış ve pad üzerine sivrisinekler yerleştirmeden önce birkaç saniye CO 2 ped şişe ayarlayın.
8. Enjeksiyon Hazırlık
- RNAi-aracılı gen Knockdown protokolü verilen talimatları izleyerek mikro enjektör ayarlayın.
- Mikro enjektör bir cam kılcal iğne yerleştirin ve iğne ucu koptu ve böylece genişlik sıvının yetecek kadar büyükakmasına uid.
- Batmak PBS tamponu iğne ve enjeksiyon iğnesi içine tampon çekmek, bu protokolü kullanmak için istenilen miktarda her sivrisinek için PBS 1.25 ul olduğunu. Not: Bu tutar, bir dişi sivrisineğin 5 tarafından alınır kan plazması ortalama miktarı taklit eder.
9. Sivrisinek Enjeksiyon
- Mikro enjektör ile daha kolay erişim sağlamak için sivrisinek hizaya.
- Iğne yerleştirildikten sonra, sivrisineğin içine PBS tamponu darbe.
- Sıvı sivrisinek içine enjekte edildiğinde, bir damlacık göğüs dışına oluşturabilir. Bu damlacık dikkatle sonraki adım önce çıkarılması gerekiyor.
- Sonraki sivrisinek bu enjeksiyon işlemi tekrarlayın. Deneyimi ile, sivrisinek yaşama oranı enjeksiyonundan sonra neredeyse% 100 olacaktır.
10. Tartım Sivrisinekler
- Enjeksiyonundan sonra yavaşça toplama şişe içinde sivrisinekler yerleştirmekve kap. Hassas dengesi kapaklı sivrisinekler içeren koleksiyon şişe koyarak 5 sivrisinek ilk ağırlık ölçümü atın.
- Kapaklı sivrisinekler ve toplama şişeden ağırlığı alarak 5 sivrisineklerin grubu ağırlığı hesaplanabilir ve kap ile boş bir koleksiyon şişeden ağırlığı çıkartılır. Not: sivrisinekler CO 2 anestezi pad çıkarıldıktan sonra 2 dakika içinde idrar salgılamaya başlar, bu yüzden onlar salgılanmasını başlamadan önce kilo ölçümü almak önemlidir.
- Bunlar idrar salgılamaya başlar küçük bir kapta sivrisinek yerleştirin.
11. İkinci ve sonraki Ağırlık Ölçümleri
Not: sivrisinek Ağırlık ölçümleri 30 dakikalık aralıklarla alınmalıdır, ama bu atılımı oranlarına bağlı olarak kısa veya daha uzun aralıklarla ayarlanabilir.
- 30 dakika sonra, grou toplamakkap ile aynı toplama şişeye bir aspiratör ile 5 sivrisinek s. Hassas dengesi kapaklı sivrisinekler içeren koleksiyon şişe yerleştirerek sivrisinek sonraki ağırlık ölçümü alın.
- Ölçümünden sonra, bir sonraki 30 dakika için aynı tutma kabı olarak sivrisinekler yerleştirin.
- Bir zaman istenilen miktar için bu işlemi tekrarlayın.
12. Belirlenmesi Sivrisinek Boşaltım Oranı
- 5 sivrisineklerin grubu içine enjekte edildi sıvının miktarı hemen enjeksiyonundan sonra ağırlığı sivrisineklerin başlangıç ağırlık çıkarılması ile hesaplanır.
- , Belirli bir zaman noktasında sivrisineklerin grup tarafından salgılanan edildi idrar miktarı belirli bir zaman noktasında sivrisineklerin ağırlığından sivrisineklerin başlangıç ağırlık çıkarılarak hesaplanabilir.
- Belirli bir zaman noktasında atılım hızı divi hesaplanabilirSıvı enjekte edilen (Tablo 1) toplam miktarı, bu zaman noktasında atılır idrar ding miktarı.
13. Temsilcisi Sonuçlar
Gen Knockdown RNAi-aracılı ve in vivo diürez tayininde Aedes aegypti sivrisinek diürez su kanallarının etkilerini incelemek amacıyla Hansen laboratuvar tarafından kullanılmıştır. Aedes aegypti Malpighi tüpleri tübüllerinde ifade Üç su kanallarının sivrisinekler 1 kontrole göre atılımı oranları üzerinde önemli etkileri olan nakavt edildi. Şekil 4 diürez testi Aedes aegypti ve Culex quinquefasciatus arasındaki atılımı oranlarını karşılaştırmak için kullanılan bir denemeyi temsilcisi sonuçlarını gösterir farklı sıcaklıklarda.
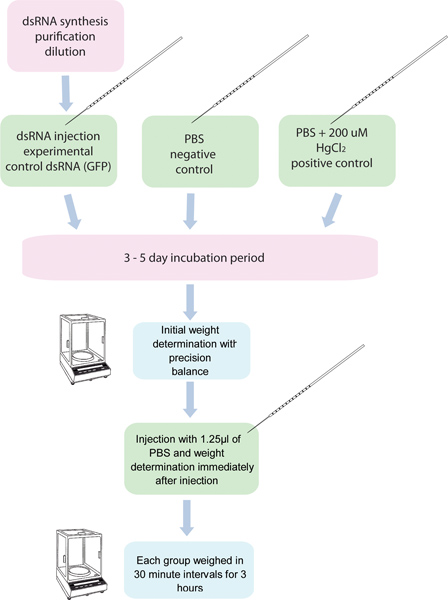
Şekil 1.. 10 sivrisinekler ea RNAi / diürez testinin Akış Şeması. 5 grupch belirli bir gen için dsRNA ile enjekte edilir ve on sivrisinek başka beş gruba kontrolü dsRNA ile enjekte edilir. PBS ile 200 uM HgCl 2 enjekte sivrisineklerin başka bir grubu, bir pozitif kontrol olarak kullanılmıştır. Bunlar, sivrisinekler enjeksiyon öncesinde ve 3 saat boyunca otuz dakikalık aralıklarla enjeksiyonundan sonra tartılır.
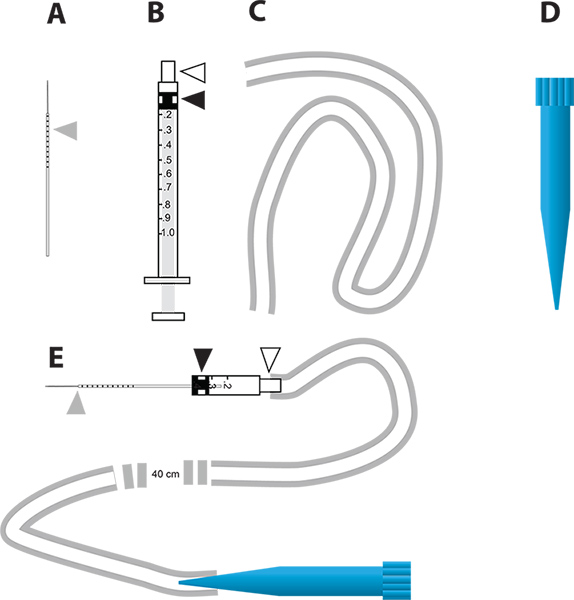
Şekil 2. RNAi-aracılı gen demonte ve in vivo diürez deneyde basit bir mikro püskürtme cihazı. A. Cam kılcal iğneler enjeksiyon için kullanılır. Gri üçgen sivrisinek içine sıvı enjekte miktarını belirtmek için iğne çizilen milimetre artışlarla temsil eder. B. 1 ml şırınga mikro enjektör oluşturmak için kullanılır. Beyaz üçgen iğne merkezi temsil eder ve siyah üçgen şırınga içinde piston bağlı lastik piston başını temsil eder. C. hortuma ağızlığın bağlamak için kullanılmaktadırenjektör. Mikroenjeksiyon cihazın ağızlık olarak kullanılır D. 1 ml pipet ucu (mavi ucu). E. AD parçaları birleştirir mikroenjeksiyon aygıtı. büyük rakam görmek için buraya tıklayın .
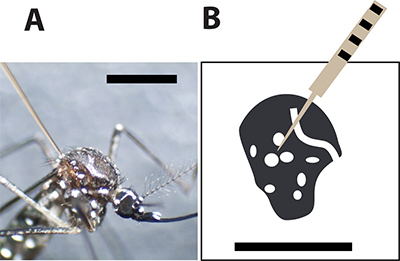
Şekil 3. Optimal sivrisinek enjeksiyon yerinde. A. Kadın Aedes aegypti sivrisinek göğüs büyük ölçekler arasında bir cam kılcal iğne ile enjekte. Siyah çubuk boyutu karşılaştırma için 1 mm gösterir. Dişi sivrisineğin toraks bir çizim B. ve beyaz noktalar sivrisinek Exoskeleton beyaz ölçekleri temsil eder. Enjeksiyon iğnesi delip noktalar arasında sivrisinek enjeksiyon sırasında ölüm oranını minimize etmek gerekir.
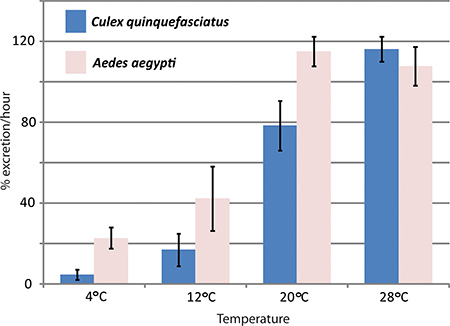
Şekil 4. Tempera EtkileriCulex quinquefasciatus ve Aedes aegypti diürez üzerine Ture. diürez assay farklı sıcaklıklarda, sivrisinekler, Aedes aegypti ve Culex quinquefasciatus iki türü ile gerçekleştirildi. Enjeksiyon sonrası ilk bir saat içinde atılım oranı yüzde olarak verilmiştir.
| Grup | TARA (G) | enjekte değil (G) | enjeksiyon sonrası (G) | 1s sonrası enjeksiyon (G) | ortalama ağırlığı (mg) | miktarda enjekte (Ul) | miktarda atılır (Ul) | % Atılır |
| 1 | 7.5938 | 7.6057 | 7.6104 | 7.6096 | 2.38 | 0.94 | 0.16 | 17.0 |
| 2 | 7.8252 | 7.8349 | 7.8415 | 7.8403 | 1.94 | 1.32 | 0.24 | 18.2 |
| 3 | 7.8896 | 7.9026 | 7.9077 | 7.906 | 2.6 | 1.02 | 0.34 | 33.3 |
In vivo diürez test sonuçları Tablo 1. Aedes aegypti. 4 de Aedes aegypti dişi sivrisinekler ile yapılan in vivo diürez tayininde ° C den Ham veri
Tartışmalar
Kullanılan RNAi protokolü California Riverside 6,7 Üniversitesi'nde Alexander Raikhel laboratuvarında geliştirilen ve Garver ve Dimopoulos 4 tarafından yayınlanan bir protokol benzer olmuştur. Bu video protokolü gösterildiği deneysel yaklaşım in vivo ortamda bir böcek diürez ilgili genler incelemek için kullanılabilir. Böcekler, Malpighi tüpleri tübüller, ve boşaltım organları diürez için 'basit' bir model sistem olarak araştırmacıların nesillerin ...
Açıklamalar
Biz ifşa hiçbir şey yok.
Teşekkürler
Yazarlar bu protokolün onun eleştirel yorumlar için Victoria Carpenter teşekkür ederim.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif ya da ekipman Adı | Şirket | Katalog numarası | Yorumlar |
| MEGAscript T7 Yüksek Kapasiteli Kiti | Ambion, Inc | AM1334 | |
| PBS tamponu | Sigma-Aldrich | P4417 | |
| Plastik boru | Yerel satıcı | PVC | |
| 1 ml plastik pipet | VWR | 83007-376 | Mavi ucu |
| 1 ml şırınga | Becton, Dickinson and Company | 309602 | |
| Makas | Yerel satıcı | ||
| Metal iğne | Carolina Biologicals | 654307 | Boyut 5 |
| Pad Fly | Genesee Bilimsel | 789060 | |
| Pille aspiratör w / tahsilat flakon | UPMA Labs | ESYM 2000 | |
| İnce uçlu forseps | Dünya Hassas Aletler | 14095 | |
| Cam kılcal iğneler | Dünya Hassas Aletler | 1B200-6 | |
| Stereo diseksiyon mikroskobu | Leica Microsystems | S6D | |
| Analitik hassas denge | Mettler Toledo | AB54S | |
| Sakaroz | Sigma-Aldrich | 84097 | |
| Bir bardak bira kaplı karton bardak mumlu | Yerel satıcı | Üretici çorba bardak | |
| Mesh net | Yerel satıcı | plastik sinek gazlı bez |
Referanslar
- Drake, L. L., et al. The Aquaporin gene family of the yellow fever mosquito, Aedes aegypti. PloS one. 5, e15578 (2010).
- Shepard, A. R., Jacobson, N., Clark, A. F. Importance of quantitative PCR primer location for short interfering RNA efficacy determination. Analytical biochemistry. 344, 287-288 (2005).
- Altschul, S. F., et al. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic acids research. 25, 3389-3402 (1997).
- Garver, L., Dimopoulos, G. Protocol for RNAi Assays in Adult Mosquitoes (A. gambiae). J. Vis. Exp. (5), e230 (2007).
- Clements, A. N. Volume 1 Development, Nutrition, and Reproduction. The Biology of Mosquitoes. 2, (1992).
- Hansen, I. A., Attardo, G. M., Park, J. H., Peng, Q., Raikhel, A. S. Target of rapamycin-mediated amino acid signaling in mosquito anautogeny. Proceedings of the National Academy of Sciences of the United States of America. 101, 10626-10631 (2004).
- Hansen, I. A., Attardo, G. M., Roy, S. G., Raikhel, A. S. Target of rapamycin-dependent activation of S6 kinase is a central step in the transduction of nutritional signals during egg development in a mosquito. The Journal of biological chemistry. 280, 20565-20572 (2005).
- Pannabecker, T. Physiology of the Malpighian Tubule. Annual review of entomology. 40, 493-510 (1995).
- Dow, J. New insights into Malpighian tubule function from functional genomics. Comp Biochem Phys A. 150, S135 (2008).
- Dow, J. A. T. Insights into the Malpighian tubule from functional genomics. Journal of Experimental Biology. 212, 435-445 (2009).
- Lawson, D., et al. VectorBase: a data resource for invertebrate vector genomics. Nucleic acids research. 37, 583-587 (2009).
- Beyenbach, K. W. Transport mechanisms of diuresis in Malpighian tubules of insects. J. Exp. Biol. 206 (Pt 21), 3845-3856 (2003).
- Coast, G. M. Continuous recording of excretory water loss from Musca domestica using a flow-through humidity meter: hormonal control of diuresis. Journal of insect physiology. 50, 455-468 (2004).
- Kersch, C. N., Pietrantonio, P. V. Mosquito Aedes aegypti (L.) leucokinin receptor is critical for in vivo fluid excretion post blood feeding. FEBS letters. 585, 3507-3512 (2011).
- Hays, A. R., Raikhel, A. S. A novel protein produced by the vitellogenic fat body and accumulated in mosquito oocytes. Development Genes and Evolution. 199, 114-121 (1990).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır