Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Modelleme ve Görüntüleme 3-Boyutlu Toplu Hücre Invasion
Bu Makalede
Özet
Üç boyutlu hücre dışı matriks içine tümör hücresi invazyonu modelleri daha iyi yansıtacak In vivo Iki boyutlu motilite testleri daha durum. Floresan etiketli hücreleri, işgali modları ve önde gelen karşı aşağıdaki hücreleri farklı katkıları hakkında detaylı bilgi konfokal görüntüleme ile birlikte matris işgali testleri kullanılarak elde edilebilir.
Özet
Kanser malignite tanımlayan ayırt edici özelliği, invazyon ve metastaz 1 . Bazı kanser türleri (E. G glioma 2), çevredeki sağlıklı doku içine lokal invazyon, hastalık ve ölüm kök nedenidir . Diğer kanserler için (e. g meme, akciğer, vb.), Tümör hücrelerinin primer tümör kitlesi hareket distal siteleri kolonize ve sonuçta organ yetmezliğine katkıda metastaz süreci, sonunda morbidite ve ölüm 3. Invazyon ve metastaz, kanser ölümlerinin 4% 90 oranında sorumlu olduğu tahmin edilmektedir . Sonuç olarak, gelişen tanı ve tedavi 5 amaçları için moleküler süreçler ve invazyon ve metastaz kritik protein arabulucular tespit yoğun ilgi olmuştur.
Kanser bilim adamları için bir meydan okuma in vivo durumu yeterince benzer işgali testleri geliştirmek içindoğru hastalığı modelleme 6 etkinleştirin. İki boyutlu hücre motilite testleri işgali yalnızca bilgilendirme yaklaşık bir yönü vardır ve aynı zamanda önemli bir unsurudur hesap ekstraselüler matriks (ECM) protein remodeling yapmayız. Son zamanlarda, tümör hücresi invazyonu anlayışımız araştırma rafine ve tek tek hücreler, uzatılmış veya yuvarlak modları 7 hareket etmiş olabileceğini göstermiştir . Buna ek olarak, özellikle epitel özellikleri korumak son derece farklılaşmış tümörler kanser 8 yayılmasını hücreleri lifler, çarşaf ve kümeler halinde işgal toplu işgali katkısı büyük takdir,, olmuştur.
Biz kolektif işgali 10 katkıları aday proteinlerin incelenmesi için zarif bir yöntem 9 sunuyoruz. Özellikle, farklı floresan proteinleri ifade hücreleri mühendislik ayrı havuzları, moleküler faaliyetler ve protei incelemek mümkünns aşağıdaki hücreleri gerekli olan karşı önde gelen hücreleri gereklidir. RNAi kullanımı deneysel yanı sıra toplu işgalinin farklı pozisyonlarda bireysel hücre invazyonu ilgili işlemleri sökmeye moleküler bir araç sağlar. Bu prosedürde, floresan etiketli hücrelerinin karışımları Matrigel ECM protein ile dolu bir transwell eklemek altındaki kaplama, daha sonra, filtre ve Matrigel içine "yukarı" işgal izin. Konfokal görüntüleme ile elde edilen üç boyutlu gösterimleri içine z serisi görüntü yığınlar, İmar lideri konumunu karşı aşağıdaki floresan etiketli hücrelerinin temsil toplu işgalci iplikçikleri ve analiz görselleştirme sağlar.
Protokol
1. Floresan proteinleri ile hücre retroviral etiketleme
- 0.25 x 10 6 hücre ortalama 6-iyi Plaka retroviral ambalaj hücreleri (örneğin Phoenix) % 10 fetal sığır serumu (FBS) / DMEM çanak.
- Retroviral DNA Transfect hücrelerin 48 saat sonra hücrelerin üreticinin talimatlarına göre Effectene kullanarak.
- Kuyu daha sonra orta 24 saat ile iki kez durulayın, daha sonra 1.5 ml% 10 de ortalama FBS / DMEM ekleyin.
- Pipetleme ve 2 ml mikrosantrifüj tüpler transfer orta 48 saat sonra doku kültürü paketlenmiş virüs toplayın.
- Pelet herhangi bir hücre için 5 dakika 1600 rpm'de santrifüj uygulayın.
- Temiz bir tüpe supernatant ve mağaza çıkarın -80 ° C
- Retrovirally transduced hücreleri 6 iyi bir yemeğin başına 1,5 x 10 5 hücre kaplama ve nemlendirilmiş bir inkübatör 37 ° C gecede yerleştirilir .
- Ertesi gün, hücreleri ve reklam ortamı çıkarın.d her kuyuya 4 ul polybrene (2 mg / ml) ile desteklenmiş virüs stokunun 1 ml. Inkübatör plakalarının değiştirin.
- 5-6 saat inkübasyon sonrasında, her bir kuyunun 2 ml% 10 FBS / DMEM eklemek ve plakalar 37 ° C inbubator gecede değiştirilir.
- Ertesi gün, medyanın yerini ve uygun seçici besiyerleri eklemeden önce hücreler 24 saat geçmesini bekleyin.
- Konfluent (hücrelerin büyüme hızını ve verimliliğini retroviral transdüksiyon bağlıdır, ancak genellikle 4-14 gün sürer) Ne zaman,-transduced kullanarak floresan hücreler için bir referans olarak hücre ve sıralama trypsinize, toplamak ve havuz hücreleri floresans, -80 olmayan transduced hücreleri ve dondurma alikotları daha büyük ° C ileride kullanmak için.
2. Ters Matrigel işgali tahlil
- Yavaşça buz (Şekil 1A) tam Matrigel (yani büyüme faktörleri içeren) bir kısım Çözülme.
- Once buz PBS içinde çözülmüş, seyreltik Matrigel 1:1 (başka herhangi bir ek ile birlikte2x konsantrasyonu PBS önce seyreltme tedaviler; Şekil 1B). Daha kolay işlemek için polimerizasyon önce Matrigel yapmak için, tüm plasticware (örneğin, ipuçları, tüpler, vb.) Buz olmalıdır.
- Kaplanmamış birçok 8 mikron gözenek 6.5 mm çapında 24 iyi doku kültürü plakası kuyuların içine gerekli Transwells olarak yerleştirin, sonra dikkatli bir şekilde kuyuları seyreltilmiş Matrigel 100 ul pipet ve 37 ~ 30 dakika inkübe bırakın ° C katılaşmaya (Şekil 1C).
- Bu süre zarfında hazırlamak, bir veya daha fazla floresan etiketli kendi normal büyüme her tedavi öncesi durum (e. g siRNA, ilaç tedavisi) hücre hattı bağlı olarak 4-1 ml başına x 10 5 hücre, hücre süspansiyonları orta (Şekil 1D).
- Matrigel filtre (Şekil 1E) yukarı bakacak şekilde alt ve hücre süspansiyonu pipetle 100 ul üzerine Transwells invert katılaşmış vardır.
- 24 iyi doku tabanı ile dikkatlice Transwells kapağıkültür plakası, hücre süspansiyonu (Şekil 1F) her damla ile temas.
- Hücre eki (Şekil 1G) izin vermek için, 4 saat süreyle ters devlet plaka inkübe edin.
- Bu süre sonrasında, plakalar sağ taraftaki yukarıya döner ve ardışık 2 x 1 ml serum serbest orta (Şekil 2A) içine batırarak her transwell yıkayın.
- (Şekil 2B) gerekli olan herhangi bir ilaç ya da tedavilerin de içeren bir üçüncü Transwells bırakın.
- Katılaşmış Matrigel / PBS karışımı üstüne transwell hafifçe (25 ng / ml 'e. g AGF) FBS / DMEM artı kemoatraktan% 10 ul 100 pipeti az 3-5 gün, 37 kapak ve inkübe yerine ° C,% 5 CO 2 (Şekil 2C).
3. Boyama ve görselleştirme
- Hücreler floresan proteinleri ifade konfokal mikroskobi önce aşağıdaki adımları atlayabilirsiniz
- Taze 24 iyi yemekler ve 4 mcM pipet 1 ml Matrigel, yer Transwells işgalci görüntü floresan olmayan hücreler içinCalcein taraf dökülme ve alt ve üst leke sağlayan, her Matrigel fiş üstünde leke çözüm AM. Calcein AM (Calcein acetoxymethyl ester) bu lekeler tüm hücrelerin canlı bir hücre boya yeşil ve hiçbir fiksasyon gerektirir.
- 1 saat 37 ° ° C'de% 5 CO noktası hücreleri tamamen boyanmış ve konfokal mikroskobi tarafından görüntülendi hazır olan 2 nemlendirilmiş atmosfer.
- Alternatif olarak, floresan olmayan hücrelerin Matrigel işgalci sabit ve 3,9-3,5 aşağıda açıklandığı gibi boyanmış olabilir.
- Yeni bir 24 plaka her transwell aktarın. Yerleşimi 1% 4 para-formaldehyde/0.2% Triton-X 100 ml.
- 0.5 saat boyunca oda sıcaklığında inkübe edin.
- Fiksatif çıkarın ve 1 ml PBS ile 3 kere yıkayın.
- 100 mcg / ml RNaz kullanarak 30 dakika RNaz tedavi ile sitoplazmik RNA çıkarın. PBS ile 2 kez yıkayın.
- Görselleştirme için PBS içinde sulandırılmış 0.01 mg / ml Propidium İyodür (PI) ve oda sıcaklığında da terk0.5 saat rk. PBS ile 3 kez yıkayın. Bu aşamada, PI transwell karanlık oda sıcaklığında en az 1 ay süreyle tutulabilir boyandı.
- Konfokal mikroskobu hassas görüntüleme yöntemleri kullanılabilir kaynakları bağlıdır. Olmayan daldırma 20 X objektif ve optik bölümleri matrigel fişi alttan her 10-15 mikron yakalamak üzerinde artık PBS büyük lamel üzerine küçük bir miktar (hava kabarcığı sağlamak) ile ters bir konfokal mikroskop, yer transwell kullanma. Bireysel optik dilim işgali ölçüde (Şekil 3A) ölçmek veya Volocity olarak uygun yazılım (Şekil 3B) kullanılarak 3 boyutlu nesneler oluşturmak için kullanılabilir.
4. Temsilcisi Sonuçlar
Şekil 3A optik dilim Z-serisi bir örnek gösterilmiştir. Bu durumda, hücreler Calcein AM ile boyandı ve mesafe ile filtre kadar işgalci hücrelerinin sayısını azaltmak görülebilir. De, ölçümüvasion oranı Calcein, AM olumlu olumsuz her aralıkta, ya da yukarıda ayrıntılı olarak tespiti / boyama yöntemi kullanarak ve her pozisyonda PI pozitif çekirdek sayma piksel piksel analiz ederek yapılabilir. Calcein bir avantajı. Boyama PM hücre işgalinin bu 3-boyutlu rekonstrüksiyonlar işgali modu (Şekil 3B) görsel bir tasviri vererek, böyle bir Volocity olarak yazılımı kullanarak monte edilebilir. Hücreleri floresan proteinlerle ifade etiketli iseniz, o zaman her renk hücre konumları ya tarafında (Şekil 3C) veya yeniden yapılanma (Şekil 3D) aracılığıyla dilimleri yaparak görüntülenebilir 3 boyutlu rekonstrüksiyonlar görüntülenmiştir olabilir.
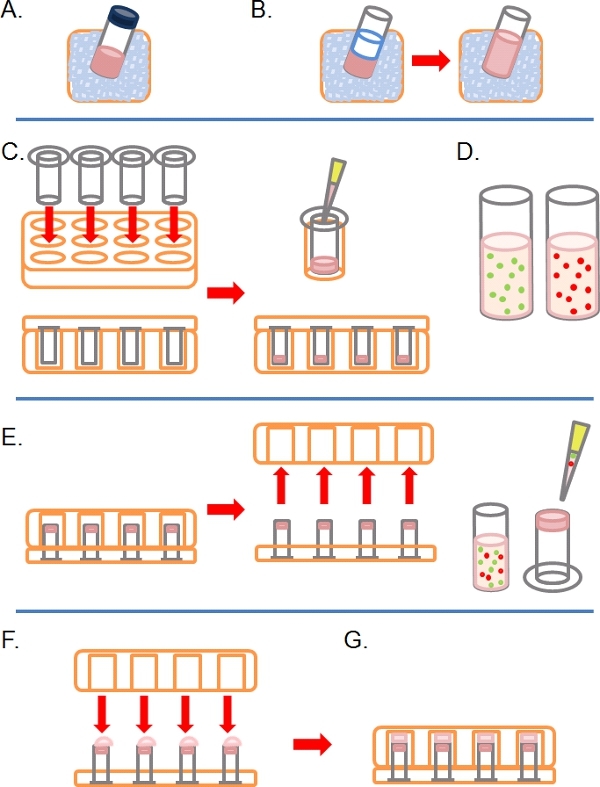
Şekil 1 şematik ters işgali tahlil kurma alan adımları. A) Matrigel ECM buz üzerinde çözülmüş. B) Matrigel iki kez final konsantrasyon herhangi bir ilaç tedavileri içeren PBS ile 1:1 seyreltilir. C) Transwell ekler multiwell plakaları yerleştirilir ve Matrigel her pipetlenir. D) Hücre süspansiyonlar istenilen konsantrasyonda yaptı. E) Matrigel sonra, plaka ters ve kaldırılır hücreleri transwell ekler alt filtre üzerine kaplanmıştır. F) ters pozisyonda, multiwall plaka dikkatle hücre süspansiyonu ile temas eden, transwell ekler üzerine yerleştirilir. G) Hücreler, 4 saat için filtre uymak izin verilir.
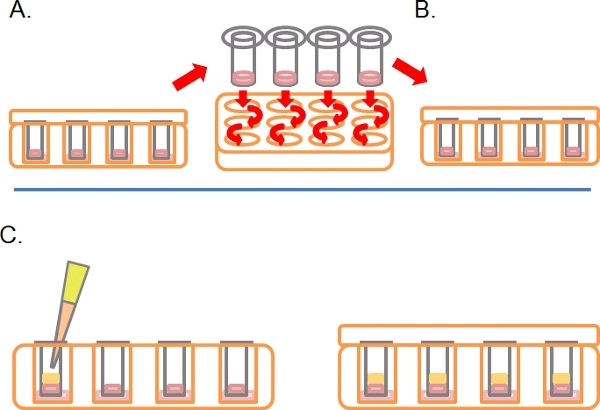
Şekil 2 ters işgali tayini için şematik diyagramı devamı. Hücreleri yapıştırılır A) Bir kez, iki kez gevşek hücreleri çıkarmak için serum ücretsiz medya her transwell batırın. B) Yer gerektiği gibi de içeren nihai bir medya artı tedaviler transwell yıkanır. C) Medya, gerektiği gibi tedavileri ile kemoatraktan (örneğin% 10 fetal sığır serumu) içeren dikkatle Matrigel üzerine katmanlı.
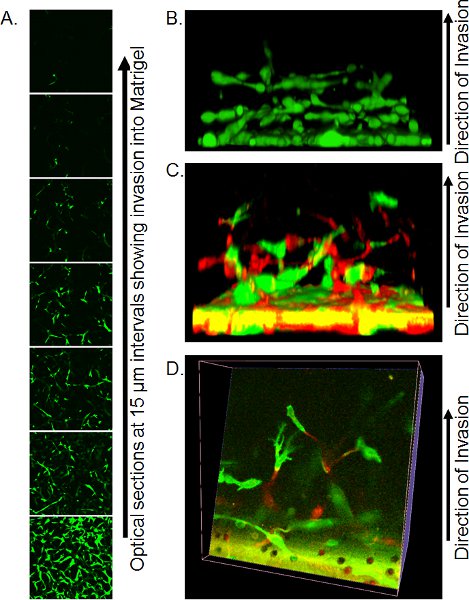
Şekil 3. Ters işgali testinin sonuçları Temsilcisi görüntüleri. A) Calcein ile boyanmış hücreler Optik bölümler konfokal mikroskobu ile 15 mikron aralıklarla alınan Matrigel işgalci PM. B) İmar, yandan bakıldığında konfokal Z-serisi görüntüleri, bir yığın hücre işgali 3 boyutlu rekonstrüksiyon. Referans, 10 yayımlanmaktadır. C) Üç boyutlu yan bakıldığında Matrigel işgalci GFP ve RFP etiketli hücrelerinin yeniden inşası. D) Optik, GFP ve RFP etiketli hücreleri 3 boyutlu rekonstrüksiyon ile dilim. Referans, 10 yayımlanmaktadır.
Tartışmalar
Matrigel işgali testleri geleneksel ve alt kısmında bir filtre aracılığıyla doğru kemoatraktan indüklenen motilite ile ekstraselüler matriks proteini bir tabaka üzerine yerleştirilen hücreleri ile kurulmuştur. Invazivlik filtrenin alt kısmında kaç hücre olabilir sayılır bir fonksiyonu olarak gol oldu. Çok az bir fark ile, yukarıda açıklanan "ters" işgal tahlil pratik olmasına rağmen, Matrigel ile yukarı taşımak ve işgalci hücreleri görselleştirme tarafından tespit edilebilir ...
Açıklamalar
Yazarlar ifşa etmek başka bir şey var.
Teşekkürler
Bu araştırma için fon Cancer Research UK.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktifi Adı | Şirket | Katalog numarası | |
|---|---|---|---|
| DMEM (Dulbecco'nun Modifiye Kartal Orta) | Gibco | 21969 | |
| Fetal sığır serumu | PAA | A15-101 | |
| Penisilin Streptomisin | Gibco | 15140 | |
| 200 mM L-Glutamine (100x) | Gibco | 25050-032 | |
| Puromycin | Sigma-Aldrich | P8833 | |
| % 0.05 tripsin EDTA | Gibco | 25300 | |
| Polybrene | Sigma-Aldrich | AL-118 | |
| Lipofectamine 2000 Reaktif | Invitrogen | 11668019 | |
| 6.5mm Transwells, 8.0 mikron gözenek boyutu | Corning | 3422 | |
| Komple Matrigel | BD Biosciences | 354234 | |
| Calcein AM | Invitrogen | C1430 | |
| RNaz | Qiagen | 19101 | |
| Propidium İyodür | Sigma-Aldrich | P4864 | |
| Konfokal microcope | Leica | SP2MP |
Referanslar
- Olson, M. F., Sahai, E. The actin cytoskeleton in cancer cell motility. Clin. Exp. Metastasis. 26, 273-287 (2008).
- Hoelzinger, D. B., Demuth, T., Berens, M. E. Autocrine factors that sustain glioma invasion and paracrine biology in the brain microenvironment. J. Natl. Cancer. Inst. 99, 1583-1593 (2007).
- Chaffer, C. L., Weinberg, R. A. A perspective on cancer cell metastasis. Science. 331, 1559-1564 (2011).
- Hanahan, D., Weinberg, R. A. The Hallmarks of Cancer. Cell. 100, 57-70 (2000).
- Francia, G., Cruz-Munoz, W., Man, S., Xu, P., Kerbel, R. S. Mouse models of advanced spontaneous metastasis for experimental therapeutics. Nat. Rev. Cancer. 11, 135-141 (2011).
- Hooper, S., Marshall, J. F., Sahai, E. Tumor cell migration in three dimensions. Methods. Enzymol. 406, 625-643 (2006).
- Croft, D. R., Olson, M. F. Regulating the conversion between rounded and elongated modes of cancer cell movement. Cancer Cell. 14, 349-351 (2008).
- Wolf, K. Multi-step pericellular proteolysis controls the transition from individual to collective cancer cell invasion. Nat. Cell. Biol. 9, 893-904 (2007).
- Hennigan, R. F., Hawker, K. L., Ozanne, B. W. Fos-transformation activates genes associated with invasion. Oncogene. 9, 3591-3600 (1994).
- Scott, R. W. LIM kinases are required for invasive path generation by tumor and tumor-associated stromal cells. J. Cell. Biol. 191, 169-185 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır