Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Fare Akciğer Dendritik Hücrelerinin İzolasyonu
Bu Makalede
Özet
Fare akciğer dendritik hücreler yüksek oranda saflaştırılmış açıklanmıştır. Özgül ağırlık, geleneksel dendritik hücre alt izolasyon verilir.
Özet
Akciğer dendritik hücreler (DC), solunum yolu kontrol tolerogenic tepkilerin yanı sıra 3 işgalci patojenlere 1,2 algılama temel bir rol oynar . Farelerde akciğer dendritik hücreler, en az üç ana alt kümelerini tarif edilmiştir: konvansiyonel DC (CDC) 4, plazmasitoid DC (PDC) 5 ve IFN-üreten katil DC (IKDC) 6,7. CDC altkümesi akciğer 8 en önemli DC alt kümesidir.
DC alt kümeleri tanımlamak için bilinen ortak işaretleyici CD11c, tip I monositler, makrofajlar, nötrofiller ve bazı B hücreleri 9 da ifade edilir transmembran integrin (β2). Bazı dokularda, fare DC tanımlamak için bir işaretleyici olarak CD11c kullanarak en CD11c + hücreleri büyük doku uygunluk kompleksi sınıf II (MHC-II) yüksek düzeyde ifade eden CDC alt kümesini temsil eder, dalak, geçerlidir . Ancak, akciğer, bir daha heterojen dokuyan DC alt setlerini, MHC-II düşük seviyelerde dersin CD11c'nin yüksek düzeyde ifade farklı bir hücre popülasyonu yüksek bir yüzdesi vardır. Karakterizasyonu ve çoğunlukla F4/80, dalak makrofaj işaretleyici ifade dayanarak, MHC-II CD11c hi lo akciğer hücre popülasyonu potansiyel bir DC 11 habercisi olarak, pulmoner makrofajlar daha yakın bir zamanda 10 olarak tespit edilmiştir.
Fare PDC aksine, pulmoner immün yanıt CDC belirli rol çalışmada, bu hücrelerin izolasyonunda yardımcı olabilir belirli bir marker eksikliği nedeniyle sınırlı kalmıştır. Bu nedenle, bu çalışmada, yüksek derecede saflaştırılmış fare akciğer CDC izole etmek için bir prosedür açıklar. Pulmoner DC alt gruplarının izolasyon solunum patojenleri akciğer konağın immün yanıtı tetikleyebilecek çevresel faktörlerin yanı sıra tepki olarak bu hücrelerin fonksiyonu içgörüler kazanmak için çok yararlı bir araç temsil eder.
Protokol
1. Akciğer perfüzyon ve tek bir hücre süspansiyonu
- Femoral ven yoluyla intraperitoneal ketamin / xylazine anestezik karışımı bir enjeksiyon (mg / fare ketamin 1.8, ksilizin 0.19) ve exsanguination fare Euthanize
- Kesme ve periton dış deri hafifçe geri çekerek göğüs boşluğu Açığa. Diyafram, kalp ve akciğerlerin maruz göğüs kafesi keserek açmaya devam edin.
- EDTA-HBSS (ücretsiz HBSS kalsiyum / magnezyum-1mm EDTA) ile dolu bir 5 ml şırınga kullanarak hafifçe akciğerler serpmek. 25 G iğne bağlayın ve sağ ventrikül içine iğne takın. Enjeksiyon sırasında sızıntıyı önlemek için iğne etrafındaki myocardiac doku forseps kullanarak güvenli. Sabit bir basınç korurken yavaşça enjekte çözüm. Doğru perfüzyon akciğer enflasyon ve pembe / beyaz bir renk değişimine neden olacaktır.
- Bu doku herhangi bir potansiyel kontaminasyon atmak için lenf düğümlerine drene çıkarın.
- Toplamakakciğer dokusu, buz üzerinde petri transferi, ve jilet kullanarak küçük parçalara doğrayın.
- GentleMACS C tüpe 5 ml / akciğer kollajenaz sindirim çözümü içeren bir topraklı doku transferi (kollajenaz tip 1A 0.5 mg / ml artı tip IV sığır pankreas DNaz 20 mg / ml% 5 FBS, 100 U / ml penisilin ve 100 mikrogram içeren HBSS ml streptomisin) /.
- GentleMACS dissociator tek bir hücre süspansiyonu elde etmek için kullanın. M_lung_01: program seçin. 30 dakika, 37 ° C'de örnek inkübe edin. Tüp doku parçaları tekrar süspansiyon her 5 dakika çalkalayın. Program m_lung_02 ile devam edin .
- 4 g 335 x 10 dakika için 15 ml konik bir tüp ve santrifüj örnek transfer ° C Bu adımdan sonra, tüm reaktifler ve santrüfüj tutmak, 4 ° C hücre canlılığı azalmayı önlemek için.
- Süpernatant atın ve oda sıcaklığında 1 dakika için ACK parçalama tampon 2 ml ekleyerek kalan kırmızı kan hücreleri lyse. 13 hücreleri yıkayın4 335 x g 'de 10 dakika süreyle soğuk PBS/0.5% BSA ve santrifüj ° C ml
- 5 ml soğuk PBS/0.5% BSA supernatant, tekrar süspansiyon toplam hücre atın ve 100 mikron naylon mesh geçirir.
- Tripan mavi dışlama boya kullanılarak toplam hücre sayısını belirler.
2. Manyetik izolasyon ve CD11c + hücreleri zenginleştirme
- 4 ° C'de 10 dakika boyunca tek bir hücre süspansiyonu 200 x g Santrifüj ve supernatant atın.
- 10 8 toplam hücre başına 400 ul ayırma tampon yeniden süspanse hücre pelet (% 0.5 BSA, PBS ve 2 mM EDTA). 4 az 30 dakika süreyle anti-CD16/CD32 antikor (0.5μg / 10 6 hücreleri) kullanarak bağlama Blok Fc aracılı belirsiz antikor ° C
- 4 200 x g 'de 10 dakika için 10 ml soğuk ayrılık tampon ve santrifüj hücre yıkayın ° C 400 ul ayırma tampon hücrelerin tekrar
- 100 10 8 başına CD11c mikro-ul ekle toplam hücre destek. İyice karıştırın ve 15 dakika buzdolabında (2-8 ° C) inkübe edin.
- 4 ° C'de 10 dakika boyunca 200 x g hücreleri yıkayın ve soğuk ayrılık tampon ve santrifüj 10 ml supernatant atın.
- 3 ml soğuk ayırma tampon hücre pelletini tekrar.
- AutoMACS Pro programı posseld seçerek TM Ayırıcı kullanarak manyetik ayırma gerçekleştirin. Olumlu bir kısmını (0,5 ml) toplayın.
3. Konvansiyonel dendritik hücre (CDC) izolasyon
- Anti-CD11c PE-Cy7 ve anti-IA/IE (MHC-II)-FITC antikorlar 30 dakika boyunca 4 ° C ile inkübe zenginleştirilmiş CD11c pozitif hücre süspansiyonu Optimize edilmiş antikor konsantrasyonu hücre 0.5 mikrogram / 10 6.
- Hücreleri 4 335 x g 'de 10 dakika süreyle soğuk PBS/0.5% BSA ve santrifüj ° C ile yıkayın Süspanse edin PBS/0.5% BSA 0.5 ml hücre ve 40 mikron naylon örgü ile aktaracaktır.
- Geçinsaflığı modunda FACS Aria hücre sıralayıcı kullanılarak hücrelerin sıralayabilirsiniz. Saflaştırılmış hücrelerin zarar görmesini önlemek için toplama tüpleri PBS/0.5% BSA 100 ul ekleyin. Hücrelerin hücre sıralama süreci boyunca soğuk hava sıcaklığında tutun.
4. Alternatif protokol, tek bir hücre süspansiyonu ve CD11c + hücreleri zenginleştirme elde etmek için
- GentleMACS dissociator değiştirilmesi, adım 1.5 topraklı akciğer dokusunda 37 ° C'de 1 saat süreyle inkübe başı akciğer ve 5 ml kollajenaz çözüm içeren 15 ml konik boru transfer olabilir Vorteks hücreler her 15 dakikada bir doku parçaları tekrar süspansiyon için. Içinde ve dışında 20 G iğne bağlanan bir 3 ml şırınga ile örnek 6-8 kez geçerek doku bozabilir. Sürecinde kabarcıkları yapmaktan kaçının, aksi halde hücre canlılığı tehlikeye olacak. Tek hücre süspansiyonu elde edildikten sonra, 1.8 adım ile devam edin.
- AutoMACSPro TM ayırma değiştirilmesitor, CD11c hücrelerinin zenginleşmesi için manyetik izolasyon, ayrıca hücre süspansiyonu geçen iki MACS sütun üzerinden elle yapılabilir. Uygun sütun seçimi, örneklem büyüklüğü olarak değişecektir.
5. Temsilcisi Sonuçlar:
Akciğer CDC CD11c hi / MHC-II yüksek hücre popülasyonu olarak tanımlanır. Şekil. 1, CDC dalak (% 4.8) gibi bazı diğer dokulara kıyasla% 1.4 daha küçük bir yüzdesini temsil etmektedir. Ancak, dalak aksine, akciğer CD11c pozitif hücrelerin CDC daha farklı bir hücre popülasyonu da dahil olmak üzere, MHC-II farklı miktarlarda ifade. Tek hücreli bir ön hazırlıktan sonra, toplam akciğer hücreleri hücre verimi 3,8-3,0 biraz% 1 üzerinde% 60-70 oranında bir canlılığı x 10 7 hücre / akciğer CDC alt kümesi temsil edildi . Bu oran, toplam akciğer CDC, yaklaşık 10 ton artırılır CD11c manyetik izolasyon sonra arttıİmes orijinal hazırlama (Şekil 2A) (>% 16). Ancak, MHC-II (CD11c hi / MHC-II lo, makrofajlar) düşük miktarda ifade CD11c hücreler akciğer CDC alt kümesi ile karışık bir yüksek kirlenmesine neden olan hücre popülasyonu (>% 70) temsil etti. Şekil. 2B, CDC saflık>% 96'ya ulaşmış hücre sıralama adımdan sonra bu hücrelerin ortadan kaldırıldı. CDC tüm prosedürü sonra her zamanki verimi 5 x 10 4 hücre / akciğer oldu. Microphotographs tipik dendritler (üst panel) ile yuvarlak hücreler olarak CDC morfolojik özellikleri göstermektedir. Öte yandan, CD11c hi / MHC-II lo makrofajlar (MΦ, alt panel) 12 tipik hücresel protuberances gösterir morfolojik olarak farklı bir alt kümesi temsil etti .
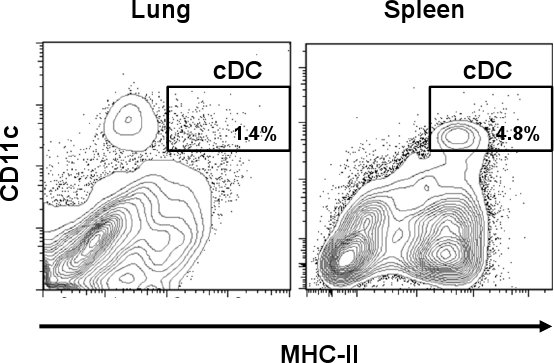
Şekil 1 fare akciğer ve dalakta Diferansiyel DC frekans. Akciğer birnd C57BL / 6 farelerin dalak doku kollajenaz ile toplanır ve tedavi edildi. Kollajenaz sindirim ardından, hücreler, anti-fare CD11c-PE-Cy7 ve anti-fare IA / IE-FITC ile boyandı. Temsilcisi akış sitometri araziler, akciğer ve dalakta CDC yüzdeleri (CD11c hi / MHC-II hi) göstermektedir .
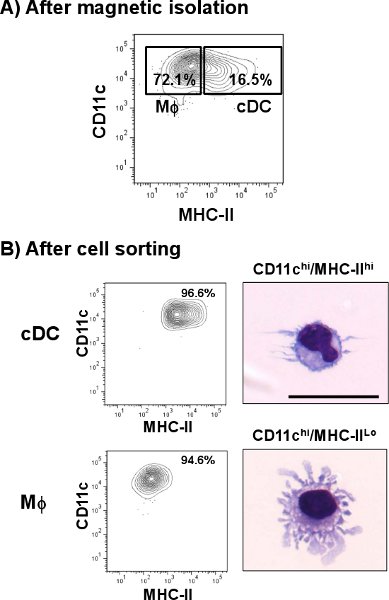
Şekil 2 fare akciğer CDC izolasyonu anti-CD11c mikro etiketli Fare akciğer tek hücre süspansiyonu ve otomatik hücre ayırıcı geçirilir. A) temsilcisi arsa CDC (CD11c hi / MHC-II hi) yüzdeleri gösterir ve Makrofajlar (MΦ MHC-II, CD11c hi / lo) CD11c zenginleştirme sonra nüfusu. Zenginleştirilmiş fraksiyonu daha fazla boyama, anti-fare CD11c-PE-Cy7 ve anti-fare IA / IE-FITC kullanılarak izledi. Çift pozitif hücrelerin sıralanır ve flow sitometri ile analiz edildi. IçinB) Temsilcisi araziler morfolojisi tespit hücreleri modifiye Wright-Giemsa boyama ile cytospun ve boyandı. CDC yüzdeleri ve hücre sıralama sonra MΦ göstermektedir. Microphotographs, akciğer CDC ve akciğer MΦ temsili bir resim göstermek için. Ölçek çubuğu = 20 mikron.
Tartışmalar
Pulmoner fare DC İzolasyon solunum uyaranların geniş bir çalışma için önemli bir tekniktir. Bu hücrelerin elde edilmesi sürecinin yanı sıra hücre canlılığı ve saflık hücre kaybı önlemek kritik adımları içerir. Toplama önce akciğer perfüze sıra kirletici eritrositler azaltmak gibi herhangi bir periferik hücrelerini ortadan kaldırmak için yardımcı olacaktır. Akciğerlerin çok sayıda işlenir otomatik disosiasyon advanteogus olabilir, aksi takdirde Elle yapıldığında kollajenaz sindir...
Açıklamalar
Yazarlar ifşa etmek başka bir şey var.
Teşekkürler
Yazarlar, hücre sıralama ve Peter Mottram microphotographs ile yaptığı yardım için ona yardım için LSU Sitometrisi Core Tesisleri'nde Marilyn Dietrich teşekkür etmek istiyorum. Bu çalışma, Uçuş Görevlisi Tıbbi Araştırma Enstitüsü, LSU-Rekabet Araştırmaları Programı Ödülü ve NIH / NIAID Hibeler P20 RR020159 ve R03AI081171 tarafından finanse edildi.
Malzemeler
| Reaktifi Adı | Şirket | Katalog numarası | Yorumlar (isteğe bağlı) |
| ACK parçalama tampon | Invitrogen | D6-0005DG | |
| Anti-fare CD11c (HL3) | BD Pharmingen | 5580979 | PE-Cy7 konjuge |
| Anti-fare IA / IE (269) | BD-Pharmingen | 553623 | Konjuge FITC |
| Collangenase Tip 1A | Sigma | 9891-500mg | |
| Hücre süzgeçler | BD Falcon | 352.340, 352.360 | |
| CD11c (N418) mikro- | Miltenyi | 130-052-001 | |
| DNaz I | Sigma | D5025-150KU | |
| Hank Dengeli Tuz çözüm | Invitrogen | 14170 | |
| HEPES tamponu çözümü | Invitrogen | 15630 | |
| Petri kapları 60 mm | BD Falcon | 351016 | |
| GentleMACS ™ C tüpler | Miltenyi | 130-093-237 | |
| Nazik MACS dissociator | Miltentyi | 130-093-235 | |
| AutoMACS-Pro ™ | Miltenyi | 130-092-545 | |
| FASCS Aria | BD |
Referanslar
- Pulendran, B., Palucka, K., Banchereau, J. Sensing pathogens and tuning immune responses. Science. 293, 253-256 (2001).
- Banchereau, J. Immunobiology of dendritic cells. Annual Review of Immunology. 18, 767-811 (2000).
- Manicassamy, S., Pulendran, B. Dendritic cell control of tolerogenic responses. Immunol. Rev. 241, 206-227 (2011).
- Steinman, R. M., Cohn, Z. A. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. J. Exp. Med. 137, 1142-1162 (1973).
- Asselin-Paturel, C. Mouse type I IFN-producing cells are immature APCs with plasmacytoid morphology. Nat. Immunol. 2, 1144-1150 (2001).
- Chan, C. W. Interferon-producing killer dendritic cells provide a link between innate and adaptive immunity. Nat. Med. 12, 207-213 (2006).
- Taieb, J. A novel dendritic cell subset involved in tumor immunosurveillance. Nat. Med. 12, 214-219 (2006).
- Guerrero-Plata, A., Kolli, D., Hong, C., Casola, A., Garofalo, R. P. Subversion of pulmonary dendritic cell function by paramyxovirus infections. Journal of Immunology. 182, 3072-3083 (2009).
- Larson, R. S., Springer, T. A. Structure and function of leukocyte integrins. Immunol. Rev. 114, 181-217 (1990).
- Sung, S. S. A major lung CD103 (alphaE)-beta7 integrin-positive epithelial dendritic cell population expressing Langerin and tight junction proteins. J. Immunol. 176, 2161-2172 (2006).
- Wang, H. Local CD11c+ MHC class II- precursors generate lung dendritic cells during respiratory viral infection, but are depleted in the process. J. Immunol. 177, 2536-2542 (2006).
- Bhatia, S. Rapid host defense against Aspergillus fumigatus involves alveolar macrophages with a predominance of alternatively activated phenotype. PLoS One. 6, e15943-e15943 (2011).
- Shao, Z., Makinde, T. O., McGee, H. S., Wang, X., Agrawal, D. K. Fms-like tyrosine kinase 3 ligand regulates migratory pattern and antigen uptake of lung dendritic cell subsets in a murine model of allergic airway inflammation. J. Immunol. 183, 7531-75381 (2009).
- Hao, X., Kim, T. S., Braciale, T. J. Differential response of respiratory dendritic cell subsets to influenza virus infection. J. Virol. 82, 4908-4919 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır