Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Tüm Dağı Muscle Analizi ile tekrarlanabilir Fare Siyatik Sinir Ezilme ve Rejenerasyon daha sonraki Değerlendirme
Bu Makalede
Özet
Bu yazıda fare siyatik sinir ezmek için bir metodu tanımlar. Bu yöntem, hazır hemostatik forseps kullanır ve kolay ve tekrarlanabilir tam siyatik sinir üretir. Buna ek olarak, siyatik sinir sonra rejenerasyon analizi için uygun kas bütün bağlar hazırlamak için bir yöntem açıklanmaktadır.
Özet
Periferik sinir sistemi (PNS) rejenerasyon yaygın insan hastalıkla ilişkisi ve böylece muhtemel MSS rejenerasyon 1 başarısızlıkları aydınlatarak PNS nöronlar tarafından monte sağlam rejeneratif yanıtı anlamak için hem de çalışılmıştır. Siyatik sinir ezilme (axonotmesis) kemirgenlerde 2 periferik sinir hasarı en yaygın modellerden biridir. Bu rejenerasyon 3,4 optimum yani kesmeleri Kırma tüm aksonlar ama Schwann hücre bazal lamina korunur. Bu araştırmacı tam Schwann hücresi ve bazal lamina 4 hem de etkileşim için büyüyen bir akson yeteneği çalışma sağlar. Sıçanlar, genellikle deneysel sinir ezme için tercih edilen hayvan modellerinde olmuştur. Bunlar yaygın olarak bulunmaktadır ve bunların lezyonlanan siyatik sinir insan sinir lezyonları 5,4 makul bir yaklaşım sağlar. Sıçan sinir büyüklüğünden daha küçük olsa da, farenin sinir birçok benzer niteliklere sahiptir. En önemlisi de, mouse modelleri, çünkü transjenik hatları geniş yer giderek değerli artık rejenerasyon 6, 7 için kritik bireysel molekülleri ayrıntılı bir Diseksiyon için olanak sağlar. Önceki araştırmacılar basit açılı forseps, soğutulmuş forseps, hemostatik forseps, vasküler kelepçeler ve araştırmacı tasarlanmış kelepçeler 8,9,10,11,12 dahil olmak üzere bir sinir ezilme veya yaralanma üretmek için birden çok yöntem kullanılmıştır. Araştırmacılar ayrıca dikiş, karbon partikülleri ve floresan boncuk 13,14,1 dahil olmak üzere yaralanma sitede işaretleme çeşitli yöntemler kullandılar. Biz doğru ve kalıcı güzel bir hemostatik forseps ve işaretleme sonraki karbon ezilme-sitesini kullanarak ezilme yerinde işaretleme ile bir tekrarlanabilir tam siyatik sinir elde etmek için bizim bir yöntem sunduk. Siyatik sinir prosedürü bizim açıklamasına bir parçası olarak biz de kas bütünün nispeten basit bir yöntem dahil ettik biz daha sonra rejenerasyon ölçmek için kullanabileceğiniz monte edilir.
Protokol
1. Hayvan Başlık
1.1. Tedavi
- Tüm hayvan prosedürleri ağrı ve rahatsızlığı en aza indirmek için alınan tedbirlerle, yerel Kurum Hayvan Bakım ve Etik Kurulu onayı ile ve Sağlık kılavuzların Kullanımı ve Komitesi ve Ulusal Sağlık Enstitüleri göre yapılmalıdır.
- Bizim fareler 12 saatlik bir ters ışık ve karanlık döngüsüne sıcaklık kontrollü şartlar altında muhafaza, beslenen fare yemi ve su ad libitum etmekte.
- Siyatik sinir gerçekleştirildiğinde yetişkin rejenerasyon çalışmaları için, farelerin yaş en az 6 hafta olmalıdır. Bu yaş polyneural nöromüsküler kavşağa budama gerçekleşecek süredir ötesindedir.
- Bu deneylerde, bu 6-8 hafta yaşında C57BL / Charles River elde edilen 6 fareleri kullanılmıştır. Siyatik sinir (örn: akson büyüme oranı) sonra rejenerasyon karşılaştırırken aksonal rejenerasyon farklılıkları yok olmuş gibi fare suşları, aynı olmalıdırFarklı doğal ırklar 15,16 arasında ed. Genetik olarak manipüle farelere kullanılacak olursa, Kardeş kontroller en uygundur.
1.2. Cerrahi Hazırlık
- Hayvanlar intraperitonal enjeksiyon yoluyla ketamin (100 mg / kg) ve Xylazine (10 mg / kg) bir kokteyli ile cerrahi derin anestezi uygulanmıştır. Her hayvan, aynı zamanda post-operatif ağrı en aza indirmek için meloksikam bir deri altı enjeksiyon (10 mg / kg) alır.
- Her iki kıç dikkatli bir cerrahi makası (Roboz, RC-5903) ve depilasyon Nair epilasyon kremi (yerel eczane bulunur) ile tamamlanır kullanarak tıraş edilmiştir.
- Cilt steril pamuk uçlu bir aplikatör ve betadin cerrahi fırçalayın (Fisher Scientific, 19.066.452) kullanılarak temizlenir.
- Oftalmik merhem (Fisher Scientific, 19.082.795) steril pamuk uçlu bir aplikatör kullanarak gözlere uygulanır.
- Fare Önceden ısıtılmış homeot yerleştirildi altında, temiz bir paslanmaz çelik levha üzerine yerleştirilirhermic battaniye sistemi (Harvard Apparatus, 507222F). Hayvan sıcaklığında 37 tutulur ° C.
- Tüm uzuvları diz eklemi vücut (Şekil 1, panel A) ile dik açı yapar simetrik nedenle arka ayakları konumlandırmak için alınan bakım, aşağı bantlanır.
- Cerrahi alan steril bir örtü ile kaplıdır. Tüm aletler otoklav veya sıcak boncuk sterilizasyon (Güzel Bilim Araçları, 18000-45) ve cerrah bir maske, önlük ve steril eldiven giyer ile sterilize edilir.
2. Tekrarlanabilir Siyatik Sinir Crush
- Hazırlandıktan sonra, orta hatta (Şekil 1) boyunca bir yarı-dairesel bir kesi cilt yapılır. Cilt hafifçe altta yatan kas disseke ve işlem sırasında yolu dışında kalması üzerine katlanır. Bu işlem sırasında 0.1 ml steril serum fizyolojik (Hospira, 0409-4888-20) uygulamaları kullanılarak nemli tutulur.
- Gluteus maksimus ve biseps femori ön kafa arasındaki fasya uçağı Açılışs siyatik sinir (Şekil 1, panel A) açığa çıkarır. Cerrahi bir kontrol için, kontralateral siyatik sinirleri çıkarıldı ve harekete, ama sağlam bırakılmalıdır. Gluteal kasların daha sonra yeniden karşı çıkan ve 6-0 örgülü ipek, emilmeyen sütürler (Roboz, SUT-1073-1011) ile sütüre edilir.
- Deneysel siyatik sinir sonra görselleştirme (Şekil 1, panel B) hafifletmek için yerinde Retraktörler ile, aynı şekilde maruz kalmaktadır. Retraktörler kullanmadan önce sterilize edilir.
Not: retraktör ticari sistemler mevcuttur karşın, genellikle oldukça pahalıdır. Biz ucuz donanım malzemeleri ve böcek iğne (Malzemeler bölümüne bakınız) kullanarak tatmin edici bir retraktör sistemi yapmak için başardık. - Siyatik sinir yavaşça iridektomi makası kullanarak çevresindeki bağ dokusu arındırılır.
- Güzel bir 5/45 (Güzel Bilim Araçları, 11251-35) forseps kullanarak sinir bir süper-ince hemostatik forseps alt çene (Güzel Bilim Too konulurls, 13020-12). Üç fasikül sıralı değil birbirlerinin üstüne (Şekil 1, inset B), hizalanır. Hemostatik forseps kendi ucundan 1.5 mm bir işareti ile kazınmış edilmiştir. Siyatik en dış bölümündeki ezme önce bu işareti uygun olarak yerleştirilir. Bu eşit genişlikte bir ezilme sağlar ve kırma gücü nedeniyle düzleştirildiğinde sinir hemostatik forseps pençesinden taşmadığından söyledi. Sinir forseps ucu ötesinde ise sinir sadece kısmen ezilmiş olacak.
- Ezilme siyatik sinir yolunu yakınlaştıran bir iş parçacığı tarafından ölçülen, üçüncü ayak 45 mm sinir dik yapılır. Sinir hemostatik forseps 3 tıklama az 15 saniye boyunca bir kez ezilir. Bakım sinir germek için değil alınır. Hemostat yeniden açıldığında, tüm sinir ezilme yerinde saydam olmalıdır.
- Önceden daldırma olmuştur hemostatik forseps ikinci bir çift (birinci özdeş)toz karbon (Fisher Scientific, C272-500) ezilme sitesi işaretlemek için kullanılır. Sinir 3 tıklama az 15 saniye boyunca aynı ezilme yerinde ezilir. Işaretleme yok karbon ilk çarpıldı sınır ötesine gerekir. Ezilme sitenin işaretleme hassas Gerekirse bu özellikle önemlidir. Kullanmadan önce, karbon tozu iki saat boyunca UV ışığına maruziyet ile sterilize edilir ve daha sonra steril tekniği kullanarak işlenir.
- Için karbon forseps önceden daldırma ancak cerrahi alanda yaygın karbon engel, forseps toz karbon açıldı, sonra yavaşça (ama tıklandığında değil) kapalı kapattı ve hemostat dışına karbon steril gazlı bez ile silinmelidir edilir . Forseps kırma yüzeyler eşit toz karbon kaplı olduğunu doğrulamak için en az 3x büyütme altında kontrol edilir. Gerekirse, tekrar daldırma ve silinir.
- Gluteal kas yeniden karşıt ve karşı taraf ile aynı şekilde dikilir edilir.
- Son olarak, cilt insizyonu 9 mm refleks klipler (;: 500.345 tabancasına Dünya Hassas Aletler, 500.346) ile kapatılır. 9 mm refleks klipleri hareketi, küçük refleks klipler veya 6-0 sütür (Roboz, SUT-1073-1011) kısıtlamak için tespit edilirse yerine kullanılabilir.
3. Post-Operatif Bakım
- Bunlar hareketi belirtileri gösteren ° C'ye kadar olan prosedür izlenerek, hayvanlara 37 az bir ısıtıcı yüzeyi üzerine yerleştirilir.
- Bunlar daha sonra su ve gıda Hidrojel ve ıslak gıda şeklinde katta kolay sağlanır ev kafesi, geri hareket ettirilir.
4. Yarı İnce Hazırlama
- Pentobarbital aşırı dozda (300 mg / kg) takiben bacak kas siyatik sinir * açığa çıkarılır. İn situ kalan sinir ile, but 30 dakika süreyle buz üzerinde 0.1 M fosfat tampon içinde% 2 ve% 2 paraformaldehit gluteraldehid batırılır.
* Tüm montaj kas hazırlığı tamamladıktan varsa, kasları hasat vardırsiyatik sinir maruz kalmadan önce ed. - Sinir dikkatle proksimal ucunda tek ele alınan bakım ile kaldırılır. Sonra, sinir, üç saat daha aynı sabitleştirici sonrası sabit olduğu.
- Sabitlenmesinden sonra sinir 0.1 M fosfat tampon içinde üç kez yıkanır.
- Sinir bir saat boyunca 0.1 M fosfat tampon içinde% 2 osmiyum tetroksit batırılır.
- Sinir daha sonra artan konsantre etanol içinde sıralı daldırma (% 50,% 70,% 80,% 95,% 100,% 100, 100%) ile kurutulmuş olup. Her daldırma 15 dakikadır.
- Susuz sinir üç dakika her biri için, propilen oksit iki kez inkübe edilir.
- Sonra sinir propilen oksit bir 1:1 karışımından batırılır ve (genellikle bir gece boyunca), en azından 6 saat boyunca 812 Embed edilir.
- Sonra sinir propilen oksit ve 2:1 karışımı batırılır ve bir gece boyunca 812 Embed.
- Son olarak, sinir altı saat için saf Göm 812 daldırılmış olan, daha sonra uygun bir kalıp ve BA gömülü48 saat boyunca 60 ° C'de Düşey Nokta Kuyu.
- 1.0 mikron kesitler Toluidin blue ile bir bıçak cam ve vitray bir Ultracut UCT ultramicrotome (Leica) kullanarak ezmek sitesinden bir set mesafede distal sinir kesiği itibaren kesilir. İnce kesitler de elektron mikroskobu ile ultrastrüktürel incelenmesi için üretilebilir.
5.. Tüm Dağı Muscle Hazırlık
- İlk olarak farelere pentobarbital bir doz (300 mg / kg) ile itlaf edilmiş ve arka bacak dizlerde kaldırılır.
- Arka bacak Dört kas analizi için kaldırılır: tibialis anterior (TA), ekstansör digitorum longus (EDL), soleus ve peroneus longus.
- Tüm kasları dikkatli disseksiyon ile kaldırılır ve siyah bir sylgard (Fisher Scientific, NC9492579) kaplı çanak kendi bağ dokusu ile tutturulmuş edilir. Bu 30 dakika için% 4 paraformaldehit in PBS ile yıkandı ve sonra tespit edilir.
- TA daha sonra OCT (Fisher Scientific, 14-3 gömülü, PBS durulanır73-65), aseton ve hızlı bir şekilde ve kuru bir buz banyosu içinde donduruldu.
- Bu -80 ° C'de bütün montaj hazırlığı başarısız durumda ince kesit boyunca saklanır. Genel olarak, TA yeterli bütün bağlar için çok kalın.
- EDL, soleus ve peroneus longus 0.1 M glisin * (Fisher Scientific, AC12007-0010; PBS ile seyreltilerek) yerleştirilir PBS ile 3 x 10 dakika boyunca çalkalanır 30 dakika boyunca, ve yine PBS içinde 3 x 10 dakika yıkanır. Daha sonra, -20 azından tam 5 dakika süreyle buz% 100 metanol ° C'de söndürüldü, PBS ile 3 x 10 dakika yıkanır, ve alfa-bungarotoxin (PBS ile seyreltilerek 1:200) 30 dakika boyunca floresan konjuge yıkandığı edilir. Kasları, bir% 2 BSA ile 1 saat blok (KPL, 50-61-00) ve% 0.2 Triton X-100 (Nokta Scientific Incorporated, 9002-93-1) takip PBS ile 3 x 10 dakika boyunca çalkalanır Aynı% 2 BSA/0.2% Triton blok içinde seyreltilmiş Primer antikor kokteyli içinde 4 ° C'de sallanan ederken PBS içinde *, ve bir gece boyunca inkübe edildi.
* Glycine ve bloke edici çözümler kas hasat olarak aynı gün yapılır ve kullanımdan önce oda sıcaklığında 30-60 dakika boyunca karıştırılmaktadır.- Bir fare monoklonal sinaptik vezikül işaretleyici (SV2 DSHB, 1:1000 sulandırılmış) ve rodamin konjuge alfa; akson ve nöromuskuler sinaps işaretlemek için, bir fare monoklonal nörofilaman marker kombinasyonu (1:1000 sulandırılmış Covance, SMI-312R) kullanabilirsiniz -bungarotoxin (Sigma-Aldrich, 1:200 oranında sulandırılmış). Reaktif Schwann hücreleri işaretlemek için biz tavşan anti-GAP-43 (Novus Biyolojik, NB300-143, 1/500 sulandırılmış) kullanın. Primer antikorlar bir IgG1 alt belirli floresein konjuge keçi anti-fare sekonder antikoru ve DyLight 649 konjuge eşek anti-tavşan (1:200 seyreltilmiş Jackson Immunoresearch) görselleştirilmiştir.
- Ertesi gün, kas 3 x 10 dakika süreyle PBS içinde yıkandı ve sekonder antikor olarak inkübe (% 2 BSA/0.2% Triton engelleme çözeltide) 1:200 seyreltilir. Bunlar daha sonra PBS ile yöne içinde 2 x 10 dakika yıkanır, ve başka bir 10 dakikalık PBS içinde durulama; 5 dakikalık bir DAPI batırıldıktan (deiyonize su içinde 300 nM ile seyreltilmiş Invitrogen, D3571) tarafından llowed.
- Her kası daha sonra siyah bir sylgard (Fisher Scientific, NC9492579) kaplı petri üzerinde disseke edilir. Iç kas lifleri (Şekil 3, panel AC) soyulmakta tarafından Başlangıçta tendonlar, kas içine yerleştirilmesi noktasında kaldırılır ve sonra kasları inceltilir. Bakım uç plakası bantları (Şekil 3, paneller DF) dahil olmak üzere kas dış yüzeyi, korumak için alınır. Çıkan kas vectashield (Vector Laboratories, H-1000) ve 22 ile artı slaytlar (Fisher Scientific, 12-550-15) üzerine monte edilir net oje tarafından mühürlenmiş x 40 mm cam lamelleri (Fisher Scientific, 12-548-5C) İki tarafta. Düzgün uç plakası bant temas coverslip slayt monte zaman.
6. Rejenerasyon Ölçme
- Rejenerasyon üç kasları (peroneus, EDL ve soleus) tahmin edilebilir. Biz genellikle eskion dört gün sinir ezilme sonra amin rejenerasyon, NMJs önemli bir yüzdesi yeniden innerve hangi bir zaman. Her iki önceki ve sonraki zaman noktalarında istenmektedir bilimsel söz bağlı olarak, hem de uygundur. Her kas, tüm uç plakası grubu yeniden innervasyon incelenmiştir. Sadece en face yüzey NMJs puanlanır. Bu şekilde, kas başına en azından 200 NMJs hızlı bir şekilde incelenebilir.
- Kas skor yeniden innervasyon bir "yeniden-innervasyon oranı" belirler. Payda α-bungarotoxin bağlayıcı ve Schwann hücre GAP-43 immunoreaktivitesi etiketli olarak Denerve kas kavşağı sayısıdır. Numaratör olarak neurofilament/SV2 immunoreaktivitesi tarafından etiketli yeniden innerve NMJs sayısıdır. Gerekirse, NMJs ya kısmen (SV2 ile α-bungarotoxin eksik kapsama) veya tamamen (SV2 ile α-bungarotoxin tam kapsama) yeniden innerve olarak sınıflandırılabilir. Yeniden innerve ve Denerve NMJs ilişkin örnekler için Şekil 3, panellerin G ve H bakınız.
7. Temsilcisi Sonuçlar
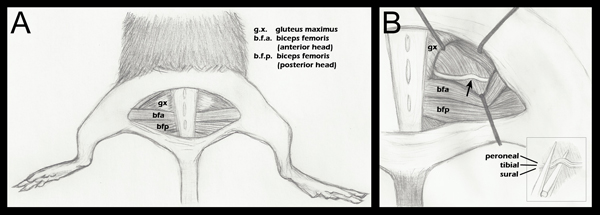
Şekil 1. Sinir ezmek için önemli arka bacak anatomisi şematik. A. yarı dairesel bir cilt kesisi altta yatan kasları ortaya yapılmıştır. B. gluteal kasların (yukarıda adım 2.4) ayrılmış ve siyatik sinir ortaya çıkmıştır. Bir ok yaklaşık ezilme sitesini ifade eder. Retraktör yerleştirme genel bir kılavuz olarak gösterilir ve ezmek için hemostatik forseps siyatik ve yaklaşım görselleştirme kolaylaştırmak için her ameliyat sırasında ayarlanır B (ilave):. Sadece ezmek önce hemostatik forseps alt çenede siyatik Yerleştirilmesi (adım yukarıda 2.5). Ayrı fasiküller ezilme sırasında değil, dikey olarak da yatay bitişik olduğunu göstermek için etiketli, ancak. Rağmen üç FYSM'yiicles Bu diyagram olarak etiketlenmiştir, bir de dördüncü bir fasikül, peroneal eklem şubesi görebilirsiniz. Siyatik sinirin dallanma düzeni daha ayrıntılı anatomik çizim ezilme noktasına distal fasikül için, Sıçan, Şekil 188 17 Greene'nin Anatomi bakın.
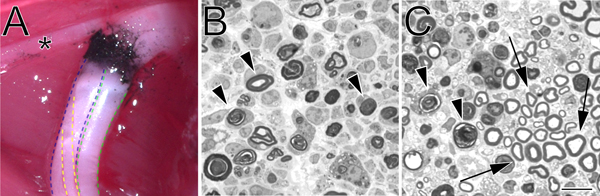
Şekil 2. Ezilmiş siyatik sinir yerinde ve Toluidin mavisi boyanmış, yarı ince kesitlerde bir karbon-işaretli ezilme sitesi. A. yerinde çarpıldı sitesi (sol arka bacak) bir örneği. Siyah karbon ezilme sitesinde gösterir. Yıldız uyluk kasları innervates ve ezilme ameliyat sırasında yararlı bir dönüm noktası olarak hizmet tibial sinirin bir dalı işaretler. Siyatik sinirin tibial bölümü mavi, yeşil peroneal belirtilen ve sarı. B. Yarı ince kesitlerde sural hemostatik kuvveti ile yapılan tam bir ezilme kanıtlıyorps. açılı forseps ile yapılan tamamlanmamış bir ezilme gösteren C. Yarı ince kesitler. Her iki görüntülerde yozlaşan miyelin profilleri ok uçları ile işaretlenir. Panelinde C okları korunmuş miyelin profillerinin örnekler ve kurtulmuş aksonların bir küme işaretleyin. Ölçek çubuğu 10 mm arasıdır.
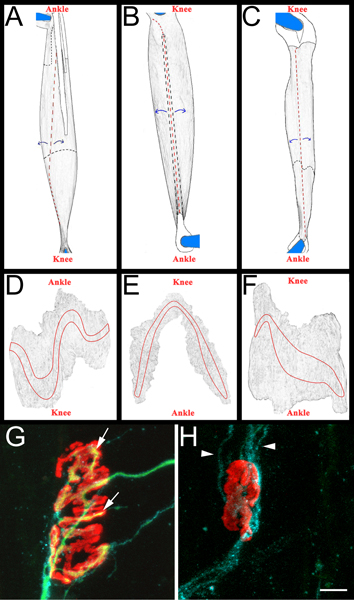
Şekil 3 Tüm montaj kas şematik ve temsilcisi NMJs AC:.. EDL (A), peroneus longus (B) ve arka bacak çıkarıldıktan sonra soleus (C) kasların Rendered görüntüler. Gösterilen Kaslar sağ arka ekstremite gelmektedir. Diz ve ayak bileği anatomik yönü de referans olarak dahil edilmiştir. Tendonlar beyaz renkli ve kas üstüne konumlandırılmış zaman düz siyah bir çizgi özetlenmiştir. Onların kas altına uzatmak ne zaman siyah bir kesikli çizgi özetlenmiştir. Kesikler kırmızı kesikli çizgiler ile gösterilmiştir.Muscle gibi mavi oklarla gösterilen kesim siteleri, uzak soyulmuş ve sonradan inceltilir. Incelme sonrası, kas tutturulmuş tendonların kalanları etrafında keserek pimleri ayrılır DF:. Rendered görüntüleri bütün montaj kasların bağ doku ve incelme sonraki çıkarıldıktan sonra. Uç plakası bantları her kas özetlenmiştir GH:. On dört gün yeniden innervasyon (G) ve denerve (H) kas kavşağı gösteren siyatik sinir sonra Soleus bütün montaj kas. Yukarıdaki bölüm 5.5.1 açıklandığı gibi bu panellerde, NMJs, aksonlar ve Schwann hücrelerinin canlandırırlar. Asetilkolin reseptörleri, aksonlar yeşil kırmızı, mavi ve Schwann hücre işler. Panel G, oklar bir akson tarafından yeniden inerve edilmiştir NMJ alanlarını gösterir. Panelinde H ok uçları GAP-43 pozitif Schwann hücre süreçlerini gösterir. Akson olmadığına dikkat edin. Ölçek çubuğu 10 mm arasıdır.
Tartışmalar
Biz ezmek sitenin işaretleme hassas bir güvenilir tam siyatik sinir elde etmek için bir yöntem sunduk. Daha önce belirtildiği gibi, siyatik sinir farelerde ve sıçanlarda periferik sinir zedelenmesini ortak bir modeldir. Çarpıldı Her yöntemin avantajları ve dezavantajları olsa da, bu yöntemin kolayca özel donanım (örneğin özel kelepçeler, vb) minimum ile kutlandı tam bir ezilme üretilen bulundu.
Crush Yöntemleri
Fare siyatik sinir için kullan...
Açıklamalar
Biz ifşa hiçbir şey yok.
Teşekkürler
Bu çalışma ayrıca NIH hibe K08NS065157 (TSK için) tarafından desteklenen, Baltalimanı Kemik Hastalıkları Penn Center, Artrit Ulusal Enstitüsü Ödülü Numarası P30AR050950, Kas-iskelet ve Deri Hastalıkları, bu iş (TSK ve Steven S. Scherer) destekledi. Son olarak, Shriners Pediatrik Araştırma Merkezi Tohum finansman (TSK) bu işi destekledi. Biz başlangıçta Şekil 1 skeçler üretiminde ona yardım için tüm montaj işlemi ve Amy A. Kim gösteren Dr Jin Young-Oğul kabul etmek istiyorum.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Adı (tanım / miktar) | Satıcı | Katalog Numarası | |
| No 0000 Blade Mini Clipper | Roboz | RC-5903 | |
| Nair Saç Çıkarıcı (9 oz.) | Kilise ve Dwight A.Ş. | N / A | |
| Betadine Cerrahi Ovalama (1 galon) | Fisher Scientific | 19066452 | |
| Oftalmik merhem (1 oz.) | Fisher Scientific | 19082795 |
Cerrahi Aletler:
| Adı (tanım / miktar) | Satıcı | Katalog Numarası |
| FST 250 Sıcak boncuk sterilizatör | Güzel Bilim Araçları | 18000-45 |
| Iris Makas (11 cm uzunluğunda) | Dünya Hassas Aletler | 500216 |
| Potts-Smith Forseps (Düz, 18cm; 1x2 Diş) | Güzel Bilim Araçları | 11024-18 |
| McPherson-Vannas Makas (5 mm bıçak) | Dünya Hassas Aletler | 14124-G |
| Dumont # 5 Forseps - Dumoxel Standart İpucu | Güzel Bilim Araçları | 11252-30 |
| Dumont # 5/45 Forseps - Dumoxel Standart İpucu | Güzel Bilim Araçları | 11251-35 |
| Ultra İnce hemostat (Düz; Pürüzsüz İç Yüzeyler) | Güzel Bilim Araçları | 13020-12 |
| Toz Aktif Karbon (500 gr) | Fisher Scientific | C272-500 |
| C-1 İğne (Steril, İpek, Siyah, Örgülü, ile Boyut 6-0 DikişlerEmilemeyen; 18 "Uzunluk, 36 Kutu) | Roboz | SUT-1073-1011 |
| Refleks Klip tabancasına (9 mm klipler) | Dünya Hassas Aletler | 500345 |
| 9mm Paslanmaz Çelik Refleks Klipler (100/box) | Dünya Hassas Aletler | 500346 |
Hayvan Bakımı:
| Adı (tanım / miktar) | Satıcı | Katalog Numarası |
| % 0,9 Sodyum Klorür (Koruyucu Ücretsiz; 20 ml) | Hospira | 0409-4888-20 |
| Esnek Prob ile komple sıcakkanlı Battaniye Sistemi (Orta, 115 VAC, 60 Hz) | Harvard Apparatus | 507222F |
Cerrahi Platform ve Retraktörler:
(Yerel nalburdan satın)
| İsim (anlatma /) | Miktar |
| Paslanmaz Çelik Platformu (Öğütülmüş; ~ 12 "x12" x1 / 8 ") | 1 |
| Düğme Mıknatıslar (Örnek: Eclipse E825) | 3 |
| Paslanmaz Çelik Cıvata (3 "Uzun; Düğme mıknatıslar tarafından belirlenir Çapı) | 3 |
| Paslanmaz Çelik Kuruyemiş (Cıvata Sığdırmak için Büyüklükte) | 9 |
| Kauçuk Gruplar (Işık Gerilim) | 3 |
| Böcek Pins (Ends Hem Hooks Form Bent) | 3 |
Yarı incelir:
| Adı (tanım / miktar) | Tedarikçi </ Strong> | Katalog Numarası |
| Paraformaldehit (1 kg) | Sigma-Aldrich | P6148-1KG |
| Sodyum Fosfat Dibazik Susuz (500 gr; Fosfat Tampon hazırlamak için kullanılır) | Fisher Scientific | S375-500 |
| Sodyum Fosfat mono Susuz (1 kg; Fosfat Tampon hazırlamak için kullanılır) | Fisher Scientific | AC38987-0010 |
| Glutaraldehit (% 50; 10 x 10 mL) | Ted Pella, Inc | 18431 |
| Osmiyum tetroksit (4% Sulu, 10 x 10 mL) | Ted Pella, Inc | 18465 |
| Propilen oksit (450 mL) | Ted Pella, Inc | 18601 |
| Embed 812 (Kit, sert blok / yüksek görüntü kontrastı için) | Elektron Mikroskopi Bilimleri | 14120 |
| ToluidiD Blue (25 g) | Ted Pella, Inc | 19451 |
Tüm Dağı Muscle Hazırlama ve İmmünohistokimya:
| Adı (tanım / miktar) | Satıcı | Katalog Numarası |
| Paraformaldehit (1 kg) | Sigma-Aldrich | P6148-1KG |
| Sodyum Fosfat Dibazik Susuz (500 gr; Fosfat Tampon hazırlamak için kullanılır) | Fisher Scientific | S375-500 |
| Sodyum Fosfat mono Susuz (1 kg; Fosfat Tampon hazırlamak için kullanılır) | Fisher Scientific | AC38987-0010 |
| % 10 BSA seyreltici / engelleme Çözelti (200 mL) | Kirkegaard & Perry Laboratories, Inc | 50-61-00 |
| Triton X-100 (100 mL) | Nokta Bilimsel Incorporated | 9002-93-1 |
| Glisin,% 98 (1 kg) | Fisher Scientific | AC12007-0010 |
| Doku-Tek Cryo-OCT Bileşik (12 Olgu; 4 oz şişe) | Fisher Scientific | 14-373-65 |
| Sylgard DOW 170 (£ 2 Kiti) | Fisher Scientific | NC9492579 |
| Paslanmaz Çelik Böcek Pimler, Boyut 1 (100/pkg) | Güzel Bilim Araçları | 26001-40 |
| Tetramethylrhodamine-A-Bungarotoxin (0.5 mg) | Sigma-Aldrich | T0195-.5MG |
| SMI-312 (0.1 mL) karşı fare monoklonal antikor | Covance | SMI-312R |
| SV2 (0.1 mL) karşı fare monoklonal antikor | Gelişim Çalışmaları Hibridoma Bankası (DSHB) | SV2 |
| Tavşan PolyGAP-43 Karşı klonal antikor | Novus Biologicals | NB300-143 |
| Flöresein Konjuge Keçi anti-fare IgG, Özgül Fcγ Sınıfı 1 | Jackson Immunoresearch | 11 5-095-205 |
| DyLight 649 Konjuge Eşek Anti-tavşan IgG | Jackson Immunoresearch | 711-495-152 |
| 4 ',6-diamidino-2-fenilindol (DAPI, dilactate; 10 mg) | Invitrogen | D3571 |
| Montaj Vectashield Orta (10 mL) | Vektör Laboratuvarları | H-1000 |
| SuperFrost Plus Mikroskop Slaytlar (Beyaz; Boyut: 75 x 25 mm; 144 adet) | Fisher Scientific | 12-550-15 |
| Fisherfinest Premium Kapak Camları (Boyut: 40 x 22 mm, 1 oz Paketi.) | Fisher Scientific | 12-548-5C |
Referanslar
- Pan, Y. A., Misgeld, T., Lichtman, J. W., Sanes, J. R. Effects of neurotoxic and neuroprotective agents on peripheral nerve regeneration assayed by time-lapse imaging in vivo. J. Neurosci. 23, 11479-11488 (2003).
- Magill, C., Tong, A., Kawamura, D., Hayashi, A., Hunter, D. Reinnervation of the tibialis anterior following sciatic nerve crush injury: A confocal microscopic study in transgenic mice. Exp. Neurol. 207, 64-74 (2007).
- Amado, S., Simñes, M. J., Armada-da-Silva, P. A. S., Luís, A. L., Shirosaki, Y. Use of hybrid chitosan membranes and N1E-115 cells for promoting nerve regeneration in an axonotmesis rat model. Biomaterials. 29, 4409-4419 (2008).
- Luís, A. L., Rodrigues, J. M., Geuna, S., Amado, S., Simðes, M. J. Neural cell transplantation effects on sciatic nerve regeneration after a standardized crush injury in the rat. Microsurgery. 28, 458-470 (2008).
- Luís, A. L., Amado, S., Geuna, S., Rodrigues, J. M., Simðes, M. J. Long-term functional and morphological assessment of a standardized rat sciatic nerve crush injury with a non-serrated clamp. J. Neurosci. Methods. 163, 92-104 (2007).
- Baptista, A. F., de Souza Gomes, J. R., Oliveira, J. T., Santos, S. M. G., Vannier-Santos, M. A. A new approach to assess function after sciatic nerve lesion in the mouse - adaptation of the sciatic static index. J. Neurosci. Methods. 161, 259-264 (2007).
- Ronchi, G., Raimondo, S., Varejão, A. S. P., Tos, P., Perroteau, I. Standardized crush injury of the mouse median nerve. J. Neurosci. Methods. 188, 71-75 (2010).
- Berg, A., Zelano, J., Cullheim, S. Netrin G-2 ligand mRNA is downregulated in spinal motoneurons after sciatic nerve lesion. Neuroreport. 21, 782-785 (2010).
- Girolami, E. I., Bouhy, D., Haber, M., Johnson, H., David, S. Differential expression and potential role of SOCS1 and SOCS3 in Wallerian degeneration in injured peripheral nerve. Exp. Neurol. 223, 173-182 (2010).
- Hossain-Ibrahim, M. K., Rezajooi, K., Stallcup, W. B., Lieberman, A. R., Anderson, P. N. Analysis of axonal regeneration in the central and peripheral nervous systems of the NG2-deficient mouse. BMC Neurosci. 8, 80-80 (2007).
- Thornton, M. R., Mantovani, C., Birchall, M. A., Terenghi, G. Quantification of N-CAM and N-cadherin expression in axotomized and crushed rat sciatic nerve. J. Anat. 206, 69-78 (2005).
- Beer, G. M., Steurer, J., Meyer, V. E. Standardizing nerve crushes with a non-serrated clamp. J. Reconstr. Microsurg. 17, 531-534 (2001).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır