Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kök Hücre yüklü Chitosan Mikrokürelerin teslimi için bir Kollajen Hidrojel oluşturma
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Mevcut kök hücre tedavilerinde büyük bir engel konak dokularına bu hücrelerin sunmak için en etkili yöntem belirlemektir. Adipoz kaynaklı kök hücreler kendi multipotency korumasını sağlarken Burada, verimli ve yaklaşım, basit bir kitosan tabanlı dağıtım yöntemi açıklar.
Özet
Multipotent kök hücreleri rejeneratif tıp 1-3 alanında çok faydalı olduğu kanıtlanmıştır. Bununla birlikte, doku rejenerasyonu için etkili bir şekilde, bu hücrelerin kullanmak için, değişken bir dizi dikkate alınmalıdır. Bu değişkenler şunlardır: toplam hacmi ve implantasyon sitenin yüzey alanı, doku mekanik özellikleri ve damarlanma miktarını ve hücre dışı matris bileşenlerini kapsamaktadır doku mikro,. Ana doku taklit eden bir mekanik mukavemet korurken Bu nedenle, bu hücrelerin sağlamak için kullanılan materyallerin belirlenmiş bir kimyasal bileşimi ile biyo-uyumlu olmalıdır. Bu malzemeler ayrıca oksijen ve besin hücrelere tutunur ve çoğalırlar için elverişli bir mikro sağlamak için geçirgen olması gerekir. Chitosan, mükemmel biyouyumluluk bir katyonik polisakkarit, kolayca kimyasal olarak değiştirilmiş ve in vivo mac in ile bağlamak için yüksek afinite edilebilirromolecules 4-5. Chitosan, hücre yapışması, göçü ve çoğalması için bir substrat olarak işlev sağlayan, ekstraselüler matriksin glikozaminoglikan kısmı taklit eder. Bu çalışmada, üç boyutlu bir yapı iskelesi 6 göre kollajen bir içine adipoz-türevi kök hücreleri (Artan) sunmak üzere mikrosferler şeklinde kitosan kullanmaktadır. İdeal bir hücreden mikrosfer oranı inkübasyon süresi ve yüklenmesi olabilir hücrelerin sayısını elde etmek için hücre yoğunluğu açısından değerlendirildi. ASC kitosan mikroküreler (CSM) üzerine ekildikten sonra, bir kollajen iskele gömülü olan ve uzun süre kültüründe muhafaza edilebilir. Özetle, bu çalışmada hassas bir üç boyutlu yapı iskelesi biyomalzemenin içinde kök hücreleri sunmak için bir yöntem sağlar.
Protokol
1. Yalıtımlı Yağ-Türetilmiş Kök Hücre (ASC)
Not: aksi belirtilmediği sürece tüm işlemler oda sıcaklığında yapıldı.
- Sıçan perirenal ve epididimal adipoz yalıtmak ve daha önce 6 açıklandığı gibi% 1 fetal sığır serumu (FBS) içeren steril Hank tamponlu tuz solüsyonu (HBSS) ile yıkayın.
- Doku kıyma ve oda sıcaklığında 8 dakika boyunca 500 g'de 50 mL tüpü ve santrifüj içine% 1 FBS içeren HBSS 25 mL içine 1-2 g transfer.
- Serbest yüzen adipoz doku tabakası ve 125 mL erlen transfer toplayın ve 37 az 45 HBSS kollajenaz tip II (200 U / ml) 25 ml ile tedavi ° orbital çalkalayıcı (125 rpm) C.
- Dikkatle sıvı kısmı (petrol ve yağ tabakası altında) kaldırmak ve 100 mikron ve 70 mikron naylon örgü filtre üzerinden sırayla filtre. Oda sıcaklığında 10 dakika boyunca 500 g'de santrifüje süzüntü, supernatan aspiret ve 25 ml HBSS ile iki kez pelet yıkayın.
- MesenPRO RS Büyüme katkısı, (100 U / penisilin G, 100 ug / mL streptomisin sülfat, ve 0.25 mg / mL Amphotericin B'nin mL) antibiyotik-antimikotik ile desteklenmiş büyüme medyumu (MesenPRO RS Bazal Medium) 50 mL hücre pelletini ve 2 T75 şişeler (25 mL / şişeye) içine 2 mM L-glutamin ve pipet hücreleri.
- Kültür 37 ° C (Artan Tüm deneyler için kullanılan Geçiş 2-4) de bir% 5 CO2 inkübatöründe nemlendirilmiş ASC.
2. Chitosan Mikroküreler (CSM) hazırlanması
Not: aksi belirtilmediği sürece tüm işlemler oda sıcaklığında yapıldı.
- CSM önceki protokolü kullanılarak bir iyonik 6 Koaservasyon tekniği ile birlikte, bir su-içinde-yağ emülsiyonlaştırıcı işlemle hazırlanır. Soya oluşan bir yağ fazı karışımı, 100 mL kitosan, sulu bir solüsyonu (0.5 M asetik asit içinde% 3 ağırlık / hacim kitosan 6 mL), emülsifiyeYağ, n-oktanol (1:2 v / v) ve% 5-sorbitan mono-oleat (p 80) emülsiyonlaştırıcı, karşıt yönlerde, üstten (1700 rpm) ve eş zamanlı olarak manyetik olarak karıştırıldı (1000 rpm) kullanılarak. Erken çapraz bağlama meydana gelmeden önce üzerinde oluşan miseller çözüm kalır ve dibe olamaz karıştırma temin eder bu ikili yöntemi. Dahası, içinde manyetik karıştırıcı yardımcıları misel oluşumu ve rigidization sırasında kitosan de-toplamak.
- Karışım sürekli stabil bir su-içinde-yağ emülsiyonu elde edilene kadar yaklaşık 1 saat boyunca karıştırıldı. İyonik çapraz bağlama 4 saat (24 mL toplam) n-oktanol, her 15 dakika içinde% 1 w / v potasyum hidroksit ile 1.5 mL eklenmesi ile başlatılır.
- Çapraz bağlama Reaksiyonun tamamlanmasından sonra, karışıma yavaş yavaş içeren CSM yağ fazı boşaltacaktır ve hemen aseton 100 mL küreler ekleyin. Yağ fazı, tamamen çıkarılana kadar aseton ile yıkanır küreler.
- Bir vakum desikatörde ve anal olarak kurtarıldı küreler kurulayındaha fazla işlem olmadan yze. Ortalama partikül boyutu CSM, miligram başına yüzey alanı ve birim hacmi kübik parçacık boyutu analiz cihazı ile tespit edildi.
- Sonraki deneyler için, kalıntı tuzları kaldırmak ve mutlak alkol ile sterilize etmek için steril su ile CSM üç kez yıkayın.
3. CSM Serbest Amino Grup Sayısını Belirleme
Not: aksi belirtilmediği sürece tüm işlemler oda sıcaklığında yapıldı.
- Bubins ve Ofner 7 trinitro benzensülfonik (TNBS) asit yöntemi kullanılarak iyonik çapraz sonra CSM mevcut serbest amino gruplarının sayısını belirleyin. 40 ° C'de 4 saat süreyle 50 mL cam tüp içinde% 0.5 TNBS solüsyonu 1 mL mikrosferler 5 mg inkübe ve 2 saat boyunca 60 ° C'de 6N HCI 3 mL ilavesi ile hidroliz.
- Oda sıcaklığına kadar soğumaya örnekleri, ve deiyonize su ile 5 mL etil 10 ml ilave edilerek serbest TNBS özüeter.
- ° C bir su banyosunda 15 dakika oda sıcaklığına kadar soğutulur ve kalan eter, buharlaşma ve 15 ml su ile dilüe etmek için 40 sulu faz bir 5 ml bir örnek ısıtılır.
- Boş ve kitosan amino gruplarının sayısı tespit etmek CSM hazırlanması için kullanılan şekliyle kitosan olmadan TNBS çözeltisi kullanılarak bir spektrofotometre ile 345 nm'de absorbans ölçün. Kitosan göre CSM serbest amino grubu ile kestirilebilir.
4. CSM içinde yükleniyor ASC
Not: aksi belirtilmediği sürece tüm işlemler oda sıcaklığında yapıldı.
- Gece steril HBSS bölümünde 2,5 sterilize CSM 5 mg dengeye ve 8 mikron gözenek büyüklüğüne membran kültür plakası eki (24-iyi plaka) ekleyin.
- CSM zarı üzerine yerleşen sonra, dikkatlice HBSS aspire ve inci büyüme medya ekleme ve 700 uL içine besiyeri 300 uL ekleyinucun dışına e.
- Kültürü plakası içine eklemek CSM içinde büyüme ortamı ve tohum 200 uL uygun konsantrasyonda Pastör pipetiyle ASC (1 x 04-04 Ekim x 10 4). Kültürü insert içinde orta son hacim, tohumlama sonra, 500 uL olup.
- 37 azından% 5 CO2 inkübatöründe nemlendirilmiş 24 saat süreyle CSM üzerine ASC tohumlu inkübe ° C.
5.. CSM içinde ASC Yükleme ve Hücre Uygulanabilirlik Yüzde Belirlenmesi
Not: aksi belirtilmediği sürece tüm işlemler oda sıcaklığında yapıldı.
- Inkübasyondan sonra, insert membran içine göç etmiş hücreleri bozmadan steril bir 1.5 ml mikrosantrifüj tüpüne ASC yüklü CSM toplamak.
- Artık orta çıkarın ve tüp taze besiyeri 250 uL ekleyin.
- Her tüp 25 uL MTT [3 - (4,5-dimethylthiozole-2-il) -2,5-difeniltetrazolium bromür] eklemekçözeltisi (5 mg / mL) ve 37 azından% 5 CO2 inkübatöründe nemlendirilmiş 4 saat süre ile inkübe edilir ° C.
- İnkübasyondan sonra, orta kaldırmak dimetil sülfoksit 250 uL ekleyin ve karmaşık formazan çözünürleştirmek için 2-5 dakika boyunca vorteks karışımı.
- 5 dakika boyunca 2700 x g'de santrifüje CSM, ve referans olarak 630 nm ile 570 nm de ölçüldü süpernatan absorbans belirler.
- Uygulanabilir ASC'nin bilinen numaraları elde absorbans değerine göre CSM ile ilişkili hücre numarasını belirlemek.
6. ASC-CSM-Gömülü Kolajen Jel Karakterizasyonu
Not: aksi belirtilmediği sürece tüm işlemler oda sıcaklığında yapıldı.
- 2 N NaOH kullanılarak pH 6.8 'arındırılmış Bornstein 8 ve fibrillate yöntemine göre, fare kuyruk tendonu ekstrakte tipi 1 kolajen (7.5 mg / mL) karışımı ASC-yüklü CSM (5 mg ≈ 2 x 10 hücre ihtiva eden 4).
- Bir 12-iyi levhaya fibrile kolajen-ASC-CSM karışımı ekleyin ve bir 37% 5 CO2 inkübatöründe nemlendirilmiş azından 30 dakika süreyle inkübe edilir ° C.
- Tam fibrilasyon sonra, 37 ° C kadar bir% 5 CO 2 nemli inkübatörde 14 gün için kolajen-ASC-CSM jeller inkübe
- Jel içine CSM gelen hücrelerin Yayın ve göç standart mikroskopi teknikleri kullanarak gözlenmiştir.
7. Temsilcisi Sonuçlar
Bu çalışmada, bir kollajen jel iskele içine kitosan mikroküreler (CSM) kök hücre sunmak için bir in vitro bir strateji geliştirdik. Birörnek (çapı 175-225 mikron) ve kompozisyon Gözenekli CSM hücre taşıyıcıları (Şekil 2) olarak hazırlanmış ve kullanılmıştır. CSM'den ASC kuluçkaya üzerine, hücreler CSM 2 x 10 cells/5mg 4 arasında bir konsantrasyonda bağlı. Filopodia uzatırken hücreleri, mikroküre yayılan kabil edildimikroküre gözenekli yarıklar (Şekil 3) takın. Hücre yüklenmiş CSM kollajen jel ile karıştırılır edildi sonra, hücreler hemen jeller (Şekil 4) içine göç başladı.
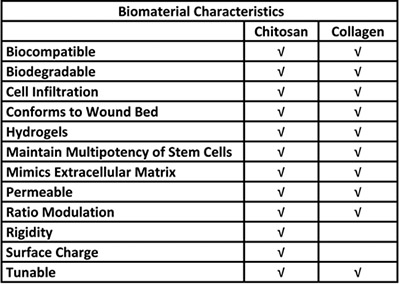
Tablo 1. Bir kök hücre taşıyıcı sisteminde kitosan ve kollajen kullanımı için biyolojik avantajları.
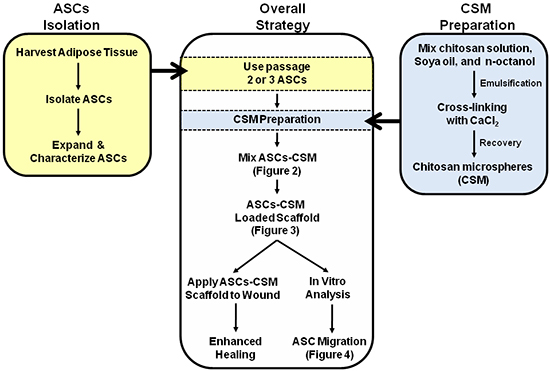
Şekil 1. Şematik ASC-CSM yüklenen kollajen iskelelerinin çift kullanımı için genel bir strateji resmediyor. Şekil 2, 3, ve 4 görüntülerin yorumlanması ile yardımcı şematik içinde açıklamalı.
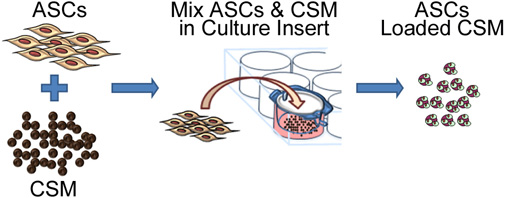
Şekil 2. Şematik kitosan mikroküreler üzerine kök hücrelerin tohumlu süreci resmediyor. Procmikron gözenek büyüklüğü membran kültür plaka insert - ess bir 8 CSM ile birlikte kültür ASC içerir. 24 saat sonra, mikroküreler ekleme kaldırılır ve bir biyomateryal matris içine almasi için hazırdır.
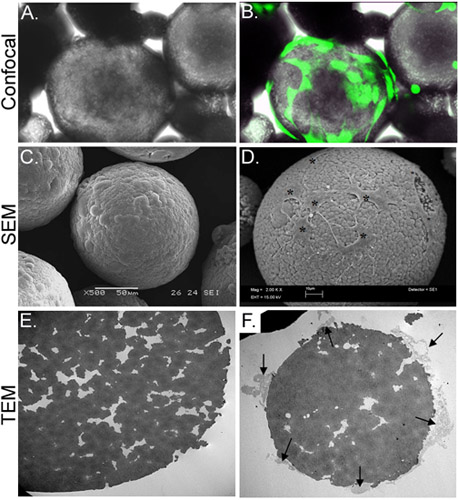
Şekil 3. ASC ile CSM yüklü morfolojik karakterizasyonu. B panelinden konfokal floresan mikroskobu ile elde edilen bir resim ile üst üste aynı görüş alanını gösterirken Panel A, ASC-yüklü CSM bir ışık mikroskobu resmediyor. ASC kalsein AM (yeşil) ile önceden yüklenmiş edildi. Panel D mikroküre (yıldız) yüklenmiştir hücreleri gösterirken Panel C, yüksüz bir mikroküre bir SEM görüntüsü bir görüntü resmediyor. Panel E TEM görüntü yüksüz mikrosfer bir kesitini göstermektedir. Gözenekler ve çatlaklar yapan çok sayıda mikroküre çapında bulunmaktadır. Panel F hücreleri ile kesitli mikroküre (oklar) eklenmiş ve CRE içine filopodia uzanan gösterirmengene. Orijinal büyütme: A & B = 70X; C = 500x, D = 2,000 x; E & F = 2,500 x.

Şekil 4. Üç boyutlu bir yapı iskelesi kollajen içine CSM gelen ASC göçü. Paneller A ve B hücreleri uzak mikroküre geçiş ve 3. günde kollajen matriks (A, oklar) içine CSM betimliyor. Panel B 12 gün sonra, benzer bir kültür gösterir. Transmisyon elektron mikroskobu (TEM) görüntüleri C, D ve C ve D E. Asteriskler tasvir hücreleri mikroküre (oklar) uzak göç ile kesitli olan bir mikroküre göstermektedir. Panel D'nin yüksek büyütmede paneli E tasvir ve kollajen fibriller (ilave) hücresine bağlı filopodia gösterir. Orijinal büyütme: A & B = 100x; C & D = 6,000 x; E = 20.000 x, inset = 150,000 x.
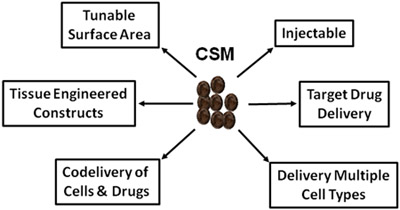
Şekil 5.Şematik rejeneratif tıp ve ilaç teslim CSM geniş kullanım resmediyor.
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Kök hücre tabanlı tedavinin başlıca engellerden biri tamir için belirtilen bölgelere hücrelerin teslimat için etkin yöntemler geliştiriyor. Hastadan hastaya olan değişkenlik nedeniyle, doku tipi, yaralanma boyutu ve derinliği; teslim kök hücre yöntemi bir vaka ile ayrı ayrı tespit edilmelidir. Bir matris içinde kök hücreleri gömerek ve yara yerine onlara teslim doku mühendisliği için bir sonraki mantıklı bir yaklaşım gibi görünse de, bazı teknik engeller devam etmektedir. Bu matris yapı...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Hiçbir rakip mali çıkarlarını var.
Feragatname
Burada yer alan görüşler ya da iddiaların yazarların özel görünümleri ve resmi olarak veya Savunma ya da ABD Hükümeti Bölümü görüşlerini yansıtan tefsir edilmesi değildir. Yazarlar, ABD Hükümeti çalışanları, ve bu çalışma resmi görevlerinin bir parçası olarak hazırlandı. Tüm çalışmalar ABD Ordusu Tıbbi Araştırma ve Malzeme Komutanlığı tarafından desteklenmiştir. Bu çalışma ABD Ordusu Tıbbi Araştırma ve Malzeme Komutanlığı Kurumsal Değerlendirme Kurulu ve onaylanmış protokole uygun olarak tarafından incelenen ve onaylanan bir protokol çerçevesinde yürütülmüştür.
Teşekkürler
DOZ Cenevre Vakfı tarafından verilen bir hibe ile desteklenmektedir. SN Pittsburgh Doku Mühendisliği Girişimi bir Doktora Sonrası Araştırma Bursu Grant tarafından desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif / ekipman Adı | Şirket | Katalog numarası | Yorumlar |
| Hanks BalancedSalt Çözüm (HBSS) | Gibco | 14175 | Sarf |
| Sığır fetüs serumu | Hyclone | SH30071.03 | Sarf |
| Kollajenaz Tip II | Sigma-Aldrich | C6685 | Sarf |
| 70 mikron naylon gözenekli filtre | BD Biosciences | 352350 | Sarf |
| 100 mikron naylon gözenekli filtre | BD Biosciences | 352360 | Sarf |
| MesenPRO Büyüme Orta Sistemi | Invitrogen | 12746-012 | Sarf |
| L-glutamin | Gibco | 25030 | Sarf |
| T75 Doku Kültürü Flask | BD Biosciences | 137787 | Sarf |
| Chitosan | Sigma-Aldrich | 448869 | Sarf |
| Asetik asit | Sigma-Aldrich | 320099 | Sarf |
| N-oktanol | Acros Organics | 150630025 | Sarf |
| Sorbitan-Mono-oleat | Sigma-Aldrich | S6760 | Sarf |
| Potasyum hidroksit | Sigma-Aldrich | P1767 | Sarf |
| Aseton | Fisher Scientific | L-4859 | Sarf |
| Etanol | Sigma-Aldrich | 270741 | Sarf |
| Trinitro benzensülfonik asit | Sigma-Aldrich | P2297 | Sarf |
| Hidroklorik asit | Sigma-Aldrich | 320331 | Sarf |
| Etil eter | Sigma-Aldrich | 472-484 | Sarf |
| 8-um Doku Kültürü Plaka Uçlar | BD Biosciences | 353097 | Sarf |
| 1.5 ml Mikrosantrifüj Tüpler | Balıkçı | 05-408-129 | Sarf |
| MTT Reaktif | Invitrogen | M6494 | Sarf |
| Dimetil Sulfoxide | Sigma-Aldrich | D8779 | Sarf |
| Qtracker Hücre Etiketleme Kiti (Q tracker 655) | Molecular Probes | Q2502PMP | Sarf |
| 1 Kollajen Tip | Travigen | 3447-020-01 | Sarf |
| Sodyum Hidroksit | Sigma-Aldrich | S8045 | Sarf |
| 12-Peki Doku Kültürü Tabaklar | BD Biosciences | 353043 | Sarf |
| Santrifüj | Eppendorf | 5417R | Ekipman |
| Orbital Çalkalayıcı | New Brunswick Bilimsel | C24 | Ekipman |
| Hava-% 5 CO2 ile nemlendirilmiş Kuluçka | Thermo Scientific | Model 370 | Ekipman |
| Tepegöz Karıştırıcı | IKA | Visc6000 | Ekipman |
| Manyetik Karıştırıcı | Corning | PC-210 | Ekipman |
| Vakum Desikatör | - | - | Ekipman |
| Parçacık Boyut Analiz Cihazı | Malvern | STP2000 Spraytec | Ekipman |
| Su Banyosu | Fisher Scientific | Isotemp210 | Ekipman |
| Spektrofotometre | Beckman | Beckman Coulter DU800UV/Visible Spektrofotometre | Ekipman |
| Girdap | Diagger | 3030a | Ekipman |
| Mikroplaka Okuyucu | Molecular Devices | SpectraMax M2 | Ekipman |
| Floresan / Işık Mikroskobu | Olympus | IX71 | Ekipman |
| Konfokal Mikroskop | Olympus | Konfokal Mikroskop FV-500 Lazer | Ekipman |
| Taramalı Elektron Mikroskobu | Carl Zeiss MicroImaging | Leo 435 VP | Ekipman |
| Transmisyon Elektron Mikroskobu | JEOL | JEOL 1230 | Ekipman |
Referanslar
- Krampera, M. Mesenchymal stem cells for bone, cartilage, tendon and skeletal muscle repair. Bone. 39, 678-683 (2006).
- Patrick, C. W. Tissue engineering strategies for adipose tissue repair. Anat. Rec. 263, 361-366 (2001).
- Pountos, I., Giannoudis, P. V. Biology of mesenchymal stem cells. Injury. 36, Suppl 3. S8-S12 (2005).
- Kim, I. Y. Chitosan and its derivatives for tissue engineering applications. Biotechnol. Adv. 26, 1-21 (2008).
- Shi, C. Therapeutic potential of chitosan and its derivatives in regenerative medicine. J. Surg. Res. 133, 185-192 (2006).
- Natesan, S. Adipose-derived stem cell delivery into collagen gels using chitosan microspheres. Tissue Eng. Part. A. 16, 1369-1384 (2010).
- Bubnis, W. A., Ofner, C. M. 3rd The determination of epsilon-amino groups in soluble and poorly soluble proteinaceous materials by a spectrophotometric method using trinitrobenzenesulfonic acid. Anal. Biochem. 207, 129-133 (1992).
- Bornstein, M. B. Reconstituted rattail collagen used as substrate for tissue cultures on coverslips in Maximow slides and roller tubes. Lab Invest. 7, 134-137 (1958).
- Benoit, D. S. Integrin-linked kinase production prevents anoikis in human mesenchymal stem cells. J. Biomed. Mater. Res. A. 81, 259-268 (2007).
- Nuttelman, C. R., Tripodi, M. C., Anseth, K. S. Synthetic hydrogel niches that promote hMSC viability. Matrix Biol. 24, 208-218 (2005).
- Shanmuganathan, S. Preparation and characterization of chitosan microspheres for doxycycline delivery. Carbohydr. Polym. 73, 201-211 (2008).
- Haque, T., Chen, H., Ouyang, W., Martoni, C., Lawuyi, B., Urbanska, A., Prakash, S. Investigation of a new microcapsule membrane combining alginate, chitosan, polyethylene glycol and poly-L-lysine for cell transplantation applications. Int. J. Artif. Organs. 28, 631-637 (2005).
- Goren, A., Dahan, N., Goren, E., Baruch, L., Machluf, M. Encapsulated human mesenchymal stem cells: a unique hypoimmunogenic platform for long-term cellular therapy. FASEB J. 24, 22-31 (2010).
- Zielinski, B. A., Aebischer, P. Chitosan as a matrix for mammalian cell encapsulation. Biomaterials. 15, 1049-1056 (1994).
- Girandon, L., Kregar-Velikonja, N., Božikov, K., Barliç, A. In vitro Models for Adipose Tissue Engineering with Adipose-Derived Stem Cells Using Different Scaffolds of Natural Origin. Folia Biol. (Praha). 57, 47-56 (2011).
- Baruch, L., Machluf, M. Alginate-chitosan complex coacervation for cell encapsulation: effect on mechanical properties and on long-term viability. Biopolymers. 82, 570-579 (2006).
- Wei, Y., Gong, K., Zheng, Z., Wang, A., Ao, Q., Gong, Y., Zhang, X. Chitosan/silk fibroin-based tissue-engineered graft seeded with adipose-derived stem cells enhances nerve regeneration in a rat model. J. Mater. Sci. Mater. Med. , (2011).
- Wang, Q., Jamal, S., Detamore, M. S., Berkland, C. PLGA-chitosan/PLGA-alginate nanoparticle blends as biodegradable colloidal gels for seeding human umbilical cord mesenchymal stem cells. J. Biomed. Mater. Res. A. 96, 520-527 (2011).
- Alves da Silva, M. L., Martins, A., Costa-Pinto, A. R., Correlo, V. M., Sol, P., Bhattacharya, M., Faria, S., Reis, R. L., Neves, N. M. Chondrogenic differentiation of human bone marrow mesenchymal stem cells in chitosan-based scaffolds using a flow-perfusion bioreactor. J. Tissue Eng. Regen. Med. , (2010).
- Kang, Y. M., Lee, B. N., Ko, J. H., Kim, G. H., Kang, K. N., Kim da, Y., Kim, J. H., Park, Y. H., Chun, H. J., Kim, C. H., Kim, M. S. In vivo biocompatibility study of electrospun chitosan microfiber for tissue engineering. Int. J. Mol. Sci. 11, 4140-4148 (2010).
- Bozkurt, G., Mothe, A. J., Zahir, T., Kim, H., Shoichet, M. S., Tator, C. H. Chitosan channels containing spinal cord-derived stem/progenitor cells for repair of subacute spinal cord injury in the rat. Neurosurgery. 67, 1733-1744 (2010).
- Leipzig, N. D., Wylie, R. G., Kim, H., Shoichet, M. S. Differentiation of neural stem cells in three-dimensional growth factor-immobilized chitosan hydrogel scaffolds. Biomaterials. 32, 57-64 (2011).
- Altman, A. M., Gupta, V., RÃos, C. N., Alt, E. U., Mathur, A. B. Adhesion, migration and mechanics of human adipose-tissue-derived stem cells on silk fibroin-chitosan matrix. Acta Biomater. 6, 1388-1397 (2010).
- Altman, A. M., Yan, Y., Matthias, N., Bai, X., Rios, C., Mathur, A. B., Song, Y. H., Alt, E. U. IFATS collection: Human adipose-derived stem cells seeded on a silk fibroin-chitosan scaffold enhance wound repair in a murine soft tissue injury model. Stem Cells. 27, 250-258 (2009).
- Machado, C. B., Ventura, J. M., Lemos, A. F., Ferreira, J. M., Leite, M. F., Goes, A. M. 3D chitosan-gelatin-chondroitin porous scaffold improves osteogenic differentiation of mesenchymal stem cells. Biomed. Mater. 2, 124-131 (2007).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır