Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Alerjen Bağlı Astım murin Modeli
Bu Makalede
Özet
Alerjik astım Deneysel fare modelleri hastalığı patogenezinde okuyan ve yeni ilaçlar geliştirmek için yeni olanaklar sunar. Bu modeller de alerjik immün yanıt, hava yolu inflamasyonu ve pulmoner patofizyolojisi yöneten ölçüm faktörleri için uygundur.
Özet
Astım dünyada 300 milyon kişiyi etkileyen, morbidite ve mortalitenin önemli bir nedenidir. ABD nüfusunun 1 fazla% 8 yaygınlığı artan, astım vardır. 2 büyük ölçüde kolaylaştıracağını diğer hastalıklar, alerjik solunum yolu hastalığı hayvan modellerinde olduğu gibi patofizyolojisinin anlaşılması, terapötik hedefleri belirlemek, yardım ve olası yeni tedavilerin klinik öncesi testler sağlar. Allerjik solunum yolu hastalığı Modelleri Çeşitli hayvan türlerinde geliştirilen, ancak sıçan modellerinde düşük maliyet, hazır durumu ve bu hayvanların iyi karakterize bağışıklık sistemleri nedeniyle, özellikle cazip olmuştur. Transgenik suşlarının çeşitli 3. Yer daha çekiciliğini arttırır Bu modellerin. biz allerjik solunum yolu hastalığının iki sıçan modellerinde tarif Burada 4, antijen olarak istihdam ovalbumin hem de. Intraperitoneal tarafından ilk duyarlılığın, bir model deliv ardındannebulizasyon, intratrakeal teslimi ile diğer tarafından antijen ers. Bu iki model her insan astım önemli özellikleri taklit ile, tamamlayıcı avantajları sunuyoruz. 5
Ve eozinofil zengin hava yolu inflamasyonu, akut astım başlıca özellikleri gibi metakolin (AHR hava yolu aşırı duyarlılığı) gibi uyaranlara karşı abartılı bir hava yolu yanıtı içerir. Bu da bizim fare modelleri, 5,6 de allerjen belirgin etkileri nelerdir ve biz onlara ölçüm teknikleri açıklamak ve böylece deneysel manipülasyon etkilerini değerlendirmek. Özellikle, hava yolu aşırı duyarlılığı ölçüm yanı sıra hava yolları ve akciğer içine inflamatuar hücre infiltrasyonu değerlendirilmesi için yöntemler için hem de 7 invaziv ve non-invaziv 8 teknikleri anlatıyoruz. Akciğer histopatolojisi organın her inflamasyon belirteçleri değerlendirmek için kullanılırken, Havayolu inflamatuar hücreler bronkoalveoler lavaj tarafından toplanmaktadır. Buteknikleri insanlarda mümkün olmazdı şekilde astımı eğitim için güçlü araçlar sunuyoruz.
Protokol
I. Alerjen duyarlılığı ve Challenge (bkz. Şekil 1)
Intratrakeal Mücadelesi için A.
- İlk sensitizasyon için, ovalbumin 20 ug (; Sigma-Aldrich, St. Louis, MO OVA) ile birlikte günde 0 ve tekrar 7. günde erkek ya da dişi C57BL / 6 ya BALB / c farelerinin (6-8 haftalık) periton içine enjekte Steril fosfat 0.2 ml emülsifiye alüminyum hidroksit ile 2 mg (Sigma-Aldrich) içeren salin (PBS) tamponlu veya kontrolü gibi steril PBS içerisinde 0.2 ml 2 mg alüminyum hidroksit ile.
- Uygun olarak antijen ile challenge (örneğin, günde 14, 16, 18 ve 20 üzerindeki). Mücadelesi prosedürü takip eder.
- Intraperitoneal ketamin bir karışımı (ip) enjeksiyonu (90 mg / kg) ve Xylazine (10 mg / kg) ile anestezi fare. Fare, en azından 10 dakika için tam olarak anestezi uygulanmış olmasına dikkat edin.
- 45 derece veya daha az Açısı işlemi yüzey. Bu yukarı doğru ventral taraf tutmak yüzeyi ve üst baş koyun fare.
- Kanca tgeri kafa tutmak için ön kesici dişler altında hread. Seviye trakea düz sağlamak ve bacaklarını tutmak için etiket şerit kullanmak birbirleriyle pençeleri. % 70 EtOH ve çubukla cerrahi alan ıslatın.
- Insizyon yerinde lokal bupivakain (% 0,25 solüsyonu 0.1 ile 0.2 ml) uygulayın.
- Nip forseps ile boğaz üzerindeki deri ve hafifçe dışarı doğru çekin. Cerrahi makas ile küçük bir düşey kesi olun. Insizyon boyutu en aza indirin.
- 50 PBS ul veya PBS içinde% 0.1 OVA ile 1 ml şırınga hazırlayın ve tekrarlayan bir pipet (Tridak Step, Torrington) takın. Bir elinde pipet alın ve cımbız ile geri doku tutmak için diğer kullanmak ve trakea ortaya.
- Mümkün olduğunca trakea paralel olarak şırınga Holding, trakea duvarı boyunca iğne takın ve çözüm enjekte edin.
- Akciğerlere yerleşip çözüm için zaman tanımak için dikey aşağıdaki enjeksiyon fare koruyun.
- Yavaşça ve sterilely yakın yara alan ilesütür ile cımbız ve mühür.
- Yer fare bir ısıtma yastığı sternumun aşağı ve tamamen ayaktan kadar kurtarmak için izin verir. Yara tamamen iyileşene kadar düzelmesini, hayvan bakım tesisi için fareyi dönmek ve seroma, iltihap veya enfeksiyon ve yara açılması belirtileri için günlük olarak izliyoruz.
Nebulizasyon tarafından Mücadelesi B.
- Kontrol olarak, steril PBS içinde 0.2 ml alüminyum hidroksit ile 2 mg (Sigma-Aldrich) içeren steril bir 0.2 ml PBS içerisinde ya da 2 mg alüminyum hidroksit ile emülsiyon haline OVA ve 20 ug intraperitoneal (Sigma-Aldrich) ile 0. günde farelere sensitize .
- Yukarıda açıklandığı gibi 14. günde, ip enjeksiyon duyarlılığa artırmak.
- 21., 22., 23., 24. ve 25. gün sonra bir ultrasonik nebülizatör (Buxco Araştırma Sistemleri, Wilmi ile teslim tek başına nebülize% 1 OVA veya PBS ile 30 dakika süreyle maruz ilk hassasiyete, meydan farelerengton, NC).
- WBP ana odacık içinde yer fareleri;, en azından 10 dakika süreyle pletismografisi odacık içinde bunları alışmak.
- Bir fincan nebülizatör ile steril PBS veya aşağıdaki adımları 4-6 açıklanan steril PBS, yalnız% 0.1 OVA Yeri 1 ml. 30 dakika boyunca Nebülize.
- Nebulizatör fincan çıkarın ve kalan çözüm atın.
- Nebülizasyon eşzamanlı olarak, bir odacık nebülizasyon kullanılarak bütün fareler üzerinde gerçekleştirilebilir.
II. Metakolin için hava yolu aşırı duyarlılığı Belirlenmesi
Tüm vücut Pletismografi tarafından hava yolu aşırı duyarlılığı A. Noninvaziv Ölçümü (WBP; Buxco Araştırma Sistemleri, Wilmington, NC)
- Toz metakolin şişe açmadan önce oda sıcaklığına kadar ısınmasını bekleyin (metakolin çok higroskopiktir ve su absorbe izin işe yaramaz öbekler şeklinde olacak). Steril PBS içinde bir 200 mg / ml stok çözeltisi hazırlanır, ardından 2-kat seri seyreltiler (örn., 100, 50, 25, 12.5 ve 6 hale0,25 mg / ml). Çözümler soğuk tutun.
- Aşağıdaki gibi ekipmanları ayarlayın: nebülizatör, hava pompasına önyargı-akış giriş ve dar lastik boru kullanılarak gaz tuzak WBP prizine WBP ana girişine bağlayın. WBP ana ve referans odaların satış köprü basınç sensörü takın. Verilen kabloları ile preamplifier için basınç sensörü bağlayın ve özel bir veri toplama kartı kullanarak bilgisayara preamplifikatör bağlayın.
- Üretici tavsiyelerine göre yazılımını kullanarak preamplifikatör kalibre.
- WBP ana odasında Yeri fareler, 3 dakika sonra en az 10 dakika, kayıt bazal değerleri (Penhbase) için pletismografisi odasında onları iklime alıştırmak.
- Nebulizer fincan steril PBS Yeri 1 ml. 2 dakika süreyle Nebülize ve daha sonra kurutma aşamasında ek bir 6 dakika için solunum değişkenlerin kontrol. Nebulizatör fincan çıkarın ve kalan PBS atın.
- Nebulizer fincan ve r 6.25 mg / ml metakolin Yeri 1 ml2 dakika artı bir 6 dakikalık izleme döngüsü için EPEAT nebulizasyon.
- Aynı 2-min nebülizasyon süresi ve 6-dakika izleme döngüsü kullanarak, 12.5, 25, 50 ve 100 mg / ml metakolin ile ölçümü tekrarlayın.
- Odalarından farelerin çıkarın ve kafese onları geri.
- Dolum nebulizatör 1 ml steril PBS ile fincan ve boru temizlemek için başka bir dizi çalıştırın.
- , Hava akımları kapatın sökmeye ve hayvanların ikinci bir set çalıştırmadan önce tüm odaları temiz silin.
Bilgisayar kontrollü Vantilatör tarafından Havayolu Duyarlılık B. İnvaziv Ölçümü (flexiVent; SCIREQ A.Ş., Montreal, Kanada)
- Fare tartılır ve kg sodyum pentobarbital başına 60 mg intraperitoneal (ip) enjeksiyonu ile uyutmak.
- Yeterli anestezi, pozisyon ventro-dorsal trakeostomi için farelerin ardından.
- % 70 etanol ile boyun deri dezenfekte. I da topikal olarak bupivakain (% 0.25 çözeltisi 0,1-0,2 ml) uygulamakncision sitesi. Boyun derisi kesilirken ve açın. Boyun kasları ayırın ve trakea ortaya.
- Ince makas ile trakeada 2 mm kesi (trakea koparmaya değil emin olmak) ve dikkatli trakeal tüpü - 1 yapın. Bir hava kaçağı önlemek için trakea etrafında bir sütür bağlayın.
- Vü odasında fare Lay ve ventilatöre takılı tüp bağlayın.
- Mekanik ventilasyon başlayın. Uygun solunum hızı ve tidal / atım hacmi (150 vuruş / dk ve 200 ul, sırasıyla 20 g fare) ayarlayın. Toraks ventilatör ile senkronize hareket ediyor emin olun. Fare ventilatör (öz-solunum) ile "kavga" ise, daha fazla anestezik enjekte ve senkronizasyon için bekleyin.
- Başlangıç ölçümlerinin ardından, başka bir 3 dakika temel havalandırma altında bulunan farelerin korumak ve sonra empedans ölçümleri kümesi 2. alır. Başlangıç ölçümleri kümesi Bu 2. kalk için kullanılırortalama başlangıç değerleri ulate.
- Ultrasonik nebulizatör ile ventilatörden kanalize inspiratuar akış PBS veya metakolin (MCh) zorlukları (6.25, 12.5, 25, 50 ve 100 mg / ml) sunun.
- MCh her uyarım (6.25, 12.5, 25, 50 ve 100 mg / ml), sonra, 120 solunum / dak 10 ml / kg 'lık bir Vt sunma piston döner ve empedans ölçümleri alır.
III. Hava sahası içine Hücresel İnfiltrasyonunun Ölçümü
A. Perform'un Bronkoalveoler Lavaj (BAL)
- AHR ölçüldükten sonra, CO 2 fareler euthanize ve cerrahi yastığı, sırtında her fare yerleştirin.
- % 70 EtOH ile alan ıslatın.
- Alt karın başlayarak, karın boşluğu kesip açmak ve kaburgaların doğru yukarı hareket, deri / kas üst kaldırın.
- Kaburga görünür sonra, dikkatle ponksiyon diyaframa makas kullanın. Akciğerler, diyafram uzak daraltmak gerekir. Özellikle ca olunreful değil nick akciğer veya kalp için.
- Tam akciğer / kalp (site dolum kan tutmak için herhangi bir büyük kan damarları kesme önlemek) ortaya çıkarmak için göğüs kafesi kesti.
- 27 gauge iğne (BD şırıngalar, Franklin Lakes, NJ), delinme kalp ventrikülleri ve yavaş ve dikkatli kan toplamak için şırınga geri çekin ile 1 ml şırınga kullanma. Kalp çöken özen göstermeli.
- Standart protokolü kullanarak bu kandan serum toplayın. -70 ° C'de saklayın kullanılıncaya kadar.
- Trakea ortaya kadar cilt ve boğaz doku kesti. Alanı içinde kolayca çalışmak için yeterli doku temizlemek (tekrar, herhangi bir büyük kan damarları kesme kaçının).
- Bir yolunu temizlemek için trakea altında kesilen kavisli makas, kullanma.
- Trakea altında kavisli bir forseps noktası Pass ve sütür bir parça sonunda kavramak. Trakea altında dikiş ipliğinin çizin.
- Boğaz düşük, trakea hakkında yarım düğüm gevşek bir bağla.
- Carefully dikiş ipliğinin üstünde, kanül için boyut yeterli, bir çentik kesti.
- Dikkatle dikiş ipliğinin noktadan deliğe ve trakeanın aşağı kanül takın. Kanül sadece (:;: BAL kurtarmak için çalışırken çöküşü trakea çok kısa ponksiyon akciğerler çok uzak) akciğerlere girişinde çıkana kadar yavaşça ileri tuşuna basın.
- Kanül etrafında trakea mühürlemek için dikiş ipliğinin ve tam düğüm sıkın.
- Kanül Lock şırınga (1 ml PBS) ve yavaşça akciğer içine sıvı basın. Akciğer lobları ayrı ayrı yavaş şişirmek gerekir. Aşırı doldurma yapmayın. Tam yetiştirilen fare 0,9-1,0 ml mutlak maksimum. 0.8 ml güvenli olabilir. Kanül için gevşek şırınga kilitle, aksi halde boşa çalışırken hasara neden olabilir.
- Akciğerlerde sıvı çekin. Direnç varsa (kanül içine çekilir doku), basın kanül yavaşça akciğer içine daha fazla ve çıkarma devam. Ayrıca yerinde kanül döndürmeyi deneyin. Durumunda bütün else başarısız, kanül kısmı yol çekme; trakea daha bu durumda daraltmak muhtemeldir.
- Kanül, konteyner içerisinde mevduat BAL sıvısı, gelen şırınga ayırın ve taze PBS çözeltisi ile 2 kez tekrarlayın.
- Aşağı bükülmüş kadar buz üzerinde BAL çözüm tutun.
- BAL sıvısı ve ticari fare IgE ELISA kitleri (MD Bioproducts, St Paul, MN) kullanarak OVA spesifik IgE ölçmek için serum kullanın.
B. Hücreleri sayın ve Diferansiyeller belirleyin
- ~ 600 × g BAL sıvısı 5 dakika, 4 ° C'de santrifüje
- PBS içinde yavaşça hücre pelletini ve buz üzerinde tutun.
- Seyreltilmiş hücre süspansiyonu ile standart bir Neubauer hemasitometre yükleyin ve hücreleri saymak.
- Cytospins için 10 ile 40 ul hacim içinde 2 alikotları × 10 4 hücre çıkarın. Gerekirse hücreleri sulandırınız.
- Cytospins için, 2 mix × 10 4 hücre, 130 ul PBS ve 10 ul FBS. Şüphe etmek, tüm hücre karışımı ekleyinle Sitospin yinelenen örnekler için çift cytoslides kullanarak, 700 rpm'de 10 dakika huni ve santrifüj.
- Slaytlar boyamadan önce 1 saat boyunca oda sıcaklığında kurumaya bırakın.
- (Siemens, Newark, DE) Diff-Quick leke kullanarak slaytlar Leke.
IV. Temsilcisi Sonuçlar
Provakatif uyaranlara takip Aşırı havayollarındaki konstriksiyon klinik astım önemli bir özelliğidir. FlexiVent sistemi (Şekil 3) ile Tüm-vücut pletismografisi (Şekil 2) ve zorlanmış salınımlar: Biz OVA-duyarlı ve meydan farelerde metakoline gibi hava yolu aşırı duyarlılığı ölçmek için iki yöntem açıklanmaktadır. Her iki yöntem OVA sensitizasyon ve meydan farelerde hava yolu aşırı duyarlılığı üretir göstermektedir.
Eozinofil zengin hava yolu inflamasyonu klinik astım ve alerjik solunum yolu hastalığı hem de bir başka önemli özelliğidir. Şekil 4 'de gösterildiği gibi , OVA sensitizasyon ve meydan büyük ölçüde BAL tarafından hava yolları elde edilebilir hücrelerinin toplam sayısını artırır. Daha az bir ölçüde eozinofil ve sayıları, nötrofil özellikle artar.
Kanıt IgE antikorlarının aşırı gelen duyarlılaştırıcı antijenlere karşı allerjik solunum yolu hastalığı sonuçları gösterir. Bizim tarif protokolleri kullanarak OVA ile sensitizasyon ve meydan tedavi edilen farelerin serum ve BAL hem sıvı (Şekil 5) IgE düzeyleri artar.
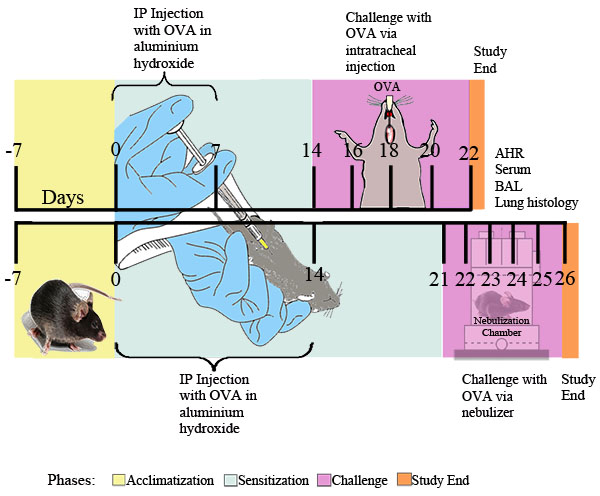
Şekil 1.. OVA bağlı alerjik astım için deneysel şeması. Fareler takip edilen, steril PBS, ya da steril PBS tek başına 0.2 ml alüminyum hidroksit ile 2 mg 0,2 ml, alüminyum hidroksit 2 mg emülsifiye OVA ve 20 ug ile duyarlı hale getirilmiş iki ip edildi onun tarafından belirtilen zaman noktalarında 0.1 OVA% veya steril PBS çözeltisi ile veya günlük ex meydan PBS veya PBS içinde% 1 nebülize OVA için 30 dakika süreyle posure tek başına bir ultrasonik nebülizatör (Buxco) vasıtasıyla sevk. Yirmi dört saat nihai OVA maruz kaldıktan sonra, havayolu duyarlılığı tespit edildi. Daha sonra, BAL sıvısı, kan örnekleri, akciğer hücreleri, doku ve daha fazla analiz için toplanmıştır.
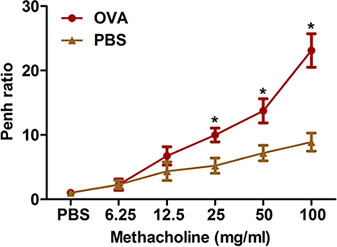
Şekil 2. Noninvaziv bir yöntem ile alerjene bağlı hava yolu aşırı duyarlılığı Değerlendirilmesi. Fareler (n = 4/group) duyarlıydı ve OVA ile meydan okudu. Son meydan takiben yirmi dört saat, metakolin inhalasyon için hava yolu aşırı olarak protokolde tarif tüm vücut pletismografisi kullanılarak belirlendi. Penh belirlenir ve Penh oranı (PBS ile 8-dk aralığındaki ortalama Penh bölünmesiyle metakolin ile 8-dakikalık bir zaman aralığı boyunca ortalama Penh) olarak ifade edildi. * P <0.05 vs PBS.
iles/ftp_upload/3771/3771fig3.jpg "/>
Şekil 3. Invazif bir yöntem ile alerjene bağlı hava yolu aşırı duyarlılığı Değerlendirmesi (zorla salınım). Fare (n = 4/group) duyarlıydı ve OVA ile meydan okudu. Son meydan takiben yirmi dört saat, metakolin inhalasyon konsantrasyonları artan havayolu aşırı olarak protokolde tarif zorla osilasyon (flexiVent) metodu ile tespit edildi. A, B) Havayolu direnci; C) Akciğer elastiki. * P <0.05 vs PBS.
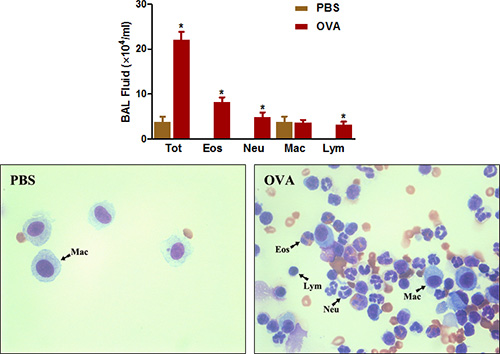
Şekil 4. BAL sıvısı hücre sayımı. Fareler (n = 4/group) duyarlıydı ve OVA ile meydan okudu. Son meydan, (Üst) takiben Yirmi dört saat BAL hücreleri toplanmış ve protokol açıklandığı gibi toplam hücre sayıldı. (Alt) Sitospin slaytlar p edildirepared ve Diff-Quick ile boyandı. Tot = toplam hücreleri; Eos = eozinofiller; Neu = nötrofiller, Mac = makrofajlar; LYM = lenfositler. * P <0.05 vs PBS.
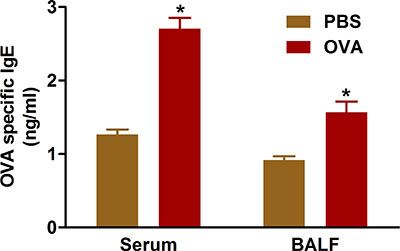
Şekil 5. OVA-spesifik IgE. Fareler (n = 4/group) duyarlıydı ve OVA ile meydan okudu. Son meydan takiben yirmi dört saat, IgE lavajda ve protokolde tarif edildiği gibi kalp ponksiyonu ile toplanır kandan serum ölçüldü. * P <0.05 vs PBS.
Tartışmalar
Allerjik solunum yolu hastalığının hayvan modelleri klinik astım ile ilgili çalışmalar için önemli bir araç sağlar. Değişik tür ve istihdam antijenleri farklı modelleri, bir dizi geliştirilmiştir. Fare, bir çekici ve sık kullanılan laboratuvar türleri, alerjik solunum yolu hastalığı modelleri için bir çok avantaj sunuyor. 9,10 gibi modeller üretmek için özellikle zor olan, kronik hastalığı yönleri ile her bakımdan astım, 11 taklit etmese de, 12,13 biz ...
Açıklamalar
Hayvanlar üzerinde deney protokolü # V010-10 kapsamında Atlanta VAMC IACUC Komitesi tarafından belirtilen kurallar ve düzenlemelere uygun olarak yapılmıştır.
Teşekkürler
Bu çalışma NIH hibe HL093196 (RCR) ve Atlanta Araştırma ve Eğitim Vakfı (Aref) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Malzeme Adı | Şirket | Katalog Numarası | Yorumlar |
| Ovalbumin | Sigma-Aldrich Louis, MO | A5503 | |
| Alüminyum hidroksit | Sigma-Aldrich | 239186 | |
| Asetil-β-methylcholine klorür | Sigma-Aldrich | A2251 | |
| Pentobarbital sodyum tuzu | Sigma-Aldrich | P3761 | |
| Tüm vücut pletismografisi (WBP) sistemi | Buxco Araştırma Sistemleri Wilmington, NC | http://www.buxco.com | |
| FlexiVent | SCIREQ, Inc Montreal, Kanada | http://www.scireq.com | |
| Işık mikroskobu | Leica Microsystems, Inc Buffalo Grove, IL | ||
| Sitospin 4 | Thermo Scientific Asheville, NC | ||
| Diff-Quick leke | Siemens Newark, DE | B4132-1A | |
| Tekrarlanan pipet | Tridak Torrington | STP4001-0025 |
Referanslar
- Braman, S. S. The global burden of asthma. Chest. 130, 4S-12S (2006).
- Akinbami, L. J., Mooman, J. E., Liu, X. Asthma Prevalence, Health Care Use, and Mortality: 2005-2009. National Health Statistics Reports. 32, 2005-2009 (2011).
- Bates, J. H., Rincon, M., Irvin, C. G. Animal models of asthma. Am. J. Physiol. Lung. Cell. Mol. Physiol. 297, 401-410 (2009).
- Drazen, J. M., Finn, P. W., De Sanctis, G. T. Mouse models of airway responsiveness: physiological basis of observed outcomes and analysis of selected examples using these outcome indicators. Annu. Rev. Physiol. 61, 593-625 (1999).
- Epstein, M. M. Do mouse models of allergic asthma mimic clinical disease. Int. Arch. Allergy Immunol. 133, 84-100 (2004).
- Blyth, D. I., Pedrick, M. S., Savage, T. J., Hessel, E. M., Fattah, D. Lung inflammation and epithelial changes in a murine model of atopic asthma. Am. J. Respir. Cell Mol. Biol. 14, 425-438 (1996).
- Martin, T. R., Gerard, N. P., Galli, S. J., Drazen, J. M. Pulmonary responses to bronchoconstrictor agonists in the mouse. J. Appl. Physiol. 64, 2318-2323 (1988).
- Hamelmann, E. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156, 766-775 (1997).
- Gelfand, E. W. Pro: mice are a good model of human airway disease. Am. J. Respir. Crit. Care Med. 166, 5-8 (2002).
- Shapiro, S. D. Animal models of asthma: Pro: Allergic avoidance of animal (model[s]) is not an option. Am. J. Respir. Crit. Care Med. 174, 1171-1173 (2006).
- Zosky, G. R. Ovalbumin-sensitized mice are good models for airway hyperresponsiveness but not acute physiological responses to allergen inhalation. Clin. Exp. Allergy. 38, 829-838 (2008).
- Nials, A. T., Uddin, S. Mouse models of allergic asthma: acute and chronic allergen challenge. Dis. Model. Mech. 1, 213-220 (2008).
- Wenzel, S., Holgate, S. T. The mouse trap: It still yields few answers in asthma. Am. J. Respir. Crit. Care Med. 174, 1173-1178 (2006).
- Rayamajhi, M. Non-surgical Intratracheal Instillation of Mice with Analysis of Lungs and Lung Draining Lymph Nodes by Flow Cytometry. J. Vis. Exp. (51), e2702 (2011).
- Swedin, L. Comparison of aerosol and intranasal challenge in a mouse model of allergic airway inflammation and hyperresponsiveness. Int. Arch. Allergy Immunol. 153, 249-258 (2010).
- Gueders, M. M. Mouse models of asthma: a comparison between C57BL/6 and BALB/c strains regarding bronchial responsiveness, inflammation, and cytokine production. Inflamm. Res. 58, 845-854 (2009).
- Zhu, W., Gilmour, M. I. Comparison of allergic lung disease in three mouse strains after systemic or mucosal sensitization with ovalbumin antigen. Immunogenetics. 61, 199-207 (2009).
- Flandre, T. D., Leroy, P. L., Desmecht, D. J. Effect of somatic growth, strain, and sex on double-chamber plethysmographic respiratory function values in healthy mice. J. Appl. Physiol. 94, 1129-1136 (2003).
- Hoymann, H. G. Invasive and noninvasive lung function measurements in rodents. J. Pharmacol. Toxicol. Methods. 55, 16-26 (2007).
- Chong, B. T., Agrawal, D. K., Romero, F. A., Townley, R. G. Measurement of bronchoconstriction using whole-body plethysmograph: comparison of freely moving versus restrained guinea pigs. J. Pharmacol. Toxicol. Methods. 39, 163-168 (1998).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır