Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Enzim immobilizasyonu ve stabilizasyonu için hidrofobik Tuz-modifiye Nafion
Bu Makalede
Özet
Bu makale, hidrofobik olarak modifiye edilmiş Nafion enzim immobilizasyon membranı ve nasıl membran içindeki protein ve / veya enzim hareketsiz ve spesifik aktivite için test etmek için sentez prosedürü tarif edecektir.
Özet
Son on yılda, biyokataliz, biyosensörler ve biyo yakıt pilleri de dahil olmak üzere tutuklanmış ve stabilize enzimleri için uygulama bir zenginlik olmuştur. En bioelectrochemical uygulamalarda 1-3, enzim veya organel bir çeşit kullanımı ile bir elektrot yüzeyine immobilize edilir polimer. Bu polimer iskele enzimler stabil tutmak ve matriks dışında molekül ve iyonları basit difüzyon için izin vermelidir. Immobilizasyon bu tür polimerler için kullanılan en poliaminler ya polialkollerdir dayanmaktadır - bunlar, hidrojen veya iyonik bağ yoluyla enzim saklanması ve stabilize bu enzimin doğal ortamda taklit eden polimerler. Enzimlerin stabilitesi için başka bir yöntem enzimler saklanması ve stabilize hidrofobik bölgeler içermesi miseller, kullanımını içerir. Özellikle 4,5, Minteer grubu, piyasada bulunan Nafion dayanan bir micellar polimer geliştirmiştir. 6,7 Nafionkendisi proton ve diğer küçük katyonlar arasında kanalı-assisted difüzyonu için izin veren bir micellar polimer, fakat miselleri ve kanallar son derece küçük olduğu ve polimer enzim harekersizliği için elverişsiz olduğu sülfonik asit yan zincirleri, nedeniyle çok asittir. Bununla birlikte, bu tür Nafion tetrabutilamonyum bromür (TBAB) gibi hidrofobik alkil amonyum tuzları bir fazlası ile karıştırıldığı zaman, kuaterner amonyum katyonları ve proton yerine polimer yan zincirleri (Şekil 1) üzerine sülfonat gruplarına karşı iyonların hale gelir. Böyle nikotinamid adenin dinükleotid (NAD) gibi enzimatik işlevi için gerekli olan geniş bir substrat ve iyon difüzyonu için izin vermek polimer içindeki büyük miselleri ve kanalları ile sonuçlanır. Bu modifiye Nafion polimer biyosensör ve biyo hücreleri kullanılmak üzere pek çok değişik enzim türleri gibi mitokondri immobilize etmek için kullanılmaktadır. 8-12 Bu kağıt Bu mikrofon yapmak için yeni bir yöntem açıklanmaktadırenzimler stabilize ellar polimer enzim immobilizasyon membran. Misel enzim immobilizasyon membran, membran içindeki enzimler immobilizing için prosedür ve immobilize enzimin enzim spesifik aktivitesi eğitimi için tahlillerin sentezi aşağıda ayrıntılı olarak açıklanmıştır.
Protokol
1. Kuaterner Amonyum Tuzları ile Nafion Modifikasyonu
- Yaklaşık kuvvetlice% 5 w / v Nafion süspansiyon bir şişe çalkalanır. Bu Nafion sağlamak için 30 saniye çözelti içinde eşit şekilde süspanse edilir.
- Bir cam şişeye (şişeye hacmi 2.5 ml ila 10 ml içerebilir) içine artık tekrar askıya Nafion 2 mL dışarı Pipeti.
- Bir 3-kat molar fazlalıktan (Nafion polimer üzerindeki sülfonik asit grupları oranla) alkil amonyum bromür tuzu (uygun kütleler Tablo 1 'de gösterilmiştir) ile ölçülür ve Nafion 2 mL ihtiva eden bir şişeye, bu ekleyin.
- 10-15 dakika 1500 rpm'de Vortex flakon.
- Yaklaşık ölçen bir plastik tartım tepsisine viskoz solüsyonu dökün. 3 x 3 inç ve tartım tepsiye tüpten kalan çözüm aktarmak için bir pipet kullanın.
- Çözücüler tartım tepsinin alt (Fi sarı / kahverengi, şeffaf film bırakarak, tartmak tekne dışarı buharlaşmasına izinGure 2). Çözücü buharlaştırma ile oranı da buharlaştırmak için tüm solvent için birden fazla 6 saat sürer ki bu olmalıdır. Çözücü buharlaşır çok hızlı, bir beyaz, kabuklu malzemenin polimerin micellar yapısı tahrip olmuştur belirten bir saydam film yerine oluşturacak ve prosedür tekrar başlaması gerekir. Solvent buharlaşması çok yavaş ise buharlaşma çok yavaş tipik bir yapışkan, portakal jel yol ve yordamı yeniden başlamalıdır, çünkü bir de nemlendirici, gerekli olabilir. 37 ° C - solvent buharlaşması için tipik sıcaklık aralıkları 20 olan Kurutma için gerçek koşulları odasında bağıl nem ve sıcaklık bir fonksiyonu vardır, ama önemli olan jel oluşumuna imkan vermek için kuruma misel yapısını korumak için yavaş olmak, ama çok yavaş olduğunu.
- Dolgu 18M Ωcm de-iyonize su (su, 10-20 ml), kapak ile tekne tartmak ve fazla alkil amonyum bromür tuzları ve HBr kaldırmak için 12-24 saat suda bekletiniz.
- suyu (ya da pipet) dökün ve tepsiyi her zaman doldurmak için yeterli DI su ile 3 kez yıkayın. Bu adım esnasında polimer filmin herhangi bir kaybetmemek için dikkatli olun.
- Polimer Bu noktada tamamen kuruduktan sonra ortaya oturmak tartım tepsisi İzin, polimer açık ve biraz kırılgan plastik film olmalıdır. Hava çok rutubetli Yine, bir nem-zamanında buharlaşma tamamlamak için gerekli olabilir.
- Spatula kullanarak, dikkatli bir şekilde tartım tepsiden kurutulmuş filmi çıkarın ve temiz bir cam şişeye aktarın.
- 2 mL etanol ve 3 seramik karıştırma boncukları ve 4 saat boyunca vorteks eklemek veya polimer filmi tamamen yeniden süspanse kadar.
2. Aktivite Tahliller için TBAB-Modifiye Nafion içine Enzimlerin immobilizasyonu
- Kuru bir enzim, bir 1.5 ml mikrosantrifüj tüp içine enzim 1-10 mg tarttın, ve bir 1-10 mg / ml enzim çözeltisi oluşturmak için 100 mM pH 7 fosfat tampon 1 ml ilave edilir. For çözelti içinde bir enzim, protein miktarını belirlemek için, bir bicinchoninic asit (BCA) test 13 kullanmak ve 1-10 mg / mL kadar protein konsantrasyonu getirmek için 100 mM fosfat tampon maddesi ile uygun bir miktarda ilave edin. 1-10 mg / mL, genellikle 1-50 nanomol / mL 'ye karşılık gelir.
- 1 mg / ml enzim çözeltisinin 120 uL için, 10 saniye için 60 alkil amonyum ile modifiye Nafion ® çözeltisi ile uL, ve girdap ekleyebilir. (Bu karışım çoğaltır büyük sayılar için kadar ölçeklendirilebilir. 2:1 enzim-to-polimer çözeltisi oranı tutun.)
- Pipet 60 3 ayrı 1 cm 2 cuvettes dibine enzim / polimer çözüm uL, ve geceleme kurumasını bekleyin.
3. İmmobilize NAD-bağımlı Dehidrogenaz Enzim Testi
- Küvetine, 50 mM sodyum pirofosfat (pH 8.8) ve 1.3 mL, 15 mM NAD (taze hazırlanmış) ve 1,5 mL ve 0,1 mL su ilave edilir.
- UV / Vis spektrofotometre (yani ThermoScientific Evolut de küvet koyuniyon 260 Bio ve Thermo Spectronic Genesys 20) 340 nm dalga boyunda ayarlanmış.
- Spektrometre sıfır, ve daha sonra 0.1 ml etanol ilave edin. Hafifçe 5 kez aşağı çözümü pipetleme tarafından reaktifleri karıştırın. Boş için ek su 0,1 ml yerine etanol 0,1 ml kullanın.
- Reaktifler sonra küvet ve 20 dakika sonra ilave edildi 5 dakikada 340 nm'de absorbans kaydediniz. Aktivite hesaplamalar için kullanılabilecek bir eğim elde etmek için iki veri noktaları çizilir.
4. İmmobilize PQQ-Bağımlı dehidrogenazlar miktar tayini
- Küvet için, sodyum fosfat 1.5 mL (pH 7.3) ve 600 mM PMS 200 ul ekleyin.
- 600 nm dalga boyunda ayarlanmış bir UV / Vis spektrofotometre içinde küvet yerleştirin ve sonra spektrometre sıfıra.
- 700 uL DCIP 100 uL ve faiz substrat (etanol, asetaldehit, gliserol, glikoz veya gliseraldehit) 200 uL ekleyin ve hafifçe solut pipetleme tarafından reaktifler karıştırıniyon aşağı yukarı 5 kez. Boş için 200 su uL yerine ilgi substrat kullanın.
- Reaktifler sonra küvet ve 20 dakika sonra ilave edildi 5 dakikada 600 nm'de absorbans kaydediniz.
5.. İmmobilize Glukoz Oksidaz miktar tayini
- Küvetine, 0.2 M, p-hidroksibenzoik asit,% 0.02 (w / v) sodyum azid, 128 U peroksidaz, 4-aminoantipirin 0.3 mM, 1 M potasyum fosfat, ve 50 mM glukoz ihtiva eden bir çözeltiden 2.0 ml ilave edilir. 5 kez aşağı yukarı pipetleme tarafından çözüm karıştırın.
- 510 nm dalga boyunda bir UV / Vis spektrofotometre sette küvet yerleştirin.
- Reaktifler sonra 20 dakika küvet içinde tekrar ilave edilmiştir sonra 5 dakika 510 nm'de absorbans kaydediniz.
6. Temsilcisi Sonuçlar
Modifiye Nafion polimerin micellar yapısı orijinal tuzu / polimer co-döküm filmin çok Haldun'un kurutularak bozulabilmektedirt. Şekil 2 doğru şeffaf, açık kahverengi bir tabakaya yolaçan kurutulmuş olan bir tuzu / polimer karışımı gösterir. Kurur çok hızlı kurutma işlemi misel yapısı tahrip etme nedeni polimer opak, beyaz pul neden olabilir bir film.
Modifiye Nafion polimer ve enzim karıştırılır ve bir küvet alt üzerinde eş-atılmıştır sonra, enzimatik testler aktivitesi polimer filmi içinde enzim stabilite değerlendirmek için kullanılabilir. Tablolar iki dehidrogenaz enzimlerin 2-4 kez deneyi sonuçları ve glukoz oksidaz sırasıyla çeşitli modifiye Nafion filmlerinde immobilize. Modifiye Nafion polimerler, aslında, belirli enzimler (superactivity olarak adlandırılır) aktivitesi artırabilir gösteren, tampon çözeltisi içinde enzimlerin vs immobilize edilen enzimler daha yüksek aktivite not edin. Diğer enzimler polimer onları hareketsiz zaman kendi özel aktivite azaltmak ulaşım sınırlamaları vardır (olan yüzeyler) oldukça büyük makromoleküller yani selülazlar ve amilazlar.
| Kullanılan kuaterner amonyum tuzu | 3 kat daha fazla |
| T3a (tetrapropylammonium bromür) | 32,37 mg / ml |
| TBAB (tetrabutilamonyum bromür) | 39,19 mg / ml |
| TPAB (tetrapentylammonium bromür) | 46,01 mg / ml |
| TEHA (triethylhexylammonium bromür) | 32,37 mg / ml |
| TMHA (trimethylhexylammonium bromür) | 27.25 mg / ml |
| TMOA (trimethyloctylammonium bromür) | 30,66 mg / ml |
| TMDA (trimethyldecylammonium bromür) | 34.07 mg / ml |
| TMDDA (trimethyldodecylammonium bromür) | 37.48 mg / ml |
| TMTDA (trimethyltetradecylammonium bromür) | 40,89 mg / ml |
| TMHDA (trimethylhexadecylammonium bromür) | 44,31 mg / ml |
| TMODA (trimethyloctadecylammonium bromür) | 47,71 mg / ml |
Tablo 1. Tetra-alkil amonyum tuzları edilmiştir Nafion polimer modifikasyonu için kullanımı.
| Nafion Tipi | Enzim aktivitesi (U / g) |
| Tampon (hayır polimer) | 16.63 ± 8.11 |
| Nafion (un-mod.) | 9.25 ± 2.21 |
| TMTDA | 3.23 ± 2.92 |
| TBAB | 3.93 ± 3.33 |
| TMDDA | 4.19 ± 1.04 |
| TMOA | 3.51 ± 1.11 |
| TMDA | 8.00 ± 4.53 |
| TMHA | 1.68 ± 1.39 |
| TMHDA | 4.83 ± 0.99 |
| TMODA | 10.45 ± 3.20 |
Tablo 2 seçilen modifiye Nafion polimerler (not: immobilize aktivitesi enzim başlangıç spesifik aktivite bir fonksiyonudur) immobilize NAD-bağımlı glukoz dehidrogenaz aktivitesi..
| Nafion Tipi | Enzim aktivitesi (mU / g) |
| Tampon (hayır polimer) | 7.18 ± 0.51 |
| Nafion (un-mod.) | 70.1 ± 0.5 |
| TMTDA | 133 ± 6 |
| TBAB | 244 ± 4 |
| TMDDA | 221 ± 6 |
| TMOA | 1.78 ± 0.63 |
| TMDA | 206 ±5 |
| TEHA | 40.1 ± 50.6 |
| TMHDA | 0 |
| TMODA | 1.45 ± 0.06 |
Tablo 3 PQQ-glukoz dehidrogenaz bağımlı aktivitesi seçilen modifiye Nafion polimerler (not: immobilize aktivitesi enzim başlangıç spesifik aktivite bir fonksiyonudur) immobilize..
| Nafion Tipi | Enzim aktivitesi (U / g) |
| Tampon (hayır polimer) | 103,61 ± 3.15 |
| Nafion (un-mod.) | 19.93 ± 10.10 |
| TMTDA | 247,25 ± 12.49 |
| TBAB | 152,27 ± 5.29 |
| TMDDA | 262,05 ± 6.26 |
| TMOA | 129,18 ± 2.31 |
| TMDA | 141,23 ± 1.97 |
| TMHA | 131,75 ± 2.89 |
| TMHDA | 132,50 ± 1.18 |
| TMODA | 136,50 ± 0.96 |
. Tablo 4 Temsilcisi glukoz oksidaz spesifik aktivite seçilen modifiye Nafion polimerler (: immobilize enzim aktivitesi ilk spesifik aktivitelerinin bir fonksiyonudur not) immobilize.
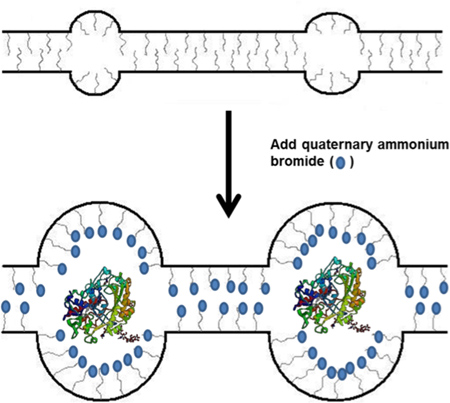
Şekil 1. Nafion polimer ve enzim immobilizasyonu daha sonraki kullanıma TBAB şirketleşme şematik.

Şekil 2. Nafion ve TBAB ilk co-döküm filmlerin optik fotoğraf. Verimleri bo kapsayan şeffaf, açık kahverengi film kurutma Yavaştartım tepsi ttom.
Tartışmalar
Açıklanan prosedür içinde, tetra-alkil amonyum tuzları enzimler hareketsiz ve stabilize etmek için kullanılabilir micellar polimerler oluşturmak için ticari Nafion değiştirmek için kullanılır. Testler polimer aktivitesi yüksek bir tutma ile enzimler çeşitli immobilize etmek için kullanılan bir prosedürü göstermektedir tarif. Söz konusu enzimi çok düşük bir aktiviteye sahiptir veya saf olmayan ise, daha yüksek bir konsantrasyonu gerekli olabilir ve 10 mg / ml 'den daha büyük konsantrasyo...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Yazarlar Donanma Araştırma, Birleşik Soya Kurulu ve finansmanı için Ulusal Bilim Vakfı Office kabul ederler.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | |
| Nafion | Sigma-Aldrich | 70160 | |
| Tetra alkilamonyum bromit tuzlarıdır | Sigma-Aldrich | n / a | |
| Alkol dehidrogenaz | Sigma-Aldrich | A3263 | |
| Nikotinamid adenin dinükleotid (NAD) | Simga-Aldrich | N7004 | |
| Sodyum pirofosfat | Sigma-Aldrich | P8010 | |
| Fenazin methosulfate (PMS) | Sigma-Aldrich | P9625 | |
| 2,6-Dichloroindophenol (DCIP) | Sigma-Aldrich | D1878 | |
| Glukoz oksidaz | Sigma-Aldrich | G7141 | |
| 4-hidroksibenzoik asit | Sigma-Aldrich | 240141 | |
| Sodyum azid | Sigma-Aldrich | S8032 | |
| Peroksidaz | Sigma-Aldrich | P8375 | |
| 4-aminoantipirin | Sigma-Aldrich | 06800 | |
| UV / Vis Spektrofotometre | Thermo | Evrim 260 Bio ya Spectronic Genesys 20 | |
| Vortex Genie | |||
| Analitik terazi |
Referanslar
- Calabrese-Barton, S., Gallaway, J., Atanassov, P. Enzymatic biofuel cells for implantable and microscale devices Chem. Rev. 104, 4867-4886 (2004).
- Cracknell, J. A., Vincent, K. A., Armstrong, F. A. Enzymes as Working or Inspirational Electrocatalysts for Fuel Cells and Electrolysis. Chem. Rev. 108, 2439-2461 (2008).
- Minteer, S. D., Liaw, B. Y., Cooney, M. J. Enzyme-Based Biofuel Cells. Curr. Opin. Biotechnol. 18, 228-234 (2007).
- Callahan, J. W., Kosicki, G. W. The Effect of Lipid Micelles on Mitochondrial Malate Dehydrogenase. Canadian Journal of Biochemistry. 45, 839-851 (1967).
- Martinek, K. Modeling of the Membrane Environment of Enzymes: Superactivity of Laccase Entrapped into Surfactant Reversed Micelles in Organic Solvents. Biokhimiya. 53, 1013-1016 (1988).
- Moore, C. M., Akers, N. L., Hill, A. D., Johnson, Z. C., Minteer, S. D. Improving the Environment for Immobilized Dehydrogenase Enzymes by Modifying Nafion with Tetraalkylammonium Bromides. Biomacromolecules. 5, 1241-1247 (2004).
- Schrenk, M. J., Villigram, R. E., Torrence, N. J., Brancato, S. J., Minteer, S. D. Effects of Mixture Casting Nafion with Quaternary Ammonium Bromide Salts on the Ion-Exchange Capacity and Mass Transport in the Membranes. J. Membr. Sci. 205, 3-10 (2002).
- Akers, N. L., Moore, C. M., Minteer, S. D. Development of Alcohol/O2 Biofuel Cells Using Salt-Extracted Tetrabutylammonium Bromide/Nafion Membranes to Immobilize Dehydrogenase Enzymes. Electrochim. Acta. 50, 2521-2525 (2005).
- Sokic-Lazic, D., Minteer, S. D. Citric Acid Cycle Biomimic on a Carbon Electrode. Biosens. Bioelectron. 24, 939-944 (2008).
- Arechederra, R. L., Minteer, S. D. Complete Oxidation of Glycerol in an Enzymatic Biofuel Cell. Fuel Cells. 9, 63-69 (2009).
- Germain, M., Arechederra, R. L., Minteer, S. D. Nitroaromatic Actuation of Mitochondrial Bioelectrocatalysis for Self-Powered Explosive Sensors. J. Am. Chem. Soc. 130, 15272-15273 (2008).
- Addo, P. K., Arechederra, R. L., Minteer, S. D. Evaluating Enzyme Cascades for Methanol/Air Biofuel Cells Based On NAD+-Dependent Enzymes. Electroanalysis. 22, 807-812 (2010).
- Smith, P. K., Krohn, R. I., Hermanson, G. T., Mallia, A. K., Gartner, F. H., Provenzano, M. D., Fujimoto, E. K., Goeke, N. M., Olson, B. J., Klenk, D. C. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150, 76-85 (1985).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır