Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Tek Oosit Bisülfit Mutagenez
Bu Makalede
Özet
Bisülfit mutagenez DNA metilasyon analizi için altın standarttır. Bizim modifiye protokolü tek hücre düzeyinde DNA metilasyon analizini sağlar ve özellikle bireysel oositler için tasarlanmıştır. Ayrıca, bölünme aşamalı embriyo için de kullanılabilir.
Özet
Epigenetik tüm kalıtsal kapsar ve geri dönüşümlü değişiklikler dolayısıyla alter gen erişilebilirlik ve gen transkripsiyonu 1 düzenleyen birincil mekanizmaları olduğunu kromatine. DNA metilasyon baskıcı bir işareti olarak ağırlıklı olarak hareket eden bir epigenetik modifikasyon olduğunu. CpG dinucleotides in sitozinleri üzerine, bir metil grubu ile kovalent yanı boyunca, bu kromatin kondensasyon ve genler 2 susturulmasında süreçleri başlatmak için ek protein ve baskıcı histon modifikasyonları katabildikleri. Bu gelişimsel programlama, hücre farklılaşması, retroviral elemanlarının baskı, X kromozomu inaktivasyonu ve genomik imprinting kritik bir rol oynar gibi DNA metilasyon normal gelişimi için gereklidir.
DNA metilasyon analizi için en etkili yöntemlerinden biri bisülfit mutagenez olduğunu. Sodyum bisülfit uracils içine sitozinleri deaminates bir DNA mutajen olup. PCR ve seque ardından ncing, bu dönüşüm olaylar thymines olarak algılanır. Metillenmiş sitozinleri deaminasyon korumalıdır ve böylece kişi nükleotid 3. seviyede DNA metilasyon belirlenmesini sağlamaktadır sitozinleri olarak kalır. Bisülfit mutagenez testin geliştirilmesi başlangıçta daha duyarlı ve 7 tekrarlanabilir hangileri doğru 4-6 bildirdi olanlardan ilerlemiştir. Bir anahtar ilerleme böylece sert bisülfit tedavisi 8 DNA koruyan bir agaroz boncuk DNA az miktarda gömme edildi. Bu etkin metilasyon analizi oosit ve blastosist aşamasındaki embriyoların 9 havuzlarda yapılacak. Bugüne kadar en sofistike bisülfit mutagenez protokolü bireysel blastosist aşaması embriyo için 10 olduğunu. Blastokist ortalama 64 hücreleri (genomik DNA 120-720 pg içeren) üzerinde var Ancak, bu yöntem bireysel oosit veya klivaj aşamasındaki embryo metilasyon çalışmaları için etkili değildir. çadır "> oosit dahil 11 dakikalık DNA miktarda agaroz gömme gelen ipuçları alarak, burada oosit doğrudan bir agaroz ve lizis çözüm boncuk hemen aşağıdaki alımı ve oosit den zona pellucida çıkarılması gömülü sayede bir yöntem sunuyoruz. Bu bize sağlar iki tek yumurta bisülfit mutagenez başlıca zorlukları aşmak:. bozulması DNA bir dakika miktarda korunması ve çok sayıda protokol adımları boyunca sonraki veri kaybını tek oosit elde edilir gibi önemlisi, havuzlar içinde PCR yanlılık sorunu ortadan kalkar Dahası. , birden fazla metilasyon desen ile herhangi bir örnek analizi 12 dışında tutulabilir yana istenmeyen cumulus hücre kirlenme. Bu metod ile tespit edilebilir Bu protokol, tek hücre düzeyinde DNA metilasyon başarılı bir şekilde ve tekrarlanabilir analizler için geliştirilmiş bir yöntem sağlar ve ideal olarak uygundur bireysel oositlerin yanı sıra klivaj dönemi embriyodan için.
Protokol
1. GÜN
Böyle GIBCO su gibi steril, distile su ile oosit toplama günü taze aşağıdaki çözümleri hazırlayın. DNA bulaşma olasılığını azaltmak için, çoğu zaman eldiven değiştirme ve filtre ipuçlarını kullanın. Zaman açık tüpler uzak açılı tutun ve kullanılmadığı zaman tüm tüpler recap. Biz çözümler n +1 olarak yapılır öneririz.
% 3 LMP Agaroz
30 mg Düşük Erime Noktası (LMP) agaroz
1 ml GIBCO H 2 O
@ 70 çözülür ° C
Lizis Çözüm
8 ul lizis tamponu
1 ul proteinaz K
1 ul% 10 IGEPAL
kullanıma hazır olana kadar buz üzerinde yer
02:01 Agaroz: Lysis Çözüm (bireysel oosit başına 10 ul, miktarı 3 oosit için)
20 ul% 3 LMP agaroz
10 ul Lizis Çözüm
@ 70 karıştırın ° C
SDS Lysis Tampon (bireysel oosit başına 501 ul)
| 1x TE pH 7.5 | 450 ul |
| % 10 SDS | 50 ul |
| Proteinaz K | 1 ul |
| 501 ul |
1. Yumurta Toplama
- M2 medyada disseke fare siyon hatası yerleştirin ve kümülüs hücre kompleksi ayıklamak için ampullae gözyaşı.
- 0.3 mg / M2 medya 30 ul açılan ml hyaluronidaz çözümü kullanarak kümülüs hücre kompleksinden oosit ayırın. Sadece uzun uzun pozlama onlara zarar verebileceği gibi, kümülüs hücreleri çıkarmak için alır gibi çözüm oosit tutun. Periyodik kümülüs hücreleri giderici M2 medya 30 ul açılan 3x oosit, yıkayın.
- Asidik tyrode çözümü kullanarak zona pellucida çıkarın. Bir 30 transfer daha sonra ilk çözüm biri 30 ul açılan oosit yerleştirin veul damla gibi birlikte yürütülen herhangi bir medya asit sulandırmak ve etkinliğini azaltacaktır. Sadece sürece uzun pozlama onlara zarar verebilir, zona kaldırmak için alır gibi çözüm oosit tutun. Not: insan zona pellucida fare daha asidik Tyrode çözeltisi ile muamele daha dirençli olduğu gibi asidik çözeltisi ya da Tyrode pronaz artan bir konsantrasyon, insan numuneler için kullanılabilir.
- Bir kez daha M2 medya 30 ul açılan oosit yıkayın.
2. Agaroz gömülmesi ve Lizis
- Agaroz gömme gerçekleştirmek için, bir 70 ° C heatblock üzerine lizis çözeltisi yerleştirin. Lizis çözüm: 2:1 agaroz üreten lizis çözümü için önceden ısıtılmış LMP agaroz ekleyin.
- Minimal M2 medyada temiz bir cam slayt üzerine tek bir yumurta koyun. Bir pipet içine lizis solüsyonu ve (mikroskop altında) yavaşça damla ile karışmasına izin cam slayt üzerine (~ 1 ul veya daha az) küçük bir miktar sınırdışı: agaroz 10 ul sürebiliral ortam. Yavaşça pipet içine oosit pick up ve boncuk bir küre oluşturur böylece 300 ul mineral yağ ile bir Eppendorf tüp içine tüm 10 ul koydu.
Not: Bu işlem agaroz gibi oldukça hızlı bir şekilde yapılmalıdır donacaktır sıcaklığı az 5 ° C ile 70 ° C'nin altına düşerse - 10 dakika süreyle buz üzerinde inkübe tüpü. Lizis gerçekleştirmek için, 300 ul mineral yağ kaldırmak ve SDS lizis tampon 500 ul ekleyin. 50 ° C su banyosunda gece inkübe edin.
Not: Lysis çözeltisi (Tablo 1), aynı zamanda, bu amaç için kullanılabilir.
2. GÜN
Bisülfit mutagenez gününde taze aşağıdaki çözümleri hazırlayın. DNA bulaşma olasılığını azaltmak için, çoğu zaman eldiven değiştirme ve filtre ipuçlarını kullanın. Zaman açık tüpler uzak açılı tutun ve kullanılmadığı zaman tüm tüpler recap. Biz çözümler n +1 olarak yapılır öneririz.
2| 3 M NaOH | |
| 0.1 M NaOH | 14.5 ml otoklavlanmış GKD 2 O 3M 0.5 ml |
| 0.3 M NaOH | 13.5 ml otoklavlanmış GKD 2 O 3M 1.5 ml |
2.5 M Bisülfit Çözüm
- 3.8 g sodyum bisülfit
5.5 ml damıtılmış GIBCO H2O
1 ml 3 M NaOH
@ oda sıcaklığında çözülür - 110 mg Hidrokinon
1 ml damıtılmış GIBCO H2O
@ 90 ° C (sadece sürece eritmek için alır gibi için, düzenli mix) çözülür
Tamamen çözündüğünde çözeltisi (a) karışımı ve (b)
* Işık * uzak tutun
3. Bisülfit Mutagenezi
- Tam 500 ul SDS lizis tamponu çıkarın ve 300 ul mineral yağ (~ 20 saat) ekleyin. Kalan herhangi bir lizis tamponu inci sulandırmak olure agaroz bu ısıtılır ve boncuk sonraki adımlarda eriterek daha duyarlı olacak zaman. Hemen bisülfit mutagenez ile devam edin, ya da 5 güne kadar -20 ° C'de saklayın.
- Varsa, dondurucudan oosit kaldırmak ve (agaroz boncuk nispeten saydam sadece kadar) çözülme sağlar. 10 dakika buz üzerinde hangi inkübe takiben, 90 ° C ısıya blok üzerinde 2.5 dakika inkübe.
Not: karıştırmak veya karıştırın, daha uzun süre 2.5 dakika uzatmak, ya da sıcaklık dalgalanma etmeyin. - Denatürasyon gerçekleştirmek için, mineral yağ çıkarmak ve her tüp, fiske 1 ml 0.1M NaOH ekleyin ve 5-6 kez ters çevirin.
- Ters bir 37 ° C su banyosunda 15 dakika, her 3-4 dakika inkübe edin. Boncuk NaOH içinde yüzer olmalıdır.
- Bisülfit tedavi gerçekleştirmek için hafifçe döndürün tüp, daha sonra NaOH kaldırmak ve 300 ul mineral yağ ve 500 ul bisülfit çözeltisi ekleyin. 50 ° C su banyosunda 3.5 saat boyunca tüp inkübe edin. * Işık * uzak tutun
Not: inkübasyon süresi ampirik ilgi gen için belirlenen gerekebilir. - Desulfonation gerçekleştirmek için, 3 dakika buz üzerinde inkübe, daha sonra, madeni yağ ve bisülfit çözüm kaldırmak hafifçe döndürün ve 1 ml 0.3 M NaOH ekleyin. Flick ve 5-6 kez ters çevirin.
- Ters bir 37 ° C su banyosunda 15 dakika, her 3-4 dakika inkübe edin. Boncuk NaOH içinde yüzer olmalıdır.
- Örnekleri yıkayın, önce yumuşak iplik tarafından, daha sonra NaOH kaldırmak ve 1 ml 1x TE pH 7.5 ekleyin. Oda sıcaklığında (bir çalkalayıcı) de 5-10 dakika boyunca sallayın. Tekrar yavaşça çevirin, daha sonra 1x TE kaldırın. Bu yıkama işlemi iki kez tekrarlayın.
- 1 ml otoklav GKD 2 O. ekle Oda sıcaklığında (bir çalkalayıcı) de 5-10 dakika boyunca sallayın. Yavaşça Spin, daha sonra 2 H, O. kaldırmak Iki kez GKD 2 O yıkama tekrarlayın.
- Üstte kalan sıvı kısmın pH kontrol edilir; bu pH 5,0 olmalıdır. Hala çok temel varsa, H 2 O ile tekrar yıkayın Sadece agaroz olması bırakarak, tüm süpernatantıreklam.
4. 1. ve 2. Yuvarlak PCR
- ** Yıkarken 1. tur PCR karışımı hazırlayın **
| Forward Outer 10 uM Astar | 0.5 ul |
| Dış 10 uM Astar Ters | 0.5 ul |
| 240 ng / ml tRNA | 1 ul |
| H2O | 13 ul |
Misal-Hazır git Sıcak Başlangıç PCR boncuk ekle
Dikkatle PCR tüpü (~ 10 ul) içine katı agaroz boncuk kaydırın
70 ° C ve karıştırın Isı
25 ul mineral yağ ekleyin
Toplam: 50 ul
- Yükseltmek
Not: Fare Snrpn için minimize eder bir örneği, 94 de 2 dakika süreyle 94 denatürasyon olup az 30 saniye 40 döngü izledi ° C, ° C, 50 ° C'de 1 dakika ile 168 dakikada ° C ve 68 azından bir nihai uzamaya 10 dakikalık bir adım ° C. 1. turda fare H19 için PCR ve Peg3 sıcaklık Tavlama 50 ° C'dir - 2. turda PCR karışımı hazırlayın
| İleri İç 10 uM Astar | 0.5 ul |
| İç 10 uM Astar Ters | 0.5 ul |
| H2O | 19 ul |
Misal-Hazır git Sıcak Başlangıç PCR boncuk ekle
Bir şablon olarak 5 ul 1. Yuvarlak ürün ekleyin. ° C'de 1 dakika agaroz yumuşatmak için 70 1. turda ürün ısıtın. Mineral yağ tabakası altında Pipeti emin olun.
25 ul mineral yağ ekleyin
Toplam: 50 ul
Not: Snrpn, H19 ve Peg3 için iç içe primer dizilerinden Pazar-Velker ark 10 bulunabilir,12.
- Yükseltmek
Not: BİSİKLET koşulları fare Snrpn için 94 de 2 dakika süreyle 94 ° denatürasyon az 30 saniye 40 döngü izledi C, ° C, 50 ° C'de 1 dakika ve 68 de 1 dakika ° C ve 10 dakikalık bir nihai uzamaya 68 de adım ° C'de 10. Fare H19 ve Peg3 gerektiren bir 50 ° C 2. tur PCR sıcaklık tavlama. - Bir tanı testi olarak, ikinci turda örnekleri metilasyon veya suş spesifik bir restriksiyon enzimi ile kesilebilir.
| 2. Yuvarlak ürün | 4 ul |
| Kısıtlama Enzim | 1 ul |
| Tampon | 1 ul |
| H2O | 4 ul |
- Bir 8% akrilamid jel üzerinde, sindirim ürünleri Electrophorese. Herhangi bir heterojen bantları, birden fazla seque temsilnce.
5.. TA Klonlama ve Colony PCR
- 2. yuvarlak ürün, 70 ilk ısı klonlamak için ° C 1 dakika Promega pGEM-T Vector Sistemi (Fisher Scientific Kedi # A1360) kullanarak vektör sonra içine ligate agaroz, yumuşatmak için.
| 2. Yuvarlak PCR | 1 ul |
| pGEMT-KOLAY vektör | 1 ul |
| Ligaz | 1 ul |
| H2O | 2 ul |
| 2x Ligasyonu Tampon | 5 ul |
Gece @ 4 ° C PCR makinesi inkübe edin.
- 15 dakika buz üzerinde yetkili E.coli hücreleri (Zymo Research Corp Kedi # T3009) çözülmesini sağlayın. 8 ul E.coli ve 15 dakika buz üzerinde inkübe ligasyona 3 ul ligasyon reaksiyonu ekleyin.
- 42 ° C su banyosunda 40 saniye için ısı çarpması,ve 2 dakika buz üzerinde inkübe. 1 saat (sallama) için 37 ° C'de 60 ul SOC orta ve inkübe ekleyin.
- 37 ° C'da gece boyunca bir LB / Agar / IPTG / Xgal / Amp plakası ve inkübe plaka üzerinde, reaksiyon karışımına tüm yerleştirin.
- Koloni PCR karışımı hazırlayın
| 20 uM M13 İleri Astar | 0.7 ul |
| 20 uM M13 Ters Astar | 0.7 ul |
| 5X Yeşil Go Taq Tampon | 7.0 ul |
| 10 mM dNTP | 0.7 ul |
| Taq DNA polimeraz | 0.28 ul |
| H2O | 25.62 ul |
| 35 ul toplam |
Bir PCR tüpüne 35 ul Colony PCR master miks ekleyin. Bir pipet ve PCR reaksiyon içine girdap onunla plakadan beyaz bir bakteri kolonisi seçin.
- 94 de 10 dakika boyunca denatürasyon ile amplifiye ° 94, 45 saniye 30 döngü izledi C, 57 ° C'de, 30 saniye ° C ve 72 de 1 dakika ° C ve 72 azından bir nihai uzamaya 10 dakikalık bir adım ° C. % 1.5 agaroz jel üzerinde 4 ul Electrophorese. Sıralama için PCR ürün ~ 30 ul gönder.
Not: oosit için 5 koloni PCR ürünleri dizilerek. - Sıralama sonuçları elde edildikten sonra, metilasyonu okunabilir. Bir CG olarak kalmıştır herhangi bir orijinal CG metillenmiş ve şimdi bir TG herhangi bir orijinal CG unmethylated edildi.
6. Temsilcisi Sonuçlar
Bizim çalışmalarımızda, tahlil bireysel oosit ve embriyoların (Şekil 1) metilasyon basılır. Bisülfit dönüştürülür primerler kullanılarak iç içe PCR ardından, bir agaroz jel (Şekil 2) bir doğru parçası boyutu görselleştirerek başarılı bir dönüşüm onaylamak mümkün. Bir birey oositBir ebeveyn aleli temsil eder, ve teorik olarak, bir baskılı metilasyon paterni vardır. Bu nedenle, ikinci tur PCR ürünleri kasıtsız kontaminasyon için test edilebilir. DNA metilasyon (örneğin HinfI ya DpnII gibi) karşı duyarlı bir kısıtlayıcı enzim, bir metil veya unmethylated alel (Şekil 3) içermesi durumunda değerlendirmek için ikinci turda PCR ürünü sindirimi için kullanılabilir. T dönüştürülür bir unmethylated C artık enzimi tarafından tanınan ve kesilmemiş bir durumdayken enzim tanıma dizisi içinde bir metil C parçalanabilen edilir. Bu kümülüs hücre kontaminasyonu (Şekil 3) göstergesi olarak metillenmiş ve unmethylated allelleri hem içeren herhangi bir MII oosit örnek, atılmalıdır. Ligasyonu ve dönüşüm sonrasında, başarılı bir koloni PCR doğru ürün boyutu numunelerde (Şekil 4) sıralama için gönderilir sağlamak için bir jelde görüntülenebilmekte. Son olarak, beş ayrı cl sekansıBir MII oosit den olanlar beş aynı metilasyonu ve aynı nonCpG dönüşüm oranları (Şekil 5a) üretmelidir. Birden fazla desen içeren herhangi bir örneği (Şekil 5B) atılmalıdır. Ovulasyon MII oosit iki kromozom kopya veya ekli bir kutup bedene sahip olduğundan, benzer iki dizi paternleri (Şekil 5c) elde etmek için bir olasılık vardır. Biz kümülüs hücre kontaminasyonu ekarte edilemez yana oldukça farklı metilasyonu sahip oositler gelen verileri atarak öneririz.

Şekil 1. Tek Oosit Bisülfit Mutagenez tahlil şematik.
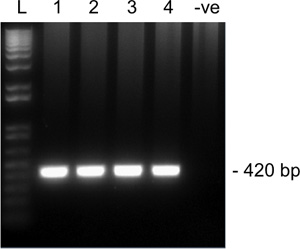
Bir şarkı gelen Snrpn için 2. turda amplifikasyon Şekil 2'de. Temsilcisi sonuçları% 1.5 agaroz jel le MII oosit. Lanes 1-4 dört tek MII oosit ve şeritli 5 negatif kontrol (oosit) 'dir. Snrpn Beklenen amplikon boyutu 420 bp olduğunu. L, merdiven.
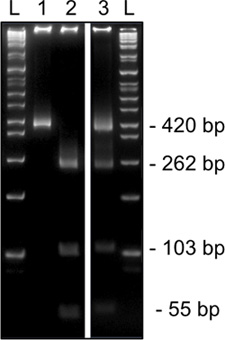
% 8'lik bir akrilamid jel üzerinde tek bir MII oosit den Snrpn için 2. turda metilasyon spesifik sınırlama sindirim gelen Şekil 3. Temsilcisi sonuçları. HinfI tanı sınırlama sindirim (420bp, hat 1) kısıtlama sitesi yasaklayan bir T barındırıyor unmethylated DNA gösterir ya (kesim, 262, 103, ve 54 bp, şerit 2) tanıma site içinde bir C içerir metillenmiş DNA. Metillenmiş ve unmethylated hem restriksiyon enzimi siteleri (kesim ve kesilmemiş bantlar, şerit 3) gösteren Sindirim kümülüs hücre kontaminasyonu göstergesidir. L, merdiven.
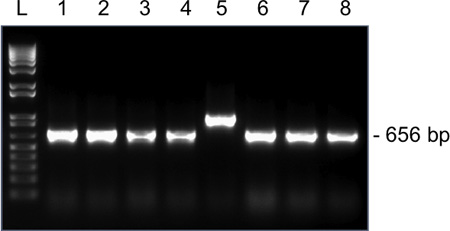
Şekil 4. % 1.5 agaroz jel üzerinde tek bir MII oosit den Snrpn için koloni PCR Temsilcisi sonuçlar. Beklenen amplikon boyutu pGEM-T Kolay vektör Snrpn ligasyonu takip eden ve ileri M13 kullanarak ve geri primerleri 656 bp olduğunu. Lane 1-8, klonlar 1-8 dan amplikonlar. Clone 5 yanlış bir amplikon boyutu vardır ve sıralama için gönderilen edilmemelidir.

Şekil 5. Temsilcisi tek MII oosit den Snrpn sonuçları sıralama. Snrpn oositlerinde metillenmiş edilir. Siyah daireler metillenmiş CpG'ler göstermektedir. Beyaz çevreler unmethylated CpG'ler göstermektedir. CpG sayısı ve yerleşimi bir B6 suşu dişi fare temsilcisidir. a) Tek bir MII oosit den Snrpn sonuçları sıralama bekleniyordu. DNA Yalnızca tek bir iplikçik beş klon yükseltmek gerekir. Tek bir metilasyon paterni ve özdeş olmayan CpG dönüşüm pıtırtı ile oositn (non-larını yüzde dönüşüm toplam olmayan CpG sitozinleri bir yüzdesi olarak timin dönüştürülür non-CpG sitozinleri sayısı olarak hesaplandı sağa gösterilir) analizleri dahil edilmesi gerekmektedir. kümülüs hücre kontaminasyonu ile tek MII oosit den Snrpn b) Sıralama sonuçları. Birden iplikçik amplifikasyon belirten metilasyon devletler ve dönüşüm kalıpları arasındaki farklılık dikkat edin. c) kromozom kopya veya polar body dahil ikisi de tek bir MII oosit den Snrpn sonuçları Sıralama.
Tartışmalar
Bu tek yumurta tahlil kritik ve özel bakım gerektiren bir dizi ile birçok adımları içerir. İlk oosit yıkanmasıdır. Mümkün olduğunca çok kümülüs hücreleri olarak kaldırmak için hiyalüronidaz tedaviyi takiben düşer taze ortamda her oosit birden çok kez yıkamak için özellikle önemlidir. Ayrıca, zona pellucida kaldırılması için asidik tyrode çözümü için oosit aktarırken orta çevreleyen cumulus hücreleri temiz olduğundan emin olun. Oosit zona çıkarılmasını takiben çok yapışka...
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
Bu çalışma, Batı Ontario, Doğum ve Jinekoloji Anabilim Dalı Üniversitesi tarafından desteklenen ve Ministryof Araştırma ve Yenilikçilik, Erken Araştırmacı Ödülü bir hibe ER06-02-188. MMD Üreme, Erken Gelişim ve Sağlık (REDIH) Lisansüstü Bursu ile Etki bir CIHR Eğitim Programı tarafından desteklenmiştir.
Malzemeler
Özel reaktifler ve ekipman Tablo.
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | Yorumlar |
| Yumurta Toplama | |||
| Hyaluronidase | Sigma | H4272 | |
| Asidik Tyrode | Sigma | T1788 | |
| Proteinaz K | Sigma | P5568 | |
| % 10 IGEPAL | Bioshop | NON999.500 | |
| Lizis Çözüm | |||
| Tris pH 7.5 | Bioshop | TRS001.5 | |
| LiCl | Sigma | L9650 | & Nbsp; |
| EDTA pH 8.0 | Sigma | E5134 | |
| KAPAKLAR | Bioshop | LDS701.10 | |
| DTT | Invitrogen | P2325 | |
| SDS Lizis Tampon | |||
| TE pH 7.5 | Bioshop (Tris) Sigma (EDTA) | TRS001.5 E5134 | |
| % 10 SDS | Bioshop | SDS001.500 | |
| Bisülfit Dönüşüm | |||
| Sodyum Hidroksit | Sigma | S8045 | |
| Sodyum hidrojensülfit (sodyum bisülfit) | Sigma | 243973 | ; |
| Hidrokinon | Sigma | H9003 | |
| Düşük Erime Noktası (LMP) agaroz | Sigma | A9414 | |
| Madeni Yağ | Sigma | M8410 | |
| M2 Orta | Sigma | M7167 | |
| GIBCO Damıtılmış su | Invitrogen | 15230-196 | |
| Otoklavlı çift distile (dd) su | |||
| PCR | |||
| Misal Sıcak Başlangıç Mix RTG | GE Healthcare | 28-9006-54 | |
| 240 ng / ml maya tRNA | Invitrogen | 15401-011 | |
| 5x Yeşil GoTaq Reaksiyon Tamponu | Profesyonelmega | M7911 | |
| İç ve dış iç içe primerler | Sigma | ||
| Ligasyonu | |||
| Promega pGEM-T Kolay Vektör | Fisher Scientific | A1360 | |
| TA Klonlama | |||
| Yetkili E.coli hücreleri | Zymo Araştırma Corp | T3009 | |
| Ekipman | |||
| Mikroskop Kesme | |||
| 70 ° C ile 90 ° C Isı Blokları | |||
| 37 ° C ile 50 ° C Isıtıcıları (42 ° C dönüşümler için) | |||
| Rock'çı | |||
| PCR makinesi | |||
Referanslar
- Jaenisch, R., Bird, A. Epigenetic regulation of gene expression: how the genome integrates intrinsic and environmental signals. Nat. Genet. 33, 245-254 (2003).
- Rodenhiser, D., Mann, M. Epigenetics and human disease: translating basic biology into clinical applications. CMAJ. 174, 341-348 (2006).
- Frommer, M. A genomic sequencing protocol that yields a positive display of 5-methylcytosine residues in individual DNA strands. Proc. Natl. Acad. Sci. U.S.A. 89, 1827-1831 (1992).
- Clark, S. J., Harrison, J., Paul, C. L., Frommer, M. High sensitivity mapping of methylated cytosines. Nucleic Acids Res. 22, 2990-2997 (1994).
- Feil, R., Charlton, J., Bird, A. P., Walter, J., Reik, W. Methylation analysis on individual chromosomes: improved protocol for bisulphite genomic sequencing. Nucleic Acids Res. 22, 695-696 (1994).
- Raizis, A. M., Schmitt, F., Jost, J. P. A bisulfite method of 5-methylcytosine mapping that minimizes template degradation. Anal. Biochem. 226, 161-166 (1995).
- Patterson, K., Molloy, L., Qu, W., Clark, S. DNA Methylation: Bisulphite Modification and Analysis. J. Vis. Exp. (56), e3170 (2011).
- Olek, A., Oswald, J., Walter, J. A modified and improved method for bisulphite based cytosine methylation analysis. Nucleic Acids Res. 24, 5064-5066 (1996).
- Mann, M. R. Selective loss of imprinting in the placenta following preimplantation development in culture. Development. 131, 3727-3735 (2004).
- Market-Velker, B. A., Zhang, L., Magri, L. S., Bonvissuto, A. C., Mann, M. R. Dual effects of superovulation: loss of maternal and paternal imprinted methylation in a dose-dependent manner. Hum. Mol. Genet. 19, 36-51 (2010).
- Meng, L. H., Xiao, S. Q., Huang, X. F., Zhou, Y., Xu, B. S. A study on bisulfite sequencing method for methylation status of imprinted genes in single human oocytes. Zhonghua Yi Xue Yi Chuan Xue Za Zhi. 25, 289-292 (2008).
- Denomme, M. M., Zhang, L., Mann, M. R. Embryonic imprinting perturbations do not originate from superovulation-induced defects in DNA methylation acquisition. Fertil. Steril. 96, 734-738 (2011).
- Tahiliani, M. Conversion of 5-methylcytosine to 5-hydroxymethylcytosine in mammalian DNA by MLL partner TET1. Science. 324, 930-935 (2009).
- Hajj, N. E. l. Limiting dilution bisulfite (pyro)sequencing reveals parent-specific methylation patterns in single early mouse embryos and bovine oocytes. Epigenetics. 6, 1176-1188 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır