Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Fabrikasyon ve mikroçevresindeki microarrays Kullanımı (MEArrays)
Bu Makalede
Özet
Hücresel fonksiyonları üzerinde mikro moleküler bileşim etkileri ilgili bilgi sağlamak için bir kombinatoryal fonksiyonel tarama yöntemi tarif edilmektedir. Yöntemi hücre yapışması ve fonksiyonel analiz destekleyen tanımlı Kombinatoryal mikroçevrelerde diziler oluşturmak için varolan mikroarray tabanlı teknolojileri yararlanır.
Özet
Hücreler ve onların etrafındaki mikroçevrede arasındaki etkileşimler hücresel davranışı için fonksiyonel sonuçları vardır. Tek hücre düzeyinde, farklı mikroçevrelerde farklılaşma, göç ve proliferasyon fenotipleri empoze edebilir ve doku düzeyinde mikroçevrede morfolojilerinden tümörogenez 1 gibi karmaşık işler. Ancak içinde mikro etki hücrelerin hücre ve moleküler içeriği, ama böylece esneklik 2 ve doku geometrisi 3 kalmaz. Hücre-hücre,-ECM ve-çözünür faktör etkileşimlerinin toplamı olarak tanımlanan, fiziksel özelliklere ek olarak, mikro çevre karmaşıktır. Bir doku içindeki hücrelerin fenotiplerini onların genomik içeriği ve microenviroment ile kombinatoryal etkileşimleri kısmen, kısmen bağlıdır. Büyük bir meydan okuma farklı davranışları ile microenvironmental bileşenleri belirli kombinasyonları bağlamaktır. ent "> Burada, kombinatoryal mikroçevrelerde 4 etkileşimlerinin hücre tabanlı fonksiyonel tarama mikroçevrede mikroarray (MEArray) platformu sunmak. metodu moleküler yapısı ve elastik modülü eşzamanlı kontrolü sağlar ve yaygın olarak mevcut mikroarray kullanımı birleştiriyor ve micropatterning teknolojileri. MEArray ekranlarında yetişkin progenitör hücreler gibi nadir hücre tiplerinin fonksiyonel çalışmalar kolaylaştırır dizi başına 10.000 hücre kadar az ihtiyaç duyar. teknolojinin bir sınırlama olduğunu tüm doku mikroçevrelerde tamamen MEArrays üzerine değinmeyecek edilemez. Ancak, karşılaştırma çok sayıda ilgili mikro için aynı hücre tipi tepkiler, örneğin, belirli bir doku karakterize ECM proteinlerinin ikili kombinasyonlar, microenvironmental bileşenler doku-spesifik fonksiyonel fenotipleri temin nasıl anlaşılmasını sağlayacaktır.
MEArrays rekombinant Gro geniş bir yelpazede kullanarak basılabilirwth faktörleri, sitokinler, ve saflaştırılmış ECM proteinleri ve bunların bileşimleri. Bu platform, sadece belirli reaktiflerin bulunması ile sınırlıdır. MEArrays zaman lapsed analizi mükellef bulunmaktadır, ancak en sık floresan problar ile ölçülebilen hücresel fonksiyonları bitiş noktası analizleri için kullanılır. Örneğin, DNA sentezi, apoptoz, farklılaştırılmış devletlerin edinimi, ya da belirli gen ürünlerinin üretiminde yaygın olarak ölçülür. Kısaca, deney MEArray temel akış baskı alt katman ile kaplanmış slaytlara hazırlamak için ve basılacak olan proteinlerin ana plaka hazırlamaktır. Sonra diziler bir mikroarray robot ile basılır, hücreler, iliştirin kültüründe yetişen ve daha sonra kimyasal deney bitiş noktası ulaştığınızda giderilen izin verilir. Geleneksel mikroskoplar veya mikroarray tarayıcılar ile görüntülenebilir Floresan veya kolorimetrik deneyleri, ilgili moleküler ve hücre fenotipleri (Şekil 1) ortaya çıkarmak için kullanılır.
Protokol
1. Baskı Substratlarla Hazırlık
(PA) polidimetilsiloksan (PDMS) kaplı veya poliakrilamid kaplı slaytları kullanma kararı deneysel tasarım önemli parametrelere bağlıdır. Hem polimerlerin elastik modülü PDMS baz / kür oranı ve PA akrilamid / bis-akrilamit oranını değiştirmeksizin farklı dokuların rijitliklerini taklit etmek ayarlanmış olabilir. PDMS 1-10MPa (örneğin, kıkırdak, kornea ve arter duvarları) aralığında sert dokuların taklit edebilir, ve PA 100Pa-100kPa (örneğin, meme, beyin, karaciğer, prostat) 5 aralığında yumuşak dokular taklit edebilir. PDMS hazırlamak için, ucuz kolaydır ve basılı özellikleri geometri baskı pim başlığı ile aynı olacaktır. Böylece özellikleri büyüklüğü ve şekli tam olarak farklı geometrilere sahip uç çiviler ile kontrol edilebilir. PDMS hücresi taşınması ve immunos sırasında bazı sorunlar neden olur, PA daha fazla hidrofobikadımlar temi, ve bazı hücre çizgilerinden ile uyumlu olabilir. PA hidrojel ve bir yerli olmayan kirlenme yüzey olduğundan, hücreler sadece destekleyen hücre adezyon proteinleri vardır noktalar eklenecektir. PA jeller üzerine yazdırılan özelliklerin geometri hassas iğne başı geometrisi uymayan; genellikle difüzyon nedeniyle çevreler, bağımsız kullanılan iğne başı geometrisi olur. Baskı temas süresi ve pim çapına parametreleri deneysel Pensilvanya jeller optimum özellik boyutu için belirlenebilir.
Polidimetilsiloksan (PDMS)
- Tek kullanımlık plastik bardak olarak 10:1 oranında sertleştirici ile Sylgard 184 silikon elastomer tabanı birleştirmek, 30 dakika boyunca oda sıcaklığında vakum çanı degas ardından depressor bir tahta veya plastik dil ile kuvvetlice karıştırın.
- Merkezi bir spin kaplayıcı bir vakum yoluyla çalıştırılan bir kavrama ile ilgili standart bir mikroskop slaydı, çiseleme kızak yüzeyi, merkezi üzerine karışık elastomer ve polimer 0.5 ml. Spin60 sn 6.000 rpm.
- Bir 70 ° C fırın içinde ya da bir gecede, 4 saat boyunca bir dijital sıcak plaka (toz korunmuş) üzerinde PDMS-kaplanmış slaytlara Cure.
- Kürlenmiş slaytlar hemen kullanılabilir, ya da plastik Ziploc çanta içinde mühürlü ve bir çekmece içinde tutulan bir slayt kutusunda birkaç ay boyunca saklanabilir. Iyi oda hava sirkülasyonu korunmalıdır böylece PDMS toz çekiyor.
- Not: PDMS elastomer kiti ile çalışırken Nitril veya diğer non-latex eldiven giyilmelidir. Lateks eldiven ile Arızi temas PDMS polimerizasyonu inhibe olur.
Poliakrilamid (PA)
- NaOH dağlama: 80 ısıtma bloğu üzerine koyun slaytlar ° C. Tüm slayt yüzeyini kapsayacak şekilde emin, her slaytta 1 ml 0.1N NaOH ekleyin. NaOH (beyaz bir filmin slayt yüzey üzerinde oluşturmalıdır) buharlaşmasına izin verin. PA jel yalnızca NaOH kazınmış yüzeylere sıkıca ekleyebilirsiniz yana, PA jel tüm slayt sörf eğer adım kuruma sırasında ayırırace NaOH kapsamında değildir. Slayt yüzeyi tamamen kapalı değil ise, 1 ml 0.1N NaOH ekleyerek tekrarlayın. Slaytlar sonra birkaç gün boyunca oda sıcaklığında (RT) saklanabilir. Not: NaOH aşındırma için alternatif bir ozon-ya da slaytlar plazma temizlemektir.
- 3-Aminopropyltriethoxysilane (APES) kaplama: bir davlumbaz, bir 15 ml çanak yer slaytlar, ve her NaOH kazınmış slaytta 300 ul MAYMUNLAR ekleyin. NaOH 5 dk için slaytlar ile MAYMUNLAR tepki edelim. Bu süre aşıldığında Tepkimeye girmemiş MAYMUNLAR reaktif yıkanması zorluk neden olur. Slaytların her iki tarafta deiyonize su ile iyice iki üç kez MAYMUNLAR yıkayın. Yıkama tam değilse, MAYMUNLAR adım 1.8 slaytlar üzerinde kahverengi tortu oluşturmaya Glutaraldehit tarafından okside edilir.
- Glutaraldehit oksidasyon: slayt yüzeylerden tüm çözümleri aspire. Her 15 cm çanak olarak, PBS içinde 25 ml% 0.5 glutaraldehit ekleyin. Karanlık bir yerde 30 dakika için reaksiyona girer. 30 dakika sonra, tüm glutaraldehid aspire ve non-tiftik işgücü kullanımıekspirayon mendil (örn. Kimwipes) dikkatle slaytlar kuru. Slaytlar sonra yukarı ila bir gün için oda sıcaklığında saklanabilir.
- Jel hazırlama: 30 dakika degas, aşağıdaki tabloya göre akrilamid, bis-akrilamit ve GKD 2 O içeren PA karışımları hazırlamak ve sonra polimerizasyon yavaşlatmak için buz üzerinde PA karışımları yerleştirdikten sonra. APS ekleyin ve TEMED ve sağ jeller yapmadan önce iyice karıştırın. Slayt yüzeyler ve yeri 24 mm üzerine Pipet PA karışımları x 50 mm, sayı PA üstüne 1 lamelleri. Birlikte lamel ve cam slayt basmaktan kaçının ve kabarcık oluşumunu önlemek. Diğer jeller 350 ul kullanmak için jeller için> 40.000 Pa, 100 ul kullanın.
| İstenilen modülü (Pa) | Akrilamid% | Bis-akrilamid% | 40% stoktan Akrilamid (ml) | % 2 stok bis-akrilamid (ml) | Deiyonize su (ml) | APS (ul) | TEMED (ul) |
| 480 ± 160 | 3 | 0.06 | 0.75 | 0.3 | 8.95 | 100 | 10 |
| 4470 ± 1190 | 5 | 0.15 | 1.25 | 0.75 | 8 | 100 | 10 |
| 40400 ± 2390 | 8 | 0.48 | 2 | 2.4 | 5.6 | 100 | 10 |
6,7 den uyarlanmıştır.
- PA jel 2 saat süreyle polimerize edelim ve sonra deiyonize su altında lamelleri çıkarın.
- Tepkimeyen akrilamidler kaldırmak için (~ 8 saat) gece suda büyük COPLAN kavanozlarda Pensilvanya jel slaytlar yıkayınız.
- 2-4 saat için ya da PA jel kadar 37 ° C fırın içinde kuru slaytlar tamamen sertleştirir.
- PA jel kızak ve mühürlü bir slayt kutu içinde bir ay için 4 ° C sıcaklıkta saklanabilir.
2. Protein Usta Levha Hazırlama
- Tüm proteinler omuzd sağlayıcı tarafından önerilen arabellekleri 10X çözümler stoklarında bölünüp -80 ° C'de saklanabilir En çok ECM proteinlerinin deiyonize su içinde çözünür olan, ancak, pH asetik asit damlaları ile ayarlanması gerekebilir. En çok büyüme faktörleri, sitokinler, ve rekombinant alıcı hücre dışı etki BSA ile PBS içinde hazırlanmış, ancak üretici koşulları değişecektir. Bir 0.45 mikron önceki depolama için naylon 4-mm şırınga filtresi (Nalgene) yoluyla protein alikotları filtreleyin.
- Istenilen protein kombinasyonları ve seyreltme ile uygun olarak bir ana plaka tasarlar. Bağlanan hücreler genellikle hücre yapışma aracılık için en az bir uyumlu ECM varlığına dayanan, fakat hücre yüzey epitoplarına karşı antikorlar da bazen bağlanma aracılık edebilir. Bu diziler daha sonra kolaylıkla merkezli olacak, böylece de en az bir serbest ya da bir boya FITC-konjuge fluorphore protein eklemek için iyi bir fikirdir.
- 100 mM oluşan baskı tampon ile protein kombinasyonları seyreltilmesi ile ana plaka hazırlanmasıTris-acetate/20% glycerol/0.05% Triton-100X pH 5.2. Genellikle, 384-kuyulu plakanın her bir kuyu en fazla 10 ul içermektedir.
- Bir sekme ayrılmış veri tabanı dosyasındaki her ana plaka her çukurun içeriği kaydedin ve benzersiz bir kimlik numarası ile her ana plaka verin. Tasarımcı harfleri tarafından takip edilen altı basamaklı tarih genellikle amacı (MMDDYYinitial) vermektedir. Miktarlar da küçük olduğundan, protein alikotları tekrarlı plakaları büyük bir sayı üretmek için verimli bir şekilde kullanılabilir. O ana plakalar -80 ° C ve her ana plaka ikiden fazla donma-çözülme döngüleri geçmelidir saklanır tavsiye edilir.
3. MEArray Baskı
- MEArrays en geleneksel mikroarray baskı robotları ile basılabilir. Silikon veya paslanmaz çelik pinler kullanabilirsiniz Quill iğneli yazıcılar iyi çalışabilir, ancak protein viskozite sorunlu olabilir. Çalıştıkları gibi Kapiler yazıcılar, bu uygulama için idealdir mikroarray baskı robotlarviskoz protein çözeltileri ile iyi.
- Bir dizi içinde iyi bir istatistiksel güç elde etmek için, her mikroçevresinin 10 ila 12 tekrarında noktalar önerilir. Böyle bir tasarım basit t-testi kullanılarak istatistik aynı dizideki bir göre bir mikroçevresindeki aktivitesi mukayese izin verir. Dunnette test diğer mikro ile bir kontrol ortamı içinde faaliyet karşılaştırmak için kullanılabilir. Işlevsel bir fenotip MEArray deneyler gerçekleştirmeden önce kontrol mikroçevrede ile ilişkili olduğu, bu tasarım en iyi şekilde çalışır.
- Nem% 50 civarında tutulmalıdır. Düşük nem işaretçilerine içinde veya baskı katmanlarından üzerine verimsiz birikimi neden ana plaka kuyularda çözüm kuru çünkü Nem kontrolü önemlidir. Nem gözeneksiz plastik örtü ile robot draping ve% 50 nem korumak için ayarlanmış bir nemlendirici ve bir de-nemlendirici kullanarak hem etkin bir şekilde kontrol edilebilir. Soğutmalı baskı plattens usef olabilir,Bazı proteinler korunması için ul, ama dikkatli slaytlar üzerinde buğulanma önlemek için alınmalıdır.
- Yazdırılan her dizi üç basamaklı bir sayı (MMDDYYinitial-nnn) izledi ana plakanın tanımlayıcı oluşan bir seri numarası ile kodlanmış dondurucu geçirmez slayt etiketleri ile etiketlenmiş olmalıdır. Her dizi veya kullanılmış dağıtılır gibi, kendi deneysel tedaviler bilgilerini bir veritabanında muhafaza edilmelidir. Baskı tarihleri ve ana plakaların donma-çözülme döngüleri takip numaraları tekrarlanabilirlik sağlamak için en uygun koşulları belirlemeye yardımcı olacaktır.
- Baskılı MEArrays fazla bir ay boyunca -20 ° C'de mühürlü kaydırma kutularını da muhafaza edilmelidir. Tekrarlanabilirlik fark bundan sonra azalır.
4. Fonksiyonel Analiz MEArrays ilgili ekimi Memeli Hücreleri
- Kültür odaları takın: medya ve MEArrays üzerinde hücre gerekli kültür numaraları hacmi sınırlamak için, plastik bir kamara fitted baskılı dizi surround. Birçok diziler için, 4.2 cm 2 lik bir alan içeren bir 2-bölme sürgüsü (Nunc) bir tek bölme kullanılabilir. Üretilen odasının slayttan odaları çıkarın ve bir jilet ile yarım odaları kesti. Bir MEArray yüzeyi üzerinde bir bölme ve pres kenarına akvaryum silikon ince bir boncuk (DAP) uygulamak için bir 3 ml'lik şırınga kullanın. Dizi özellikleri uygulanan akvaryum silikon haznesi yerleştirmekten kaçının.
- Engelleme ve durulama: MEArrays hücreleri için toksik olabilir tepkimeye girmemiş monomerler, kaldırmak için iyi yıkanmış olması gerekir. PDMS-kaplanmış slaytlara kullanılacak olursa, o zaman baskılı özellikleri arasındaki bölgelerin birinci hücre yapışmasını önlemek için bir non-kirlenme kaplama ile bloke edilmesi gerekir, su içinde% 1 Pluronic F108 (BASF) ya da içinde% 2 BSA içinde inkübe diziler vakum altında 15 dk için su. PA jel slaytlar engelleyici bir adım gerekmez. Tüm durumlarda, (medya tercih bağlı beş dakika için hücre kültürü ortamı ile dizileri üç kez durulamaKullanılan hücreler üzerinde, fakat antibiyotiklerin kullanımı) bağımsız olarak ortam veya hücre tavsiye edilir. PA jeller jel rehidrate medya ek 30 dakika inkübasyon gerektirir.
- Hücre eki: Dört beş diziler steril Petri tek bir 15 cm içine sığabilir. Diziler steril tutmak için bir kapaklı Petri kabı Kapak. 10.000 ila 1.000.000 'hücre / ml' lik nihai bir konsantrasyona ortam içinde hücreler ekleyerek MEArray için son ortam hacminin yarısına ekleyin. Hücreler baskılı mikroçevresinin kompozisyonuna bağlı olarak farklı oranlarda baskılı özellikler eklenecektir. 15 ila 20 dakika aralıklarla ters mikroskobu aracılığıyla diziler görüntüleyerek üniforma eki için kontrol edin. Hafifçe ileri geri MEArrays sallama ile, desenli bir şekilde bağlama hücre yüzer, bağımsız hücrelerden ayırt edilebilir.
- İlişkisiz hücrelerin çıkarılması: PA-kaplı MEArrays üzerinde, ilişkisiz bir hücre aspire edilebilir ve ortam uygun bir hacim ile değiştirilebilir. P üzerindeHücrelerin kurumasına ve hemen ölür çünkü DMS kaplı MEArrays, medyanın tamamen de kaldırıldı olamaz. Bağlanmamış hücreler olarak mikroskopik inceleme ile belirlendiği kaldırılana kadar Böylece PDMS-kaplı MEArrays üzerinde, bağlanmamış hücreleri ortam hacminin yarısı ardışık değişim bir işlem ile çıkarılması gerekir. PDMS de-ıslatma ile serum ihtiva eden ortam tanımlı medya göre kullanıldığı zaman, daha az belirgindir, ve zaman BSA Pluronics F108 ile karşılaştırıldığında baskısız alanların bloke etmek için kullanılır.
- Hücreler normal bir ortam değişiklikleri ile birçok gün için 15 cm Petri kapları içine yerleştirilir MEArrays kültüre edilebilir. PDMS slaytlarda Ortam değişiklikleri medya hacminin yarısını izleyen değişiklikler yapılmalıdır.
- Örneğin paraformaldehit ve metanol / aseton gibi ortak fiksatifler, MEArray sistemleri ile uyumludur. PA-kaplı MEArrays üzerinde boyanan hücrelerin zaman, tespit ediciler ilave edilebilir ve bunlar, geleneksel bir boyama işlemi içinde olacağı gibi yıkadı.Bununla birlikte PDMS-kaplı MEArrays üzerinde boyanan hücrelerin zaman, yüzey bile tespit sırasında ıslak kalması gerekir. Medyanın yarısı aspire ve fiksatif ile değiştirin. Iyi fiksatif çoğunluğu ile dolu birkaç kez kadar işlemi tekrarlayın. Tespit edildikten sonra, sabitleştirici kademeli olarak analiz sonraki adım için uygun olan bloke edici tampon ile aynı şekilde değiştirilir.
- İmmun Boyamanın sık hücresel fonksiyonları analiz etmek için kullanılır. Boyama rutinleri değişecektir ancak PDMS MEArrays üzerinde çalışırken, bir ihtiyacı her yıkama ve yukarıdaki gibi aspirasyon adımı gerçekleştirmek için, yavaş yavaş çözümler değişen ve de-ıslak için yüzeye izin asla. De-ıslatma boyama eserler neden olacaktır.
- Chambers bir tıraş bıçağı yardımıyla temizlenebilir. Lameller Fluoromount-G (Southern Biotech) kullanılarak lekelenmektedir MEArrays üzerine monte edilebilir. Algılama çok renkli floresan mikroarray tarayıcıları ile veya motorlu ile konfokal mikroskoplar yapılabilirkiremitli görüntü toplama modları.
5. Temsilcisi Sonuçlar
Örneğine göre, protein birikimi bir örneği, bir baskılı PDMS-coasted Şekil 2 'de gösterilen bir mızrap pim mikro baskı robot üzerinde bir kare-uçlu silikon pimleri kullanarak MEArray. Baskılı çeşitli proteinlerin çökelmesi immünofloresan kullanarak antikorları (Şekil 2A) tarafından kontrol edilebilir. Ana plaka protein çözeltileri çözeltiler baskı katmanlarından yüzey (Şekil 2B) biriken miktarı (floresan yoğunluğu yansıtan vardır). Hücreler açık desenli bir şekilde (Şekil 2C) baskılı özellikler eklemek gerekir.
Iki mikroçevresindeki protein ters dilüsyonları bir insan meme epitelyal multipotent p bir protein konsantrasyona bağımlı bir şekilde spesifik olarak keratin ifade profilleri yol açtığını gösteren bir MEArray deney bir örneğirogenitor hücre hattı (D920 hücreleri), Şekil 3 'de gösterilmiştir. Kabarcık araziler belirli fenotipleri bir dilüsyon serileri tekrarında özellikleri hücreleri dayatılan olup olmadığının belirlenmesinde yararlıdır. Bir mikro içinde, belirli bir molekülün farklı bir fenotip neden Örneğin, eğer, bir kez öğretici bileşen fenotip değiştirmek ya da kaybolur nötr bir ECM'in alındığım bildiren bir arka plan için yeterli miktarda seyreltik edilmiştir. Keratin 8 ve keratin 14 ara filament proteinlerin immünofloresan algılamanın bir Akson 4200A (Moleküler Cihazlar) mikroarray tarayıcı ile yapıldı. Oniki çoğaltmak dilüsyon serileri her MEArray basılmış, ve keratin 14 keratin 8 günlük 2 oranı floresan yoğunluğu sinyal değişimi ve tekrarlanabilirliği gerçekçi bir fikir vermek için bir kabarcık komplo olarak grafikle edildi demek edildi. Gösterilen hücre bağlı olduğu ve bağlanmamış hücreleri (Şekil 3A) uzağa yıkandı, sonra sabit bir MEArray verileri, ve cultu 24 saat sonrare (Şekil 3B). Bu göreceli olarak küçük analiz için, bir tek-yönlü varyans analizi iki-kuyruklu t-testi belirlemek için kullanıldı, her zaman noktasındaki ortalama sinyal dan varyans belirlemek için kullanılır, ve iki gruba ayrıldı olup olmadığını tip I kolajen farklı seyreltiklerde ve rekombinant insan P- cadherin keratin ifadesinde değişikliğe yol açmıştır. Sadece ek sonra özellikleri hücreler arasındaki ortalama hiçbir varyasyon yoktu, ancak hücreler arasındaki keratin ifadede önemli farklılıklar farklı mikroçevrelerde maruz kalma 24 saat sonra vardı. T-testleri doğrulandı yüksek tip I Yüksek P-kaderin konsantrasyonları 24 saat sonra güçlü bir keratin 14 sinyal elicited ise kollajen konsantrasyonları, yüksek keratin 8 ifadesi ortaya çıkardı. Bu sonuç, P-kaderin içeren mikroçevrelerde iki güçlü meme progenitör hücreler 4 K14-ifade myoepitelyal fenotip empoze edeceği önceki raporlar ile uyumlu idi.
Bütün bir scanne bir örneği, 40,000 Pa PA jel üzerinde basılı d MEArray Şekil 4 'de gösterilmiştir.

Şekil 1. MEArray prosedürünün bir akış şeması. Birincisi, baskı katmanlarından PDMS ya da PA ile ya da hazırlanır. İkincisi, ana plakalar bir veritabanında hazırlanmış ve açıklamalı vardır. Üçüncüsü, MEArrays baskılı ve seri numaraları ile kodlanır. Dördüncü, kültür odalarına bağlı, yüzeyleri blok ve / veya çalkalanmalı, sonra da hücre eklemek için izin verilir ve ilişkisiz hücreleri yıkandıktan vardır. Beşinci olarak, hücrelerin deney tasarımı göre kuluçka döneminden sonra boyama ya da biyo-tahlil ile tedavi edilebilir. Nihayet, MEArray Görüntüler elde edilen ve uygun tarayıcı ve yazılım ile analiz edilebilir.
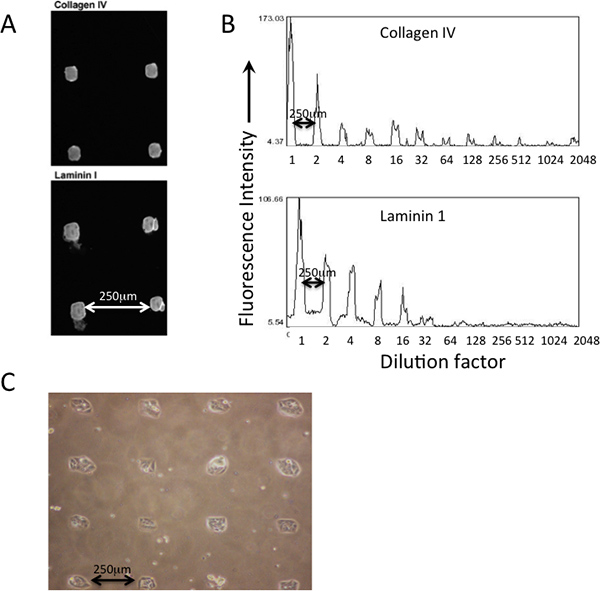
Şekil 2. Deposbaskılı proteinlerin ition ve göreceli bolluk hücre eki öncesinde immünboyama ile kontrol edilebilir. A) tip IV kollajen tanınan ve laminin-111 bir MEArray basılı özellikleri kendi varlığını doğrulamak için kullanılan antikorlar. B) NIH ImageJ yazılım, 200 ug / ml bir protein solüsyonu başlangıç dilüsyonu, bir dizi karşısında iki proteinin nispi bolluk içinde bir ortalama piksel yoğunluk analizi özelliği kullanılarak, niteliksel olarak değerlendirilebilir. Basılı bir PDMS kaplı MEArray kare biçimli özelliklere bağlı D920 hücreleri C) Faz mikrografı.
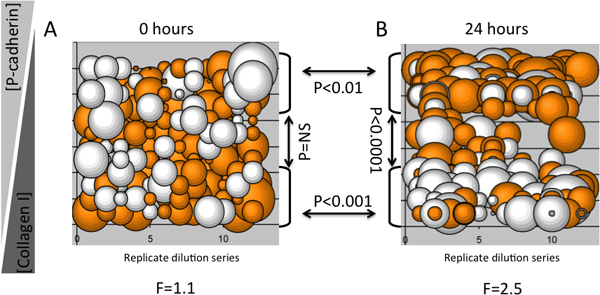
Şekil 3,. Zaman ve mikroçevresinin bir fonksiyon olarak bir multipotent projenitör hücre hattı içinde keratin ifade değişiklikleri kullanarak MEArray analizinin bir örneği. Her kabarcık keratin 8 ve keratin oranları bir fea bağlı 10-15 hücrelerden 14 protein düzeyi temsilBir MEArray yılında Ture. İfade immünofloresan probları ile belirlenmiştir. A) sadece eki sonra hücreleri keratin oranı gösterir, ve B) paralel kaplandı bir dizide 24 saat sonra keratin oranlarını göstermektedir. Her iki protein maksimum konsantrasyonu 200 ug / ml seyreltilmiş ve 2-kat olmuştur. Bir kabarcık çapı keratin 8 ve keratin 14 ortalama yoğunluğu günlük 2 oranın büyüklüğünü temsil eder ve turuncu ve beyaz renkli kodlama sırasıyla değerleri> 0 ve <0 gösterir. Tek yönlü ANOVA ve T-testi ve kıyasla nüfus tespit oklarla parantez P-değerleri için F-değerleri gösterilmektedir.

Şekil 4. Bir MEArray tarama örneği konfokal mikroskop tarama bir lazer üzerinde kiremitli edinimi modunu kullanarak satın aldı. Bu tespit önce 4 saat için DNA analog edu birleştirmek için izin HCC1569 hücreleri.DAPI (mavi) ve Edu (kırmızı) gösterilir.
Tartışmalar
Burada sunulan MEArray yöntemi hücre ve kombinatoryal mikroçevresindeki etkileşimleri 4 fonksiyonel analiz sağlar. MEArray analizi temel micropatterning teknolojileri, hücre biyolojisi ve mikroarray baskı robotlar ve birçok çok kullanıcılı tesisleri mevcuttur analiz cihazları kullanımı birleştiriyor. Serumsuz ortam formülasyonlar ek artırmak BSA ya da <% 1 serum dahil etmek için bazı durumlarda ayarlanması gerekebilir rağmen MEArray ekranlar, en yapışık hücre tipleri ile uyumludur...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
ML NIA (R00AG033176 ve R01AG040081) tarafından ve Laboratuvar Yönetmen Araştırma ve Geliştirme, # DE-AC02-05CH11231 Enerji sözleşme ABD tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | Yorumlar (isteğe bağlı) |
| Cam 25 mm x 75 mm slaytlar | VWR | 48311-600 | |
| Cam lamelleri (no.1) 24 mm x 50 mm | VWR | 48393-241 | |
| Boyama çanak (veya COPLAN jar) | VWR | 25461-003 | |
| Petri kapları (15 cm) | BD Falcon | 351058 | |
| NaOH (1.0N) | Sigma-Aldrich | S2567 | |
| Maymunlar (>% 98 (3-Aminopropil) triethoxysilane) | Sigma-Aldrich | A3648 | |
| Glutaraldehit | Sigma-Aldrich | G7651 | Su içinde% 50 |
| APS (>% 98 Amonyum Persülfat) | Sigma-Aldrich | A3678 | GKD 2 O ile% 10 çalışma çözeltisi hazırlayın |
| TEMED (N, N, N ', N'-Tetramethylethylenediamine) | Sigma-Aldrich | T9281 | |
| Akrilamid (% 40) | Sigma-Aldrich | A4058 | |
| Bis-akrilamid (% 2 w / v) | Fisher BioReagents | BP1404-250 | |
| 0.45 mikron Şırınga filtresi 4-mm naylon | Nalgene | 176-0045 | |
| FITC | Sigma-Aldrich | F4274 | |
| PDMS (polidimetilsiloksan) | Dow Corning | 3097358-1004 | Ellsworth Yapıştırıcılar aracılığıyla Sylgard 184 Elastomer kiti |
| 2 odacıklı slaytlar | NUNC | 177380 | |
| Pluronic F108 | BASF | 30089186 | |
| AquArium mastik | Dow Corning | DAP 00688 | |
| Fluormount-G | Güney Biotech | 0100-01 | |
| Tek kullanımlık plastik bardaklar | |||
| Abeslang | |||
| Nitril eldivenler | |||
| Plastik mikroskop lamı kutuları | |||
| Spin coater | WS-400B-6NPP/LITE | Laurell Technologies Corporation | |
| Fırın | |||
| Dijital hotplate | |||
| 384-kuyucuklu levhalar | Mikroarray robot için uygun bir marka | ||
| Mikroarray baskı robot | |||
| Ters faz ve floresan mikroskop | |||
| Akson mikroarray tarayıcılar | Molecular Devices | Çoklu konfigürasyonları mevcut |
Referanslar
- Bissell, M. J., Labarge, M. A. Context, tissue plasticity, and cancer: are tumor stem cells also regulated by the microenvironment. Cancer Cell. 7, 17-23 (2005).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126, 677-689 (2006).
- McBeath, R., Pirone, D. M., Nelson, C. M., Bhadriraju, K., Chen, C. S. Cell shape, cytoskeletal tension, and RhoA regulate stem cell lineage commitment. Dev. Cell. 6, 483-495 (2004).
- LaBarge, M. A. Human mammary progenitor cell fate decsions are products of interactions with combinatorial microenvironments. Integrative Biology. 1, 70-79 (2009).
- Kim, H. N. Patterning Methods for Polymers in Cell and Tissue Engineering. Annals of biomedical engineering. , (2012).
- Boudou, T., Ohayon, J., Picart, C., Pettigrew, R. I., Tracqui, P. Nonlinear elastic properties of polyacrylamide gels: implications for quantification of cellular forces. Biorheology. 46, 191-205 (2009).
- Tse, J. R., Engler, A. J. Preparation of hydrogel substrates with tunable mechanical properties. Current protocols in cell biology. Chapter 10, Unit 10 (2010).
- Flaim, C. J., Chien, S., Bhatia, S. N. An extracellular matrix microarray for probing cellular differentiation. Nat. Methods. 2, 119-125 (2005).
- Soen, Y., Mori, A., Palmer, T. D., Brown, P. O. Exploring the regulation of human neural precursor cell differentiation using arrays of signaling microenvironments. Mol. Syst. Biol. 2, 37 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır