Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Fetal Fare Visseral Organlardan Otonom Sinir progenitörlerin Floresans aktive Hücre Sıralama (FACS) İzolasyon için bir optimize Prosedürü
Bu Makalede
Erratum Notice
Özet
Fetal fare dokulardan nöral krest kaynaklı nöronal ataları arındırmak için optimize edilmiş bir prosedür anlatılmıştır. Bu yöntem, floresan ile aktive olan hücre sıralama (FACS) tarafından ayrı nüfus yalıtmak için floresan muhabiri allellerinin ifade yararlanır. Tekniğin geliştirilmesi boyunca veya yetişkin dokulardan nöronal subpopülasyonunun izole etmek için uygulanabilir.
Özet
Geliştirme nöral krest (NC) sırasında kaynaklı nöronal ataları bağırsak ve alt üriner sistem gibi iç organlarda otonomik gangliyonlar oluşturmak için nöral tüp uzağa göç. Lazer yakalama mikro diseksiyon gibi yöntemleri kullanarak ayrık nüfusların izolasyon zordur bu nedenle gelişimi sırasında ve olgun dokularda hem bu hücreler sıklıkla yaygın doku boyunca dağılmış bulunmaktadır. Onlar ancak Tirozin hidroksilaz (TH) gibi nöron spesifik genlerin düzenleyici bölgelerden sürülen floresan gazetecilere ifadesi doğrudan görüntülenebilmekte. Biz canlı TH yüksek verim + bağırsak ve bölünmeler ve floresan aktive hücre sıralama (FACS) dayalı alt üriner sistem (LUT) dahil fetal fare viseral dokular, gelen nöronal ataları için optimize edilmiş bir metodu tanımlar.
Pe geni katekolaminlerin üretimi için hız sınırlama enzimi kodlayan. Enterik nöronal progenitörlerin TH dur ifade etmeye başlayacakfetal intestinal 1 ve TH onların göç ing de yetişkin pelvik ganglion nöronlar 2-4 bir alt kümesi mevcuttur. Bu soy ve bu LUT diğer yönlerine nöronlar ve bunların izolasyon dağılımının ilk görünümü tarif edilmemiştir. TH ifade Nöronal ataları transgen yapı Tg (Th-EGFP) DJ76Gsat/Mmnc 1 taşıyan farelerde EGFP ifade ile kolayca görüntülenebilmekte. Biz 0.5 DPC olarak fiş algılama sabah tayin, 15.5 gün sonrası cinsel birleşme (DPC) de gelişmekte LUT olarak TH dağıtım + hücreler belgelemek için fetal farelerde bu transgen ifade görüntülendi ve gözlenen coalescing nöronal ataları bir alt pelvik ganglion ekspres EGFP.
LUT TH + nöronal ataları izole etmek için, başlangıçta fetal fare bağırsak 2-6 nöral krest kök hücreleri arındırmak için kullanılan yöntemlerin optimize edilmiş. Dayanılmıştır NC-türetilmiş nüfus izole önce çabalarıAkım sitometri için hücre süspansiyonları elde etmek kollajenaz ve tripsin bir kokteyl ile sindirim. Elimizdeki bu yöntemler nispeten düşük canlılığı ile LUT gelen hücre süspansiyonları üretti. Fetal LUT dokularda nöronal progenitörlerin zaten düşük insidansı göz önüne alındığında, son ayrışmaktadır hücre sağkalım artış olacağı gibi ayrışma yöntemleri optimize etmek için yola çıktı. Bizi aşağı analiz için yeterli nöronal progenitörlerin sonraki verimleri ile sürekli daha fazla yaşama (toplam hücrelerinin>% 70) elde etmek için izin düşük basınçta sıralama bu nazik Accumax DİSOSİASYON (Yenilikçi Cell Technologies, Inc), otomatik filtreleme, ve akış belirlenir. Bu tarif yöntemi genel olarak fetal veya yetişkin için mürin dokular ya gelen nöronal popülasyonlarının çeşitli izole etmek için uygulanabilir.
Protokol
1. Ortam hazırlanması (Tüm adımları doku kültürü davlumbaz yapılır)
- Aşağıdaki Kombine: 44 ml L-15 Orta, 0.5 ml 100X penisilin / streptomisin (P / S), 0.5 ml 100 mg / ml sığır serumu albümini (BSA), 0.5 ml HEPES 1M, 5 ml Doku Kültürü dereceli su. Eklemeden önce iyice BSA ve P / S karıştırmak için emin olun. Bu hacim kadar çözülmesi için beş farklı doku tiplerine uygun olmalıdır. Bu ortam, doku enzimatik ayrışma sonra kullanım için su verme çözümler hazırlamak için Adım 3,4 kullanılacaktır.
- 0.22 mikron Polyethersulfone (PES) filtresi olsa Filtre Medya.
- 1X Hank Dengeli Tuz Çözeltisi (HBSS) ve 1X Fosfat hazırlayın doku kültürü dereceli su kullanarak 10X Hisse Senetleri (PBS) Tamponlu Salin. 0.22 mikron PES filtre süzülür. Bu reaktiflerin büyük miktarları vaktinden önce hazırlanmış ve 4 ° C'de saklandı, gerektiğinde, bir doku kültüründe davlumbaz daha küçük hacimli aliquoting edilebilir.
- 1X HBSS, (birden fazla 15 ml konik tüpler doldurunEğer alt diseksiyon planı dokuların sayısı) buz üzerinde tüpleri tutarak eşit tüplerinin sayısı.
2. Diseksiyon
- 60 veya 100 mm petri içeren buz 1X PBS içine kurumsal hayvan bakımı ve kullanımı komitesi onaylanan protokoller ve transfer rahim uyarınca hamile fare zamanlanmış Euthanize.
- Rahim embriyo çıkarın ve buz 1X PBS dekapitasyon yoluyla euthanize. Floresan aydınlatma altında bireysel Ekran, pozitif transgenik ve yabani tip (WT) nontransgenic havuzları bölünerek. Diseksiyon boyunca buz 1X PBS içinde embriyo tutun.
- Bir mikroskop altında, ürogenital sistem alt-teşrih. Ince forseps ile ön ayaklardan düzeyde yer embriyo tutun. Sonra briskly aşağı ve dorsal vücut duvarı ile iç organları çekerek diyaframın düzeyinde forseps ekleyerek genital tüberkül için karaciğerden organlar aşağı doğru çıkarın.
- Ek bir alt-dokuya tahliluzaklıkta çevreleyen doku (Şekil 1) faiz. Buz 1X HBSS içeren 15 ml konik tüp içine her biri ayrı ayrı alt disseke doku tipi yerleştirin. Havuz her bir doku tipi birlikte embriyo fenotipe göre (yani tüm GFP + fetal barsak örnekleri tek bir 15 ml'lik konik tüp içinde birleştirilir).
- Buna paralel olarak, akım sitometri de tazminat kontrolleri için kullanmak wild-tip embriyoların karşılaştırılabilir dokuları diseke.
3. Subdissected Dokuların Çözülme
- Pelet 5 dakika boyunca 210 bağıl santrifüj kuvveti (RCF), 4 ° C'de santrifüje edilerek alt-dokuya disseke. Santrifüj sonrasında, mümkün olduğunca çok HBSS kapalı olarak aspire.
- Doku tiplerinin çapraz bulaşmayı önlemek için her bir numune arasında pipet uçları değiştirmek için emin olmak, Accumax (Yenilikçi Cell Technologies, Inc) içinde doku pelletini. Accumax katma miktarı dokusunun büyük veya daha küçük tutarlar için ölçeklendirilebilir. Tipik olarak 1 için-5 Fetal barsak örnekleri, Accumax 1 ml kullanılacak ama büyük doku havuzu daha büyük bir hacmi ayrışma elde etmek isteyecektir.
- 37 ° izole olan doku (örneğin 13.5 DPC bağırsağın 20 dakika, 15.5 DPC bağırsak 35 dk) aşamasına bağlı olarak 20-45 dakika C su banyosu. Icine koyun tüpler Halfway ayrışma zamanı olsa, elle su banyosu (ya da herhangi bir katı yüzeyi) tarafına karşı tüpü vurmak suretiyle ve (bir eski moda bir cıvalı termometre aşağı sallamak olur gibi) tüp "Flicking" ile doku ayrılıyoruz. Ayrışma süresi sonunda daha örnek ayırmak için prosedür birden çok kez aşağı sallamak tekrarlayın. Daha kırılgan örnekleri için, aşağı titremesinin vigorousness azaltmak ve ayrışma yerine uygun bir düzeyde sağlamak için Adım 3.5 sırasında triturasyonun pipet kullanın. DPC 14.5 ve 15.5 DPC LUT için tipik ayrışma kez sırasıyla 35 ve 45 dakika vardır.
- Doku Accumax içinde kuluçkaya edilirken, Quenching yüzden makyajEtkin çözüm olarak adlandırılan Quench ve 1:5 Quench. Söndürmesinden 6 ml L-15 Ortam için 45 ul 5 mg / ml Dnaz i katarak yapılır. Quench 01:05 30 ml L-15 Media ila 45 ul 5 mg / ml Dnaz i katarak yapılır.
- Ayrışmanın sonunda, buz üzerine 15 ml tüpler hareket ve hemen her tüpe 1 ml Quench ekleyin. Doku (Şekil 2) neredeyse tamamen ayrışmış kadar her numune yukarı ve aşağı öğütmek. Hareketsiz çözeltide doku mevcut bazı küçük parçalar olacaktır. Tamamen homojen örnek ulaşılması kolay ulaşılabilir ne de kötü hücre canlılığı ile sonuçlanabilir olarak istenen bir şey.
- Protokol kalanı için mümkün olduğu kadar buz üzerinde örnek tutun. Quench veya örneklerin çapraz bulaşmayı önlemek için 01:05 Quench kadar pipetleme zaman taze bir pipet kullandığınızdan emin olun.
4. Hücre Süspansiyon Filtreleme
- % 70 etanole batırılmış edilmiştir forseps kullanarak üzerinde 38 mikron naylon örgü membranın kare, 3 cm (Sefar Amerika) koyunYeni bir 15 ml konik tüp ağız. Dar delik ipuçlarını kullanarak membran merkezi haline pipetleme tarafından mesh Filtre hücreleri. Membran filtre ederken doymuş hale gelirse, çıkarmak bir kimwipe olan tüpün ağız kuruması ve hücre süspansiyonu kalanı filtre naylon elekten yeni bir parçası kullanılır. Tüm hücrelerin filtre ettikten sonra, tüp yıkayın ve kalan hücrelerin filtre 1:5 Quench 1 ml kullanın.
- Süzme tamamlanıncaya ya da tıkanmış bir membran değiştirirken, örgü iki rulo ve hücrelerin herhangi bir asılı damlacıkları kaldırmak için tüpün üstünde membran silmek için forseps kullanabilir.
- 210rcf santrifüj ile pelet hücre süspansiyonu, 5 dakika süreyle 4 ° C. 1 ml Quench 1:5 süpernatan ve Pastör pipetiyle pelet kapalı aspire.
- 5 ml polistiren tüpler içine naylon gözlü bir Filtre hücre süspansiyonu. 1 ml ile 15 ml tüp yıkayın 1:5 ve filtre kalan hücreler yakalamak için Quench.
5.. FACS için Örnekler hazırlanması
- Sıralama ve tazminat kontroller için aynı doku kullanıyorsanız, 1/10 th tazminat kontrolleri için kullanılacak yeni bir 5 ml polistiren tüp için örnek hacminin 1 / 20. transfer. Iki porsiyon halinde yaban-tip doku örneği böler. Ikinci yarı 7-Aminoactinomycin D (7-AAD, bir "canlılığı lekesi" olarak kullanılan canlı hücreler dahil bir floresan intercalator) sahip olacak iken bir kısmı (7-AAD sadece buna eklendi (Sadece WT) vahşi tip renksiz edilecektir ). Bunlar tek tek kontrol akışı sıralayıcı de ayrık florofor emisyon arasında bir spektral örtüşme tazminat sağlamak için gereklidir. Örneğin, EGFP gibi tek bir flüoresan raportör için, gerekli kontroller şunlardır: sadece boyanmamış WT hücreleri ve sadece 7-AAD (Şekil 3) ile boyanmış bir tüp EGFP.
- 5 dk için 210rcf azından Quench 1:05 ve santrifüj, 4 ° C ile hücre süspansiyonu içeren bütün 5 ml'lik tüplere doldurulur. Sıvı yaklaşık 200 ul bırakarak, süpernatan aspiretüpünde.
- Quench 1:5 7-AAD 1:1000 sulandırınız. 7-AAD sadece kompanzasyon kontrolü ve sıralanmasını örnekleri 7-AAD boyama seyreltme ekleyin. Sadece EGFP veya WT sadece tazminat kontrolleri 7-tipi AAD katmayın. Hacmi elde edilen hücre peleti başlangıç materyali ve boyuttaki miktarına bağlı olarak değişir eklenecek 7-AAD. 7-AAD uygun tüplere eklendikten sonra, örnekler sıralanabilir hazırız.
Doku Örnek Pool Boyut Cilt tüp * eklenecek 7-AAD 15.5 DPC Bağırsaklar 1-5 200 ul 15.5 DPC LUT 1-5 150 ul
Medya aspirasyon olduğundan Tablo 1. Farklı doku ayrışarak her tüp * nihai toplam miktarın ilave 7-AAD miktarı 50-100 ul arasında değişen bir miktar değişecektir biryaklaşık proses n ve pellet önlemek için gerçekleştirilir. Nihai çözelti hacmi hücre işleme en aza indirecek şekilde ölçülen değildir. - 1.5 ml mikrosantrifüj tüpleri için 0.75 ml TRIzol-LS ekleyerek RNA izolasyonu için hücreleri yakalamak için toplama tüpleri hazırlayın.
- Daha önce açıklandığı gibi in vitro kültür için hücrelerin yerine RNA izolasyonu toplamak, doğrudan 6 sıra doku kültürü plaklarda kendini yenileme ortamı içine tür hücreler, fibronektin kaplı ve medya ile dolu olursa. 2,6,7
6. Akım Sitometri
- Akış sitometresi, geri kirlenmesini önlemek için her bir numune arasında temizlemek için emin olmak, ilk tazminat kontrolleri değerlendirmek. Sıralama için gerilim / kapıları ayarlamak için tazminat örneklerin profilleri kullanın. İstenen dokuda pozitif hücrelerin sınırlayıcı sayıda mevcut ise, farklı bir doku floresans yoğunluğunu ve hücre boyutuna sürece telafisi ayarlar oluşturmak için de kullanılabilir dikkatörnekleri arasında karşılaştırılabilir.
- 7-AAD boya sürebilir ve lekesiz denetimleri (Şekil 4) GFP floresans göreli yüksek yoğunluklu sergileyen hücreleri toplamak ölü hücreleri önlemek için tazminat parametreleri ve kapıları ayarlayın.
- Her mikrosantrifüj tüpüne maksimum 25.000 hücreleri sıralayın. Sıralama geniş çaplı nozul ve nöronal progenitör canlılığını korumak için düşük akış hızı (örneğin, 17psi, 100 mikron meme, 3000 olayları / sn) ile mümkün olan en düşük basınçta yapılmalıdır. Türlü EGFP + hücreler izole etmek için biz EGFP muhabiri heyecanlandırmak için bir 488nm 20mW lazer kullanarak BD Biosciences FACSAriaII bizim izolasyonlar gerçekleştirin.
- Örneklerinde yüksek hücre konsantrasyonlarına içeriyorsa, o daha 7-AAD sıralarken yüksek yakalama verimi sağlamak üzere lekeyi 1:1000 kullanarak hücre süspansiyonu sulandırmak için tavsiye edilir.
- Hemen sıralama sonrasında TRIzol-LS yakalanan hücrelerin Girdap Her bir tüp.
7. Temsilcisi Sonuçlar
Akış sıralama için bir hücre süspansiyonları üretmek için Doku ayrışma yeterli enzimatik sindirimi ve düşük hücre canlılığı neden olabilir kaçınarak aşırı sindirim arasında hassas bir denge olduğunu. Doku ayrışma arzu edilen seviyede bir örnek, Şekil 2 'de gösterilmiştir. Uygun bir şekilde sindirilir dokuda alt disseke organların el öğütme parçaları hala net bir şekilde ortaya çıkmadan (Şekil 2b, 2f). Enzimatik zaman ya da enzimin çok yüksek bir konsantrasyonda çok uzun bir süre boyunca tedavi edilmektedir dokularda, elde edilen süspansiyonun, doku herhangi bir rezidüel büyük parçaları (Şekil 2b, 2H) yoksundur.
Filtreleme Uygun ayrışma ve manuel tipik olarak% 90 daha canlı hücreler sergilemek ve EGFP ifade yüksek düzeyde (Şekil 4) göstermek akım sitometri de sıralama profilleri üretmek. Bu yöntemle elde edilen hücre popülasyonlarının iyi göstermekcanlılığı ve EGFP yakalama + nöronal ataları için gating ile gen ekspresyon sonraki kültür veya analiz için yakalanabilir.
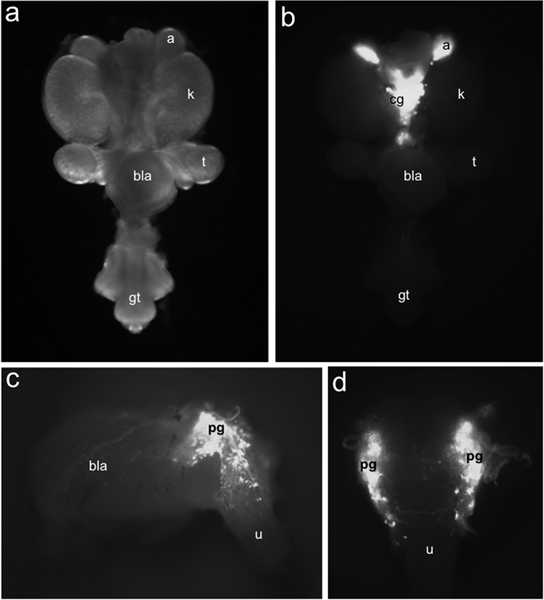
Şekil 1. Fetal fare LUT olarak TH-EGFP + nöronal progenitörlerin Dağılımı. 15.5 DPC de Tüm-mount ürogenital sistem floresan aydınlatma (b) kapsamında belirlenen TH-EGFP transgen ifadesi ile etiketlenmiş EGFP + hücrelerinin dağılımı karşılaştırıldığında (a) aydınlık alan aydınlatma altında ventral izlendi. TH-EGFP ifade adrenaller (a) ve mediale yer çölyak ganglion (cg) mevcuttur. Pelvik ganglion (pg), mesane duvarında (bla) ve üretradan (u) transgen ifadeden floresans 15.5 DPC TH-EGFP alt disseke mesane sergileyen Yanal (c) görünümü. Dorsal görünümünde (d) EGFP + hücreleri dorsal anterior üretrada belirgindir. Diğer etiketler: böbrekler (k), testis (t), mesane (bla) ve genital tüberkül (gt).

Şekil 2,. 15 fetal DPC LUT (a) ve bağırsak (e) 'aydınlık görüntüler, sırasıyla, ayrışma İnkübasyon sonunda, ayrışma inkübasyon periyodu boyunca yarım görüntülenmiştir önce manuel bozulması sonra parçalama (b, f), (c, g), ve bir örnek için (d, s) aşırı ayrışmış olmuştur.
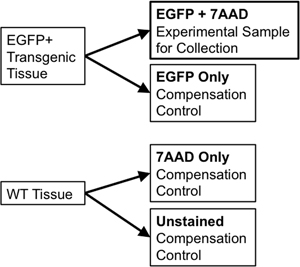
Şekil 3. Şematik titiz FACS yolluk parametreleri kurmak için gerekli tazminat kontrol göstermektedir.
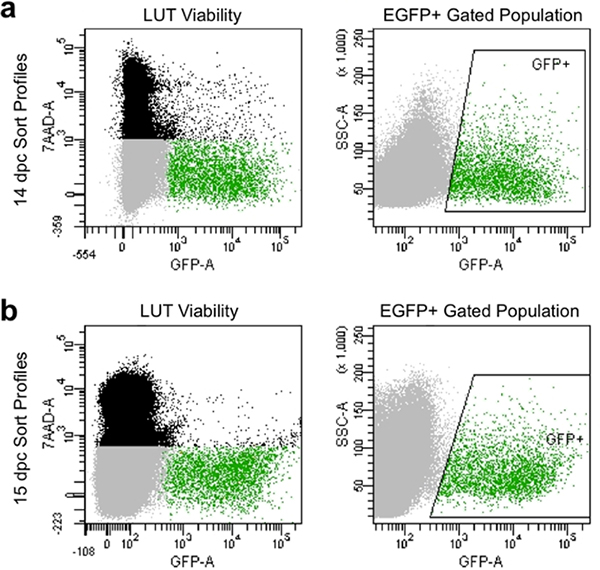
Şekil 4. Akışı tür profilleri Temsilcisi görüntü 14.5 DPC (a) ve 15.5 DPC (b). Siyah nüfusun ölü öne ve yana yayılım dayalı tek hücreler oluşur tarafından etiketlenmiştir7-AAD floresans. Gri nüfusu 7-AAD dışlanmış ve böylece yaşayabilir olan öne ve yana yayılım dayalı tekli hücreler oluşur. Yeşil kapılı nüfus kutulu "GFP +" alanı ile gösterilir ve 7-AAD (canlı) hariç ve EGFP floresans sergilemek sahip tek hücre oluşur.
Tartışmalar
Floresan gazetecilere ifade Fare muhabiri hatları fare genetik topluluk 1,8,9 birden fazla çabalarıyla yaygın olarak kullanılabilir hale gelmektedir. Bunun sonucu olarak Burada gösterilen çözünme yöntemi yaygın fetal veya yetişkin dokular ya gelen nörotransmiter veya reseptör salgılanma modellerini dayalı kesikli nöronal alt tiplerinin izolasyon için uygulanabilir. Bir flüoresan raportör transgen ifade göre bu yöntem optimize edilmiş olmakla birlikte, aynı zamanda hücrenin canlı imm?...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Yazarlar resimli sanatsal yardım için Vanderbilt Üniversitesi Tıp Merkezi ve Melissa A. Musser az Akım Sitometri Paylaşılan Kaynak destek için hücre bölünme yöntemleri ve Kevin Weller, David Flaherty ve Brittany Matlock önerileri için Catherine Alford teşekkür etmek istiyorum. Biz Dr teşekkür ederim. Nöronal progenitörlerin izolasyon uygulanması konusunda tavsiye için Jack Mosher ve Sean Morrison. VMC Akım Sitometri Paylaşılan Kaynak Vanderbilt Ingram Kanser Merkezi (P30 CA68485) ve Vanderbilt Sindirim Hastalıkları Araştırma Merkezi (P30 DK058404) tarafından desteklenmektedir. Bu çalışma Sağlık hibe DK064251, DK086594 ve DK070219 ABD Ulusal Sağlık Enstitüleri tarafından finanse tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Satıcı | Katalog numarası | Yorumlar |
| Accumax | Sigma (mfr: Yenilikçi Hücre Teknolojileri) | A7089-100ML | 1 ml hacme donmuş Mağaza |
| DNase I | Sigma | D-4527 | Depolanan -20 ° C 1xHBSS 5 mg / ml, (Quench Kullanılan, 1:5 Quench) |
| 10X PBS pH 7.4 | Gibco | 70011-044 | Sonra steril filtre doku kültürü dereceli su ile 1x Makyaj |
| 10X HBSS w / o Ca ya da Mg | Gibco | 14185-052 | Sonra steril filtre doku kültürü dereceli su ile 1x Makyaj |
| Leibovitz L-15 orta | Gibco | 21083027 | |
| 100X penisilin / streptomisin | Gibco | 15140-133 | Mağaza -20 ° C'de bölünüp |
| BSA | Sigma | A3912-100G | -20 ° C'de su içinde 100 mg / ml 'de bölünüp depolamak |
| Biowhittaker 1M% 0.85 NaCl HEPES | Lonza | 17-737E | |
| 38 mikron NITEX Naylon Mesh Membran | Sefar Amerika | 3-38/22 | ~ 3 cm'lik kareler halinde kesin. UV doku kültürü kaputu sterilize etmek için gece boyunca tedavi. |
| 7-AAD | Invitrogen | A1310 | 1 mg / ml |
| TRIzol LS | Invitrogen | 10296-028 | |
| 5 ml polistiren tüpler | Şahin | 352058 | |
| 15 ml'lik tüplere konik | Corning | 430790 | |
| Güzel Kesme Forseps | Güzel Bilim Aletleri | 11251-30 | Dumont # 5 forcep, Dumoxel, standart ucu 0.1x0.06mm |
| Kaşık Kesme | Güzel Bilim Aletleri | 10370-18 |
Referanslar
- Gong, S. A gene expression atlas of the central nervous system based on bacterial artificial chromosomes. Nature. 425, 917-925 (2003).
- Morrison, S. J., White, P. M., Zock, C., Anderson, D. J. Prospective identification, isolation by flow cytometry, and in vivo self-renewal of multipotent mammalian neural crest stem cells. Cell. 96, 737-749 (1999).
- Kruger, G. M. Neural crest stem cells persist in the adult gut but undergo changes in self-renewal, neuronal subtype potential, and factor responsiveness. Neuron. 35, 657-669 (2002).
- Bixby, S., Kruger, G. M., Mosher, J. T., Joseph, N. M., Morrison, S. J. Cell-intrinsic differences between stem cells from different regions of the peripheral nervous system regulate the generation of neural diversity. Neuron. 35, 643-656 (2002).
- Walters, L. C., Cantrell, V. A., Weller, K. P., Mosher, J. T., Southard-Smith, E. M. Genetic background impacts developmental potential of enteric neural crest-derived progenitors in the Sox10Dom model of Hirschsprung disease. Human Molecular Genetics. , (2010).
- Corpening, J. C. Isolation and live imaging of enteric progenitors based on Sox10-Histone2BVenus transgene expression. Genesis. 49, 599-618 (2011).
- Morrison, S. J. . Isolation of fetal rat neural crest stem cells (NCSC) from gut and sciatic nerve. , (2012).
- Skarnes, W. C. A conditional knockout resource for the genome-wide study of mouse gene function. Nature. 474, 337-342 (2011).
- Harding, S. D. The GUDMAP database--an online resource for genitourinary research. Development. 138, 2845-2853 (2011).
- Joseph, N. M. Enteric glia are multipotent in culture but primarily form glia in the adult rodent gut. J. Clin. Invest. 121, 3398-3411 (2011).
- Newgreen, D. F., Murphy, M. Neural crest cell outgrowth cultures and the analysis of cell migration. Methods Mol. Biol. 137, 201-211 (2000).
Erratum
Formal Correction: Erratum: An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice
Posted by JoVE Editors on 10/01/2012. Citeable Link.
The authors middle initials were omitted from the publication of An Optimized Procedure for Fluorescence-activated Cell Sorting (FACS) Isolation of Autonomic Neural Progenitors from Visceral Organs of Fetal Mice.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır