Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
SeqA-DNA kompleksleri kristalleşmesi için DNA dupleksler optimizasyonu İteratif
Bu Makalede
Özet
Protein-DNA kompleksleri Kristal yapısı, protein işlevi, etki mekanizması, aynı zamanda, belirli bir etkileşimin doğasını ilişkin bilgi sağlayabilir. Burada ile birlikte kristalleşme için uzunluk, sekans ve dupleks DNA uçları optimize etmek için rapor Escherichia coli SeqA, çoğaltma inisiyasyon negatif regülatörü.
Özet
Escherichia coli SeqA çoğaltma 1 kökeni olan iyon hemimethylated GAİK kümelere göre prematüre reinitiation olayları önler DNA replikasyonunun negatif düzenleyicisidir. Kökeni ötesinde, SeqA çoğaltma çatal, daha yüksek sıralı yapılarına yeni çoğaltılmış DNA düzenlemektedir 2 de bulunur. SeqA ortakları yalnızca zayıf tek GAİK dizilerine sahip, ancak birden çok GAİK siteleri içeren DNA dubleksler yüksek afinite kompleksleri oluşturur. SeqA arasında en az işlevsel ve yapısal birim böylece hemimethylated DNA 3 ile yüksek afiniteli kompleks oluşumu için en az iki GAİK dizileri ihtiyacını açıklayan bir dimer. Ayrıca, oligomerizasyonun ve esnek bir bağlayıcı ile ayrılmış DNA-bağlayıcı etki ile SeqA mimarisi, üç helisel tur kadar ayrılmış GAİK tekrarlar için bağlayıcı sağlar. Bu nedenle, bir moleküler düzeyde SeqA fonksiyonu anlama yapısal ana gerektirirSeqA parçalanma birden GAİK dizileri bağlanmıştır. Protein-DNA kristalizasyon DNA, protein ve DNA göreceli boyutları ve mimariye bağlı olarak ambalaj etkileşimleri üzerinde olağanüstü bir etkisi yok olabilir. Protein veya DNA izleri, DNA'nın çoğu daha büyük ise, kristal paketleme öncelikle protein-protein etkileşimleri aracılığı ile ortaya çıkmaktadır. Tersine, protein DNA ile aynı büyüklükte veya daha az olduğu veya sadece DNA, DNA-DNA, DNA-protein etkileşimlerinin bir kısmını kapsayan zaman kristal paketleme hakim. Bu nedenle, protein-DNA kompleksleri kristalleşme DNA uzunluğu 4 ile DNA uçları (küt çıkıntı veya) 5-7 sistematik olarak tarama gerektirir. Bu yazıda, tasarımı optimize, arındırmak ve yapı tayini için uygundur kristaller elde SeqA bir dimerik varyantı (SeqAΔ (41-59)-A25R) ile kompleks içinde tandem GAİK tekrarlar içeren hemimethylated DNA dubleksler kristalize nasıl açıklar.
Protokol
1. Protein Saflaştırma
Bağlayan esnek bağlayıcı N-(oligomerizasyonun) ve C-terminal (DNA bağlayıcı) SeqA yardımları DNA üzerinde 1-3 tur ayırarak hemimethylated GAİK tekrarlarının tanınması etki. Bu çalışma için, biz daha oligomerizasyonun ve tarafından özel olarak ayrılmış tandem GAİK için bağlayıcı DNA tekrarlar kısıtlayan kısaltılmış bir bağlayıcı engeller N-terminal etki alanındaki bir nokta mutasyonu ile SeqA bir dimerik varyantı (SeqAΔ (41-59)-A25R) kullanılır DNA üzerindeki bir dönüş (Şekil 1) 2,8.
- T7 promotörü kontrolü altında kodlama plazmid SeqA ile BL21 (DE3) hücreleri Transform
- Levha 100 ug / ml ampisilin içeren LB agar plakaları içinde dönüşüm reaksiyonu
- Küçük ölçekli bir gecede kültürü aşılamak için karışık koloniler seçin (LB ortamı 100 mg / ml ampisilin ile),
- Ertesi sabah overni bir 1:100 dilüsyon kullanarak bir ortam 1 L aşılamakGHT kültür,
- ~ 0.7 bir OD 600 hücrelerinin büyümesini ve 1 mM nihai bir konsantrasyona izopropil β-D-1-thiogalactopyranoside (IPTG) ilavesiyle protein üretimi indükleyebilir
- , Orbital sallama ile 37 ° C 'de 3 saat boyunca inkübasyon devam edilmesi ve daha sonra santrifüjle (3,300 g, 10 dakika) ile hücreler hasat
- Saflaştırma tampon A hücre pelletini tekrar ve sonication tarafından lyse,
- Santrifüj (39,000 g hızında 40 dakika) ile temizleyin ve lizat arıtma tamponu ile dengelenmiş bir sütun üzerine heparin süpernatant yük,
- Zehir SeqA, 1 M NaCl (~ 0.7 M NaCl SeqA elutes) bir doğrusal gradyan kullanılarak
- Havuz bir arada SeqA içeren fraksiyonları, saflaştırma tamponu ile dengelenmiş bir katyon-değişim kromatografisi kolon içine iyonik gücü ve örnek yükünü azaltmak için seyreltin
- Doğrusal bir tuz degrade kullanarak, saf SeqA, ~ 0.4 M NaCl elutes
- Birlikte Havuz SeqA içeren fraksiyonları, concentratE (3 mg / ml) ve depolama tampon içinde saklayın.
2. DNA Saflaştırma
- Favori şirket Sipariş tamamlayıcı unmethylated ve metil oligonükleotidler
- , Otoklavlanmış GKD 2 O, vorteks 800 ul Her liyofilize tek iplikli DNA 1 mmol çözülür ve 10-20 dakika bekletin
- Her oligonükleotid için ısıtılmış 2X yükleme tampon 800 ul ekleyin,
- 20-30 nükleotid uzunluğunda oligonükleotidler, büyük bir% 10 denatüre edici jel kolonu (160 x 250 x 1 mm) hazırlanması:
* Iyi% 10 SAYFA karışımı, 80 ul TEMED ve jel başına 800 ul amonyum persülfat 80 ml karıştırın ve dökün,
* Bir kez polimerize, tarak kaldırmak ve GKD 2 O iyice ile kuyu durulayın
* Soğutma plakası içeren jel dökme üzerine jeller birleştirin ve sonra (1X TBE) tamponu ile çalışan üst ve alt rezervuarları doldurmak,
* 55 ° C jel ısınmak için 700-750 V jel önceden çalıştırın,
* Run durdurun ve kuyular THORO durulamaughly tampon çalışan. - 90 oligonükleotidler ısıtılır ° C'de 2 dakika süreyle,
- Vortex ve örnekleri spin ve hemen jel yüklemeden önce,
- ~ 700 V jel çalıştırın ve oligonükleotid yarıya göç etmiş bir kez bunu durdurmak. (% 10 poliakrilamid jel üzerinde bromofenol mavi ~ 60 üsleri uzun ~ 20 üsleri uzun ve ksilen cyanol FF oligonükleotidler ile işbirliği geçirir unutmayın)
- Jel durdurun, jel kutusundan sökmeye ve pullar çıkarın
- Düz bir yüzey üzerinde, bir cam plaka kaldırmak ve plastik wrap ile jel kapağı
- , Jel Dönün diğer cam plaka kaldırmak ve plastik ile ortun
- , DNA gölge görmek için jel arkasındaki UV ışığı ve floresan plaka kullanarak bantları işaretleyin
- Küçük parçalar halinde bir jilet ile bant kesin ve steril bir 15 ml tüp içine aktarın,
- Elüsyon tampon 9 ml ekleyin ve ajitasyon ile 37 ° C gecede Zehir,
- Dikkatle çözümü aktarmakaktarımı akrilamid parçalar önlemek ve pH 7'de 3 M sodyum asetat (1:10 seyreltme) 1 ml artı soğutulmuş% 100 etanol (2.5 hacim) ve 25 ml eklemek için bir jel yükleme pipet ucu kullanılarak bir otoklav santrifüj tüpüne,
- En azından 3 saat boyunca -20 ° C'de inkübe
- , Aşağı spin ve ayrı bir tüpe supernatant aktarın
- Orta ısıda hız amfi üzerine pelet kurulayın,
- Otoklavlanmış GKD 2 O 400 ul pelletini tekrar ve yeni bir tüp aktarmak,
- PH 7'de 3 M sodyum asetat ve% 100 etanol ve 1 mL, 40 ul ekle; iyi karışımı (vorteks) ve oda sıcaklığında 30 dakika inkübe edilir, 30 dakika -20 ° C'de, ardından
- 18.000 g'de 15 dakika boyunca santrifüj ve süpernatant atmak
- 18.000 g, 6 dakika için pelet ve dönüş sonrası kalan tuz çıkarmak için% 70 etanol soğuk 100 ul ile pelet durulayın. , Etanol atın ve hız-amfi üzerine pelet kuru
- Otoklavlanmış GKD 100 ul olmak üzere toplam pelet yeniden süspanse edin 2 O. , Oligonükleotid konsantrasyonunu ölçmek
- Hemimethylated DNA dubleksler tavlama için, onlara su banyosu içinde yavaş yavaş oda sıcaklığına soğumaya bırakın daha sonra tamamlayıcı tek iplikçikleri ekimolar konsantrasyonları karıştırıp ° C de 5 dakika su banyosunda 95 karışımlarının ısı ve.
3. Protein-DNA Kompleks Oluşumu ve Analizi
- Saflaştırılmış SeqAΔ eşit hacimde (41-59)-A25 (81 uM) ve hemimethylated DNA (81 uM), Mix
- 4 az 15 dakika ve mağaza için oda sıcaklığında inkübe ° C bunu kullanmaya hazır oluncaya kadar,
- Ticari seyrek matris ekranları kullanarak kristalizasyon koşulları için Ekran,
- İlk kristalizasyon kabloları tespit edildikten sonra, kırınım kalite kristalleri büyümeye koşulları optimize
- Ya da% 25'lik bir nihai konsantrasyona (göre kristallendirme çözeltisi içinde mevcut PEG 400 miktarı artırılarak edilen SeqA-DNA kristaller Cryoprotectv / v) ya da, kristalleşme çözeltisine% 20 gliserol (v / v) eklendikten
- Naylon bir döngü ile bireysel kristaller Scoop, ve sıvı azot içinde onları flaş dondurma,
- 100 K 'de her bir kristal bir kırınım limit test
4. Temsilcisi Sonuçlar
Hemimethylated GAİK dizileri arasındaki mesafeyi (i); dubleks (ii) uzunluğunda ve (iii): hemimethylated DNA'ya bağlandığı SeqAΔ (41-59)-A25R kristal yapısı elde etmek için, ardışık DNA üzerindeki üç parametre optimize yokluğu / 5 'çıkıntılarının varlığı.
Elektro-mobilite kayma deneyleri SeqAΔ (41-59)-A25R tercihen 9-10 baz çifti (Şekil 1) ile ayrılır GAİK tekrarlar bağlandığını göstermektedir. Bu nedenle, başlangıçta uzun 9 ya da 10 bps ile ayrılmış iki hemimethylated GAİK dizileri içeren (bps) dubleksler 23-24 baz çifti gösterildi. Üç dubleksler güzel şekilli kristaller (Şekil 2) vermiştir. Alyüksek çözünürlüklü kırınan kristaller hiçbiri, 23 9 bps GAİK ayrılması kristalizasyon için tercih edildi belirten diğerlerinden daha iyi X-ışınları kırınım 9 baz puan ile ayrılan iki GAİK siteleri ile uzun dubleks bps olsa. Bu nedenle, sonraki tüm ekranlar için 9 bps arası GAİK boşluk giderilmiştir.
Birden fazla DNA molekülleri kristal 9 içindeki B-DNA sürekli oluşturmak için baş-kuyruk yığını olabilir çünkü genellikle DNA kristalizasyon tam sarmal dönüşler karşılık dubleks uzunlukları için tercih edilmektedir. Bu nedenle, 21 bps (yani iki sarmal dönüşler) için dubleksler toplam uzunluğu kısalır. Künt uçlu bir 21 bps duplex kırınım kaliteli kristaller (veriler gösterilmemiştir), kristaller verim vermedi her iki ucundaki nükleotid tek bir 5 'çıkıntı ile 21 bps duplex bizim evde kaynağındaki 5 Å için kırınan. Verim almazken Kırınım sınırı üzerinde iyileştirme uçtan uca dubleks dernek gerçekten lehine olduğunu öne sürdüing kristal paketleme.
SeqA DNA aynı yüzü üzerinde GAİK dizileri ile etkileşime girer, DNA dubleks bir ters yüz çözücü maruz olmalıdır. Daha da karmaşık ve kristaller iyileştirmek için, daha sonra çift yönlü ters yüz yoluyla kristal içinde bitişik DNA molekülleri ile oluk-omurga etkileşimi teşvik etmek için iki GAİK siteleri arasında bir CG dinükleotid, bir yöntem dahil etmek için çift yönlü dizisini değiştirilmiş Bu son 10 içinde DNA kristalleşme geliştirmek için kullanılmıştır. Bununla birlikte, CG-içeren çift yönlü ile Büyüyen kristallerin kırınım sınırı CG dinükleotid (Şekil 3) içermiyordu benzer bir dupleks DNA ile büyümüş olan ile aynıydı. Bu sonuç oluk omurgası etkileşimleri bu durumda önemli olmadığını belirtti. Bu daha sonra her iki adet ek nükleotid olan bir dubleks DNA ile Büyüyen kristallerin karşılaştırarak çıkmalarla uzunluğu optimize5 'ucu. Bu değişiklik, kristal morfoloji üzerinde önemli bir etkisi olduğu gibi, sınır kırınım ek nükleotid büyük ölçüde moleküler temas ve gelişmiş kristal organizasyon (Şekil 3) değiştiğini göstermektedir.
SeqAΔ (41-59)-A25R kristal yapısı DNA'nın çift yönlü ücretsiz yüz kristal arasındaki temaslara olmadığını doğruladı bu son DNA dubleks bağlı olarak bir CG-dinükleotid tanıtılması sınırlı etkisi bekleniyor. Protein ve DNA göreceli büyüklüğüne rağmen, simetri arkadaşları arasındaki en etkileşimleri protein-protein ve protein-DNA etkileşmeleri (Şekil 4) aracılık eder. İlginç bir şekilde, bu özel durumda, bir 5 'çıkıntı dinükleotid yararlı etkisi olan bir sözde-sürekli DNA oluşumuna bağlı değildir. Bunun yerine, 5 'uzak DNA eksenleri gelen metile iplikçik projelerin sonu ve neden iki nükleotidler w açıklayan karmaşık proksimal SeqA molekülü ile etkileşime ere kesinlikle 8,11 ambalaj kristal değiştirmek için gereklidir.
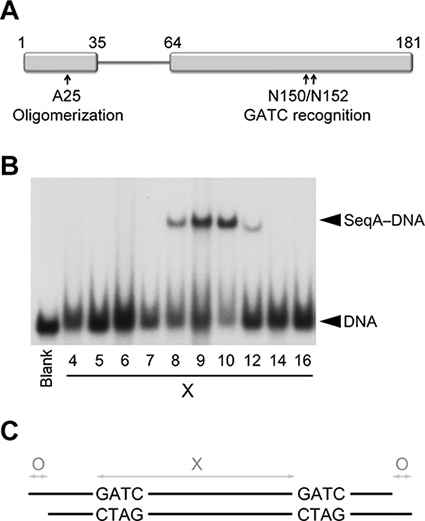
Şekil 1. Hemimethylated DNA ile SeqAΔ (41-59)-A25R bağlanması. SeqA bir etki (A) şematik aracılık protein oligomerizasyonun ve DNA bağlayıcı olduğunu. Baz çiftlerinin giderek artan sayıda (ile ayrılmış iki hemimethylated GAİK dizileri içeren DNA'lar ile SeqAΔ (41-59)-A25R (B) Elektroforetik Devingenlik Değişimi Analizi X). En soldaki şerit (Boş etiketli) SeqAΔ yokluğunda (41-59) olarak iki GAİK sekanslar arasında bir ekimolar 5 ile DNA karışımı, 7, 12, 21, 25 ve 34 baz çiftini içermektedir-A25R. (C) Diyagram kırınım kaliteli kristaller elde DNA dubleksler üzerine optimize edilmiş üç değişken tasvir.
upload/4266/4266fig2.jpg "fo: content-width =" 6in "fo: src =" / files/ftp_upload/4266/4266fig2highres.jpg "/>
Şekil 2. 9 ya da 10 baz çifti ile ayrılmış iki hemimethylated GAİK bölgelerini içeren bir 23-24 bp uzunluğunda dupleksler ile elde kullanılan oligonükleotidler ve kristaller arası mesafe GAİK. Özeti değişen etkisi. Kristallerin Tüm resimler aynı büyütme düzeyinde alınan ve ölçek çubuğu 100 mikron gösterir edildi. Her SeqAΔ ve çözünürlük sınırı (41-59)-A25R-DNA kristal bir RIGAKU RU-300 X-ışını jeneratörü sistemi üzerinde toplanan kırınım görüntüleri dayanmaktadır. büyük bir rakam görmek için buraya tıklayın .

Şekil 3,. T DNA değişen etkisi sona erer. Özeti21 baz uzunluğunda dupleksler 9 baz çifti ile ayrılmış iki hemimethylated GAİK siteleri içeren ve 0, 1 ya da 2 nükleotid 5 'ucunu içeren çıkıntılar ile o oligonükleotidler kullanılır ve kristaller elde edilmiştir. Kristallerin Tüm resimler aynı büyütme düzeyinde alınan ve ölçek çubuğu 100 mikron gösterir edildi. Her SeqAΔ ve çözünürlük sınırı (41-59)-A25R-DNA kristal (NSLS, BNL) X12C ve X29 beamlines toplanan kırınım görüntüleri dayanmaktadır. büyük bir rakam görmek için buraya tıklayın .
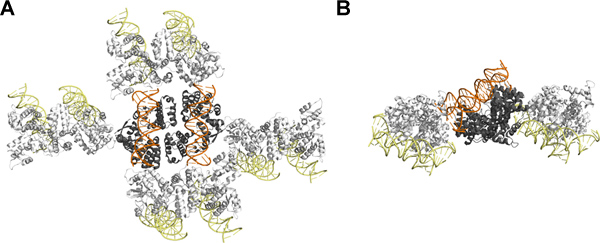
Şekil 4. SeqAΔ Crystal ambalaj (41-59)-A25R dinükleotid çıkıntı ile DNA bağlı: (A) üst ve yan (B) Baktı. Asimetrik birim iki SeqAΔ (41-59)-A25R-DNA, DNA turuncu gösterilen sırasında protein gri gösterilmiştir kompleksleri içerir. SimetrikRy ilgili SeqAΔ (41-59)-A25R-DNA moleküllerinin protein ve DNA sarı için beyaz gösterilmiştir. Bu şekil, PyMOL 12 kullanılarak hazırlanmıştır. Bu rakam Movie 1 ile ilgilidir. büyük bir rakam görmek için buraya tıklayın .
Film 1. filmi görmek için buraya tıklayın .
Tartışmalar
Makromoleküler X-ışını kristalografisi en büyük zorluklardan biri difraksiyon kaliteli kristaller elde edilir. Protein veya protein-DNA kompleksleri halinde, bu sorun optimize edilmesi gerekmektedir ilave değişkenlere bağlı olarak daha da artmaktadır. Bu yaygın DNA uzunluğu ve yapışkan çıkıntılar varlığında daha uzun bir yarı-ana dubleks parametrelerini optimize etmek için olan komşu DNA moleküllerinin ilişki artırmak için düşünülmektedir. Bununla birlikte, bu çıkıntılar doğası ve...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Yazarlar DNA saflaştırılması ile ilgili yardım için veri toplama ve Monica Pillon sırasında yardım için NSLS (Brookhaven Ulusal Laboratuvarı) da PXRR personel teşekkür etmek istiyorum. Bu çalışma Sağlık Araştırması Kanada Enstitüleri (MOP 67189) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog # | Yorumlar (isteğe bağlı) |
| TRIS | Bioshop | TRS003.5 | |
| Etilendiamintetraasetik asit (EDTA) | Fisher Scientific | E478-500 | |
| Dithiotheitrol (DTT) | Bio Basic Inc | DB0058 | |
| NaCl | Bioshop | SOD002.10 | |
| Gliserin | Caledon | 5350-1 | |
| Sakaroz | Sigma-Aldrich | S5016-500G | |
| Sodyum dodesil sülfat (SDS) | Bioshop | SDS001.500 | |
| Üre | Bioshop | URE001.5 | |
| 40% 29:1 Bis / akrilamit | Bio Basic Inc | A0007-500ml | 4 ° C'de saklayın |
| Asit borik | EMD | BX0865-1 | |
| Ksilen cyanol FF | Bio-Rad | 161-0423 | |
| Bromophenol Mavi | Bioshop | BR0222 | |
| Çift Ayarlanabilir Dikey Jel Sistemi | CBC Bilimsel Company Inc | DASG-250 | |
| Endeks kristalizasyon ekranı | Hampton Araştırma | HR2-144 | 4 ° C'de saklayın |
| Sihirbazı Ben kristalizasyon ekranı | Zümrüt BioSystems | EBS-WIZ-1 | 4 ° C'de saklayın |
| Wizard II kristalizasyon ekranı | Zümrüt BioSystems | EBS-WIZ-2 | 4 ° C'de saklayın |
| Klasikler kristalizasyon ekranı | Qiagen | 130701 | 4 ° C'de saklayın |
| Intelliplate tepsileri | Sanat Robbins Aletleri | 102-0001-00 | |
Çözümler Protein saflaştırma tamponu: 100 mM Tris pH 8, 2 mM EDTA, 2 mM DTT,% 5 gliserol. Protein saklama tamponu: 20 mM Tris pH 8, 150 mM NaCl, 5 mM DTT, 0.5 mM EDTA,% 5 gliserol. Jel yükleme karışımı: otoklavlanmış GKD 2 O. 70 ml kadar sakaroz ve 20 g, bromofenol mavi 25 mg, ksilen cyanol FF 25 mg,% 10 w / v SDS, 1 ml ve 10X TBE 10 ml Sukroz eriyene kadar hafif ısıtma ile karıştırın ve nihai ayarlayınhacmi 100 otoklavlanmış GKD 2 O. ml 4 ° C'de depolayın 2X yükleme tamponu: jel yükleme karışımı 10 ml üre, 11 g ekleyin. Üre eriyinceye kadar sıcak tabakta karıştırın. 4 az 2 ml tüpler ve mağaza kısım ° C. 10X PAGE karışımı: Karışım üre 420,4 g, 10X TBE 100 ml (otoklavlanmış),% 40, 250 ml 29:1 GKD 2 O. Bis / akrilamid Tamamen çözülene kadar karıştırın ve 1 litrelik hacim ayarlayın. 4 ° C'de karanlıkta şişelerde saklayın 10X TBE: eritilir 108 g TRIS, GKD 2 O. 1 litre borik asit ve 55 g EDTA ve 9.3 g Otoklav oda sıcaklığında depolanır. Elüsyon tamponu: GKD 2 O. 200 ml 5 M NaCI, 1 M Tris, pH 7.5, 0.5 M EDTA, pH 8, 0,4 ml, 2 ml seyreltik 8 ml Otoklav oda sıcaklığında depolanır. |
Referanslar
- Campbell, J. L., Kleckner, N. E. coli oriC and the dnaA gene promoter are sequestered from dam methyltransferase following the passage of the chromosomal replication fork. Cell. 62, 967-979 (1990).
- Guarné, A. Crystal structure of a SeqA-N filament: implications for DNA replication and chromosome organization. Embo. J. 24, 1502-1511 (2005).
- Brendler, T., Austin, S. Binding of SeqA protein to DNA requires interaction between two or more complexes bound to separate hemimethylated GATC sequences. Embo. J. 18, 2304-2310 (1999).
- Jordan, S. R., Whitcombe, T. V., Berg, J. M., Pabo, C. O. Systematic variation in DNA length yields highly ordered repressor-operator cocrystals. Science. 230, 1383-1385 (1985).
- Tan, S., Hunziker, Y., Pellegrini, L., Richmond, T. J. Crystallization of the yeast MATalpha2/MCM1/DNA ternary complex: general methods and principles for protein/DNA cocrystallization. J. Mol. Biol. 297, 947-959 (2000).
- Rice, P. A., Yang, S., Mizuuchi, K., Nash, H. A. Crystal structure of an IHF-DNA complex: a protein-induced DNA U-turn. Cell. 87, 1295-1306 (1996).
- Yang, W., Steitz, T. A. Crystal structure of the site-specific recombinase gamma delta resolvase complexed with a 34 bp cleavage site. Cell. 82, 193-207 (1995).
- Chung, Y. S., Brendler, T., Austin, S., Guarne, A. Structural insights into the cooperative binding of SeqA to a tandem GATC repeat. Nucleic Acids Res. , (2009).
- Anderson, J., Ptashne, M., Harrison, S. C. Cocrystals of the DNA-binding domain of phage 434 repressor and a synthetic phage 434 operator. Proc. Natl. Acad. Sci. U.S.A. 81, 1307-1311 (1984).
- Timsit, Y., Moras, D. DNA self-fitting: the double helix directs the geometry of its supramolecular assembly. Embo J. 13, 2737-2746 (1994).
- Chung, Y. S., Guarne, A. Crystallization and preliminary X-ray diffraction analysis of SeqA bound to a pair of hemimethylated GATC sites. Acta Crystallogr Sect F Struct Biol Cryst Commun. 64, 567-571 (2008).
- DeLano, W. L. . The PyMOL Molecular Graphic Systems. , (2002).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır