Method Article
Cep Takip Boyalar kullanarak Hücre Bölünmesi İzleme için optimize Boyama ve Çoğalma Modelleme Yöntemleri
Bu Makalede
Özet
Immün hücre fonksiyonu ve proliferasyonu izlemek için hücre izleme boyalar başarıyla kullanımı pek çok kritik adımlar içerir. Biz yöntemleri açıklanmaktadır: 1) membran boyalarla parlak, homojen, tekrarlanabilir etiket-ing almak; 2) florokromlar ve veri toplama şartlarının belirlenmesi ve 3) boya seyreltme esas hücre çoğalması ölçmek için bir model seçerek.
Özet
Floresan hücre izleme boyalar, akım ve görüntü sitometrisi ile birlikte, in vitro ve in vivo olarak farklı hücre tipleri etkileşimleri ve kaderi çalışma hangi güçlü araçlardır. 1-5 tür boyalar kullanılarak yayınları binlerce, bazı anlamıyla olsa En sık görülen hücre izleme uygulamaları izleme şunlardır:
- kök ve progenitör hücre sükunet, proliferasyon ve / veya farklılaşma 6-8
- antijen tahrik zar transferi 9 ve / ya da öncü hücre proliferasyonunu ve 3,4,10-18
- immün düzenleyici ve efektör hücre fonksiyonu 1,18-21.
Piyasada bulunan hücre izleme boyalar onların kimyaları ve floresans özellikleri yaygın değişebilir ama hücre etiketleme mekanizmasına dayalı iki sınıfa birine büyük çoğunluğu sonbaharda. "Membran boyalar", yüksek lipofilik boyalar t vardır, PKH26 tiplemesindekihücre zarları 1,2,11 içine stabil ancak non-kovalent şapka bölümü. "Protein boyalar", KAKE ile özdeşleşen, hücre proteinleri 4,16,18 stabil kovalent bağlar oluştururlar amino-reaktif boyalar vardır. Her sınıf kendi avantajları ve sınırlamaları vardır. Onların başarılı kullanımı için anahtar, özellikle birden çok boyalar farklı hücre tipleri izlemek için kullanılan renkli çalışmalarda, her sınıf 2-4,16,18,24 optimum kullanımını sağlamak kritik sorunları anlamak taşımaktadır.
Protokoller hücre izleme boyalar kullanıldığında zayıf veya değişken sonuçlar üç yaygın nedenleri vurgulamak buraya dahil. Bunlar şunlardır:
- Parlak, homojen, tekrarlanabilir etiketleme ulaşmak için başarısızlık. Bu, herhangi bir hücre izleme çalışması için gerekli bir başlangıç noktasıdır, ama protein boyalar veya antikorlar gibi denge bağlama reaktifleri kullanırken daha membran boyalar kullanarak farklı değişkenler için dikkat gerektirir.
- Suboptimal florokrom kombinasyonlarnd / veya başarısızlık kritik tazminat denetimleri eklemek için. Boya floresan izleme genelde 10 2 - antikor floresans 10'dan 3 kat daha parlak. Bu, izleme boya varlığında kullanılan diğer problar tespit etmek için imkan verecek olduğunu doğrulamak için elzemdir.
- Pik modelleme yazılımı ile iyi bir uyum elde etmek için başarısız. Böyle bir yazılım habercisi frekans veya başka metriklere dayalı farklı popülasyonlar veya uyaranlara boyunca proliferatif cevap kantitatif karşılaştırılması sağlar. Iyi bir uyum elde edilmesi, ancak bir boya dilüsyon profilleri bozabilir hücreleri ölüyor ve gözlenen boya seyreltme profili özellikleri ile modelin altında yatan varsayımların eşleşen / ölü. Çıkarılmasını gerektirir
Burada verilen örnekler hücre çoğalması izlemek membran ve / veya protein boyalar kullanılırken bu değişkenlerin sonuçları nasıl etkilediğini göstermektedir.
Protokol
1. PKH26 Cep Takip Dye ile Genel Membran Etiketleme (Ref. 25; Şekil 1)
- 1.9 - 1.1 adımları steril tekniği kullanın. Trombosit kontaminasyonu en aza indirmek için bir son 300 xg spin ilavesi ile laboratuarın standart metod kullanılarak ~ 10 7 insan periferik kan mononükleer hücreleri veya lenfositler (hPBMC, hPBL) hazırlayın. Adım 2 kullanılmak için bir 500 ul alikot (5x10 6 hücre), rezerv, buz üzerinde 10 HBSS +% 1 BSA ve yerinde 7 / ml 'de hücreler yeniden süspanse edin.
- Bir 12 x 75 mm'lik polipropilen konik tüpe il 5x10 6 hücreleri (500 ul). 3,5 ml HBSS ile bir kez yıkayın. Dikkatle rezidüel sıvı artık 15-25 daha ul bırakarak, ancak hücreleri çıkarmak için özen, süpernatant aspire. Adım 1.4 'de 2x hücre süspansiyonu hazırlamak için bu tüpü kullanın.
- Basamak 1.2 'de yıkama esnasında hücre, bir 12 x 75 mm'lik polipropilen konik tüpe Seyreltici C etiketleme araç ve 0,5 ml (PKH26GL kit) ekleyin. Hazırlık için bu tüpü kullanınAdım 1.5 2x PKH26 çözümdür.
- Aşama 1.2 'den yıkanmış hücre peleti seyreltici C etiketleme araç 0.5 ml ilave edilir ve tek bir hücre süspansiyonu (2 x hücreleri) elde etmek için 3-4 kez aspire ve dağıtmak. Hücre canlılığı ve kurtarma azaltabilir kabarcık oluşumu ve karıştırma, aşırı kaçının.
- Hemen Adım 1.4 2x hücre süspansiyonu hazırlandıktan sonra, Adım 1.3 ve vorteks için hazırlanan Dilüent C tüp etanol içinde 1.0 mM PKH26 boya stoku (PKH26GL kiti) 2.0 ul ekleyerek 2x (4 uM) boya çözeltisi hazırlamak eşit dağıtmak.
- Hemen Adım 1.5 2x boya çözeltisinin hazırlanmasından sonra, hızla 2x boya çözeltisi içine Adım 1.4 2x hücre süspansiyonu Pipeti ve aynı anda aspire ve tamamen boya hücreleri dağıtmak için 3-4 kez vazgeçemeyeceği yapın:. Doğrudan 1.0 mM boya ekleyin hücreleri; 2x boya içine 2x hücreleri dökün; veya vorteks ise boya 2x 2x hücreleri ekleyin. Boyama neredeyse anlık olduğundan, bu tür yöntemleri daha az verimÖnerilen yöntem daha üniform şiddetleri (Şekil 2).
- 1 dakika sonra, ısı inaktive serum veya hücre zarının içine boya alımını durdurmak için HBSS +5% BSA 1.0 ml ekleyin. Yeterince protein kullanmayı Başarısızlık yıkama adımları sırasında hücreleri ile pelet can ve diğer hücrelerin istenmeyen etiketleme neden bir deney mevcut boya agrega, oluşumu riski. % 10 ısıyla inaktive serum (CM) ve HBSS +% 1 BSA ile orta durdurma ayıraç olarak kullanılacak ise, bir 15 ml polipropilen konik tüpe boyanma gerçekleştirmek ve her adsorpsiyonu temin etmek durdurma reaktif en az 5.0 mL adi boya.
- 5 dk için etiketli hücreler santrifüje @ ~ 400 x g. Hücreler çıkarmadan süpernatant dikkatlice aspire. Iyi recentrifugation önce pelet dispersiyon, CM veya HBSS +1% BSA 4 ml ile iki kez pelet yıkayın. Tüp duvarları üzerinde adsorbe edilen boyarmadde taşınmasını en aza indirmek ve yıkama verimliliği maksimize etmek için, fi sonra taze polipropilen tüp hücreleri aktarmakrst resüspansiyon. Not: yeterince lekeli hücreler topak belirgin bir pembe bir belirti sergileyecektir.
- 1.0 ml HBSS +1% BSA yıkanmış hücre pelletini tekrar. , Hücreleri sayın hücre elde belirlemek, ve 10 7 / ml 'lik bir nihai konsantrasyon vermek için hacim ayarlayın. Dikkatli aspirasyon ile, hücre kurtarma ≥% 85 olmalıdır. Hücre kurtarma <% 70 ise, devam etmeden önce nedenini belirlemek. Adım 2 kullanım için buz üzerinde 150 ul kısım (1.5x10 6 hücre) ve yeri çekin.
2. Enstrüman ve Test Ayar Kontrolleri Hazırlanması (Tablo 1)
- 1, 3, 4, 5 ve 7: beş 1.8 ml Eppendorf tüpleri içine her Adım 1.1 kaydedilmiş hücre süspansiyonu boyanmamış hücreleri 50 ul alikot (5x10 5). 2, 6 ve 8: PKH26 pos üç tüplerin her birine Aşama 1.9 'den hücre 50 ul alikot (5x10 5).
- Tüpler 1-8 için; 10 ul IgG bloğu (Reaktiflerin tabloya bakınız 100 mikrogram / IgG tüp) ekleve ortam sıcaklığında (20-25 ° C) sıcaklıkta 10 dakika için inkübe edilir.
- Tüpler bir doygun 4, 5, 7 ila Tablo 1 'de antikor miktarı (ler), ve 8 ekleyin ve 30 dakika oda sıcaklığında ve ışıktan koruyarak için tüm örnekler (Tüpler 1-8) inkübe edilir.
- Tüm örnekler HBSS +1% BSA 1.5 ml ekleyin, pelet santrifüj (5 dak 400 xg) ve dikkatli aspirasyon ile HBSS +1% BSA 1.5 ml ile bir kez yıkayın tarafından hücrelerin hücre kaybını önlemek için.
- HBSS +1% BSA 500 ul her örnek süspanse edin. Sizin sitometresinde analiz edilecek numuneler için gereken, bir 12 x 75 mm yuvarlak dipli tüp transfer. Tablo 1 'de olduğu gibi Tüpler 3, 6, 7 ve 8-100 mg / ml 7-AAD çalışma stok günlük (Reaktiflerin tabloya bakınız) 10 ul ekle. Akış sitometresi kurulum ve boyama doğrulama (3. Basamak) içinde kullanılmadan önce 30 dakika süre ile buz üzerinde inkübe edin.
3. Akış Sitometresi Kurulum ve Boyama Doğrulama
- Doğrulayın akış cytometer günlük kalite kontrolü için laboratuvar kurdu prosedürlerini kullanarak, düzgün çalışıyor demektir. Bu sinyaller doğrulama kolayca kullanılmak üzere her spektral pencerede tespit edilir ve detektör çoğalma tepkileri izleme 14 için kullanılacak pencere içinde yoğunluk sinyali doğrusal orantılı olduğu varsayılır. Edilebilir
- Lineer ekran ölçekler kullanılarak FSC vs Tüp 1 için SSC verileri edinin. Lenfosit popülasyonu nokta arsa sol alt kadranda düştüğü her dedektörün amplifikasyonu gibi ayarlayın, her iki parametreyi de off-ölçekli değildir ve eşikleme nedeniyle kesintiye uğramaz. 3.7 - Adımlar 3.3 Tüm örnekler için ungated FSC vs SSC verileri toplayın.
- Tüm 4 floresan dedektörler için renk yok tazminat ve logaritmik ekran ölçekler kullanarak, Tüp 1 için veri edinin. / Hayır hücreleri ilk kanal birkaç biriken ölçekte boyanmamış lenfositlerin otofloresans yerleştirmek için her dedektörün yüksek gerilim (HV) ayarlayın. Her histogram analizi sınır ayarlamaboyanmamış hücrelerinin parlak% 2 karşılık gelmektedir.
- Adımları 3.2 ve 3.3 'te kurulan hiçbir renk tazminat ve HV ayarları kullanarak, FSC, SSC ve tüm 4 floresans dedektörleri sinyalleri toplayarak, Tüp 2 için veri elde. PKH26 floresans izlemek için kullanılan dedektör için son kanal birkaç / hiçbir hücre ile, tüm PKH26 pos hücreleri 3. -4 dekadlarıdır tek bir simetrik pik olarak ölçekte göründüğünü doğrulayın. Orada birden zirveleri ya da tepe şekli çarpık ise, minimizasyonu ve karıştırma tekniği (Şekil 2) tuzlu özenle Adım 1'i tekrarlayın. Eğer gerekirse, boya konsantrasyonu ayarlanır.
- Adım 3.3 'de kurulan ayarları kullanarak, FSC, SSC ve tüm 4 floresans dedektörleri sinyalleri toplayarak, Tüp 3 için veri elde. 7-AAD floresans izlemek için kullanılan dedektör için, 7-AAD pos hücreleri (cansız hücreleri iyi çözümlenir yani, Adım 3.3 yılında% 2 sınır üzerinde düşüş olduğunu doğrulayınuygulanabilir 7-AAD neg hücreleri).
- Adım 3.3 'de kurulan ayarları kullanarak, FSC, SSC ve tüm 4 floresans dedektörleri sinyalleri toplayarak, Tüp 4 için veri elde. CD8 pos hücreleri de boyanmamış hücreleri (yani, FITC dedektör için Adım 3.3 kurulan% 2 sınır üzerinde düşüş) çözümlenir doğrulayın. Tüp 5 ile tekrarlayın ve CD8 pos hücreleri de boyanmamış hücreleri (yani sonbahar APC dedektör için Adım 3.3 kurulan% 2 sınır yukarıda) çözümlenir doğrulayın.
- Adım 3.3 'de kurulan kullanarak ayarları, FSC, SSC ve tüm 4 floresans dedektörleri sinyalleri toplayarak, Tüpler 6, 7 ve 8 için veri elde.
- Tüpler 1-5 ve diğer üç florokromlar izlemek için kullanılan dedektörler her florokrom için matris örtüşmeyen bir renk oluşturmak için renk kompanzasyon yazılımı için toplanan liste modunda dosyaları kullanın. Örnek 6 için liste modu dosyası için bu matrisi uygulayın ve doğrulayın PKH26 laboratuvar varlığıeling 7-AAD kut hücreleri algılamak için yeteneğini etkilemez.
- A) 3 düzeldi altgrupları (CD3 neg neg CD4, CD3 pos CD4 neg ve CD3 pos CD4 pos) bir FITC vs ile tespit edilebilir: Renk Örnek 7 için liste modu dosyası için adım 3,8 matris örtüşen ve doğrulamak Uygula APC nokta arsa, ve anti-CD3-FITC ve anti-CD4-APC b) varlığında 7-AAD kutuplu hücreler tespit etme yeteneğine değiştirmez. , Anti-CD3-FITC varlığında PKH26 detektör toplanan veriler için üst sınır% 2 değiştirilmesi durumunda, gerekli olan sınır yeniden ayarlanması.
- Adım 3,8 Örnek 8 için liste modu dosyası için renk örtüşme matris uygulayın. PKH26 etiketleme varlığında Adım 3.3 otofloresans kontrolü kullanarak bu kümesinden FITC, 7-AAD veya APC dedektörler için% 2 sınır değiştirir ise, Tablo 1 Tüp 7 kullanılarak gerektiğinde sınır (lar) yeniden ayarlayın ve doğrulayın o yine disting mümkündüruish CD3 pos CD4 pos, pos CD3 CD4 neg ve CD3 neg neg CD4 hücreleri ayarlanmış sınır (lar) kullanarak.
4. Boya Seyreltme tarafından Hücre Bölünmesi İzleme Proliferasyon Model Seçimi
- Sizin Sitometre üzerinde kanallar ve logaritmik yıllardır sayısına bağlıdır nesiller arasındaki aralığı belirleyin. Dijital aletleri için bu değer, tipik olarak 4 veya 5 on, dijital sinyal işlemcisi içinde kutuların sayısına göre belirlenir. Analog aletler üzerinde, yıllardır sayısı nadiren bütün bir sayıdır, doğru bir modelleme deneysel olarak tespit edilmesi onlarca yıl kesin sayısı gerektirir. Bunu yapmak için, üretici tarafından atanan göreceli yoğunlukları ile kalibre floresan boncuk karışımı veri deneyde kullanılan aynı detektör yüksek voltaj ayarlarında elde edilir. Boncuk tepe noktalarının konumu int açısından logaritmik ölçekli kalibrasyon sağlarGeçmiş on yılda densite aralığı. Özellikle, bu üretici tarafından değeri log karşı her bir boncuk tip için kanal numarasını çizilmesi ile yapılır. Boncuk veri değerleri için en uygun doğrunun eğimi kanal başına bağıl yoğunluk birimlerinin sayısını verir. Kanal sayısı ile çarpılır, bu değer daha sonra yoğunluğu iki kat azalma (yani, kızı nesil aralık) karşılık gelen kanal sayısı 14 hesaplanabilir hangi tam ölçek için günlük on sayısı olacaktır.
- Nesiller arasında sabit bir aralık kullanmak veya aralık dalgalanmaya bırakmaya karar verin. A Standart (sabit) ayarı, her kuşağın yerini atamak Adım 4.5 belirlenen kuşak boşluk değerini kullanacak ve histogram farklı zirveleri yoksun olduğunda genellikle kullanılır. A Float ayar her kuşak peak pozisyonuna histogramın şekli ile tespit edilebilir ve ne zaman distinguishabl genellikle kullanılırE kuşak zirveleri belirgindir.
- Tüm kuşaklar veya kayan genişliği için sabit bir tepe genişliği kullanacağınıza karar verin. Sabit bir genişlik tüm nesillere modellemek için uyarılmamış kontrol örneği için SD hesaplanan kullanır ve örnek ayırt nesiller zirveleri yoksun olduğunda genellikle seçilir. Bir yüzer genişlik programı bağımsız olarak her kuşak için SD değişmesini sağlar ve en iyi şekilde ayırt edilebilir kuşak zirveleri ile birlikte kullanılır.
- Proliferasyonu analiz modülü (burada ModFit LT Sürüm 3.3) içeren bir program çalıştırın. (Örneğin, Tablo 1'de Tüp 8 olarak zıt PKH26 pos hücreleri uyarılır 96 saat kültür) analiz edilecek veri kümesinin gelen uyarılmış PKH26 pos dosya yükleyin.
- Bu durumda uygulanabilir kapılanan PKH26 (585/42) (7-AAD neg) CD3 pos lenfositler ve küçük moloz ve büyük agrega (Şekil 3) dışlamak için FSC vs SSC içinde, analiz için parametreleri seçin. TanımlarkenBu bölgelerde patlamalar genellikle bulunan yüksek forward scatter alanı vardır ve CD3 ekspresyonu uyarılır kültürlerde aşağı modüle olabilir dikkat etmek dikkatli olun.
- Silahların Sihirbazı'nı kullanarak yeni bir proliferasyon modeli oluşturun. Açık Veri Dosyası (Başlangıç sekmesi) kullanarak, uyarılmamış PKH26 pos kontrol dosyası yüklemek ve bölünmemiş hücrelere karşılık gelen ebeveyn dağılımındaki pik kanalın konumunu tanımlamak.
- Ebeveyn pik konumu ve genişliği (standart sapma) değerleri belirterek, uyarılmamış PKH26 pos kontrol dosyası analiz. Sabit bir zirve genişliği (SD) istenirse, Kilit SD kontrol edin.
- PKH26 negatif kontrol (örn., PKH26 negatif hücreleri 96 saat kültür Tablo 1 'de Tüp 7 zıt olarak) yerleştirin. PKH26 neg denetimi yukarıda dimmest nesil için pik kanalı ayarlayarak nesiller sayısını ayarlayın. Bu nu belirlermodeli doğru sığabilecek kızı nesillerin mber ve genellikle 6-9 nesiller.
- Uyarılan numune için veri dosyasını (örneğin, Tablo 1 'de Tüp 8 olarak zıt PKH26 kutuplu bir hücre stimüle 96 saat kültürü) açık olup Aşama 4.7' de tanımlandığı gibi ebeveyn tepe pozisyon ve şizoaffektif bölgeleri değişmeden kalır teyit etmektedir. Sabit kuşak aralığı isteniyorsa, Standart model seçeneği seçin; aksi Yüzer seçeneğini seçin.
- Adım 4.9 'de tanımlanan aynı modeli kullanarak, veri kümesindeki her bir deney dosyasını analiz edin. Hem görsel hem de azaltılmış ki kare (RCS) değere göre tanımlanan ebeveyn tepe konumuna ufak ayarlamalar çok iyi oturması için gerekli olabilir.
- Veri kümesinde her bir deneysel dosya için en iyi uygun sonucu arzu edilen çoğalma ölçümleri kaydedin. Mümkün ölçümleri kapsamlı bir açıklaması için bkz: Ref. 22.
Sonuçlar
PKH26 gibi Membran boyaların hücre zarının içine ziyade kimyasal reaksiyon (KAKE için) veya denge bağlanma (antikor) tarafından neredeyse anlık bölümleme ile leke. Şekil 1 'de belirtilen kritik konuya dikkat eksikliği, Şekil 2' de gösterilen tipteki bulanık ya da heterojen bir boyama meydana gelebilir. Buna karşılık, (Şekil 1, Tablo 2) optimize edilmiş etiketleme koşulları boya seyreltme (Şekil 3) dayanan hücre bölünmesini kontrol de dahil olmak üzere hücre izleme çeşitli uygulamalar için uygun parlak homojen dağılımı ile sonuçlanır kullanır. Ölü / ölen bu hücreleri genişletmek ve / veya eğriltme kızı nesil şiddetleri ve boya seyreltme 3,4,16,18 esas yayılması modelleme karmaşıklaştırıyor izleme boya miktarları, değişen kaybeder. Ölü hücrelerin önemli sayıda önceden edilebilir koşullar altında boya seyreltme veri toplarken bir canlılık boya kullanın nedenle tavsiye edilirBöyle uyarılmış kültürleri (Şekil 3) veya daha büyük numuneler (Şekil 4) olarak gönderilir.
Boya etiketleme izleme tipik floresan yoğunlukları immünofenotipleme büyükse birkaç büyüklük verir Çünkü, uygun bir tazminat kontrolleri (Tablo 1) dahil etmek ve boya izleme varlığı antikoru pozitif ve negatif hücre (Şekil çözmek için yeteneği bozulma olmadığını doğrulamak için önemlidir 4). aşırı renk telafisi için ihtiyaç önlemek için, izleme boya bitişik spektral kanal içinde bir parlak florokrom, ya da bu gibi canlı hücreler tarafından hariç bir boya olarak ilgi hücreleri üzerinde bulunan bir tane değil, (s) yerleştirmek tercih edilir, (Şekil 4A & B vs. 4C-Ge). Iyi bir uyum elde, çoğalma ölçüde ölçmek için pik modelleme yazılımı kullanırken boya seyreltme prof özelliklerine modeli içinde eşleşen varsayımlar gerektiririles (Şekil 5 ve Tablo 3) analiz edilmektedir. Izleme boyalar ve canlılığı reaktiflerin uygun şekilde seçimi ile, aynı anda birden fazla lenfosit alt proliferatif yanıtları karakterize etmek de mümkündür. Şekil 6 içinde gösterildiği gibi, örneğin, bir 2 izleme boya ilave düzenleyici T hücreleri (CellVue Bordo ile etiketlenmiş) ve yüksek oranda çoğalmıştır efektör T hücreleri arasındaki ayrım basitleştirir (CFSE ile etiketlenmiştir) ile elde edilebilir göre olan etkileşimleri ile ilgili çok daha fazla detay sunar 3 H-timidin etiketleme 18,27 kullanarak.
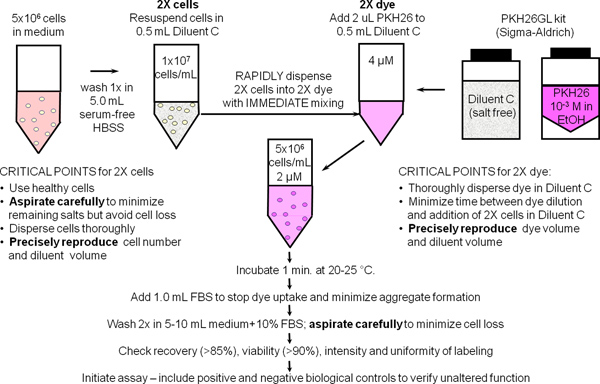
Şekil 1. PKH26, PKH67 ve CellVue boyalar için Genel membran etiketleme protokolü. Hücre zarı içine bu oldukça lipofilik boyalar Bölümlemeeşya boyama çözünürlük ve boya boyama etkinliğini maksimize etmek, sunulan tuzsuz Seyreltici C araç içinde gerçekleştirilir hücreleri ile karıştırma üzerine esasen anında meydana gelir. PKH26 ile genel zar etiketleme için bu şematik de özetlendiği gibi, parlak, homojen ve tekrarlanabilir bir boyama bundan dolayı en kolay şekilde elde edilir: 1) garantiler bir karıştırma tekniği kullanılarak) boyanma adım 2'de mevcut protein ve / veya tuzlarının miktarının en aza indirilmesi boya hücrelerin hızlı homojen dağılımı (yani, aynı anda boya ile aynı konsantrasyon için bütün hücrelerin ortaya koyar).
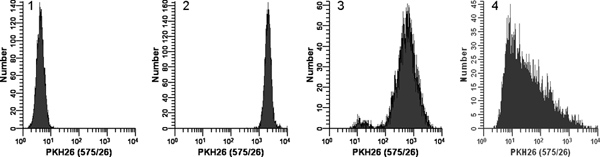
Şekil 2. PKH26 floresans dağılımları (Ref yeniden basıldı. 18) üzerine şartları boyama Etkisi. Logaritmik büyüyen, kültürlü U örnekleri ÇoğaltIle ya da boya 2x 2x hücrelerin üzerine ilave hemen karıştırma olmadan, oda sıcaklığında 3 dakika için: - 937 hücreleri PKH26 (15 uM PKH26 1 x 10 7 hücre / ml, 12 nihai konsantrasyonlar) ile boyandı. Yıkadıktan sonra, boyanan hücreleri alet sabiti ayarları kullanarak bir Beckman Coulter camgöbeği akış sitometresinde analiz edilmiştir Histogram 1:. PKH26 Dedektör gerilimi ile boyanmamış kontrolü birkaç / hayır hücreleri ilk kanal biriken ile ilk on yılda ölçekte tüm hücreleri yerleştirmek için ayarlanabilir. Histogram 2: Derhal karıştırma ile boya 2x 2x hücrelerinin ek kullanarak 15 mcM boya boyanması birkaç / son kanal biriken hiçbir hücre (gMFI = ile, parlak, homojen boyanmış, dördüncü on yerleştirilen hücrelerinin simetrik nüfus sonuçlandı . 2548, GCV =% 26.2) Histogram 3: boya 2x 2x hücrelerinin ek kullanarak 15 mcM boya az ama hemen karıştırma olmadan boyanması yoğunluğu azaltılmış sonuçlandı ve daha geniş bir CV (gMFI = 505 , GCV =% 116) hem de boru çeperi üzerinde yerine 2x boya çözeltisi içine dağıtılan hücreler bir düşüş nedeniyle muhtemelen bir loş lekeli alt populasyonun, Histogram 4:. Bir boyama hata konsantre etanolik boya 3 ul yol açmıştır stok daha ziyade bu 12 mcM nihai boya konsantrasyonu ile sonuçlanmıştır Dilüent C. 2x boya çözeltisi hazırlamak için kullanılan daha karıştırmadan Dilüent C hücreleri 2x doğrudan eklenmiş ama son derece loş ve heterojen boyanma (verdi ediliyor gMFI = 32.9, GCV % = 1020). Sağa skew büyük olasılıkla kombine etkilerini yansıtan gözlenen: i) düşük geniş ölçüde farklı hücre ve boya hacmi nedeniyle karıştırma ve ii) boya dağıtma noktasına en yakın hücreleri öteye daha boya daha yüksek bir konsantrasyonuna maruz kalacağı aslında uzaklıkta. büyük bir rakam görmek için buraya tıklayın .
re 3 "src =" / "fo: content-width =" files/ftp_upload/4287/4287fig3.jpg 4.5in "fo: src =" / files/ftp_upload/4287/4287fig3highres.jpg "/>
Şekil 3,. Canlılık sonda kullanılması T-hücresi çoğalması profillerin gating basitleştirir hPBMC PKH26 (nihai hücre yoğunluğu: 3x10 7 / ml nihai boya yoğunluğu: 10 uM) ile işaretlendi.. 96. varlığında saat (uyarılan) veya anti-CD3 ve IL-2 yokluğu (uyarılmamış) için kültür sonra, hücreler, anti-CD3-FITC, anti-CD19-APC ve 7-AAD ile zıt edildi ve analiz edildi FACSCalibur flowsitometri (ayrıntılar için referans 13). Renk kompanzasyon kablolu kompanzasyon devresi kullanarak veri toplama sırasında yapıldı. ModFit LT3.3 içinde çoğalması Sihirbazı kullanılarak Aşama 4'te tarif edildiği gibi çoğalma derecesi, modellenmiştir. PKH26 neg kontrolü (Tablo 1, Tüp 7) Veri referans (sütun 3 gri doldurulmuş histogramlar) için üst üste. Uyarılmamış için canlılığı ve stimulated kültürler% 76 ve% 62 (paneller için ungated veri A ve B) idi. ortam içinde 96 saat süre ile kültüre Panel A. PKH26 boyalı hücrelerin uygun (7-AAD neg), CD3 kutuplu hücreler (R1) içerecek şekilde işlenir edildi. Antikor içerme ve 7-AAD ölü hücre dışlama kapısına ek olarak, bir ileri saçılım (FSC) karşı yan dağılım (SSC) kapısı (R2) enkaz ve agrega dışlamak için kullanıldı. Bu panelde son arsa ölü hücrelerin olmadığına dikkat edin. PKH26 çoğalması profili (sütun 3) için en uygun modeli RCS = 2.1 (Donör 6, Tablo 3), gösteren iyi bir simetri ile tek bir pik verdiği ve ebeveyn konumunu tanımlamak için kullanılan ve uyarılmış analizi için pik genişliği başlangıç oldu Bu veri kümesi (Panel B) numune. Panel B. PKH26 boyalı hücrelerin bir alikotu tekrarında yüzer tepe pozisyon ile bir model Panel A. de olduğu gibi aynı şekilde işlenir ve 96 saat için, anti-CD3 ve IL-2 ile kültüre edildi ve yüzer pik genişliği verdi RCS = 1.3 (Donör 6, Tablo 3). Panel C. A 7-AAD verilerin kullanımı olmadan analiz edildi Masası'ndaki gibi aynı veri dosyası ile bu veriler için en uygun. Birincil FSC vs SSC kısmen ölü hücreleri ve agrega (R2) ve CD3 pozitif olaylar (R3) seçmek için bir tali kapısı dışlamak için kullanılan zaman, ölü hücrelerin küçük bir kalıntı nüfus (Geçitli olayların% 0,2) kalmıştır. En uygun modeli (Geçitli olayların% 1,29) uyarılmış numune ölü hücrelerin büyük rezidüel nüfus Not Panel C gibi Masası'ndaki olarak B Geçitli RCS = 2.2. Panel D. aynı veri dosyası tek bir pik verdiği Bu yolluk strateji. En uygun modeli kayan pik konumu ve kayan tepe genişliği (RCS = 1.3) ile biriydi. büyük bir rakam görmek için buraya tıklayın .
ig4.jpg "fo: content-width =" 5in "fo: src =" / files/ftp_upload/4287/4287fig4highres.jpg "/>
Şekil 4. Florokrom seçim ve PKH26 ile etiketlenmiş immünfenotip lenfositler yeteneği üzerindeki boya konsantrasyonunun etkisi. HPBMC 24 saatlik eski kandan izole edilen ve boyama 12 x 75 mm yuvarlak dipli içinde gerçekleştirildiği durum ile, adım 1 'de tarif PKH26 ile işaretlendi polistiren tüpler oldukça 12 x 75 mm'lik polipropilen tüplere göre konik. Hemen PKH26 ile etiketleme sonrasında, hücrelerin belirtilen immünofenotipik ve canlılığı reaktifleri ile zıt ve Şekil 3A yolluk strateji ve aşağıdaki optik yapılandırmayı kullanarak bir LSRFortessa akış sitometresinde analiz edildi: 488 nm lazer: FSC-A (488 nm); SSC -A (488/10 BP), FITC-A (530/30 BP), PKH26-A (575/26 BP), 7-AAD-A veya PerCP-A (695/40 BP). 640 nm lazer: APC-A veya Topro-3-A (670/14 BP). Renk kompanzasyon BD DiVa yazılımı kullanarak veri toplama sırasında yapıldı. "Otomatik"(paneller C ve D için A ve B, PerCP paneller için APC), ilgili spektral pencerede no-antikor kontrolü otofloresans gösterir. PKH26 neg kontrolü (Tablo 1, Tüp 7) Veri referans (gri dolu histogramlar, sütun 5) üst üste. Post-boyama canlılığında bütün numuneler (88-92%) için benzer idi. 2 uM bir nihai konsantrasyonda PKH26 ile etiketlenmiş Panel A. Hücreler, anti-CD3-FITC, anti-CD4-, APC, ve 7-AAD (kullanarak zıt edildi Tüp Tablo 3 'de 8). Canlı üzerinde yolluk (7-AAD neg) CD3 pos lenfositler (Sütun 1) ve enkaz ve FSC ve SSC (Şekil 3A) temel alınarak agregaların bırakılmasından sonra PKH26 yoğunluğu APC CD4 (Kolonlar 2 ve 3) ile birlikte değerlendirildi. Dengelenmemiş (sütun 2) ya da (sütun 3) telafi olsun, bu kombinasyon florokrom) CD4 pos CD4 T hücreleri ve negatif T-hücreleri arasında iyi çözünürlük ile sonuçlanmıştır, hem bir no-a ile doğrulanmışntibody, autofluorescent kontrolü (Tablo 1 Tüp 6; Sütun 4) ve CD3 vs iki renkli arsa. CD4 (Sütun 6). Panel B'de. Paneli aynı florokrom kombinasyonu olarak kullanılması, ancak 4 uM son PKH26 konsantrasyonu arttırarak olumsuz CD4 neg T hücreleri CD4 Poz T hücreleri gidermek için yeteneğini etkileyebilir vermedi. Paneli C. bağımsız olarak 2 uM bir nihai konsantrasyonda PKH26 ile işaretli hücrelerin tekrarında kısım, anti-CD3-FITC, anti-CD4-PerCP ve Topro-3 kullanılarak zıt edildi. Canlı (Topro-3 neg) CD3 pos lenfositler (Sütun 1) ve enkaz ve FSC ve SSC (Şekil 3A) temel alınarak agrega dışlama yolluk sonra PKH26 yoğunluğu anti-CD4-PerCP (Sütun 2 ve birlikte değerlendirildi 3). PerCP kanal içine PKH26 önemli spektral örtüşme kompanse verileri (sütun 2) belirgin ve PKH26 pos CD4 arasındaki çözünürlük pos ve CD4-negatif PKH26 pos etkinlik sınırda. Panel D. PKH26 konsantrasyonu 4 uM arttırılır, bu artık mümkün değildir PerCP kanal içine PKH26 Panel C. spektral örtüşme florokrom arada kullanmak için CD4 (Sütun 2) CD4 ve gelen sinyalin yoğunluğu aşar pos PKH26 kutuplu olaylar artık CD4-negatif PKH26 ikinci konum T-hücrelerinde (sütun 3 çözülebilir vs. Sütun 4). büyük bir rakam görmek için buraya tıklayın .
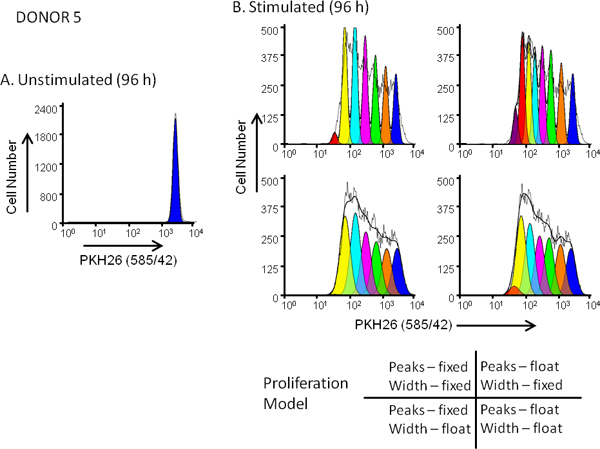
Şekil 5,. Üzerine proliferasyonu model seçimi Etkisi. boya dilüsyon profilleri için uyum iyiliği hPBMC PKH26 (:; nihai boya konsantrasyonu 3x10 7 / ml: 10 uM son hücre konsantrasyonu) ile işaretlendi. 96. varlığında saat (uyarılan) veya anti-CD3 ve IL-2 yokluğu (uyarılmamış) için kültür sonra, hücreler, anti-CD3-FITC, anti-CD19-APC ve bir FACSCalibur 7-AAD ve analiz ile zıt hasat edilmiştir flowsitometri (ayrıntılı yöntemler için Başvuru 13). Renk telafi kablolu telafi devresi kullanarak veri toplama zamanında gerçekleştirildi. Panel A, Şekil 3A'da gösterilen ve ModFit Proliferation sağlamak için kullanılan gibi. Donor 5, bir orta yanıtlayıcı, bir uyarılmamış 96 saat kültüre PKH26 yoğunluk profili geçişli . Panel B bölünmemiş ebeveyn hücreleri temsil eden zirve için konumu ve genişliği bir ilk tahmin olan Sihirbazı. paralel gelen PKH26 yoğunluk profili 96 saat kültürü teşvik den başlayan tahminleri kullanılarak analiz edildiGösterildiği gibi izleyen kızı nesiller için Panel A ve 4 sabit veya yüzer pik şiddetleri karşılık 'Silahların Sihirbazı' ayarlarını farklı birleşimlerini, ve sabit veya yüzer tepe genişlikleri. Tablo 3, gözlemlenen veri için en uygun verdi modeli özetlenmiştir (düşük indirgenmiş chi-square; RCS) pik pozisyonları aynı zamanda kızı nesil doruklarına standart sapmaları değil sadece izin edildiği "yüzen / yüzen" kombinasyon oldu değişir (RCS = 1.5). Aynı model Donor 6, bir yanıt veren (Şekil 3B ve Tablo 3) için en uygun verdi.
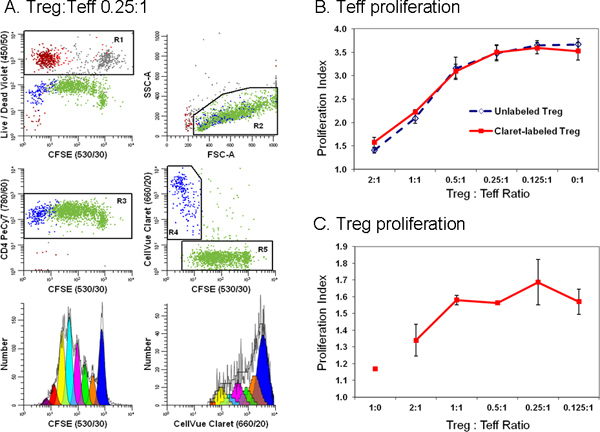
Şekil 6. İkinci bir cep izleme boya ilavesi akım sitometri baskılama testinde efektör ve düzenleyici T hücreleri arasındaki ayrım kolaylaştırır. TRIMA lökaferezis filtreleri hazırlanan Monosit-tüketilmiş lenfositlerin anti-CD127-PE, anti-CD4-PE-Cy7 ile boyandı (. 18 Ref uyarlanmış), ve anti-CD25-APC ve akış efektör (Teff popülasyonları içine sıralanır; CD4 pos CD127 parlak CD25 dim), düzenleyici (Treg; CD4 pos CD127 loş CD25 pos), ve aksesuar (CD4 neg) hücreleri. KAKE (son hücre konsantrasyonu: 5 × 10 7 / ml; nihai boya konsantrasyonu, 5 mcM) ile etiketlenmiş ve kriteri Teff:;: CellVue Claret (1 uM son boya konsantrasyonu 1x10 6 / ml son hücre konsantrasyonu) ile etiketlenmiş kriteri Treg hücreler oldukları , anti-CD3, anti-CD28 ve ışınlanmış aksesuar hücrelerin varlığında, değişen oranlarda da ko-kültive. 96 saat sonra, kültürler hasat edildi, anti-CD4-PE-Cy7 ve ölü / canlı tamir edilebilir Violet ile zıt ve bir LSRII akış sitometresi ve renk dengeleyici üzerinde analiz verileri acquisitio sırasında gerçekleştirildin BD DiVa yazılımı (tazminat kontrolleri dahil olmak üzere ayrıntılı bilgi için Başvuru 18 bakınız). Aşama 4'te tarif edildiği gibi Teff ve Treg için proliferasyon indeksi ModFit LT3.3 içinde çoğalması Sihirbazı kullanılarak, örnek alınmıştır. Paneller B ve C Veri noktaları nüsha örneklerinin ortalama ± 1 standart sapma temsil Panel A. Örnek veriler Treg az üç nüsha örnekleri biri için gösterilir:. 0.25:1 arasında Teff oranı. Tüm diğer veri parsellerden; LIVE / DEAD tamir edilebilir Menekşe reaktifi ölü hücreleri (= kırmızı-kahverengi, cansız Teff = gri ve cansız Treg = kırmızı aksesuar hücreleri R1, sol üst arsa) dışlamak için kullanıldı. CellVue Claret boyama canlı Treg (R4, merkez sağ arsa; mavi) ayırt etmek için kullanılan geçerli değil ama oldukça Teff (R5, merkez sağ arsa; yeşil) çoğaldı. Teff (sol alt arsa) için tek bir parametre KAKE çoğalması profili KAKE pos (R5), canlı CD4 pos (R3), (değil R1) idi hücreleri üzerinde yolluk tarafından oluşturulan ve lenfosit sc vardıardıl özellikleri (R2). Treg için tek bir parametre CellVue Claret çoğalması profili CellVue Claret pos (R4), canlı CD4 pos (R3), (değil R1) idi hücreleri üzerinde yolluk tarafından oluşturulan ve lenfosit dağılım özellikleri (R2) vardı. Lenfosit patlamaların içerecek şekilde tanımlanmış cömert lenfosit bölgesi (R2) unutmayın. Toplanan hücrelerin toplam sayısını ilgi, en düşük frekans nüfus bağlı olduğu da not edin. İlgilenilen popülasyonun yedi ya da sekiz hücre nesilleri arasında, bir çok sayıya kadar temsil yoğunluğu geniş bir yelpazesi üzerinde dağıtılabilir bir hücre proliferasyon deneyde doğru modeli ve her kuşakta hücre sayısını hesaplamak için toplanmalıdır. Nadir hücrelerinin öğrenim görürken, sadece olayların mümkün olan maksimum sayıda toplamak için neredeyse kuru numune tüpü çalıştırmak için gerekli olabilir. Burada gösterilen örnek için, bu iş 11,923 Teff tane olmak üzere toplam ~ 25,000 olayları, (Proliferation bir toplam sonuçlanmıştırndex 3.85) ve 1.380 Treg (proliferasyon indeksi 1.83) olarak bulundu. Panel B., beklendiği gibi, Teff hücre proliferasyonunu büyük bir bastırma yol açmıştır eş-kültür içinde Tregs mevcut oranını artırmaktadır. Benzer sonuçlar potens Treg etkilemedi CellVue Claret izleme boya ile bu boyanma gösteren CellVue Bordo-lekeli (düz çizgi) veya boyanmamış (kesikli çizgi) Treg iki ile elde edilmiştir. Panel C Treg beklendiği gibi, nispeten anerjik ve yaptım, Teff hücrelerin yokluğunda (1:0 arasında Teff oran Treg) anti-CD3, anti-CD28, ve yardımcı hücreleri ile inkübe zaman çoğalırlar değildir. Ancak, ko-kültürler içinde Teff mevcut olan oran (yani, Treg olarak: Teff oranı düşürülebilir) artış, Treg çoğalma ölçüde artmıştır. En azından kısmen, bu veriler için genel olarak daha büyük bir hata çubukları, belirsiz Teff göre toplanmış ve daha fazla olay daha az sayıda yol açan, çoğalma sınırlı ölçüde yansıtmakHer nesil hücrelerinin sayısında modellenmesinde ty. büyük bir rakam görmek için buraya tıklayın .
| Tüp No (Amaç) | PKH26 | Antikor (ler) | 7-AAD |
| 1 (Kur, tazminat) | - | - | - |
| 2 (Kurulum, tazminat) | + | - | - |
| 3 (Kurulum, tazminat) | - | - | + |
| 4 (tazminat) | - | CD8-FITC b | - |
| 5 (tazminat) | - | CD8-APC b | - |
| 6 (hayır Ab kontrolü) | + | - | + |
| 7 (hayır izleme boya control) | - | CD3-FITC CD4-APC veya CD19-APC c | + |
| 8 (T0 kontrolü) | + | CD3-FITC CD4-APC veya CD19-APC c | + |
. Tablo 1 Enstrüman Ayar Kontrolleri a kullanarak 4-renk CD4 T hücre proliferasyonunu izleme denemesi için uygun listelenen Denetimleri:. PKH26 (proliferasyon boya), CD3-FITC (pan-T hücre belirteci), CD4-APC (T-helper hücre belirteci), 7-aminoactinomycin D (7-AAD; ölü hücre dışlama) b CD3-FITC ve CD4-APC Parlak suretler (tazminat hataları tespit etmek için daha iyi bir yetenek c) Şekil 3:.. CD3-FITC ve CD19-APC. d Şekil 4: CD3-FITC ve CD4-APC.
| Hücre tipi | Nihai Hücre Konsantrasyon | Nihai Boya Konsantrasyonu </ Strong> | Referans |
| hPBMC b | 1 x 10 7 / ml | 2 mcM PKH67 | 10,17 |
| 5 x 10 6 / ml | 2 mcM PKH26 | 12 | |
| 3 x 10 7 / ml | 10 uM PKH26 | 13 | |
| 5 x 10 7 / ml ' | 30 uM PKH26 | 18 | |
| 1 x 10 6 / ml | 1 uM CellVue Claret c | 18 | |
| 3 x 10 7 / ml | 4 mcM CellVue Claret | 13 | |
| 5 x 10 7 / ml ' | 5 uM CellVue Claret | 18 | |
| Hücreler kültür içinde | 5 x 10 5 / ml | 0.1 uM PKH26 (1 ° meme hücreleri) | 8 |
| 1 x 10 7 / ml | 15 uM PKH26 (U937) | 18 | |
| 1 x 10 7 / ml | 12.5 -15 uM PKH26 (U937) | 15 | |
| 1 x 10 7 / ml | 1 uM PKH67 (K562) | 18 | |
| 1 x 10 7 / ml | 1 uM PKH67 (T hücre soyu) | 9 | |
| 1 x 10 7 / ml | 10 uM CellVue Bordo (YAC-1) | 23 |
Tablo 2. Olmayan dalgalanmayla Membran-Boya Boyama Koşullar a. Bir Uyarlanmış ve Ref güncellendi. 18 b. Karışım düşük devirli yıkama (300 xg) trombosit kontaminasyonu en aza indirmek için kullanılmıştır. C Treg hücreleri (akış kriteri CD4 pos CD25 pos CD127 neg lenfositler).
| Model Ayarları | Model Sonuçları | ||||||||
| Verici | Tedavi | Tepe Noktası | SD | Ebeveyn Pozisyon | Ebeveyn SD | # Peaks Fitted | RCS | PI | PF |
| 5 | Uyarılmamış | Şamandıra | Şamandıra | 209 | 4.5 | 1 | 5.1 | 1.0 | 0 |
| 5 | Uyarılmış | Sabit | Sabit | 209 | 4,5 | 7 | 35 | 3.9 | 31 |
| 5 | Uyarılmış | Şamandıra | Sabit | 209 | 4.5 | 8 | 19 | 4.3 | 30 |
| 5 | Uyarılmış | Sabit | Şamandıra | 209 | 9.2 | 6 | 1.9 | 3.8 | 30 |
| 5 | Uyarılmış | Şamandıra | Şamandıra | 209 | 9.0 | 7 | 1.5 | 3.7 | 29 |
| 6 | Uyarılmamış | Şamandıra | Şamandıra | 205 | 4.0 | 1 | 2.1 | 1.0 | 0 |
| 6 | Uyarılmış | Sabit | Sabit | 205 | 4.0 | 6 | 42 | 6.6 | 60 |
| 6 | Uyarılmış | Şamandıra | Sabit | 205 | 4.0 | 7 | 12 | 7.4 | 60 |
| 6 | Uyarılmış | Sabit | Şamandıra | 205 | 8.6 | 6 | 6.9 | 6.8 | 62 |
| 6 | Uyarılmış | Şamandıra | Şamandıra | 205 | 6.5 | 6 | 1.3 | 6.5 | 59 |
Tablo 3. Yiligi (RCS) ve Çoğalma Ölçümleri Şekil 3A ve B açıklandığı gibi. Örnek boyama, veri toplama ve yolluk üzerine Proliferation Modelinin Etkisi.
Tartışmalar
Burada açıklanan yöntemler, en güvenilir membran boyalar 13,16,18 kullanarak hPBMC etiketleme ve membran veya protein boyalar 2,11,13,16 kullanarak lenfosit fenotiplen yayılması izleme için optimum sonuçlar vermek bizim kombine laboratuvarlarda bulunan olanlardır 18. Şekiller 1 ve 2 'de gösterildiği gibi, parlak tekdüze etiketleme en kolay fizyolojik tuzları varlığında sınırlayan ve bir karıştırma tekniği kullanılarak elde edilir boya ile aynı konsantrasyon tüm hücrelerin hızlı ve homojen bir poz sonuçları. Membran boyalarla boyanması iki tabakalı lipid bölünme ile oluşur çünkü, ücretsiz boya konsantrasyonu değiştirebilecek diğer değişkenleri de etiketleme verimliliğini etkileyebilir. Örneğin, önceki Dilüent C resüspansiyon için tuz az verimli yıkama yuvarlak alt polistiren tüplerin sonuçlarında etiketlenmesi ve de özellikle, tüp duvarları üzerine adsorpsiyon boya nedeniyle azalan ücretsiz boya konsantrasyonudüşük boya konsantrasyonlarda. Her iki faktör konik alt polipropilen tüplere (Şekiller 3, 4 ve etiketleme kullanılarak yapıldığı zaman daha geniş kapsamlı leke dağılımları vermek eğilimindedir yayınlanmamış sonuçlar). Optimize boyama işlemleri kullanıldığında bile örnek yaşını ve türünü de pik genişliği etkileyebilir. Örneğin, 24 saat eski kan örnekleri veya TRIMA pheresis filtreleri aralığı izole lenfositler için CV ise% 14-20 den taze alınmış bir kan aralığı (Şekil 3, No. 13 ve yayınlanmamış sonuçlar) izole PKH26 Poz lenfositler için CV 25-30 % (Şekil 4 ve Ref. 18).
Homojenlik ve cansız hücreler analiz dışında her ikisi de ayırt edilebilir kız zirveleri sırayla gözlenen verilerin (Şekil 5 ve 6 için uygun bir model çoğalma tercih etkiler boya seyreltme profil, belirgin ölçüde etkilememektedir edilebilir ölçüde Boyama ). ModFit (Verity Software House, Topsham, ME) gibi çoğalması Endeksi ve Öncü Frekans (Şekil 3, 5 ve 6; Çizelge 3) gibi metrikler oluşturmak için kullanılan yazılım burada örnek olarak kullanılmasına rağmen, diğer yazılım paketleri de modül analiz içerir proliferasyon veri. Bunlar FCSExpress (De Novo Yazılım, Los Angeles, CA) ve FlowJo (Ağaç Yıldız, Inc, Ashland, OR). Tüm bu programlar iteratif konumu, yükseklik ve sıralı kızı nesiller temsil Gauss doruklarına SD (veya genişlik) değiştirerek ham veri için en uygun bulmak için bir non-lineer en küçük kareler analizi kullanın. Proliferatif İndeksi (PI) ve Prekürsör Frekans (PF) çoğalması ölçüde en sık kullanılan önlemlerdir. Tarafından tanımlandığı gibi ModFit PI, bir timidin alımının testinin 'uyarım endeksi "benzer tahlil boyunca hücre sayısındaki artış, bir ölçüsüdür. PF ilk populat hücre fraksiyonu döndürürçoğalan uyarana cevap iyon. Terminoloji yazılım paketleri (örn., FlowJo ve ModFit "Silahların Endeksi" ne kastedildiği için farklı tanımları ve hesaplamaları kullanabilirsiniz) 22 arasında biraz değişir yana edebiyat okurken Dikkat, ancak tavsiye edilir.
Protein boya kullanırken membran boyalarla etiketleme ve proliferasyon analizi için burada tartışılan önemli konular da rastlanmaktadır. Örneğin, karıştırma tekniği dikkat da CFSE (Şekil 6) 2-4,13,18,24 kullanıldığında düzgün dağılımlar ve ayırt edilebilir kız zirveleri elde etmek üzere, ölü / ölen hücrelerin dışlanması ile birlikte, dikkat edilmelidir. Fenotiplen canlılığı değerlendirmesi için florokromlar uygun seçimi özellikle KAKE 2-4,11,13,16,18 gibi görünür yayan protein boyalarla, aşırı spektral örtüşme ve antikor pozitif hücrelerin fark edememe önlemek için de önemlidir . Izleme boya konsantrasyonu azaltılması bitişik spektral kanal tazminat sorunlar azalır ama yavru hücre yoğunlukları otofloresans örtüşmek başlamadan önce de izlenebilir hücre bölünmeleri sayısını sınırlar. Alternatif olarak, uzak kızıl yayan CellVue Bordo (Sigma-Aldrich, St Louis, MO) veya menekşe yayan CellTrace Violet (Life Technologies, Grand Island, NY) gibi yeni hücre izleme boyaların dengeleme sorun (Şekil 6) azaltabilir kullanır. Membran boyalar genel olarak daha az toksisite 11,26 distorsiyonu üretmeğe temayül gösterir, ancak sonunda, bu boya ya da sınıf ile aşırı-etiketli hücre mümkündür. Bu, kullanılan izleme boya konsantrasyonu izlenir için hücrelerin işlevlerini (Şekil 6) 3,13,16,18 değiştirilmiş olmadığını doğrulamak için her zaman bu nedenle gereklidir.
Açıklamalar
K. Humphrey, JD Tario, Jr ve PK Wallace Life Technologies, Inc ve BD Biosciences değerlendirmeye için ticaret öncesi hücre izleme reaktifleri aldık. AD Bantly ve JS Moore değerlendirilmesi için reaktifler izleme ticaret öncesi hücre almış boyalar izleme çeşitli CellVue hücre ticaret öncesi karakterizasyonu için PTI Research, Inc Life Technologies, Inc ve finansman. K. Muirhead (Phanos Technologies, Inc danışmanlık hizmetleri sağlar (PKH ve CellVue boyalarının sahibi) ve Sigma-Aldrich ve Moleküler Hedefleme Technologies, Inc için yedekleme teknik destek sağlar SciGro, Inc tarafından istihdam ediliyor bu distribütörleri boyalar).
Bu makalenin Üretim ve Serbest Giriş Sigma-Aldrich tarafından desteklenmektedir.
Teşekkürler
Bruce Bagwell (Verity Software House), Nadège Bercovici (IDM), Lizanne Breslin (Zynaxis Hücre Bilimi ve PTI Araştırma): Yazarlar, özellikle yıllar boyunca bu yöntemlerin geliştirilmesi için teknik ve entelektüel katkıları için aşağıdaki kişilere teşekkür etmek istiyorum Brian Gray (PTI Araştırma), Jan Fisher (Dartmouth Tıp Okulu), Alice Givan (Dartmouth Tıp Okulu), Betsy Ohlsson-Wilhelm (SciGro, Inc) ve Mary Waugh (Dartmouth Tıp Okulu). Onlar da Şekil 2'de gösterildiği verileri oluşturulan Yıllık Araştırma Yöntemleri Dersler ve Flow Sitometri Uygulamaları, 2006 yılının Bowdoin sınıf teşekkür etmek istiyorum.
Flow sitometri NIH Paylaşılan Enstrüman Programı ekipman hibe kısmen kurulmuş Roswell Park Kanser Enstitüsü Akım Sitometri Laboratuvarı, gerçekleştirilen ve Milli gelen Çekirdek Grant (5 P30 CA016056-29) destek alır edildiKanser Roswell Park Kanser Enstitüsü ve Abramson Kanser Merkezi Akış Sitometri ve NIH Paylaşılan Enstrüman Programı ekipman hibe kısmen kuruldu Pennsylvania Üniversitesi, Hücre Ayırma Kaynak Laboratuvarı Enstitüsü ve NIH # 2P30 destek alır Ulusal Kanser Enstitüsü'nden CA016520. Şekil 3 ve 5'te gösterilmiştir çalışmaları da PTI Research, Inc verilir Biyomedikal Görüntüleme ve Biyomühendislik Ulusal Enstitüsü (NIBIB) den SBIR hibe EB00228 tarafından kısmen desteklenmiştir
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif veya ekipman | Şirket | Katalog numarası | Yorumlar |
| Ticari olarak satın | |||
| 7-Aminoactinomycin D | Sigma-Aldrich | A9400 | |
| Sığır serum albümini (BSA) | Sigma-Aldrich | A4503 | |
| Fetal bovin serumu (FBS) | Atlanta Biyolojik | S11150 | |
| Hanks dengeli tuz çözeltisi (HBSS) | Yaşam Teknolojileri | 14175-079 | Fenol kırmızısı olmadan Kalsiyum ve magnezyum serbest, |
| İnsan IgG Cohn fraksiyon II ve III globulinler | Sigma-Aldrich | G-4386 | |
| Fare anti-insan CD3-FITC | BD Biosciences | 349201 | Laboratuvar titrasyon tarafından belirlenen doyurarak konsantrasyonu |
| Fare anti-insan CD4-APC | BD Biosciences | 340672 | Laboratuvar titrasyon tarafından belirlenen doyurarak konsantrasyonu |
| Fare anti-insan CD4-PECy7 | BD Biosciences | 348799 | Laboratuvar titrasyon tarafından belirlenen doyurarak konsantrasyonu |
| Fare anti-insan CD8-FITC | BD Biosciences | 347313 | Laboratuvar titrasyon tarafından belirlenen doyurarak konsantrasyonu |
| Fare anti-insan CD8-APC | Caltag (Life Technologies) | MHCD0805 | Laboratuvar titrasyon tarafından belirlenen doyurarak konsantrasyonu |
| Fare anti-insan CD19-APC | Caltag (Life Technologies) | MHCD1905 | doyurarak konsantrasyonu |
| Fare anti-insan CD25-APC | BD Biosciences | 340938 | Laboratuvar titrasyon tarafından belirlenen doyurarak konsantrasyonu |
| Fare anti-insan CD127-PE | BD Biosciences | 557938 | Laboratuvar titrasyon tarafından belirlenen doyurarak konsantrasyonu |
| Fare anti-insan CD3 | eBiosciences | 16-0037-85 | 1.0 mg / ml; azid ücretsiz |
| Fare anti-insan CD28 | eBiosciences | 16-0289-85 | 1.0 mg / ml; azid ücretsiz |
| PBS | Gibco | 21300-058 | |
| EtOH 10-3M PKH26 ve Dilüent C içeren PKH26 kırmızı floresan hücre bağlayıcı kiti | Sigma-Aldrich | PKH26GL-1KT veya MINI26-1KT | Adım 1 usuller de geçerlidirPKH67 içeren kitleri veya diğer CellVue boyalar |
| EtOH ve Dilüent C 10-3M CellVue Claret içeren CellVue Claret kadar kırmızı floresan hücre bağlayıcı kiti | Sigma-Aldrich | MINCLARET-1KT veya MIDCLARET-1KT | |
| 5 - (and-6)-carboxyfluorescein diasetat, süksinimidil ester (CFDA-SE) | Invitrogen (Life Technologies) | C34554 | Sigara floresan; oluşturmak için membran esterazlarla yarılan floresan amino-reaktif carboxyfluorescein sukkinimidil ester (KAKE) |
| DEAD / CANLI tamir edilebilir Violet | Invitrogen (Life Technologies) | L34955 | |
| Steril 12 konik x 75 mm polipropilen tüpler ve kapakları | VWR | 60818-102 | Iyi membran boya boyama etkinliği (; süpernatant aspirasyon sırasında daha az hücre kaybı azalır boya adsorpsiyon) verir |
| 12 x 75 mm round alt Polistiren tüpler | Becton Dickinson | 21008-936 | |
| Akış sitometresi | Bioscience BD | FACSCalibur LSRFortessa | Ve APC ex; FITC, PKH26, ve 7-AAD (. Em sırasıyla 520 nm, 567 nm ve 655 nm, örneğin 488 nm) tespit edebiliyoruz herhangi sitometresinin. 633-640 nm; em. 660 nm) |
| Akış sitometresi | Beckman Coulter | LSRII Cyan | Ve APC ex; FITC, PKH26, ve 7-AAD (. Em sırasıyla 520 nm, 567 nm ve 655 nm, örneğin 488 nm) tespit edebiliyoruz herhangi sitometresinin. 633-640 nm; em. 660 nm) |
| Laboratuvar Hazırlayan | |||
| 7-Aminoactinomycin D, konsantre stok | NA | NA | PBS içinde 1 mg / ml idi. -20 ° C'de alikotları ve mağaza içinde dondurun |
| 7-Aminoactinomycin D, kelkral stok | NA | NA | 100 mikrogram / PBS ml 1 mg / ml dondurulmuş stok günlük hazırlamak. |
| IgG bloğu | NA | NA | HBSS + 10 mg / ml insan IgG Cohn fraksiyonu II ve III globülinler + 10 mg / ml BSA. |
Referanslar
- Poon, R. Y., Ohlsson-Wilhelm, B. M., Bagwell, C. B., Muirhead, K. A., Diamond, R. A., DeMaggio, S. Use of PKH Membrane Intercalating Dyes to Monitor Cell Trafficking and Function. Living Color: Flow Cytometry and Cell Sorting Protocols. , 302-352 (2000).
- Wallace, P. K., Muirhead, K. A. Cell Tracking 2007: A Proliferation of Probes and Applications. Immunol. Invest. 36, 527-562 (2007).
- Hawkins, E. D., Hommel, M., Turner, M. L., Battye, F. L., Markham, J. F., Hodgkin, P. D. Measuring lymphocyte proliferation, survival and differentiation using CFSE time-series data. Nat. Protoc. 2, 2057-2067 (2007).
- Quah, B. J., Warren, H. S., Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nat. Protoc. 2, 2049-2056 (2007).
- Bolton, D. L., Minang, J. T., Trivett, M. T., Song, K., Tuscher, J. J., Li, Y., Piatak, M., O'Connor, D., Lifson, J. D., Roederer, M., Ohlen, C. Trafficking, Persistence, and Activation State of Adoptively Transferred Allogeneic and Autologous Simian Immunodeficiency Virus-Specific CD8+ T Cell Clones during Acute and Chronic Infection of Rhesus Macaques. J. Immunol. 184, 303-314 (2010).
- Juopperi, T. A., Sharkis, S. J. Isolation of Quiescent Murine Hematopoietic Stem Cells by Homing Properties. Meth. Mol. Biol. 430, 21-30 (2008).
- Kusumbe, A. P., Bapat, S. A. Cancer stem cells and aneuploid populations within developing tumors are the major determinants of tumor dormancy. Cancer Res. 69, 9245-9253 (2009).
- Pece, S., Tosonim, D., Confalonieri, S., Mazzarol, G., Vecchi, M., Ronzoni, S., Bernard, L., Viale, G., Pelicci, P. G., Fiore, P. P. D. i. Biological and Molecular Heterogeneity of Breast Cancers Correlates with Their Cancer Stem Cell Content. Cell. 140, 62-73 (2010).
- Gertner-Dardenne, J., Poupot, M., Gray, B. D., Fournié, J. -. J. Lipophilic fluorochrome trackers of membrane transfers between immune cells. Immunol. Invest. 36, 665-685 (2007).
- Bercovici, N., Givan, A. L., Waugh, M. G., Fisher, J. L., Vernel-Pauillac, F., Ernstoff, M. S., Abastado, J. P., Wallace, P. K. Multiparameter precursor analysis of T-cell responses to antigen. J. Immunol. Methods. 276, 5-17 (2003).
- Givan, A. L., Fisher, J. L., Waugh, M. G., Bercovici, N., Wallace, P. K. Use of cell-tracking dyes to determine proliferation precursor frequencies of antigen-specific T cells. Methods Mol. Biol. 263, 109-124 (2004).
- Schwaab, T., Tretter, C. P., Gibson, J. J., Cole, B. F., Schned, A. R., Harris, R., Fisher, J. L., Crosby, N., Stempkowski, L. M., Heaney, J. A., Ernstoff, M. S. Tumor-related immunity in prostate cancer patients treated with human recombinant granulocyte monocyte-colony stimulating factor (GM-CSF). Prostate. 66 (6), 667-674 (2006).
- Bantly, A. D., Gray, B. D., Breslin, E., Weinstein, E. G., Muirhead, K. A., Ohlsson-Wilhelm, B. M., Moore, J. S. CellVue Claret, a New Far-Red Dye, Facilitates Polychromatic Assessment of Immune Cell Proliferation. Immunol. Invest. 36, 581-605 (2007).
- Givan, A. L. A flow cytometric assay for quantitation of rare antigen-specific T-cells: using cell-tracking dyes to calculate precursor frequencies for proliferation. Immunol. Invest. 36, 563-580 (2007).
- Tario, J. D., Gray, B. D., Wallace, S. S., Muirhead, K. A., Ohlsson-Wilhelm, B. M., Wallace, P. K. Novel lipophilic tracking dyes for monitoring cell proliferation. Immunol Invest. 36, 861-885 (2007).
- Wallace, P. K., Tario, J. D., Fisher, J. L., Wallace, S. S., Ernstoff, M. S., , ., Muirhead, K. A. Tracking Antigen-Driven Responses by Flow Cytometry: Monitoring Proliferation by Dye Dilution. Cytometry. 73, 1019-1034 (2008).
- Barth, R. J., Fisher, D. A., Wallace, P. K., Channon, J. Y., Noelle, R. L., Gui, J., Ernstoff, M. S. A Randomized Trial of Ex vivo CD40L Activation of a Dendritic Cell Vaccine in Colorectal Cancer Patients: Tumor-Specific Immune Responses Are Associated with Improved Survival. Clin. Cancer Res. 16, 5548-5556 (2010).
- Tario, J. D., Muirhead, K. A., Pan, D., Munson, M., Wallace, P. K. Tracking Immune Cell Proliferation and Cytotoxic Potential Using Flow Cytometry. Meth. Mol. Biol. 699, 119-164 (2011).
- Fuse, S., Underwood, E. Simultaneous Analysis of In Vivo CD8+ T Cell Cytotoxicity Against Multiple Epitopes using Multicolor Flow Cytometry. Immunol. Invest. 36, 829-845 (2007).
- Schütz, C., Fleck, M., Mackensen, A., Zoso, A., Halbritter, D., Schneck, J. P., Oelke, M. Killer artificial antigen-presenting cells: a novel strategy to delete specific T cells. Blood. 111, 3546-3552 (2008).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Rev. Vaccines. 9, 601-616 (2010).
- Roederer, M. Interpretation of cellular proliferation data: Avoid the panglossian. Cytometry. 79A, 95-101 (2011).
- Quah, B. J. C., Parish, C. R. The Use of Carboxyfluorescein Diacetate Succinimidyl Ester (CFSE) to Monitor Lymphocyte Proliferation. J. Vis. Exp. (44), e2259 (2010).
- Houlihan, D. D., Newsome, P. N. Critical Review of Clinical Trials of Bone Marrow Stem Cells in Liver Disease. Gastroenterology. 135, 438-450 (2008).
- Brusko, T. M., Hulme, M. A., Myhr, C. B., Haller, M. J., Atkinson, M. A. Assessing the In Vitro Suppressive Capacity of Regulatory. T Cells. Immunol. Invest. 36, 607-628 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır