Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bir Tam Kan fenotipleme Testi Kullanarak Çok Merkezli Klinik Araştırmalar için Binbaşı Periferik Kan Lökosit Populasyonlarının Numaralama
Bu Makalede
Özet
Bu raporda, biz büyük doğal ve adaptif lökosit popülasyonlarının numaralandırmak için taze tam kan üzerinde gerçekleştirilen bir feno testinin boyama ve analiz adımları göstermektedir. Biz çok merkezli klinik çalışma kapsamında bu işlemler gerçekleştirmek için konuları vurgulamaktadır.
Özet
Periferik kan lökositleri Kriyoprezervasyon yaygın klinik çalışmalarda bağışıklık yanıtı değerlendirme için hücreleri korumak için kullanılan ve immünolojik değerlendirme kolaylığı ve standardizasyon için birçok avantaj sunmaktadır, ancak bu sürecin olumsuz etkileri, granülosit gibi bazı hücre alt, B hücreleri üzerinde gözlenmiştir edilir , 1-3 ve dendritik hücreler. Taze lökositleri assaying hücrelerinin in vivo durumda daha doğru bir görüntü verir, ancak sık sık büyük klinik çalışmalarda bağlamında gerçekleştirmek zordur. Taze hücresi tayinlerinde zaman alıcı varsa, bunların uygulama nedeniyle laboratuvar personelinin gerekli çalışma saatleri için pratik olabilir, gönüllü taahhütler ve zamanlamalar bağlıdır ve. Buna ek olarak, çalışmalar birden fazla merkezde yürütülen zaman, testleri gerçekleştirmek için gerekli kaynakları ve eğitim laboratuvarları klinik siteleri için yeterli yakınında yer olmayabilir. Bu sorunları çözmek için, var develBöyle bir gibi testlere göre daha güçlü bir hücre tipinde belirli bir bilgi elde edilmesinde, fenotip için ve periferik kan içinde büyük lökosit popülasyonları numaralandırmasına; Trucount tüpler (San Jose, CA Becton Dickinson) ile birlikte kullanılabilecek bir 11 renkli antikor boyama paneli intravazasyonunda tam kan sayımı (CBC) veya sadece birkaç hücre tipleri için leke Trucount tüpler için tasarlanmış piyasada bulunan paneller ile ölçülür. Boyama işlemi basittir, taze tam kan sadece 100 ul gerektirir ve uygulanabilir standart kan işleme laboratuarları gerçekleştirmek için yapım, yaklaşık 45 dakika sürer. Bu BD Trucount tüp teknik föy (uyarlanmıştır sürüm 8/2010 ). Boyama antikor kokteyli merkezi bir tahlil laboratuvarından toplu olarak önceden hazırlanan ve site işleme laboratuarları sevk edilebilir. Vitray tüpler sabit olabilirve renkli akım sitometri analizi için merkezi tahlil laboratuvarından gönderilmek için dondurulmuş. Bu boyama panelinden üretilen veri müdahale ile ilgili olarak zaman içinde lökosit konsantrasyonlarda değişiklikleri izlemek için ve kolay bir şekilde daha fazla ilgi belirli hücre tipleri aktivasyonu durumları değerlendirmek için geliştirilmiş olabilir kullanılabilir. Bu yazıda, taze tam kan ve çok merkezli klinik araştırma merkezi bir destek tahlil laboratuvarında bu lekeli numunelerin analiz adımları boyama gerçekleştirmek için kan işleme laboratuvar teknisyenleri tarafından kullanılan yordam göstermek. Video ayrıntılar bu HIV aşısı Denemeler Ağı (HVTN) içinde bir klinik deneme kan alımından bağlamında yapılır gibi işlem.
Protokol
Not: ışıktan fluorofor konjuge antikorlar korumak için, ışığı bir biyo-güvenlik kabini tüm adımları gerçekleştirin.
1. Antikor Boyama Paneli Hazırlama
- Antikor boyama pano Tablo 1 'de bulunabilir. Antikor konsantrasyonu bütün kan ile titrasyon ile belirlenen ve aynı akış sitometrisi ekipman ve lekeli fenotipleme numuneleri elde etmek için kullanılacak olan prosedürler kullanılarak verilmelidir.
- Uygun boyama titreleri belirlendikten sonra, bir kilit kapaklı tüp içinde tek bir karışımın içine tüm antikorlar birleştirir. 100 ul toplam hacim getirmek için akış yıkama tamponu (% 2 ısı inaktive edilmiş fetal bovin serumu ile Dulbecco PBS) ekleyin. Lekeli olan numune sayısı için karışım Scale. Bu karışım, sekiz hafta boyunca 4 ° C'de muhafaza edilebilir.
2. Lekelenme
- Toplanan kan reklam da başka amaçlar için kullanılması isteniyorsadaha fazla zaman duyarlı prosedürleri kalan kan gerçekleştirilirken bu testte hiç Buna ilave, kenara bir kısım ayarlayın. Alikot önemli hücre kaybı olmadan Damara sonra 4 saat için oda sıcaklığında kadar saklanabilir.
- Sağlam bir boncuk topak Trucount tüp ve etiket örnek boyanmış olan belirlemek için tüpün alt tabaka olduğundan emin olun. HVTN klinik çalışmalarda, Laboratuvar Bilgi Yönetim Sistemi (Sınır Bilim ve Teknoloji Araştırma Vakfı; Amherst, NY) lekeli örnekleri etiketlemek ve izlemek için kullanılır.
- Lot numaraları ve tüm reaktiflerin son kullanma tarihlerini kaydedin. Tüplerin çanta üreticisi tarafından sağlanan Trucount tüp boncuk saymak numarasını kaydedin; çanta üzerinde çok sayıda tüp üzerinde parti numarası aynı olduğundan emin olun.
- Doğru sadece metal tespit yukarıda Trucount tüpe kan 100 ul Pipeti için pipetleme tersine kullanın. Tüp tarafı aşağı bulaşması kan kaçının.
- Trucount tüpüne düzenli (ileri) pipetleme tekniği, karışık antikor boyama paneli pipet 100 ul (Bakınız Tablo 1) kullanarak. Yaklaşık 15 sn karıştırmak için düşük hızda tüp ve vorteks kapak takın. Görsel olarak boncuk topak tamamen eriyene sağlamak için boru kontrol edin.
- Karanlıkta oda sıcaklığında (15-30 ° C) 15 dakika boyunca Trucount tüp inkübe edin.
- Gerekirse, dih 2 O. kullanarak 1X 10 bir kısım × FACS Lysing çözeltinin 900 ul 1 × tüp FACS Lysing çözüm ekleyin.
- Karıştırmak için yaklaşık 15 saniye düşük hızda iyice tüp ve vorteks kapak takın. Laboratuar film ile boru ve conta konumunu kilitleme sıkıca kapağını aşağı doğru itin.
- -65 De tüp Mağaza ° C -95 ° C Numunenin merkez analiz laboratuvarına sevk veya evde analiz için hazır olana kadar. Numuneler en az dört hafta için bu aşamada stabildir. Derhal nakliye veya assaying varsagörmesini sağlayın, bu adım atlanabilir.
3. Nakliye
Not: Aşağıdaki talimatlar özellikle Uluslararası Hava ve Taşımacılığı Birliği (IATA) yönetmeliklerine göre nakliye kategori B muaf biyolojik maddeler için tasarlanmış Saf-T-Pak, Inc bir yalıtımlı nakliye sistemi kullanmaktadır. Boyama oluştu aynı yerde örnekleri analiz, bölüm 4'e gidin.
- Örnekler hemen boyandıktan sonra sevk edilebilir veya bir kez onlar -65 tek dondurulur ° C -95 ° C Lekeli örnek kutusunda folyo ve yerde tamamen her tüp sarın. Emici malzeme ile sızdırmaz bir poli-çantada lekeli numune kutusu yerleştirin.
- Çanta mümkün olduğunca az hava gibi bir Tyvek çantası ve mühür içine sızdırmaz poli-çanta ve içerikleri yerleştirin.
- Iç kahverengi kutu içindeki numune paketi (ikincil ambalaj içine numune) yerleştirin.
- Iç kahverengi b yerleştirinStrafor göğüs içindeki öküz, değişen önlemek için girinti içine güvence.
- Kuru buz (yaklaşık 8 kg) ile strafor göğüs doldurun ve göğüs üzerinde, kapağı iyice yerleştirin.
- Güvenli bant nakliye kutusunu ve gemi Biyolojik Madde gibi, düzgün Kuru Buz (UN1845) işaretleri ile Kategori B (UN3373); IATA PI-650 yönergeleri izleyin.
- Aldıktan sonra, numuneler -65 saklanır ° C -95 ° C de analiz kadar.
4. Çözülme ve Akış Sitometri Analizi
- Akış sitometresinde toplama önce karanlıkta oda sıcaklığında çözülmesini dondurucu lekeli örnek çıkarın. Birden fazla numune üzerinde veri toplama ise, tüp 1 saatten daha uzun her biri için oda sıcaklığında oturma değildir, böylece çözülme şaşırtıcı tüm borular için işlem standartlaştırmak.
- Numuneler gibi BD LSR uygun filtreler ile donatılmış dört lazer akış sitometresinin kullanarak elde edilmelidirII. Veri toplama 4 için standart sitometresinin kalibrasyon ve floresans kompanzasyon yöntemleri kullanın.
Not: toplama 5 sırasında forward scatter ve yan dağılım eşikleri ayarlamak etmeyin. Trucount boncuk boncuk bir alt grup analizi esnasında hesaba değil neden bu parametreler için mümkün olan en düşük eşik ayarı altına düşebilir. Bir eşik belirlemek için cihaz tarafından Gerekiyorsa, mümkün olan en düşük Am Camgöbeği kanallı eşik ayarlayın. Paneli ile boyandı CD45 + lökositleri Camgöbeği olumlu Am edilecek ve Trucount boncuklar da Am Camgöbeği kanalda floresan Çünkü, bu uygun tahsil edilecek tüm ilgili veriler için izin vermelidir.
- Akış sitometresinde yüklemeden önce 5 saniye vorteksleyin numune tüpü. Trucount boncuk birçok kanal son derece floresan. PE Cy5 ve APC (iki Colo için son derece çift pozitif nüfus bularak Kapısı toplama sırasında boncuklarEn kolay hücrelerden ayırt boncuklar rs) araçları bağlı olarak değişebilir. En az 20.000 boncuk edinilen kadar durdurma kapısı olarak boncuk kapı seçin ve kayıt verileri.
- Böyle FlowJo (Treestar; Ashland, OR) gibi uygun bir yazılım kullanarak verileri analiz edin. Şekil 1 bir temsilci kontrol kan beraberlik farklı lökosit popülasyonlarının analizi için kullanılan yolluk planını göstermektedir.
5. Trucount Hesaplamalar
- Her Trucount tüp floresan boncuk liyofilize pelet içerir. Tüp ile sıvı ekleme ve vorteks sonra boncuklar eşit olarak numune içinde dağılmış hale gelmelidir. Pelet boncuk sayısı lot sayısına göre biraz değişir ve tüpleri için saklama çantası bulunabilir.
- Kapı Trucount boncuklar ve hücre popülasyonu her bir nüfus için olay sayımları belirlemek için Şekil 1 'de gösterildiği gibi. Olayların sayısının karşılaştırılması iN tüp içinde orijinal olarak boncuk toplam sayısı ile boncuk kapı daha sonra her bir nüfus için mutlak konsantrasyonu (yani, hücre / ul) belirlemek için kullanılan örnek toplanan oranı belirlemek için izin verir. Hücre yoğunluğu (# hücre / ul kan) = [/ # nüfus etkinlik (# boncuk etkinlik / # pelet içinde toplam boncuk)] / 100 ul: Aşağıdaki denklem bu amaç için kullanılabilir.
6. Temsilcisi Sonuçlar
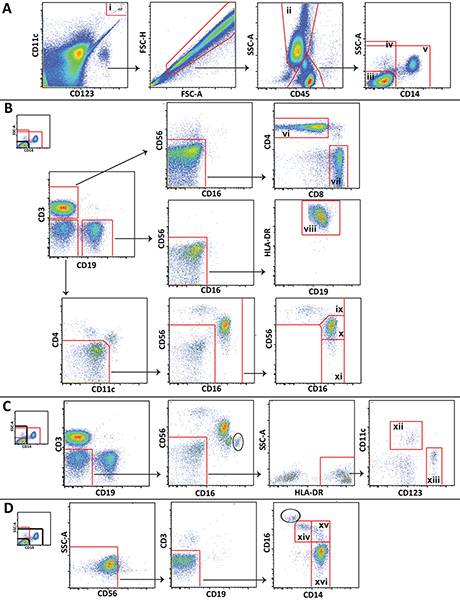
Şekil 1. Yolluk düzeni sağlıklı gönüllüden temsilcisi verileri gösteren önemli lökosit popülasyonlarının analizi için kullanılmıştır. A) Trucount boncuk (i) Geçitli ve hücreler dışlanmıştır. Granülositler (ii) tarif edilmektedir ve lympohcytes ve monositler 3 popluations ayrılır: CD14negatif lenfositler (iii) tüm CD14 negatif hücrelerde, (iv) ve non-lenfositler (v). B) CD14 negatif lenfositler CD4 + T hücreleri (vi), CD8 + T hücreleri (vii), B hücreleri (viii), CD56 parlak NK hücreleri, (ix), CD56 loş NK hücreleri, (X), ve CD56 negatif NK hücreleri ayırmak için kapı vardır (xi). C) Her CD14 negatif hücrelerde miyeloid (xii) ve plazmasitoid (xiii) dendritik hücreleri ayırmak için kapı vardır. D) Sigara lympocytes klasik olmayan (xiv), orta (xv) ve klasik (xvi) monositler ayırt kapı vardır. büyük bir rakam görmek için buraya tıklayın .
Şekil 1 (örn., NKT hücreleri veya nötrofiller) gösterilmeyen Daha spesifik hücre alt aynı zamanda mevcut paneli kullanılarak ayırt edilebilir, ve gating düzeni genişletilmiş veya belirli çalışma ihtiyaçlarını karşılamak üzere modifiye edilebilir. Gösterilen bazı yolluk adımları bu yöntem özeldir. Özellikle dikkat, içerme kapısı vedışlama kapısı Trucount boncuk etrafında çizilmiş ve birbirinin üstüne yerleştirilir, sayım için kapı boncuk, diğeri hücresel analizi (Şekil 1A) gelen boncuklar dışlamak için vardır. Onlar CD45 ekspresyonu ve yan dağılım (Şekil 1A) genellikle gereklidir kullanarak ileri saçılım ve yana saçılım, yolluk bu hücreler periferik kan mononükleer hücrelerinde olduğu gibi Ayrıca, çünkü lenfositler, monositler ve granülositler gibi kolayca tam kanda ayırt edilmezler. CD45 ve yan dağılım kullanılarak lenfositler ve monositler ayrılmış olamazdı kirleticiler granülositler (daire içinde) yüksek CD16 ekspresyonu (Şekil 1C ve Şekil 1D) tarafından bazı komplolara ayırt edilebilir. Kontamine granülosit sayısı genelde azdır ve onlar monosit ve NK hücre yolluk ile karışmaz.
Tartışmalar
Bu yazıda, flow sitometri ile taze tam kan lökosit popülasyonlarının numaralandırma için bir boncuk-tabanlı bir yöntem sunmak ve merkezi numune analizi ile çok merkezli bir klinik çalışmada kullanılması için gerekli parametreleri kapsamaktadır. Bu yöntem üzerine kurulmuş ve BD Trucount protokolü optimize eder ve çok merkezli klinik ortamda güvenilir kullanım sağlar. Boyama testi basit ve uygulanabilir kan işleme laboratuar teknisyenleri bunu gerçekleştirmek için ve analiz için merkezi bir t...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu yöntem, el yazması ve video gelişiminde onların yardım için Jessica Jones, Erica Clark, Constance Ducar, Donna Smith, Roy Lewis, Lily Apedaile, Joanne Wiesner, Devin Adams, Corey McBain ve Stephen Voght ederim.
Bu çalışma Bill ve Melinda Gates Vakfı CAVD hibe 38645 (MJM) ve Sağlık hibe Ulusal Sağlık Enstitüleri UM1 AI068618 ve U01 AI069481 (MJM) tarafından desteklenmiştir. EA-N. NIH Grant T32 AI007140 tarafından desteklenmektedir. Biz onların cömert donanım bağışı için James B. Pendleton Charitable Trust ederim.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | |
| Mutlak Sayım Tüpler Trucount | BD Biosciences | 340334 | |
| 10X FACS Çözüm Lysing | BD Biosciences | 349202 | |
| İzoleli Kategori B & Muaf Nakliye Sistemi, | Saf-T-Pak | STP-320 | |
| AmCyan CD45 monoklonal antikor | BD Biosciences | 339192 | |
| FITC CD3 monoklonal antikor | BD Biosciences | 349201 | |
| CD8 PerCp-Cy 5.5 monoklonal antikor | BD Biosciences | 341051 | |
| CD4 Alexa Fluor 700 monoklonal antikorlardy | BD Biosciences | 557922 | |
| HLA-DR ECD monoklonal antikoru | Beckman Coulter | IM3636 | |
| V450 CD14 monoklonal antikor | BD Biosciences | 560349 | |
| PE CD19 monoklonal antikor | BD Biosciences | 555413 | |
| CD16 APC-H7 monoklonal antikor | BD Biosciences | 560195 | |
| CD56-PE Cy7 monoklonal antikor | BD Biosciences | 335791 | |
| CD11c APC monoklonal antikor | BD Biosciences | 559877 | |
| CD123 PE-Cy5 monoklonal antikor | BD Biosciences | 551065 |
Referanslar
- Taylor, M. J., London, N. J., Thirdborough, S. M., Lake, S. P., James, R. F. The cryobiology of rat and human dendritic cells: preservation and destruction of membrane integrity by freezing. Cryobiology. 27, 269-278 (1990).
- Reimann, K. A., Chernoff, M., Wilkening, C. L., Nickerson, C. E., Landay, A. L. Preservation of lymphocyte immunophenotype and proliferative responses in cryopreserved peripheral blood mononuclear cells from human immunodeficiency virus type 1-infected donors: implications for multicenter clinical trials. The ACTG Immunology Advanced Technology Laboratories. Clin Diagn Lab Immunol. 7, 352-359 (2000).
- Boonlayangoor, P., Telischi, M., Boonlayangoor, S., Sinclair, T. F., Millhouse, E. W. Cryopreservation of human granulocytes: study of granulocyte function and ultrastructure. Blood. 56, 237-245 (1980).
- Perfetto, S. P., Ambrozak, D., Nguyen, R., Chattopadhyay, P., Roederer, M. Quality assurance for polychromatic flow cytometry. Nat Protoc. 1, 1522-1530 (2006).
- Brando, B., Barnett, D., Janossy, G., Mandy, F., Autran, B., Rothe, G., Scarpati, B., D'Avanzo, G., D'Hautcourt, J. L., Lenkei, R., Schmitz, G., Kunkl, A., Chianese, R., Papa, S., Gratama, J. W. Cytofluorometric methods for assessing absolute numbers of cell subsets in blood. European Working Group on Clinical Cell Analysis. Cytometry. 42, 327-346 (2000).
- Bull, M., Lee, D., Stucky, J., Chiu, Y. L., Rubin, A., Horton, H., McElrath, M. J. Defining blood processing parameters for optimal detection of cryopreserved antigen-specific responses for HIV vaccine trials. J. Immunol Methods. 322, 57-69 (2007).
- Kantor, A. B., Roederer, M., Herzenberg, L., Blackwell, C., Weir, D. . The handbook of Experimental Immunology. 43, 1-49 (1996).
- Hulspas, R. Flow cytometry and the stability of phycoerythrin-tandem dye conjugates. Cytometry A. 75, 966-972 (2009).
- Le Roy, C., Varin-Blank, N., Ajchenbaum-Cymbalista, F., Letestu, R. Flow cytometry APC-tandem dyes are degraded through a cell-dependent mechanism. Cytometry A. 75, 882-890 (2009).
- Mandy, F., Brando, B. Enumeration of absolute cell counts using immunophenotypic techniques. Curr. Protoc. Cytom. Chapter 6, Unit 6 (2001).
- Vuckovic, S. Monitoring dendritic cells in clinical practice using a new whole blood single-platform TruCOUNT assay. J. Immunol Methods. 284, 73-87 (2004).
- Lichtner, M. Circulating dendritic cells and interferon-alpha production in patients with tuberculosis: correlation with clinical outcome and treatment response. Clin. Exp. Immunol. 143, 329-337 (2006).
- Hosmalin, A., Lichtner, M., Louis, S. Clinical analysis of dendritic cell subsets: the dendritogram. Methods Mol. Biol. 415, 273-290 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır