Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kullanılarak DNA hasar Checkpoint incelenmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Xenopus yumurta özü DNA hasarı kontrol noktasında araştırmak için yararlı bir model sistemidir. Bu protokol, Xenopus yumurta özü ve DNA hasarına neden olan kontrol noktası reaktiflerin hazırlanması içindir. Bu teknikler DNA hasar kontrol noktası sinyalleşmenin çalışmada DNA hasarına yaklaşımların çeşitli uyarlanabilir.
Özet
Günlük olarak, hücreler, endojen ve çevresel hasarlar çeşitli tabi tutulur. Bu hakaretler mücadele etmek için, hücrelerin DNA hasarı ve DNA hasarı doğrudan hücresel yanıtları anlamda bir gözetim mekanizması olarak sinyalizasyon DNA hasarı kontrol noktasında gelişmiştir. DNA hasarı kontrol noktasında sinyal (Şekil 1) yer alan sensörler, transdüserler ve etkileyiciler adlandırılan proteinlerin birkaç grup vardır. Bu kompleks sinyal yolu olarak, ATR (ATM ve RAD3 ile ilgili) DNA hasarına ve çoğaltma strese cevap verebilecek kinazları önemli biridir. Aktif ATR gibi Chk1 olarak aşağı yüzeylerde (Checkpoint kinaz 1) fosforile edebilir. Sonuç olarak, fosforilasyona ve hücre döngüsünün durması, transkripsiyon aktivasyonu, DNA hasarının tamiri ve apoptosis ya da yaşlılık (Şekil 1) dahil olmak üzere DNA hasar kontrol noktası olarak çok sayıda alt-etkilere yol açar Chk1 aktive edildi. DNA hasar gördüğünde, unrep yılında DNA hasarı kontrol noktasında sonuçlar etkinleştirmek için başarısızyayınlanan hasar ve, sonradan, genomik instabilite. DNA hasarı kontrol noktasında çalışma hücrelerinin genomik bütünlüğünü korumak nasıl açıklamak ve kanser gibi insan hastalıkları, nasıl geliştiğini daha iyi anlaşılmasını sağlayacaktır.
Xenopus laevis yumurta özleri DNA hasarı kontrol noktasında araştırma güçlü bir hücre serbest ekstresi model sistem olarak ortaya çıkmaktadır. Düşük hızda ekstresi (LSE) başlangıçta Masui grup 1 de tarif edilmiştir. DNA kez hücre döngüsü başına semiconservative moda çoğaltılır çekirdeklerin oluşumu LSE sonuçlarına demembranated spermin kromatin eklenmesi.
ATR/Chk1-mediated noktası sinyal yolağı DNA hasarı veya çoğaltma stres 2 tarafından tetiklenir. DNA hasar yaklaşımlar ve DNA hasar taklit eden yapılar 3: iki yöntem, şu anda DNA hasar noktası indüklemek için kullanılır. DNA hasar ultraviyole (UV) ışın tedavisi, γ-ışınlama, metil metan indüklenebiliresulfonate (MMS), mitomisin C (MMC), 4-nitroquinoline-1-oksit (4-NQO), afidikodin ya da 3, 4. MMS DNA replikasyonu inhibe eder ve ATR/Chk1-mediated DNA hasar kontrol noktası 4-7 aktive edilen bir alkilleştirme ajanı. UV radyasyona da ATR/Chk1-dependent DNA hasar kontrol noktası 8 tetikler. DNA hasar taklit eden yapı AT70 iki oligonükleotidlerin poli (dA) 70 ve poli-(dT) 70 ve tavlanmış bir komplekstir. AT70 sistemi Bill Dunphy laboratuvarında geliştirilen ve yaygın olarak 9-12 ATR/Chk1 kapısı sinyalizasyon ikna etmek için kullanılır.
Burada, (2) DNA hasarına taklit eden yapı hazırlamak için, iki farklı DNA zarar yaklaşımlar (PYS ve UV), (3) ile birlikte Xenopus sperm kromatin tedavi etmek için hücre içermeyen yumurta ekstreleri (LSE) maddesinin hazırlanması için protokolleri (1), tanımlamak AT70, ve (4) hasarlı sperm kromatin ya da bir DNA hasar taklit eden yapı ile LSE olarak ATR/Chk1-mediated DNA hasarını kontrol noktası tetikleyebilir.
Protokol
1. LSE Hazırlık
- Erkek kurbağalar (Xenopus laevis) yumurta toplama için iki kez enjekte edilir. İlk enjeksiyon (priming) kurbağa başına 100 U PMSG (Gebe Kısrak Serum Gonadotropin) 'dir. Indükleyici yumurtlama ve astarlanmış kurbağaları iki hafta için elverişlidir önce Kurbağalar en az iki gün astarlanmalıdır. Başbakan kurbağalar için, 3 ml şırınga ve 27 G iğne kullanılarak dorsal lenf torbalarıyla subkütan olarak PMSG enjekte.
- Yumurtlama teşvik etmek için, 27 G iğne kullanılarak dorsal lenf torbalarıyla subkütan olarak astarlanmalı kurbağa başına 500 U hCG (insan koryonik gonadotropin) enjekte. 1x Marc modifiye Ringer solüsyonu (MMR) 2 litre içeren ayrı kovalarda enjekte kurbağa inkübe edin. Toplanmasından önce yumurtalarını bırakmak için kurbağa 14-20 saat bekleyin.
- Kepçelerinden kurbağalar çıkarın ve yaklaşık 100 ml kalana kadar MMR çözümü kapalı dökün. 250 ml'lik behere yumurta aktararak kovalar yumurta elde.
- % 2 sistein, 100 ml (ayarlamak ekleyerek Dejelly yumurta10 M KOH ile 7.8 pH). Ters cam Pasteur pipeti (çapı 0.7 cm) yaklaşık her 30 sn yavaşça girdap yumurta. Durusu ve inkübasyon sırasında iki kez taze sistein ile değiştirin. Yumurta beherin altındaki bir daha yoğun bir tabaka oluşturur zaman dejellying işlem yaklaşık 5-15 dakika içinde tamamlandı.
- Sistein solüsyonu atın ve 0.25x MMR ile yumurta üç kez yıkayın. Bir cam pipet ile çözelti içinde çalkalanarak yumurta. "Bad" yumurta basit görsel muayene ile tespit ve görünüş olarak "kabarık" beyaz vardır. "Kötü" yumurta girdapladıktan sonra çanağın merkezine birikir. Pasteur pipeti ile "kötü" yumurta çıkarın.
- Yumurta Lizis Buffer (ELB) üç kez yumurta ile yıkayın. Pasteur pipeti tarafından herhangi bir ek "kötü" yumurta çıkarın. 14 ml Falcon tüp içine yumurta dökün.
- Yumurta sıkıştırmak için bir sallanan kova rotor ile CL2 IEC klinik masa üstü santrifüj kullanılarak 188 xg (1.100 rpm) 55 sn için Falcon tüp Spin. Dan fazla tampon kaldırYumurta katmanın üstüne. Aprotinin / Löpeptin stokunun 0.5 ul ve sıkıştırılmış yumurta ml başına Sitokalazin B stokunun 0.5 ul ekleyin.
- 4 az 15 dakika boyunca 16.500 xg'de (10.000 rpm) yumurta santrifüjleyin ° C HB6 sallanan kepçe rotorlu Sorvall RC6 artı SuperSpeed santrifüj kullanarak. Santrifüj sonra, yumurta tüp içinde üç katmandan fraksiyonlaşma: sırasıyla lipid, özü ve sarısı / üstten alta pigment. Bir 21 G iğne ile özü orta tabaka alt kısmında da delinme Falcon tüpün yan. Delme iğnesi plastik tarafından kesilebileceği gibi dikkatlice iğneyi çıkarın. Özü toplamak için ponksiyon içine 1 ml enjektöre bağlanmış taze 21 G iğne takın. Yavaşça lipid ve sarısı / pigment katmanları ile hava kabarcıkları ve kontaminasyon enjektöre özü aspire.
- Soğutulmuş bir 1,5 ml mikrosantrifüj tüp içine özleri yerleştirin. Yumurta özü mililitre her biri için, içinde aşağıdaki kimyasal stok çözeltileri eklemekendikedir nihai konsantrasyon (parantez içinde gösterilmiştir): (1) 10 ul Sikloheksimit (100 ug / ml), (2) 1 ul Aprotinin / Löpeptin (10 ug / ml her biri), (3) 1 ul Sitokalazin B (5 ug / ml ), (4) 1 ul ditiyotretol (1 mM) ve (5) 0.33 ul Nokodazol (3 ug / ml). Yumurta hafifçe en az 10 kez ayıklamak Invert. Bu taze yapılmış ve 4 saat içinde kullanılmalıdır LSE vardır. LSE kalitesi 4 saat veya donma-çözülme sonrasında tehlikeye girer.
2. DNA Zararlı Yaklaşımlar ile Sperm Kromatin Tedavisi
- Daha önce 13 tarif edilen metoda göre normal sperm kromatin hazırlayın.
- MMS ile tedavi edilen spermin kromatin hazırlayın
- 0.5 ml Tampon X'de normal sperm kromatin süspanse
- 100 mM nihai konsantrasyonu kromatin yeniden süspanse 500 ul MMS ~ 5.5 ul (stock 9.1 M) ekleyin.
- Rotasyonu ile 30 dakika süreyle oda sıcaklığında mikrosantrifüj tüpü içinde sperm kromatin inkübe edin.
- M Spinsallanan kova rotor ve boru adaptörü ile IEC CL2 klinik santrifüj kullanılarak oda sıcaklığında 10 dakika boyunca 686 x g (2100 rpm) icrocentrifuge tüpü.
- Süpernatant atılır, Tampon X artı BSA (% 3), DTT (0.1 mM) ve aprotinin / Löpeptin (10 ug / ml her biri) 0.5 ml olarak pelet tekrar süspansiyon.
- Adım (4) tekrarlayın ve (5) iki kez sperm kromatin yıkamak.
- Hemasitometre ile sperm kromatin yoğunlaşması belirleyin ve 100.000 sperm / ul seyreltin. Daha fazla kullanım için -80 ° C derin dondurucuda 5 ul alikotları kaydedin.
- UV ile muamele edilen spermin kromatin hazırlayın
- Parafilm bir parça yüzeyine normal sperm kromatin istenilen miktarda (örneğin 10 ul) ekleyin.
- UV çapraz bağlayıcı içine Parafilm yerleştirin. Denemenizi bağlı olarak istenilen enerji parametre, Set ve UV ışığı ile spermin kromatin zarar başlar. Örneğin, 1.000 J / m 2 'ulaşmak için yaklaşık 21 saniye sürer.
- UV irra sonradiation, UV ile muamele edilen sperm kromatin hemen yumurta özleri için ilave edilmelidir.
3. DNA Hasarı-taklit Yapısının Hazırlanması (AT70)
- İki sentetik oligonükleotidler çözülür poli (dA) sırasıyla 70 (A70 olarak belirlenmiştir) ve poli-(dT) 70 (T70 olarak belirlenmiştir) 2 mg / ml 'lik bir konsantrasyon ile su içinde.
- Bir 1.5 ml mikrosantrifüj tüpüne A70 100 ul ve 100 ul T70 ekleyin. Bir heatblock 95 5 dak ° C için karışık sentetik oligo kaynatıp.
- Kuru banyo bloğu üzerinden (bu karışım AT içeren tüp ile) alınız ve bir laboratuar tezgah üzerinde oda sıcaklığına kadar soğumasını bekleyiniz. Bu sıcaklık ayarı 45-60 dakika sürer.
- Soğutulan karışım, 2 ug / ul nihai konsantrasyon ile AT70 olup. Daha fazla kullanım için -20 ° C derin dondurucuda AT70 alikotları Mağaza 10 ul.
4. Hasarlı Sperm Kromatin veya DNA Hasarı ile LSE yılında DNA Hasarı Checkpoint Tetikleme-Taklit Yapısı
- Hasarlı sperm kromatin ile LSE DNA hasarı kontrol noktasında ikna
- 1,5 ml mikrosantrifüj tüp LSE 50 ul ekleyin ve Enerji Karışım 1 ul ve hasarlı sperm kromatin (son konsantrasyonu ~ 4.000 sperm / ul reaksiyon) 2 ul ile tamamlıyor.
- 90 dakika süre ile oda sıcaklığında inkübe edin ve reaksiyon tüpü tüp her 10 dk hafifçe vurun.
- 30 dakikalık inkübasyondan sonra nükleer boya çözeltisinin 1 ul ile desteklenmiş bir mikroskop lamı üzerine reaksiyon karışımı 1 ul dağıtın. Reaksiyon karışımı üzerinde bir kapak kayma yerleştirin ve floresan mikroskop aracılığıyla çekirdeklerin oluşumu için kontrol edin. Genellikle, yuvarlak nükleus DNA replikasyonu başlatmıştır gösteren, inkübasyon 30 dakika sonra oluşturacaktır.
- Numune tamponu 90 ul reaksiyon karışımı içine 10 ul al. Numuneler anti-Chk1 P-S344 ya da anti-Chk1 antikorlar kullanılarak immünoblot vasıtasıyla analiz edilir.
- Ile LSE DNA hasar kontrol noktası indüklemekAT70
- Enerji Karışım 1 ul ve Tautomycin stokunun 1.6 ul desteklenmiş 1.5 ml mikrosantrifüj tüp LSE 50 ul ekleyin.
- Her reaksiyon için önceden hazırlanmış AT70 (2 ug / ul) ve su (negatif kontrol olarak) ve 1.25 ul ekle. 90 dakika için oda sıcaklığında reaksiyon inkübe edin. Reaksiyon tüpleri her 10 dk hafifçe vurun.
- Numune tamponu 90 ul reaksiyon karışımı içine 10 ul ekle. Numuneler anti-Chk1 P-S344 ya da anti-Chk1 antikorlar kullanılarak immünoblot yoluyla incelenmiştir.
5. Temsilcisi Sonuçlar
Hasarlı sperm kromatin ya da DNA hasarı taklit eden yapısı Xenopus yumurta özü sisteminde ATR/Chk1-mediated DNA hasarı kontrol noktasında tetikleyebilir. MMS bir göstergesidir Ser344 az Chk1 fosforilasyon (Chk1 P-S344), uyardığı Şekil 2A gösterileri ATR kinaz aktivasyonu. Şekil 2B olduğunu AT70, bir DNA hasarı taklit eden stru gösterircture, ayrıca Chk1 fosforilasyon tetikler. Toplam Chk1 örnekler her iki örnekte de yükleme kontrol olarak kullanılmıştır.
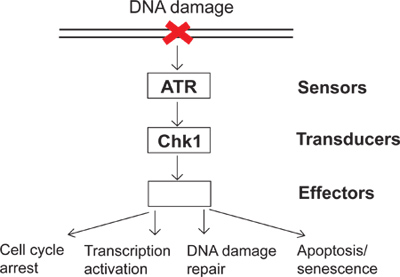
Şekil 1. DNA hasarı kontrol noktasında sinyalizasyon bir diyagram.
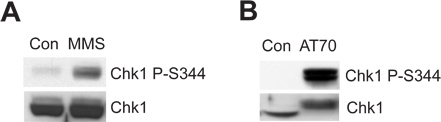
Şekil 2. Chk1 fosforilasyon MMS veya Xenopus yumurta özler AT70 tedaviler ya tarafından indüklenir. (A) MMS-hasarlı sperm kromatin (MMS) veya normal sperm kromatin (Con) 90 dakika boyunca yumurta özleri içerisinde inkübe edilir. Chk1 Ser344 az fosforilasyon (Chk1 P-S344) ve yumurta özler toplam Chk1 immunoblotting yoluyla incelenmiştir. (B) ya da su AT70 (Con), sırasıyla, yumurta özleri içine ilave edilir. Örnekler ayrıca (A) 'de immünoblot vasıtasıyla analiz edilir.
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Xenopus yumurta özler kullanılarak DNA hasarı kontrol noktasında eğitim çeşitli avantajları vardır. Yumurta ekstrelerin hücre döngüsünün ara yüzeyinde eşzamanlı hücre içermeyen özler bir çok miktarda içerir. Yumurta ekstreler kolay ve ucuz hale getirilebilir. Bu DNA veya kromatin zarar ve yumurta özü bir hedef protein immunodepleting sonra DNA hasarı kontrol noktasında bir kusur ortaya nispeten kolaydır. Daha sonra, bir olası fonksiyon bozukluğu vahşi tip ya da mutant rekombinan pr...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Bu çalışma Charlotte, Kuzey Carolina Üniversitesi, öğretim mükemmellik için Wachovia vakıf fonu ve NIGMS (R15GM101571) hibe tarafından sağlanan fonların kısmen desteklenmektedir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktifler | |||
| Anti-Chk1 P-S344 antikor | Hücre Sinyal | 2348L | |
| Anti-Chk1 antikor | Santa Cruz | SC7898 | |
| Aprotinin | MP Biomedicals | 0219115880 | |
| Siklohekzimid | Sigma | C7698-5G | |
| Sitokalazin B | EMD | 250233 | |
| Ditiyotretol (DTT) | VWR | JTF780-2 | |
| hCG | Sigma | CG10-10VL | |
| L-Sistein | Sigma | C7352-1KG | |
| Löpeptin | VWR | 97063-922 | |
| Metil metansülfonat (MMS) | Sigma | 129925-5G | |
| Nokodazol | Sigma | M1404-2MG | |
| PMSG | Calbiochem | 367222 | |
| Numune tamponu | Sigma | S3401 | |
| Tautomycin | Wako Kimyasallar Turkey | 209-12041 | |
| Ekipman | |||
| Yumurtlama için Kepçe | Rubbermaid ticari ürünler | 6308 | |
| Sallanan kepçe rotorlu CL2 IEC santrifüj | Thermo Scientific | 004260F | |
| HB6 sallanan kova rotor | Thermo Scientific | 11860 | |
| Sorvall RC6 artı SuperSpeed santrifüj | Thermo Scientific | 46910 | |
| UV çapraz bağlayıcı | UVP | 95-0174-01 | |
| Çözümler | |||
| 1x MMR | 100 mM NaCl, 2 mM KCl, 0.5 mM MgSO4, 2.5 mM CaCl2, 5 mM HEPES, 10 M NaOH ile pH 7,8 'e ayarlamak | ||
| Aprotinin / Löpeptin stok | 10 mg / ml her biri su içinde. -80 ° C'de saklayın alikotları 20 ul | ||
| Tampon X | 0.2 M sukroz, 80 mM KCI, 15 mM NaCl, 5 mM MgCl2, 1 mM EDTA, 10 mM HEPES, HCl ile pH 7.5 'e ayarlamak | ||
| Siklohekzimid stok | 1Su içinde 0 mg / ml. -20 ° C'de saklayın 1 ml alikotları | ||
| Sitokalazin B stokları | DMSO içinde 5 mg / ml idi. -20 ° C'de saklayın alikotları 20 ul | ||
| Ditiyotretol (DTT) stok | Su içinde 1 M. -20 ° C'de saklayın 1 ml alikotları | ||
| ELB | 0.25 M sukroz, 1 mM DTT, 50 ug / ml sikloheksimid, 2.5 mM MgCl2, 50 mM KCI, 10 mM HEPES, pH7.7 | ||
| Nokodazol stok | DMSO içerisinde 10 mg / ml idi. -80 ° C'de 5 ul alikot depolayın | ||
| Enerji Karışım | 375 mM kreatin fosfat, 50 mM ATP, 25 mM MgCl2. Alikotlar -80 ° C'de saklanır | ||
| Nükleer boya çözeltisi | 0.4 mg / ml Hoechst 33258,% 25 gliserol(V / v) içinde 1 x PBS | ||
| Tautomycin stok | DMSO içinde 100 uM. -80 ° C'de saklayın alikotları 10 ul |
Referanslar
- Lohka, M. J., Masui, Y. Formation in vitro of sperm pronuclei and mitotic chromosomes induced by amphibian ooplasmic components. Science. 220 (4598), 719-721 (1983).
- Cimprich, K. A., Cortez, D. ATR: an essential regulator of genome integrity. Nat. Rev. Mol. Cell Biol. 9 (8), 616-627 (2008).
- Lupardus, P. J., Van, C., Cimprich, K. A. Analyzing the ATR-mediated checkpoint using Xenopus egg extracts. Methods. 41 (2), 222-231 (2007).
- Lupardus, P. J., Byun, T., Yee, M. C., Hekmat-Nejad, M., Cimprich, K. A. A requirement for replication in activation of the ATR-dependent DNA damage checkpoint. Genes Dev. 16 (18), 2327-2332 (2002).
- Stokes, M. P., Van Hatten, R., Lindsay, H. D., Michael, W. M. DNA replication is required for the checkpoint response to damaged DNA in Xenopus egg extracts. J. Cell Biol. 158 (5), 863-872 (2002).
- Kato, K., Strauss, B. Accumulation of an intermediate in DNA synthesis by HEp.2 cells treated with methyl methanesulfonate. Proc. Natl. Acad. Sci. U.S.A. 71 (5), 1969-1973 (1974).
- Paulovich, A. G., Hartwell, L. H. A checkpoint regulates the rate of progression through S phase in S. cerevisiae in response to DNA damage. Cell. 82 (5), 841-847 (1995).
- Guo, Z., Kumagai, A., Wang, S. X., Dunphy, W. G. Requirement for Atr in phosphorylation of Chk1 and cell cycle regulation in response to DNA replication blocks and UV-damaged DNA in Xenopus egg extracts. Genes Dev. 14 (21), 2745-2756 (2000).
- Jazayeri, A., Balestrini, A., Garner, E., Haber, J. E., Costanzo, V. Mre11-Rad50-Nbs1-dependent processing of DNA breaks generates oligonucleotides that stimulate ATM activity. EMBO. J. 27 (14), 1953-1962 (2008).
- Kumagai, A., Dunphy, W. G. Claspin, a novel protein required for the activation of Chk1 during a DNA replication checkpoint response in Xenopus egg extracts. Mol. Cell. 6 (4), 839-849 (2000).
- Yan, S., Lindsay, H. D., Michael, W. M. Direct requirement for Xmus101 in ATR-mediated phosphorylation of Claspin bound Chk1 during checkpoint signaling. J. Cell Biol. 173 (2), 181-186 (2006).
- Shiotani, B., Zou, L. Single-stranded DNA orchestrates an ATM-to-ATR switch at DNA breaks. Mol. Cell. 33 (5), 547-558 (2009).
- Tutter, A. V., Walter, J. C. Chromosomal DNA replication in a soluble cell-free system derived from Xenopus eggs. Methods Mol. Biol. 322, 121-137 (2006).
- Cross, M. K., Powers, M. Preparation and Fractionation of Xenopus laevis Egg Extracts. J. Vis. Exp. (18), e891(2008).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır