Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bir Stereotaktik Enjeksiyon MicroRNA-ifade Fare Hippocampus CA1 Bölgesi Lentiviruses ve Davranış Sonuç Değerlendirilmesi
Bu Makalede
Özet
MicroRNA beyin yapısı ve fonksiyonu önemli rolleri vardır. Burada aşırı ifadesi bir mühendislik miRNA-ifade lentivirüs stereotaktik enjeksiyonu kullanılarak hipokampal miRNA uygulamak için bir yöntem açıklanmaktadır. Bu yaklaşım, değerlendirmek için nispeten hızlı bir yöntem olarak hizmet verebilir In vivo Spesifik beyin bölgelerinde aşırı ifade miRNAs etkisi.
Özet
MicroRNA (miRNA'lar) uzun 22 nükleotid çevresinde küçük düzenleyici tek zincirli RNA molekülleri olduğunu olabilir her hedef çok sayıda mRNA transkript ve neden olan yıkım ve / veya bu hedeflere inhibe çeviri tarafından loş bütün bir gen yolu. Çeşitli miRNA'lar nöronal yapı ve fonksiyonu sürdürmek ve üst düzey beyin fonksiyonlarında önemli rol oynayan ve yöntemleri bu işlevler keşfetmek için kendi seviyelerini değiştirmek için aranır. Burada, MiRNA kodlayan virüs partiküllerinin stereotaktik enjeksiyon yoluyla uygulanan farelerde aşırı miRNAs bilişsel sonuçları incelemek için in vivo metot, doğrudan mevcut. Özellikle, mevcut protokol memeli bellek konsolidasyon, öğrenme ve stres yanıtları katkıda bulunur ve uygun bir enjeksiyon yeri sunmaktadır hipokampal CA1 bölgesinde, içine enjeksiyon içerir. Koordinatları fare bregma ve virüs perfüzyon dijital kontrollü ve çok yavaş tutulur göre ölçülür.Enjeksiyon sonrası, cerrahi yara kapalı ve hayvanların kurtarmak olduğunu. Ilgili mRNA hedeflerin susturucular kodlama lentivirüsler naif fare ile, gözlenen etkisi sorumlu özel miRNA / hedef etkileşimi ima hizmet, tuzlu ve kontrol grubu olarak "boş" lentivirüs vektörleri enjekte fareler enjekte fareler. Bir ay sonrası enjeksiyon, hayvanlar kendi navigasyon öğrenme ve bellek yeteneklerini değerlendirmek için Morris Su Maze (MWM) incelenmiştir. MWM 1 cm su yüzeyinin altında batık küçük bir platformu ile renkli su dolu yuvarlak bir tank. Tankın etrafında sabit görsel ipuçları mekansal navigasyon (ses ve dünyanın manyetik alanı da navigasyon hayvanlar yardımcı olabilir) için izin verir. Video kamera izleme bulmak ve platform miktar için yüzme ve zaman yol ölçüm sağlar. Fare ilk gizli montaj platformu zorla yüzme bir kaçış sunuyor öğretilir, daha sonra bu kaçış ve f kullanmak için test edilirinally, platform kaldırılır ve fare önceki konumuna hatırlar eğer prob testleri incelemektir. Birkaç gün üst üste tekrar tekrar test platformu bulmak ve monte etmek daha kısa gecikmeleri test farelerin gelişmiş performans vurgulamak ve daha direkt hatları platform ya da konumu ulaşmak için. Bu gelişme daha sonra (yükseltilmiş artı labirent gibi) özel olarak test edilebilir bozulmuş öğrenme ve bellek ve / veya anksiyete, temsil göstermek için başarısız. Bu yaklaşım, bilişsel eğitim ve / veya stres ile ilgili işlemlerde özel miRNAs ve hedef transkript doğrulama sağlar.
Giriş
Sinir sisteminin işleyişinde özellikle miRNA'lar rolü son zamanlarda birçok çalışmada lentiviral enjeksiyon meydan olmuştur. MiRNA sinaps yapısı 1, sinaptogenez 2 ve sinaps yeniden ve bakım 3 bakımı ve yeniden şekillendirme için çok önemli olduğu tespit edilmiştir. Bu çalışmalar güçlü bir yukarı şekillendirme hem de sinir sistemi, bilişsel fonksiyon ana çıkış korunmasında çok katmanlı düzenleyici etkileri ile, miRNA'lar meşgul olduğunu göstermektedir. Kemirgen beynindeki belirli bölgeleri lentivirüs parçacıkların stereotaktik enjeksiyon sinaps morfolojisi ve nöronal aktivite Değişiklik için arama sağlar ve 4,5-aşırı ifade transkript fonksiyonel önemi kurulması için kullanılmıştır. MiRNA-ifade lentivirüsler ile iyi tanımlanmış beyin alanlarda nöronların doğrudan enfeksiyon yaşlanma, beyin hastalıkları ve nörodejenerasyon çalışmalarında karışmış olabilir; miRNA Çalışmalarıs davranışsal düzenleme 6-8 dünyasında bir çok daha az gelişmiş devlet altındadır, ve stereotaktik enjeksiyon miRNA-ifade davranış testleri takip lentivirüs parçacıklar gibi amaçlar için yararlı olabilir. Aşırı ya da az ifade uyaran için çok daha zahmetli yöntemi genetik knock-in veya farelerde mühendislik içerir. Genetik sistemleri daha da ifade koşullu ve zamansal kontrolünün (örneğin, Kre-Lox, Tet sistemler) için izin verebilir, ancak bu pek bir enjeksiyon işlemi uzamsal özgüllüğünü sunmak ve sızdırma bir miktar hemen hemen her zaman bulunmamaktadır. Ayrıca, mühendislik yöntemleri ameliyat gerektirmeyen ve nispeten iyi tekrarlanabilirlik ile laboratuvarlar arasında kullanılabilir, ancak onlar daha yavaş ve çok daha fazla insan gücü ve mali kaynak gerektirir. Buna ek olarak, kontrol geçici aşırı ya da enjekte edilmiş farelerde altında ekspresyonu genetik farelere kıyasla çok daha doğru olacaktır.
Protokol
1. Lentivirüs Hazırlık
- % 90 izdiham HEK-293FT hücreleri büyütün.
- Serumsuz DMEM transfeksiyon değişim hücre orta günde 1 mM glutamin, ve 50 mg / ml penisilin-streptomisin ile takviye edilmiş.
- Bir pLKO.1-Puro, vektör ve bir taşıyıcı olarak 9: 1 mg / ml 'polietilenimin 10 ul kullanılarak delta R8.2 ve VSV-G grupları ve ilgi MiRNA kodlayan plazmid ile ko-transfekte hücreleri.
- 0.45 mikron filtre ile filtre, 24 saat ve 48 saat sonrası transfeksiyon de ambalajlı lentivirüsler toplayın.
- 2 saat ve 15 ° -70 C, kısım ve mağaza ° C için, 70.000 xg de Ultrasantrifügasyon kullanarak lentivirüsler Konsantre
- Seri seyreltilmiş virüs preparatları (kuyu başına vektör 1 ile 10 -6 ml) ile HEK-293T hücreleri enfekte ölçüm virüs titresi. Elde edilen titresi (~ 1, en az 10 ml x 9 bulaşıcı parçacıklar tavsiye edilir) ge sentezlenmesi için değerlendirilirilgi ne, puromycin seçimi kullanarak ve floresan hücreleri sayma yoluyla virüs ifade GFP miktarının tarafından.
Lentivirüs hazırlık daha ayrıntılı bir protokol için 10 bakın.
2. Cerrahi Hayvanlar hazırlanması
- Cerrahlar giysi cerrahi önlük, steril eldiven, şapka ve maske içermelidir.
- Hayvan tartılır, daha sonra her bir ilaç için belirtilen hayvan ağırlığı ile orantılı hacmi ile, bir Ketamin karışımın bir IP enjeksiyonu ile anestezi. Bir Ketamin / Ksilazin karışım için 80-200 mg / kg ketamin ve 7-20 mg / kg 'Ksilazin bir doz aralığı genellikle farenin için kullanılır.
- Hayvan tam anestezi kadar bekleyin, sonra bacak uzanan ve sonra parmağınızla bastırarak hayvanın arka bacak içinde geri çekilme refleksi eksikliği olup olmadığını kontrol edin.
- Kutunun üzerinde belirtilen ağrı kesici, Rimadyl ile deri altı hayvan enjekte edilir. Rymadil için tipik doz aralığı 5-10 mg'dır.
- Sabit bir vücut sıcaklığı tutmak ve merhem ile gözleri nemlendirmek için bir ısıtma yastığı hayvan yerleştirin.
- Bir kırpma makine ile iki kulak arasındaki alanda tıraş.
- Betadin ile cilt dezenfekte.
3. Kafatası ve Sondaj maruz kalma
- Hayvanın kulak sadece ön yarıklar içine çubuklar ayarlayarak STEREOTAKT içindeki hayvanın yerleştirin.
- Kulak arasındaki yaklaşık 1,5 cm bir ön-arka kesi yapmak ve cerrahi kelepçeleri (serfines) ile açık tutmak için bir neşter kullanın.
- Bregma ve koronal ve lambdoidea'ya sütür arasındaki kesişme yani,, koronal sütür ve sagittal sütür arasındaki kesişme kadar bir pamuklu çubukla kafatası yüzeyini temizlemek yani lambda, görülebilir.
- Her üç eksen de bregma noktasına STEREOTAKT tarafından düzenlenen şırınga ucu,,, gelin. Koordinatları yazın. Bu noktada sıfır po olarak düşünülebilirher üç eksende int.
- Bir düzlemsel hareket kafatası çizilmeye ve doğru konuma şırınga kafa hareket olmaz ki dikey eksende şırınga kaldırın. -2 Ön / arka eksende, ± medial / yan ekseninde 1.8 ve dorsal / ventral ekseninde -1.5: hipokampal CA1 enjeksiyon aşağıdaki mm bregma göre koordine gerektirir.
- Bu kafatası temas edene kadar şırınga ucu indirin ve bir işaretleyici ile nokta işaretleyin. Bıçaklama önlemek için geri şırınga çıkarın.
- Sadece ince bir delici kullanarak kafatası kemik sığ bir delik, açın. Bu nedenle yumuşak doku altında içine matkap devam olmaz delici sabit tutun. Sen diğer steadying bir elle ve kısa bakliyat delerek bu önleyebilirsiniz.
4. Lentivirüs Enjeksiyon
- Konsantre lentivirüs bir çözeltinin 0.5 ml çekin.
- Delik üzerinde şırınga yerleştirin ve Rea kadar yavaşça dikey olarak daha düşükkafatasının nü içerir yüzeyi. Çok yavaş, beyin içine şırınga düşürmek için devam edin. Bu aşamada bir miktar kanama mutlaka başarısız bir penetrasyon göstermez hangi oluşabilir. Kanama oluşursa bir pamuklu çubuk ile paspas.
- Dijital pompaya 0.02 ml / dakika (0.5 ul 25 dakika içinde enjekte olacak) ayarlayın ve infüzyon başlar. Yavaş infüzyon dokuya virüsün yayılmasını etkili için izin verir ve geri akışını engeller. Bazı şırınga tiplerinde orijinal koordinatları ve beslerken çekilmeden önce 0,5 mm ekstra bir derinlik için şırınga takmadan düşünün.
- Infüzyon tamamlandıktan sonra malzeme yerine bir şırınga ile oluşturulan kanal içine geri çekilen bir beyin içine yaymak için izin vermek için ek 5 dakika boyunca bekleyin.
- Çok yavaş şırınga çıkarın ve geri akışları için izleyin. Bir geri akış bu adımda gözlenirse, enjekte edilen malzemenin bir kısmını muhtemelen kayboldu.
5. Yara Sızdırmazlık ve Kurtarma
- Seal inciE histoakril ile yara. Gözlerinin içine histoakril sızmasını önlemek için emin olun.
- Dehidratasyon önlemek için, 1 ml önceden ısıtılmış tuzlu su ile hayvan intraperitoneal (İP) enjekte edilir.
- Isıtılmış bir pad üzerinde konumlandırılmış bir kurtarma kafeste hayvan yerleştirin. Bu, ilave bir saat için geri alırken hayvan izleyin.
Kilo kaybı, iştahsızlık durumunda, zayıf / yem ya da su, can çekişme durumuna ya da enfeksiyon, hayvanın ötenazi elde edememe yapılmalıdır. Kemirgenler ötenazi kabul edilebilir yöntemler barbitüratlar, uçucu anestetikler, CO2, CO, veya genel anestezi ile birlikte potasyum klorürdür.
4-6 hafta sonra, hayvanın navigasyon bellek Morris su labirentinde değerlendirilir değerlendirmek. Lentivirüs genellikle enjeksiyon alanı içinde en hücreleri enfekte olacaktır.
6. Morris Su Maze Davranış Değerlendirme
- M hayvanları yetiştirmeksüsen Su Labirent. Tam eğitim ve test protokolü için 11 bakın. Her deneme sonra, kuru bir havlu ile kurulayın hayvan kafesine değiştirin ve depodaki su yenileyin.
- Her gün birbirini takip eden 3 gün, 4 denemeler için, Morris su labirentinde hayvanlar test edin. Doğu-batı-kuzey-güney, iki gün: batı-güney Her gün örneğin gün biri için, değişen bir sırayla labirent (kuzey, güney, doğu ve batı) ve 4 yönde her labirent içine hayvan yerleştirin -kuzey-doğu. Her deneme sonra hayvanlar silin.
- Test sırasında denemeler gibi Noldus izleme sistemi gibi bir takip sistemi ile hayvan izleyebilirsiniz.
- 12. Test deneme sonra, bir dakika için bir platform olmadan su tankı içine hayvan yerleştirin. Bu hayvan alıyor arama stratejisi analiz için kullanılacak.
- 12 önerilen gibi verileri analiz.
Sonuçlar
Protokol bölümünde belirtilen debi ile fare hipokampta CA1 bölgesinde, içine 0.5 ul lentivirüs enjeksiyon rostral-kaudal ekseninde yaklaşık 1 mm enfekte bir küre verir ve 0.5 medial yan mm ve ön ile ilgili -arka eksen (Şekil 3).
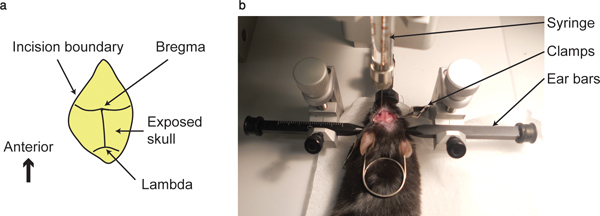
Şekil 1. Bregma noktası ve enjeksiyon cihazı. (A) gösterilir bregma (koronal ve sagital sütür kavşak) ve ...
Tartışmalar
Bir lentivirüs stereotaktik enjeksiyon için hem yukarı veya farklı genler ve miRNA'lar yük atma in vivo değerlendirme için nispeten hızlı bir yöntemdir. Başlıca alternatif daha sonra çok daha zahmetli ve zaman alan bir tekniktir lentivirüs doğrudan enjeksiyon, bir genetik faredir. Buna ek olarak, yukarı regülasyonu, lentivirüs enjeksiyon, yetişkin fare belirli bir zamanda meydana gelir ve çoğu zaman geçici denetimi genetiği farelerde olduğu gibi, geliştirme sırasında sızdırma ol...
Açıklamalar
Yazarlar hiçbir rakip mali çıkarlarının olmadığını beyan ederim.
Teşekkürler
Bu çalışma, Beyin Bilimleri Edmond ve Lily Safra Merkezi (SB dostluk), İsrail Bilim Vakfı (HS Hibe No 378/11,) The Legacy Mirası Biyomedikal Bilim Ortaklık Programı ve Bilimsel için Alman İsrail Vakfı tarafından desteklenmiştir Araştırma ve Geliştirme (GIF) (HS Grant No 1093-32.2/2010,).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Rodent weigh scale | Burtons (UK) | 115-455 | |
| heating pad | FIRstTechnology | DCT-25 | |
| trimming machine | Stoelting | 51465 | |
| stereotact | Stoelting | 51730 | |
| Scalpel and blades | Kent scientific | INS500348 | |
| Harland syringe | Hamilton | 7632-01 | |
| driller | Stoelting | 51449 | |
| digital pump | Harvard apparatus | 704507 | |
| Water tank and platform | Stoelting | 60135 | |
| Reagents | |||
| ketamine | Vetoquinol(Lure France) | 3055503 | |
| domitor | Orion pharma | 107140-10 | |
| Rimadyl | Pfizer animal health | 24751 | |
| moisture ointment - Synthomycine 5% | Rekah Pharmaceutical | 195 | |
| histoacryl | Braun | 112101 | |
| saline | Sigma Aldrich | D8662 | |
Referanslar
- Siegel, G., et al. A functional screen implicates microRNA-138-dependent regulation of the depalmitoylation enzyme APT1 in dendritic spine morphogenesis. Nature Cell Biology. 11, 705-716 (2009).
- Jin, P., et al. Biochemical and genetic interaction between the fragile X mental retardation protein and the microRNA pathway. Nature Neuroscience. 7, 113-117 (2004).
- Simon, D. J. The microRNA miR-1 regulates a MEF-2-dependent retrograde signal at neuromuscular junctions. Cell. 133, 903-915 (2008).
- Consiglio, A. In vivo gene therapy of metachromatic leukodystrophy by lentiviral vectors: correction of neuropathology and protection against learning impairments in affected mice. Nature Medicine. 7, 310-316 (2001).
- Jakobsson, J., Lundberg, C. Lentiviral vectors for use in the central nervous system. Molecular Therapy: The Journal of the American Society of Gene Therapy. 13, 484-493 (2006).
- Berson, A. Cholinergic-associated loss of hnRNP-A/B in Alzheimer's disease impairs cortical splicing and cognitive function in mice. EMBO Molecular Medicine. , (2012).
- Haramati, S. MicroRNA as repressors of stress-induced anxiety: the case of amygdalar miR-34. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 31, 14191-14203 (2011).
- Shaltiel, G., et al. Hippocampal microRNA-132 mediates stress-inducible cognitive deficits through its acetylcholinesterase target. Brain Structure & Function. , 10-1007 (2012).
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92, 7297-7301 (1995).
- Mendenhall, A., Lesnik, J., Mukherjee, C., Antes, T., Sengupta, R. Packaging HIV- or FIV-based lentivector expression constructs & transduction of VSV-G pseudotyped viral particles. J. Vis. Exp. (62), e3171 (2012).
- Nunez, J. Morris Water Maze Experiment. J. Vis. Exp. (19), e897 (2008).
- Bromley-Brits, K., Deng, Y., Song, W. Morris water maze test for learning and memory deficits in Alzheimer's disease model mice. J. Vis. Exp. (53), e2920 (2011).
- Regev, L., Ezrielev, E., Gershon, E., Gil, S., Chen, A. Genetic approach for intracerebroventricular delivery. Proceedings of the National Academy of Sciences of the United States of America. 107, 4424-4429 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır