Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Fare Omurilik Koşullu Gen Manipülasyon için bir Viral Vector Stereotaksik Enjeksiyon
Bu Makalede
Özet
Viral vektörler hedefli gen manipülasyonu için izin verir. Bu arka boynuzu içine, bir viral vektör stereotaksik enjeksiyon, birincil somatosensoriyel afferentleri ve merkezi sinir sistemi nöronları arasındaki sinaptik bir temas önemli yer kullanılarak, koşullu gen ekspresyonu ya da fare omurilik ablasyonu için bir yöntem göstermektedir.
Özet
Bir viral vektörün intraparankimal enjeksiyon nöronlar ya da merkezi sinir sisteminin belirli bölgelerinde farklı popülasyonlarda şartlı gen manipülasyonu sağlar. Biz fare omurilik dorsal boynuz hedeflenen gen ekspresyonu veya susturulması sağlayan bir stereotaksik enjeksiyon tekniği göstermek. Cerrahi prosedür kısa. Bu hayvan ve omurganın uğramamış motilite hızlı kurtarma sağlayan, tek vertebra laminektomi gerektirir. Eğimli cam kanül ile mikroenjektör düşük hız ve kullanım küçük bir vektör süspansiyon hacmi Kontrollü enjeksiyonu doku lezyonu aza indirmek. Vektör lokal bağışıklık cevabında istihdam virüs içsel özelliklerine bağlıdır; bizim deneyim, bir rekombinant adeno-ilişkili virüs kullanıldığında küçük ve kısa sürelidir. Bu tür gelişmiş yeşil floresan proteini gibi bir raportör gen vektör izlenmesi uzaysal dağılımının kolaylaştırır ve etkinliği ve hücresel specitransfeksiyon özgüllük.
Giriş
Fare koşullu gen manipülasyonu Gelişmiş teknolojiler merkezi sinir sisteminde sinaptik yollar ve fonksiyonel bağlantılarının araştırılması için çok yönlü yaklaşımlar sağlar. Transgenlerin östrojen reseptör 1 mutasyona uğramış bir ligand-bağlayıcı etki tanıyan bir repressör veya gen transkripsiyon aktivatörü veya tamoksifen gibi çalışması için dizayn edilebilir bir tetrasiklin kontrollü Transaktivatörü, hareket gibi doksisiklin gibi küçük moleküllü etkileyiciler tarafından düzenlenebilir . Tersinmez transgen değişiklik yaygın deoksiribonükleik asit (DNA) rekombinaz tarafından elde edilir. Cre (nedenleri rekombinasyon) ve FLP (flippase rekombinasyon enzim) eksizyonu, inversiyon veya sırasıyla 1 loxP (crossing x odağı üzerinde, P1) veya Frt (flippase tanınması hedef) siteleri tarafından kuşatılmıştır DNA parçalarının translokasyon katalize. Uygulamalar gen aktivasyonu veya susturulması ve indüklenebilir ribonükleik asit (RNA) girişime dahil 2. Bu tür β-galaktosidaz, alkalin fosfataz ya da enzimatik olarak floresan muhabir Koşullu ifade nöronlar etiket ve bunların topikal organizasyon ve bağlantı 3 incelemek için kullanılabilir. Kuzey Amerika (Büyük ölçekli mutajenez projeler http://www.norcomm.org/index.htm ) ve Avrupa ( http://www.knockoutmouse.org/about/eucomm ) ile fare embriyonik kök hücre klonlarının kütüphaneleri üretiyoruz sonunda tüm fare genomuna kapsayacak koşullu gen hedefleri ve tuzaklar. Bu klonlar elde Fare seçici gen manipülasyonu için nöronların belirli bir nüfus (özel yararlanıcılar veya lokus altında DNA rekombinaz ifade o fare hatları genişleyen bir sayı ile geçilebilir http://nagy.mshri.on.ca/cre_new/index . php ).
Ancak, nöronların veya ilgi belirli bölgelerde ayrı nüfus gen manipülasyonu kısıtlayan genetik ilgi nöron topluluğuna özgü bir organizatörü bilinir değilse yalnız hedefleme veya bölgedeki bütün nöronlar tarafından ifade değil elde edilemez ilgi. Spinal kord, deneysel tasarımlar bir veya iki kraniokaudal kesimlerine gen manipülasyonu mekansal kısıtlanması gerekebilir. Cre veya FLP ifade eden bir viral vektör Stereotaksik enjeksiyonu floxed veya flrted alel denilen, DNA parçalarının loxP veya Frt siteleri tarafından çevrili olduğu farelerde omurilik bölgelere gen rekombinasyon sınırlanmasını sağlayan. Bünye DNA düzenlenmesi aksine, hangi Rekombinaz ifade fare ile melezleme hayvanlardan neden olur, bu strateji aynı zamanda gen aktivasyonu veya susturulması üzerinde zamansal kontrol sağlar. Kodlama Viral vektörler floxed veya transgenlerin correspo ifade farelerde gen manipülasyonu bir ters seçeneği sunuyoruz flörtBir nöron spesifik promotör Rekombinaz aşağı nding. Nöronlara afinite ile Çeşitli rekombinant vektörler 4 mevcuttur. Yüksek kapasiteli (korkak) adenovirüs, adeno-ilişkili virüs, herpes simpleks virüsü ve lentivirüs yaygın nörotropik vektörler kullanılır. Bir araştırma sorusu için uygun olan virüs seçilmesi deneysel tasarım çok önemli bir parçasıdır. Transgen büyüklüğü, doğum şekli, inflamatuar ve toksik yan etkileri 4 düşünülmesi gereken glial hücreleri, enfeksiyon etkinliği, aksine nöronlara enfeksiyon özgüllüğü.
Burada omurilik dorsal boynuz, biz ağrı nörobiyoloji üzerine araştırma koşullu gen regülasyonu için kullandıkları bir tekniktir bir viral vektör stereotaksik enjeksiyon tarif. Dorsal boynuz nosiseptif nöronlar da dahil olmak üzere birincil somatosensoriyel nöronlardan gelen afferent girdi alır. Projeksiyon nöronları onu ifade etmeden önce yerel internöron bilgi işlembeyin 5 dorsal boynuz. Biz yapısal olarak aktif sitomegalovirüs organizatörü altında arttırılmıştır yeşil flüoresan protein (eGFP) ifade eden bir nörotropik rekombinant adeno-ilişkili virüs (rAAV) ile spinal segmental seviyede L4 dorsal boynuz nöron enfeksiyonu gösterir.
Protokol
Açıklanan cerrahi prosedür Columbia Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Kurulu (IACUC) tarafından onaylanmıştır.
1. Ekipman ve Virüs Parçacık Süspansiyon hazırlanması
- Ekipmanı temizleyin ve dezenfekte edin, cerrahi aletler ve vertebra L1 düzeltmek için kullanılacak V çentik sivri sterilize.
- Çekin ve konik cam pipetler. Biz, 40 um arasında bir uç çapı olan ve 20 ° 'lik bir açı ile eğimli olan pipetler kullanır. Cam pipetler sterilize.
- Stereotaksik çerçeve kurma, manipülatör üzerine mikroenjektör enjektör montaj ve kontrol için enjektör bağlayın.
- Sıkıştırma montaj takımı kullanılarak mikroenjektör için cam pipet bir takın.
- Mikroenjektör gelen plenseri ve mineral yağ ile şırınga doldurun. Oil Red O (1 - (2,5-dimetil-4-(2,5-dimethylphenylazo) fenilazo)-2-naftol) kendi v artırmak için mineral yağ ile eklenebilirisibility. Piston takın ve ucu tüm yol kadar itin. Dikkatlice bir hava kabarcığı oluşturmaktan kaçının.
- Bir biyogüvenlik kabine virüs parçacık süspansiyonu hazırlayın. Buz üzerinde donmuş virüs çözülme ve kullanmadan hemen önce, istenen partikül konsantrasyonu tuzlu steril fosfat-tamponlu ile seyreltin.
- Enjektör üzerindeki yuvasına mikroenjektör yerleştirin.
- Küçük bir plastik levha üzerine virus süspansiyonu pipetle 5 ul, örneğin Parafilm. Damla içine cam pipet indirin ve mikroenjektör doldurmak için pistonu çekiniz. Tıkanmasını önlemek için pipet ucunda küçük bir hava kabarcığı oluşturun.
2. Laminektomi
- Tezgah ve dezenfektan ile ısıtma pedi silerek ameliyat alanı hazırlayın.
- Fare anestetize. Biz izofluran ile inhalasyon anestezi kullanmak (% 3 indüksiyon, bakım sırasında% 2 -3% sırasında).
- Sırasında kurumasını gözleri korumak için her gözün üzerine yağ koyunişlem.
- Alt arka fare boyun kürk Tıraş ve böyle klorheksidin veya povidon-iyot ve% 70 etanol gibi bir topikal antiseptik mendil alternatif ile cildi dezenfekte edin. Cerrahi örtü ile aseptik hazırlanmış sitede ayırın ve bupivakain (% 0.25, serum fizyolojik ile sulandırılmış 1:10) ile kesi yeri sızmak.
- Orta hat (2-3 cm) boyunca göğüs kafesinin kaudal sonunda cilt kesilirken ve omurga kapsayan fasya ayırın.
- Omurilik vertebral kolon daha postnatal gelişimi sırasında önce büyümesini durdurur Çünkü, spinal segmentin L4 İlk lomber vertebra (L1) altında yatıyor. Vertebra L1 kaburga son çifti tutan vertebra kaudal yer almaktadır. Belirleyin ve küçük spinal kas ve dorsal yüzeyine yapışan ligament kaldırarak vertebra L1 maruz kalmaktadır.
- Hafif bir Adson forsepsi ile vertebra L1 kaldırın ve tutun. Dorsal Portio kaldırmak için özel bir laminektomi forseps kullanınn vertebra (omurga ve lamina) ve spinal kord teşhir. Omurilik zarar vermekten kaçının.
- Stereotaksik çerçevesinde ısıtma plakası üzerine fare aktarın. Müteakip çalışma esnasında fare sıcaklığı izleyin.
3. Enjeksiyon
- V çentik sivri vertebra L1 Fix. Omur solunum sırasında hareket etmez, böylece ani omurga stabilize olmalıdır.
- Yakın böylece pipet laminektomi sitenin üstünde olduğunu mikroenjektör getir. Eğer pipet çıkmadan virüs süspansiyonu görene kadar pistonu aşağı indirin. Steril pamuk uçlu damlacık çıkarın.
- Maruz omurilik rostral en kısmında pipet ucu yerleştirin. Merkezi posterior median sulkus üzerinde pipet, daha sonra 500 mikron yanal ucu hareket ettirin. Kablosunu ve delinme duramater yüzeyine ucu indirin veya bir unbeveled cam pipet ile çalışıyorsanız, d ponksiyon için eğimli çelik kanül kullanınura. Omurilik içine cam pipet 300 um uç alçaltın.
- 200 nl / dak 'lık bir hızla virüs süspansiyonu 1 ul enjekte edilir.
- Enjeksiyonun sonunda, yavaş yavaş geri çekme pipet önce en az 2 dakika bekleyin.
- Spinal segmentin L4 viral vektör tam dağılımı elde etmek için maruz omurilik kuyruk kısmının en az 3.5 kadar olan adımları 3.3 tekrarlayın. Iki enjeksiyon siteleri hedef bölgede doku hasarı önlemek için rostral ve L4 segment kaudal bulunmaktadır.
4. Yara Kapatma
- Yayın omur V çentik kelepçelerden L1 ve stereotaksik çerçeveden fareyi çıkarın.
- 5.0 vikril ile fasya dikin. Kapalı fasya laminektomi site için kapak sağlar.
- Naylon sütür veya cerrahi zımba ile cildi kapatın.
5. Postoperatif Bakım
- Yumuşak, nonparticular yatak ile bir kurtarma kafes fare aktarın. T yerleştirino rahat nefes için yan. Bu yürüyebilen, tamamen uyanık ve içme başlayana kadar hayvan izleyin.
- Biz, carprofen günlük subkutan enjeksiyon (5.0 mg / kg) ile 72 saat için cerrahi sonrası analjezi sağlar.
- Ilk olarak 3 gün için günlük olarak kontrol cerrahi sonrası iyileşme izleyin, sonra deney kadar her gün ya da 3 gün haftada tamamlandı.
- Yara iyileşmesi tamamlandığında, 7 ila 10 gün operasyon sonrası deri sütürler veya zımbaları çıkarın.
- Deneyin tamamlanmasından sonra, hayvanın Euthanize.
Sonuçlar
Başarılı transfeksiyon getirileri karşı tarafa, ventral boynuz ve dorsal kök gangliyon dorsal boynuz koruyucu enjekte dorsal boynuz (Şekil 1) nöronlar, sağlam gen ekspresyonu.
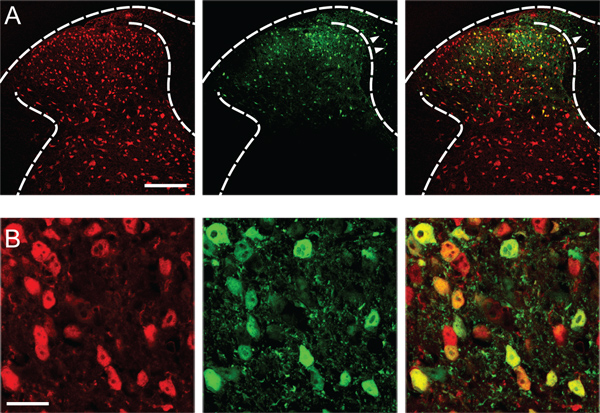
Şekil 1. Dorsal boynuz nöron transfeksiyonu. (A) L4 omurilik, rAAV-EGFP bir stereotaksik enjeksiyon iki hafta sonra (serotip AAV2 / 8/10 9 genom kopyalarının sol arka boynuzu flüoresan rapo...
Tartışmalar
Stereotaksik vektör enjeksiyon, nörodejenerasyon 11 önlenmesi veya tedavisi için yaralanma 9,10, veya gen tedavisi rejenerasyon sırasında 6,7 veya optogenetic disseksiyon 8, akson kılavuz yayılan virüs transsinaptik dayalı bu tür nöronal ağ eşleme gibi uygulamalar için, omurilik nöronları hedefleme sağlar 12. Viral vektörler somatosensoriyel, motor ve otonomik yolların 9,10,13-15 çalışma omurilikte gen manipülasyonu içi...
Açıklamalar
Yazarlar hiçbir rakip mali çıkarlarının olmadığını beyan ederim.
Teşekkürler
Biz teknik yardım için Bakhos A. Tannous, Ph.D., rAAV-eGFP vektör bize sağlamak için Massachusetts Genel Hastanesi, Charlestown, Massachusetts, Nörobilim Merkezi Vektör Geliştirme ve Üretim Direktörü, ve John Whang ederim. Bu çalışma Nörolojik Bozukluklar ve İnme Ulusal Enstitüsü ödenekle R01 NS050408 (JS için) desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Malzeme Adı | Şirket | Katalog Numarası | |
| Spinal taban plakası | David Kopf Instruments | 912 | |
| Küçük hayvan stereotaksik alet | David Kopf Instruments | 900 | |
| Fare gaz anestezi kafa tutucu | David Kopf Instruments | 923-B | |
| Ayarlanabilir taban bağlar | David Kopf Instruments | 982 | |
| V çentik sivri | David Kopf Instruments | 987 | |
| Küçük hayvan sıcaklık kontrol sistemi | David Kopf Instruments | Tcat-2LV | |
| Adson forsepsi | Güzel Bilim Araçları | 11006-12 | |
| Laminektomi forseps | Güzel Bilim Araçları | 11223-20 | |
| SYS-Micro4 Controller ile UltraMicroPump (bir) | Dünya Hassas Aletler | UMP3-1 | |
| Mikroenjektör, 65RN | Hamilton | 7633-01 | |
| RN sıkıştırma uydurma, 1 mm | Hamilton | 55750-01 | |
| Borosilikat cam kapilerleri | Dünya Hassas Aletler | 1B100F-4 | |
| Microgrinder | Narishige | EG-44 |
Referanslar
- Lewandoski, M. Conditional control of gene expression in the mouse. Nature Reviews Genetics. 2, 743-755 (2001).
- Couto, L. B., High, K. A. Viral vector-mediated RNA interference. Curr. Opin. Pharmacol. 10, 534-542 (2010).
- Luo, L., Callaway, E. M., Svoboda, K. Genetic dissection of neural circuits. Neuron. 57, 634-660 (2008).
- Davidson, B. L., Breakefield, X. O. Viral vectors for gene delivery to the nervous system. Nature Reviews Neuroscience. 4, 353-364 (2003).
- Todd, A. J. Neuronal circuitry for pain processing in the dorsal horn. Nature Reviews Neuroscience. 11, 823-836 (2010).
- Wall, N. R., Wickersham, I. R., Cetin, A., De La Parra, M., Callaway, E. M. Monosynaptic circuit tracing in vivo through Cre-dependent targeting and complementation of modified rabies virus. Proceedings of the National Academy of Sciences of the United States of America. 107, 21848-21853 (2010).
- Lo, L., Anderson, D. J. A Cre-dependent, anterograde transsynaptic viral tracer for mapping output pathways of genetically marked neurons. Neuron. 72, 938-950 (2011).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nature Methods. 8, 745-752 (2011).
- Tang, X. Q., Heron, P., Mashburn, C., Smith, G. M. Targeting sensory axon regeneration in adult spinal cord. J. Neurosci. 27, 6068-6078 (2007).
- Cameron, A. A., Smith, G. M., Randall, D. C., Brown, D. R., Rabchevsky, A. G. Genetic manipulation of intraspinal plasticity after spinal cord injury alters the severity of autonomic dysreflexia. J. Neurosci. 26, 2923-2932 (2006).
- Passini, M. A., et al. CNS-targeted gene therapy improves survival and motor function in a mouse model of spinal muscular atrophy. The Journal of Clinical Investigation. 120, 1253-1264 (2010).
- Lutz, C. M., et al. Postsymptomatic restoration of SMN rescues the disease phenotype in a mouse model of severe spinal muscular atrophy. The Journal of Clinical Investigation. 121, 3029-3041 (2011).
- Chen, S. L., et al. dsAAV type 2-mediated gene transfer of MORS196A-EGFP into spinal cord as a pain management paradigm. Proc. Natl. Acad. Sci. U.S.A. 104, 20096-20101 (2007).
- South, S. M., et al. A conditional deletion of the NR1 subunit of the NMDA receptor in adult spinal cord dorsal horn reduces NMDA currents and injury-induced pain. J. Neurosci. 23, 5031-5040 (2003).
- Tappe, A., et al. Synaptic scaffolding protein Homer1a protects against chronic inflammatory pain. Nat. Med. 12, 677-681 (2006).
- Colle, M. A., et al. Efficient intracerebral delivery of AAV5 vector encoding human ARSA in non-human primate. Human Molecular Genetics. 19, 147-158 (2010).
- Carbajal, K. S., Weinger, J. G., Whitman, L. M., Schaumburg, C. S., Lane, T. E. Surgical Transplantation of Mouse Neural Stem Cells into the Spinal Cords of Mice Infected with Neurotropic Mouse Hepatitis Virus. J. Vis. Exp. (53), e2834 (2011).
- Snyder, B. R., et al. Comparison of adeno-associated viral vector serotypes for spinal cord and motor neuron gene delivery. Hum. Gene Ther. 22, 1129-1135 (2011).
- Towne, C., Pertin, M., Beggah, A. T., Aebischer, P., Decosterd, I. Recombinant adeno-associated virus serotype 6 (rAAV2/6)-mediated gene transfer to nociceptive neurons through different routes of delivery. Mol. Pain. 5, 52 (2009).
- Kaplitt, M. G., et al. Long-term gene expression and phenotypic correction using adeno-associated virus vectors in the mammalian. 8, 148-154 (1994).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır