Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Çip üzerinde Stres Kaynaklı Antibiyotik Duyarlılık Testi
Bu Makalede
Özet
Hızlı antibiyotik duyarlılık testi için mikroakışkan bir platform geliştirdik. Sıvı, mikroakışkan bir kanalın dibinde hareketsiz hale getirilen bakteriler üzerinde yüksek hızlarda geçirilir. Stres ve antibiyotik varlığında, hassas bakteri suşları hızla ölür. Ancak dirençli bakteriler bu stresli koşullarda hayatta kalabilirler.
Özet
Strese dayalı bir ortamda antibiyotik duyarlılığı testi için hızlı bir mikroakışkan yöntem geliştirdik. Sıvı, mikroakışkan bir kanalın dibinde hareketsiz hale getirilen bakteriler üzerinde yüksek hızlarda geçirilir. Stres ve antibiyotik varlığında, hassas bakteri suşları hızla ölür. Ancak dirençli bakteriler bu stresli koşullarda hayatta kalabiliyor. Bu yöntemin arkasındaki hipotez yenidir: antibiyotiklerin hedefi olan biyokimyasal yolların stres aktivasyonu antibiyotik duyarlılık testini hızlandırabilir. Standart antibiyotik duyarlılık test yöntemleri ile karşılaştırıldığında, antibiyotik uygulaması sırasında hız sınırlayıcı adım - bakteriyel büyüme - atlanır. Yöntemin teknik uygulaması standart teknikler ve yenilikçi yaklaşımların bir kombinasyonundadır. Yöntemin standart bölümleri arasında bakteri kültürü protokolleri, polidimetilsiloksan (PDMS) içinde mikroakışkan kanalların tanımlanması, floresan ile hücre canlılığı izleme ve bakteri sayımı için toplu görüntü işleme yer almaktadır. Yöntemin yenilikçi kısımları, mekanik stres uygulaması için kültür ortam akışının kullanılması, bakterilere zarar vermek ancak öldürmemek için enzimlerin kullanılması ve bakteri bağlanması için mikroarray substratlarının kullanılmasıdır. Geliştirilen platform antibiyotik ve nonantizyotik ile ilgili ilaç geliştirme ve testlerinde kullanılabilir. Standart bakteriyel süspansiyon deneylerine kıyasla, ilacın etkisi kontrollü zaman periyotlarında tekrar tekrar açılıp kapatılabilir. Aynı bakteri popülasyonunun tekrarlayan gözlemi aynı deney boyunca mümkündür.
Giriş
Bakteri direncinin artması, son çare ilaçlarımızı korumak için hızlı fenotip bazlı antibiyotik duyarlılık testlerine olan ihtiyacı yoğunlaştırmaktadır. Standart duyarlılık testleri, tamamlanması birden fazla (8-24) saat süren antibiyotiklerin varlığında bakteri üreme inhibisyonunu temel alır. Antibiyotiklerin eylemini hızlandırmak için biyosintetik yolların stres aktivasyonuna dayanan mikroakışkan bir platformda yeni bir antibiyotik duyarlılık testi geliştirdik.
Mikroakışkan ölçekte antibiyotik duyarlılık testleri, az sayıda bakteri gerektirdiğinden etkili numune kullanımının avantajını taşır. Ayrıca, mikroakışkan cihazlar birden fazla örnek birden fazla koşulda test etmek için çoklayıcı olabilir1,2. Son zamanlarda, antibiyotik duyarlılık testi için bir dizi mikroakışkan yöntem bildirilmiştir3-9. Bu yöntemlerde, bakteriler nano ve picoliter damlacıkları içinde yetiştirilir3,7Mikroakışkan kanalın tam hacminde4-6,8veya tek bakteri olarak kanalın alt yüzeyine elektriksel olarak lokalize9. Bu testler mikroakışkan kanallarda yapılmasına rağmen, hepsi geleneksel yöntemlere benzer antibiyotiklerin varlığı ve yokluğunda mikrobiyal büyümeyi izler. Büyüme ölçümleri optik yoğunluk, pH'a duyarlı boyalar veya parlak alan/faz kontrastı veya floresan görüntüler aracılığıyla alınır. Bu testlerin bazıları geleneksel yöntemlerden daha hızlı olsa da, her biri pasif olarak antibiyotik direncini tespit ederler. Başka bir deyişle, bu yöntemler hala kullanıcının son okuma olarak bakteri üremesini beklemesini gerektirir.
Buna karşılık, antibiyotiğe duyarlı biyokimyasal yolları etkinleştirmek için kesme ve enzimatik stresin bir kombinasyonunu kullanan bir yöntem geliştirdik10. Stresli bakterilere bu antibiyotiklerle meydan okumak daha hızlı bir duyarlılık testi oluşturur. Antibiyotiğe dirençli bakteriler stresli koşullara dayanabilir. Öte yandan, hassas bakteriler, kombine stresler tarafından hızla öldürülür. Floresan ölü hücre lekesi kullanılarak mikroskopi ile ölçülen bir saat sonra hücre ölüm yüzdesi, bakterilerin fenotipini tanımlar (dirençli vs. duyarlı).
Yöntemimizin başarılı bir şekilde uygulanması için bakterilerin mikroakışkan kanalın alt yüzeyinde hareketsiz hale getirilmelidir. Bu şekilde bakteriler çeşitli streslere maruz kalabiliyor ve aynı anda tek bir düzlemde mikroskop altında görüntülenebiliyor. Bakterilerin hareketsiz hale getirilmesi için kaplamalı mikroskop cam kaydırak kullanılır. Slayt, üretici tarafından spesifik olmayan protein bağlama için epoksit grupları ile önceden kaplanmıştır. Bu epoksitlerin bakteriyel yüzey proteinlerine spesifik olmayan bağlanması, bakterileri slayt yüzeyine katarak kovalentli olarak bağlar.
Suşlar, antibiyotik yokluğunda (kontrol) ve mevcudiyetinde (deney) aynı koşullar altında (kesme + enzimatik stres) test edilir. Her kanalın faz kontrastı ve floresan mikroskop resimleri bir saat boyunca her iki dakikada bir otomatik olarak alınır. Daha sonra deney kanalındaki ölü bakterilerin yüzdesi kontrol kanalında bulunanlarla karşılaştırılarak direnç tanımlamaları yapılır. Bir saat sonra, hücre ölüm yüzdesi% 1'den büyük olan bir örnek duyarlı olarak kabul edilirken,% 0.5'ten az ölüm direncin göstergesidir. Bu iki kesme arasına giren yüzdeler belirsiz olarak kabul edilir ve örnek tekrar test edilmelidir.
Mikroakışkan kanallar, mikroakışkan cihazlar için tercih edilen bir malzeme olan PDMS'de tanımlanır11. PDMS, biyouyumlu, atıl, gazlara geçirgen ve sıvılara geçirgenliği düşük, çok çeşitli dalga boylarında optik olarak şeffaftır; bu nedenle bu deneyler için çok uygundur.
Mekanik/kesme stresi, oda sıcaklığı ortamlarının hareketsiz bakteriler üzerinden akmasıyla oluşur. (Not: Ortamın 37 °C'ye kadar ısınmasının test sonucu üzerinde önemli bir etkisi yoktur.) Otomatik şırınga pompaları, 6,25 kPa kesme kuvveti veya 6.000 sn-1kesme hızı vermek için 1 ml/dk akış hızında mikroakışkan kanallardan (200 μm x 400 μm) medyayı (ölü hücre lekesi +/- antibiyotik ve isteğe bağlı enzymatic stressörler içerir) zorlar. Bu oran, Staphylococciüzerinde daha önce çalışılan kesme gerilmelerine eşittir veya aşar.
Lysostaphin enzimi, Staphylococcus hücre duvarına doğrudan zarar verdiği için ön deneyler için seçildi. Lisostafin konsantrasyonu (0.7 ng/ml) bakteri hücre duvarı hasarına neden olmak için yeterliydi, ancak deneyin zaman diliminde antibiyotik olmadan bakteri hücresi ölümüne neden olmak için yeterli değildi. Lysostaphin bakteriyel duyarlılığın doğru tanımlanması için gerekli değildir, ancak sonucu artırarak hassas suşlarda hücre ölümünün artmasına yol açar. Buna karşılık, kesme stresi tahlil fonksiyonu için kritik öneme sahiptir. Metisiline duyarlı Staphylococcus aureus suşları akış yokluğunda lysostaphin ve oksasilin ile tedavi edildiğinde, deney boyunca hücre ölümü kaydedilmemektedir.
Hücre canlılığı floresan ölü hücre lekesi ile izlenir12. Boyanın seçimi, sadece hasarlı hücreleri seçici olarak lekeleme yeteneğine, canlı hücrelere olan sarhoşluğuna ve ek adımlar olmadan hücre ortamına doğrudan eklenmesine izin veren düşük arka plan floresansına dayanıyordu. 0.25 μM floresan boya konsantrasyonunun seçimi, floresan ekscitasyon ışığına 1.6 sn maruz kalma süresi boyunca kabul edilebilir sinyal seviyeleri elde etmekti.
Ön çalışmalarımızda beta-laktam, oksasilin kullanıldı. Metisiline dirençli S. aureus (MRSA) türleri oksilasiline karşı dirençlidir ve deneyin zaman diliminde kayda değer bir hücre ölümü göstermez. Ön çalışmalarda 50 μg/ml konsantrasyon belirlendi. Daha düşük antibiyotik konsantrasyonları dirençli ve hassas suşlar arasında daha az ayrım yaparken, daha yüksek konsantrasyonlar deneysel sonuçlarda kayda değer bir farka neden olmadı.
Daha önce bakteriyel hücre duvarı13'ü doğrudan etkileyen mekanik ve enzimatik stresleri hücre duvarı biyosentezini inhibe eden bir antibiyotikle birleştiren bir testin başarılı gelişimini bildirdik14,15. Bu ilke kanıtı deneyleri MRSA ve metisiline duyarlı S. aureus (MSSA) panelinde gerçekleştirildi. Bununla birlikte, uygun deneysel parametrelerin seçimi ile yöntemimiz birden fazla bakteri türüne ve birden fazla antibiyotik sınıfına uygulanmalıdır.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. PDMS Katmanını Yapın (Şekil 1)
- PDMS ve kürleme maddesini 10:1 oranında kuvvetlice karıştırın. Kabarcıkları çıkarmak için, viskoz karışımı oda sıcaklığında 1 saat boyunca bir vakum odasında gazdan arındırın.
- Bir ölçekte, PDMS'yi alüminyum kalıbın üzerine yavaşça dökün. Merkezden dökün ve kalıbı düz tutun. Pimleri açık bıraktığından emin ol. Hedef ağırlığa ulaşıldıktan sonra dökmeyi durdurun.
Kalıbımız 4 g PDMS ve 0,4 g kür reaktifi gerektirir. - Kalıbı bir fırının içinde düzleştirme ve geceleme 37 °C'de kürleme.
Alternatif kürleme süreleri 60 °C'de 2 saat veya 90 °C'de 1 saattir. - Kürlenmiş PDMS tabakasını kalıbın kenarı boyunca parçalara ayrıştırın ve bir çift kümesle kalıp yüzeyinden dikkatlice soyun. Kalıp yüzeyini % 70 etanol ve bir Q ucu ile temizleyin.
2. Akış Hücresini Şekil 2'ye Göre Monte Edin
PDMS'nin cam kaydıraklarla standart montajı, pdms ve mikroskop cam kaydırağı arasında sızdırmaz bağlanma sağlayan her iki yüzeyin oksijen plazması tedavisi yoluyla yapılır. Sunulan protokolde plazma tedavisi cam slayttaki kimyasal kaplamayı yok edecekti. Bu nedenle slayt plazma tedavisi yerine basınçla kapatılmış.
- Cam pencereyi akış hücresi cebine yerleştirin.
- Aktif tarafı yukarıda olacak şekilde akış hücresinin cebinin içindeki cam pencerenin üzerine kaplamalı bir cam slayt yerleştirin ve PDMS katmanını üzerine kanallar bakacak şekilde yerleştirin. PDMS slaydını, kanal girişlerini metal plakadaki deliklerle hizalanacak şekilde yerleştirin. Havayı katmanların arasından yavaşça dışarı itin.
- PDMS/cam slayt montajını, PDMS'nin cam pencereye bakana kadar çevirin. PDMS kanal girişlerini metal plakadaki deliklerle örtüş.
- Basınç plakasını üzerine yerleştirin ve vidaları sıkın.
- Birleştirilmiş akış hücresini mikroskobun altına yerleştirin. Mikroskop büyütmeyi 60X olarak ayarlayın ve kanal konumlarını önceden hizalayın.
3. Kütük Faz Bakterilerini Hazırlayın
- Deneyden bir gün önce: Bakteri kolonisi ile% 2 NaCl (MH2) içeren 50 ml Mueller Hinton suyu aşıla. 37 °C'de bir gecede 250 rpm'de çalkalayın.
Açıklanan kurulum için bir veya iki bakteri türü bir deneyde incelenebilir. - Deneyden önce: 50 μl gece bakteri kültürünü 50 ml MH2 ortamına karıştırın. Bakterilerin kütük fazında olduğundan emin olmak için 37 °C'de 3 saat boyunca 250 rpm'de çalkalayın.
4. Deneysel Çözüm Bileşenlerini İhtiyaç Duyulmadan En Az 10 Dakika Önce Isıtın
- Floresan boyayı (5 mM stok) ve lisostaphin'i (10 μg/ml stok) oda sıcaklığında çözün.
- Oksilasin tozlarını oda sıcaklığına ısıtın.
5. Bakteri Süspansiyonu Hazırlayın ve Yükleyin
- 3 saat alt kültürün bitiminden sonra: 2 dakika boyunca 1.650 x g'da 10 ml bakteri kültürü ve santrifüj alın.
- 1 ml taze MH2 ortamlarında süpernatant ve resuspend bakterileri çıkarın.
- 1 ml Luer kilit şırındıcına kısa bir boru uzunluğu takın. Şırınd boruyu 1 ml ortamla yıkayın. Bakteriyel süspansiyonu çekerken hava kabarcıklarını önlemek için boruda biraz medya bırakın.
- Şırındağa 0,7 ml bakteri türü 1 yükleyin. Akış hücresinin iki kanalını bakteri tip 1 ile doldurun. Sıvının ca'dansonra kanalın diğer tarafında görünmesini izleyin. 150 μl.
Kanalın şeffaflığı bakterilerle dolduğu için değişir. - Birden fazla bakteri türüyle denemeler yapıyorsanız, bakteri tipi 2 için yükleme prosedürünü akış hücresinin kalan iki kanalına tekrarlayın.
- Akış hücresini, bakteriyel çökeltme ve slayt yüzeyine bağlanmaya izin vermek için 45 dakika boyunca 37 °C'de inkübatörün içine yerleştirin.
6. Deneysel Çözümleri Hazırlayın ve Yükleyin
- 14 μl floresan boya stoğunu (5 mM) ve 126 μl MH2 ortamı karıştırarak 140 μl 0,5 mM floresan boya çözeltisi hazırlayın.
- 250 μg/ml oksasilin nihai konsantrasyonu elde etmek için 40 ml MH2 ortamlarında 10 mg oksasilin seyreltin.
- 0,25 μM floresan boya ve 0,7 ng/ml lisostafin son konsantrasyonlarında 130 ml kontrol çözeltisi hazırlayın. Bunu yapmak için, 65 μl floresan boya (0,5 mM), 9,12 μl lysostaphin stoğu (10 μg / ml) ve 130 ml MH2 ortam karıştırın.
- Son konsantrasyonlarda 0,25 μM floresan boya, 0,7 ng/ml lisostafin ve 50 μg/ml oksasilin içeren 130 ml antibiyotik çözeltisi hazırlayın. Bunu yapmak için, 65 μl floresan boya (0,5 mM), 9,12 μl lysostaphin stoğu (10 μg/ml), 26 ml oksasilin (250 μg/ml) ve 104 ml MH2 ortam karıştırın.
- İki adet 60 ml şırınnayı kontrol çözeltisi ve iki adet 60 ml şırındıcı antibiyotik çözeltisi ile doldurun. Reaktiflerin hafif kaynaklı bozulmasını önlemek için çözeltileri alüminyum folyoya sarılmış tutun.
Borunun yıkanması nedeniyle kaybı hesaba katmak için şırınnaları aşırı doldurun. - Şırındlara dokunarak hava kabarcıklarını çıkarın. Giriş borusunu deneysel çözelti ile ucuna takın ve doldurun.
- Şırınnaları pompaya monte edin. Şırınnayı önce en küçük hacme yerleştirin, ardından piston konumunu kilitleyin. Şırınnaların geri kalanını pompaya takın, pistonlarını gerektiği gibi sıkın.
- Pompa hızını 1 ml/dk'ya ve pompa hacmini 60 ml'ye ayarlayın. Tüm şırınnalardan sabit bir sıvı akışı görülene kadar pompa ile bir yıkama yapın.
7. Akış Hücresini Mikroskop Altında Kurun
- Akış hücresini santrifüjden çıkarın ve mikroskop aşamasına monteederek (Şekil 3).
- Giriş/çıkış borularını akış hücresi kanallarının her birine bağlayın (kanal başına bir giriş/bir çıkış).
Çıktının dört farklı kap halinde toplanması, tek tek kanal çıkış hacimlerinin ölçülenimine olanak tanır.
8. 60 Dakikalık Deneyi Çalıştırın
- Adım 2.5'ten önceden hizalanmış pozisyonları kontrol edin. Mikroskop görüş alanı kanalda ortalanmazsa ve/veya odak dışındaysa, ayarları yapın ve yeni konumları kaydedin.
Yüklü bakterilerin yüksek yoğunluğu nedeniyle akış başlamadan önce hassas odaklama mümkün olmayabilir. - Faz kontrast alma süresini 10 milisaniyeye ve floresan alım süresini 1.600 milisaniye olarak ayarlayın.
- Akışı başlatmadan önce her pozisyon için faz kontrastı ve floresan görüntüler elde edin.
Bu, yüklenen bakteri yoğunluğunun nitel bir tahminini verir. - Sıvı akışını başlatın ve mikroskobun kanalların altına odaklanıp odaklanmadığını hemen kontrol edin.
- Akışın ilk dakikasında hedef alanların faz kontrastını ve floresan görüntülerini alın.
- 60 dakikalık akış gerçekleşene kadar ilk görüntü kümesinden sonra her 2 dakikada bir görüntü alın. Gerektiğinde yeniden odaklan.
9. Akış Hücresini Dezenfekte Edin
- Bir beherde %10 çamaşır suyu çözeltisi yapın (100 ml). 4 x 20 ml şırındyakları 10 ml karışımla doldurun. Şırınnaları hata ayıklayın ve akış hücresine takın.
Kanalların bakterilerden arındırılması ~1-2 dakika sürecektir. - Pompa hızını 1 ml/dk'ya ve pompa hacmini 3 ml'ye ayarlayın. 3 dakika koş.
- 4 x 60 ml şırınnayı 60 ml DI su ile doldurun. Şırınnaları hata ayıklayın ve akış hücresine takın.
- Pompa hızını 1 ml/dk'ya ve pompa hacmini 30 ml'ye ayarlayın. 30 dakika koş.
- Mikroskop altında kanal temizliğini izleyin.
- Akış hücresini sökün. Kullanılan epoksi slaydını atın. Akış hücresi bileşenlerini DI suyunda 20 dakika bekletin.
10. Görüntüleri Analiz Edin ve Veri Oluşturun
- Her görüntüdeki bakteri sayısını sayın.
Açık erişim yazılımı CellProfiler toplu görüntü işleme gerçekleştirmek için kullanılır16. CellProfiler yordamının üst düzey anahattı Tablo 1'de özetlenmiştir. Faz kontrast görüntüsünde (Np)bulunan bakteri sayısı toplam bakteri sayısını verir. Floresan görüntüde (Nf)görülebilen bakteri sayısı ölü bakteri sayısını verir. - Normalleştirilmiş bakteri hücre ölüm yüzdesini zamanın bir fonksiyonu olarak hesaplayın.
- Tek tek görüntüler için Nf ve Np'yi veri analizi yazılımına aktarın.
- Her kanaldaki ölü bakterilerin fraksiyonunu t = T'deki fraksiyonun (Nf / Np)verdiği belirli bir zaman noktasında hesaplayın.
- Hem kontrol hem de deneysel kanallar için deneyin başında bulunan ölü bakterilerin fraksiyonunu çıkarın (t = 1 dk).
- Kontrol kanalında bulunan ölü bakterilerin fraksiyonunu, aşağıdaki denklemle her zaman noktasında deneysel kanalda bulunandan çıkarın:
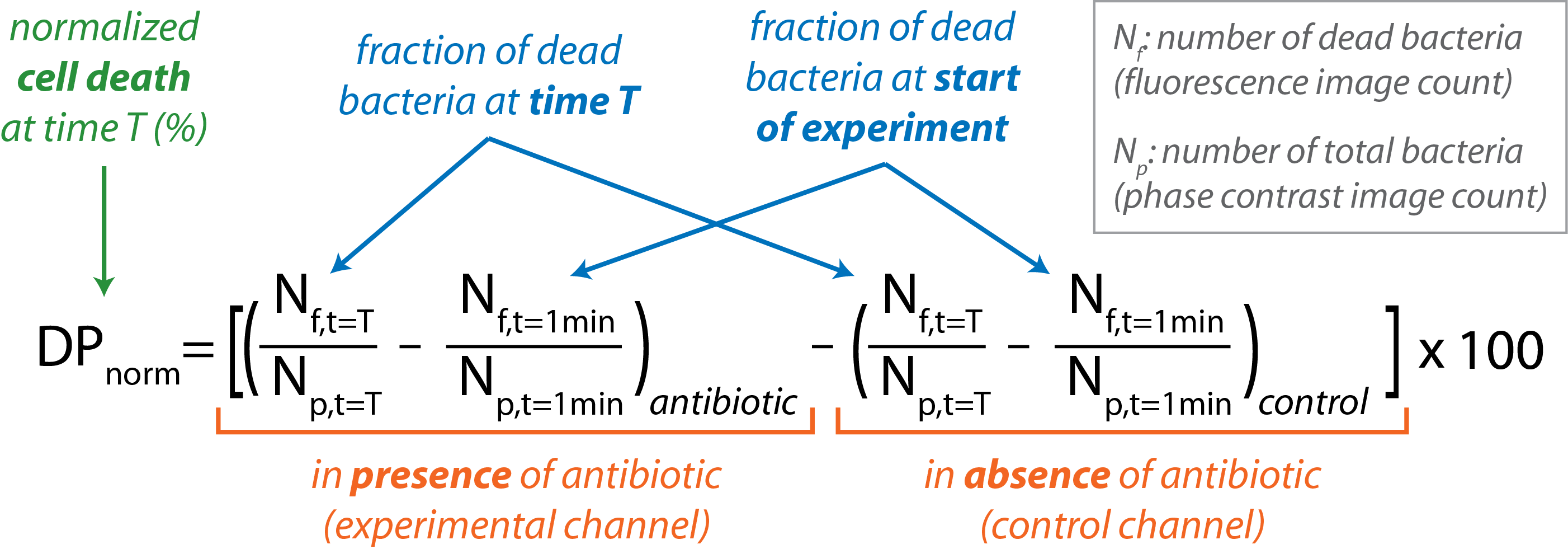
- Grafik DPnorm ve denemenin seyri için t.
Hücre ölüm yüzdesi %1'den büyük olan bir örneğin hassas kabul edildiğini, %0,5'ten az ölümün ise direncin göstergesi olduğunu unutmayın. Bu iki kesme arasına giren yüzdeler belirsiz olarak kabul edilir ve örnek tekrar test edilmelidir. - Farklı denemelerden elde edilen sonuçları özetlemek ve çözümlemek için bir elektronik tablo kullanın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Şekil 4'te sunulan veriler, antibiyotik içeren bir mikroakışkan kanalda hassas bir Staphylococcus aureus suşunun zaman içinde yanıtını göstermektedir. 1 dakikada ve 1 saat deneyinin sonunda elde edilen faz kontrast görüntüleri Şekil 4A ve B'degösterilmiştir. Analiz edilen 1 saat verileri Şekil 4C'de kırmızı ile vurgulanan bakterilerle gösterilmiştir (toplam 5.828). İlgili floresan görüntüler Şekil 4D<...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Sunulan protokol, metisiline duyarlı ve metisiline dirençli Staphylococcus aureus suşları10ile yapılan bir dizi deneyde doğrulandı ve optimize edildi. Bu nedenle, bu protokol değiştirilmeden, bakteri hücre duvarı biyosentezini etkileyen etki mekanizmalarına sahip diğer S. aureus suşları ve diğer antibiyotikler için doğrudan uygulanmalıdır. S. aureus dışındaki bakteri türleri stres parametrelerinde değişiklik gerektirebilir: çözünür (enzymatic) ve mekanik...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Mikroakışkan yöntem patent beklemede: Sauer-Budge A, Sharon A, Kalaşnikof M, Wirz H, mucitler; Bakteriyel Antibiyotik Direncinin/Duyarlılığının Hızlı Tespiti için Yöntem ve Cihaz PATENT PCT/US10/33523.
Teşekkürler
Fraunhofer Üretim İnovasyon Merkezi'ndeki mühendislere ve öğrencilere teşekkür ediyoruz. Deneysel sistemin tasarımına, işlenmesine ve otomasyonuna yardımcı olduğu için Andreas Prinzen, Holger Wirz, Doug Foss, David Chargin ve Dr. Sudong Shu'ya teşekkür ederiz. Deneysel protokollerin test ve veri toplama konusundaki yardımları için Julia Kuckartz, Melanie Zimmermann, Niko Kraetzmar, Tim Gumbel, Josh Villanueva, Minori Shimizu ve Katarzyna Kuliga'ya teşekkür ederiz. CellProfiler'deki görüntü analizi rutininin geliştirilmesine yardımcı olmak için Harvard ve MIT Geniş Enstitüsü Görüntüleme Platformu'ndan Dr. Anne E. Carpenter ve Mark-Anthony Bray'i kabul ediyoruz. Açıklanan proje kısmen Ulusal Alerji ve Bulaşıcı Hastalıklar Enstitüsü'nden R21AI079474 ve 1R01AI101446 Ödülleri tarafından desteklendi. İçerik sadece yazarların sorumluluğundadır ve Ulusal Alerji ve Bulaşıcı Hastalıklar Enstitüsü'nün veya Ulusal Sağlık Enstitülerinin resmi görüşlerini temsil etmek zorunda değildir. Proje Fraunhofer USA tarafından da desteklendi.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| SYTOX Green | Invitrogen Corporation | S7020 | Dead cell fluorescence stain |
| Bovine Serum Albumin (BSA) | Sigma Aldrich, Inc | A9418-5G | Used for lysostaphin storage |
| Sodium Acetate | Sigma Aldrich, Inc | S8750-500G | Used for lysostaphin storage |
| Lysostaphin | Cell Sciences | CRL309A | Arrives as 1 mg solid. For storage: Dissolve in 20 mM sodium acetate. Mix with BSA solution to final concentration of 1% BSA and 100 µg/ml lysostaphin for storage |
| Oxacillin salt | Sigma Aldrich, Inc | 28221-1G | Antibiotic |
| Mueller Hinton Broth | Fisher Scientific | DF0757-17-6 | |
| Sodium chloride | Sigma Aldrixh | S3014-500G | 2% added to Mueller-Hilton broth prior to autoclaving |
| 1 ml, Luer-lock syringe | BD (Beckton, Dickinson and Comp.) | 14-823-2F | |
| 2 oz, Luer-lock syringe | BD (Beckton, Dickinson and Comp.) | 309653 - 60 mL | Overfill to ~65 ml |
| Microscope | |||
| Inverted Fluoresccence Microscope Olympus IX-70 | Cambridge Scientific | 9349 | |
| 60X, Fluorescence/Phase contrast objective | Olympus Corp. | LCPlan F1 60x/0.70 Ph2 | |
| Retiga 12-bit monochrome CCD camera | QImaging | RET-4000R-F-M-12-C | |
| Microscope automation | |||
| Shutters phase contrast/fluorescence | PRIOR Scientific | H204/H202 | |
| X/Y Stage | PRIOR Scientific | H107AENN | |
| Focus motor | PRIOR Scientific | H122 | |
| Joystick for XYZ control | PRIOR Scientific | CS152EF | |
| Proscan Controller | PRIOR Scientific | H3-XY2 | |
| Image Acquisition Software | Fraunhofer CMI | ||
| Flow Cell Assembly and PDMS | |||
| Flow Cell | BU Scientific Instruments Facility/Fraunhofer CMI | 3333-1044 | Engineering drawings were produced by Fraunhofer CMI |
| Glass window | Fraunhofer CMI | 3333-1054 | Glass window was cut to the proper size at Fraunhofer CMI |
| BOROFLOAT Window 50 mm x 50 mm | Edmund Optics Inc. | NT48-543 | |
| Sealing plate | BU Scientific Instruments Facility | 3333-1045 | |
| Epoxide glass slide | Arrayit Corporation | SuperEpoxy 2 | |
| PDMS master | Fraunhofer CMI | 3333-1053 | Master machined in aluminum or brass with UPM-0005 (ultrapresicion fly-cutting machine) |
| PDMS slide design | Fraunhofer CMI | 3333-1053 | |
| Tubing | |||
| Nut, Super flangeless Tinytight, headless, 1/16 in, PEEK, green | IDEX Health Science | M-644-03 | Flow cell inputs/outputs are tapped for this ferrule |
| Ferrule, Tinytight, 1/16 in, 6-40, .030 in TH, PEEK w/ SS lock ring, black | IDEX Health Science | M-657 | |
| Nut, Super flangeless Tinytight, headless, 1/16-1/32 in, 1/4-28, PEEK, natural | IDEX Health Science | P-255 | |
| Ferrule, Super Falngeless, 1/16 in, Tefzel (ETFE), yellow | IDEX Health Science | P-259 | Fits Luer-lock adapter |
| Tubing, Teflon FEP, .030 in x 1/16 in x 20 ft, green | IDEX Health Science | 1520G | |
| Adapter, quick connect female Luer to female 1/4-28, PEEK, red | IDEX Health Science | P-658 |
Referanslar
- Mairhofer, J., Roppert, K., Ertl, P. Microfluidic systems for pathogen sensing: a review. Sensors. 9, 4804-4823 (2009).
- Yager, P., et al. Microfluidic diagnostic technologies for global public health. Nature. 442, 412-418 (2006).
- Boedicker, J. Q., Li, L., Kline, T. R., Ismagilov, R. F. Detecting bacteria and determining their susceptibility to antibiotics by stochastic confinement in nanoliter droplets using plug-based microfluidics. Lab Chip. 8, 1265-1272 (2008).
- Cao, J., et al. Uncovering toxicological complexity by multi-dimensional screenings in microsegmented flow: modulation of antibiotic interference by nanoparticles. Lab Chip. 12, 474-484 (2012).
- Chen, C. H., et al. Antimicrobial susceptibility testing using high surface-to-volume ratio microchannels. Anal. Chem. 82, 1012-1019 (2010).
- Churski, K., et al. Rapid screening of antibiotic toxicity in an automated microdroplet system. Lab Chip. 12, 1629-1637 (2012).
- Eun, Y. J., Utada, A. S., Copeland, M. F., Takeuchi, S., Weibel, D. B. Encapsulating bacteria in agarose microparticles using microfluidics for high-throughput cell analysis and isolation. ACS Chem. Biol. 6, 260-266 (2011).
- Kim, K. P., et al. In situ monitoring of antibiotic susceptibility of bacterial biofilms in a microfluidic device. Lab Chip. 10, 3296-3299 (2010).
- Peitz, I., van Leeuwen, R. Single-cell bacteria growth monitoring by automated DEP-facilitated image analysis. Lab Chip. 10, 2944-2951 (2010).
- Kalashnikov, M., Lee, J. C., Campbell, J., Sharon, A., Sauer-Budge, A. F. A microfluidic platform for rapid, stress-induced antibiotic susceptibility testing of Staphylococcus aureus. Lab Chip. 12, 4523-4532 (2012).
- McDonald, J. C., Whitesides, G. M. Poly(dimethylsiloxane) as a material for fabricating microfluidic devices. Acc. Chem. Res. 35, 491-499 (2002).
- Roth, B. L., Poot, M., Yue, S. T., Millard, P. J. Bacterial viability and antibiotic susceptibility testing with SYTOX green nucleic acid stain. Appl. Environ. Microbiol. 63, 2421-2431 (1997).
- Francius, G., Domenech, O., Mingeot-Leclercq, M. P., Dufrene, Y. F. Direct observation of Staphylococcus aureus cell wall digestion by lysostaphin. J. Bacteriol. 190, 7904-7909 (2008).
- Jordan, S., Hutchings, M. I., Mascher, T. Cell envelope stress response in Gram-positive bacteria. FEMS Microbiol. Rev. 32, 107-146 (2008).
- Koch, A. L. Bacterial wall as target for attack: past, present, and future research. Clin. Microbiol. Rev. 16, 673-687 (2003).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7, R100 (2006).
- Kohanski, M. A., Dwyer, D. J., Collins, J. J. How antibiotics kill bacteria: from targets to networks. Nat. Rev. Microbiol. 8, 423-435 (2010).
- Kohanski, M. A., Dwyer, D. J., Hayete, B., Lawrence, C. A., Collins, J. J. A common mechanism of cellular death induced by bactericidal antibiotics. Cell. 130, 797-810 (2007).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır