Method Article
Biyobozunur Polimer Parçacıklarının Lenf İçi Düğüm Enjeksiyonu
Bu Makalede
Özet
Lenf düğümleri immün yanıtı düzenleyen immünolojik dokulardır ve aşılar için kritik bir hedeftir. Lenf düğümlerini daha iyi hedeflemek ve antijenlerin veya yardımcıların doğumlarını kontrol etmek için biyomalzemeler bunların uzaması haline getirildi. Bu makalede, lenf düğümlerine biyouyumlu polimer parçacıkları enjekte etmek için bu fikirleri birleştiren bir teknik açıklanmaktadır.
Özet
Adaptif immün yanıtın üretilmesi, bu yabancı moleküllerin T ve B lenfositlerine işlenmesi ve sunulması için lenf düğümlerine verimli drenaj veya antijen kaçakçılığına dayanır. Lenf düğümleri böylece yeni aşılar ve immünoterapiler için kritik hedefler haline gelmiştir. Bu dokuları hedeflemek için yeni bir strateji çözünür aşı bileşenlerinin doğrudan lenf nodu enjeksiyonudur ve bu tekniği içeren klinik çalışmalar umut verici olmuştur. Lenf nodu hedeflemesini iyileştirmek için çeşitli biyomalzeme stratejileri de araştırılmıştır, örneğin biyomalzeme aşı parçacıklarının optimal drenajı için parçacık boyutunu ayarlama. Bu yazıda, doğrudan lenf nodu enjeksiyonu ile antijen, adjuvan veya diğer aşı bileşenleriyle dolu olabilecek biyobozunur polimer parçacıklarını birleştiren yeni bir yöntem sunuyoruz. Bu yöntemde polimerik mikropartiküller veya nanopartiküller lipid stabilizatörlerini içeren modifiye çift emülsiyon protokolü ile sentezlenir. Partikül özellikleri(örneğin boyut, kargo yükleme) sırasıyla lazer kırınım ve floresan mikroskopi ile doğrulanır. Fare lenf düğümleri daha sonra hedef enjeksiyon bölgesinin görselleştirilmesine ve daha sonra lenf düğümlerinde polimer parçacıklarının birikmesine izin veren toksik olmayan bir izleyici boyasının periferik enjeksiyonu ile tanımlanır. Bu teknik, lenf düğümlerine teslim edilen biyomalzemelerin ve aşı bileşenlerinin dozları ve kombinasyonları üzerinde doğrudan kontrol sağlar ve yeni biyomalzeme bazlı aşıların geliştirilmesinde kullanılabilir.
Giriş
Lenf düğümleri (LN' ler) bağışıklık sisteminin komuta merkezleridir. Bu immünolojik sitede, hücreleri sunan antijen, hücresel ve humoral immün yanıtları aktive etmek için belirli yabancı antijenlere karşı naif lenfositleri astarlar. Böylece LN'ler aşı ve immünoterapilerin teslimi için cazip bir hedef haline gelmiştir. Ne yazık ki, çoğu aşı stratejisi antijen ve yardımcıların lenfoid dokuya verimsiz, geçici olarak verilmesiyle sonuçlanır1. Bu nedenle, LN'lerde aşı bileşenlerinin hedef ve tutulmasını geliştiren yaklaşımlar, yeni aşıların gücü ve verimliliği üzerinde önemli bir etkiye sahip olabilir.
Yeni klinik çalışmalara büyük ilgi gösteren LN hedeflemesinin zorluğunu atlatmak için bir strateji doğrudan, LN içi (i.LN.) enjeksiyon2-4. Bu denemelerde, basit bir ayakta tedavi prosedürü olarak LN'lere aşı ulaştırmak için ultrason rehberliği kullanıldı. Geleneksel periferik enjeksiyon yolları ile karşılaştırıldığında, bu yaklaşım alerjiler ve kanser2-4dahil olmak üzere terapötik bağlamlarda önemli dozdan sağlayıcı ve daha iyi etkinlik ile sonuçlandı. Bu çalışmalarda lenfatik drenaj ile hızla temizlenen çözünür aşıların(yani biyomalzeme içermeyen) i.LN. enjeksiyonu kullanıldı. Bu nedenle, bu etkileyici terapötik etkileri elde etmek için çoklu enjeksiyonlar veya çoklu enjeksiyon döngüleri uygulandı. LN'de daha iyi elde tutulması, antijen ve/veya adjuvan ve bağışıklık hücreleri arasındaki etkileşimi artırarak bağışıklık hücresi astarlamanın gücünü daha da artırabilir. Bu potansiyel, antijen kinetiği ve adjuvan doğumun5-7oluşturulan spesifik immün yanıtın belirlenmesinde kritik bir rol oynadığını gösteren son çalışmalarla desteklenmektedir. Ayrıca, ilaç ve aşı dozlarının lokalize ve en aza indirilmesi kronik inflamasyon gibi sistemik etkileri azaltabilir veya ortadan kaldırabilir.
Biyomalzemeler aşıların gücünü ve verimliliğini artırmak için kapsamlı bir şekilde çalışılmıştır1,8,9. Biyomalzeme taşıyıcılarında kapsülleme veya adsorpsiyon, kargoyu bozulmaya karşı fiziksel olarak koruyabilir ve çözünürlük sınırlamalarının üstesinden gelebilir. Polimerik mikro veya nanopartiküller gibi biyomalzeme taşıyıcıların bir diğer önemli özelliği, birkaç kargo sınıfını birlikte yükleyebilme ve daha sonra bu kargoları kontrollü aralıklarla serbest bırakma yeteneğidir. Bununla birlikte, in vivo biyomalzeme aşıları ve immünoterapileri engellemeye devam eden önemli bir sınırlama, bağışıklık hücrelerinin verimsiz hedeflenmesi ve lenf düğümlerine sınırlı kaçakçılıktır. Örneğin, biyomalzeme aşıların konvansiyonel rotalardan(örneğin intradermal, intramüsküler) periferik enjeksiyonu tipik olarak zayıf LN hedeflemesi sergiler ve enjekte edilen malzemenin% 99'u enjeksiyon yerinde kalır4,10. Daha yakın zamanda, biyomalzeme aşı taşıyıcılarının büyüklüğü, bu aşıların interstisyel akış yoluyla LN'lere tercihli ticaretini veya drenajını iyileştirmek için ayarlanmıştır8,10. Bu gelişmeler, LN ortamının yeni aşılar için hedeflenme ve mühendisliğinin öneminin altını çizerek hücresel ve humoral immün yanıtların artmasına yol açmıştır.
Bu makale, kontrollü salınımlı aşı depoları5,11oluşturmak için lipid stabilize polimer parçacıklarını ve i.LN. teslimatlarını birleştiren bir aşılama protokolü sunun. İ.LNiçin cerrahi teknikler kullanan son çalışmalara dayanarak. farelerde6,7,12,13, küçük hayvanlara biyomalzeme aşıları enjekte etmek için hızlı, cerrahi olmayan bir strateji geliştirdik5. i.LN. dağıtımını biyomalzeme aşı taşıyıcıları ile birleştirmek, kontrollü salınımlı aşı depolarının tek bir enjeksiyonundan sonraki 7 gün içinde CD8 T hücre yanıtını güçlü bir şekilde artırmıştır5. Güçlü bir humoral yanıt(yani antikor titreleri) de üretildi; her iki gelişme de, biyomalzeme taşıyıcılarından kontrollü salınımla aracılık edilen lenf düğümlerinde aşı bileşenlerinin daha fazla tutulmasıyla bağlantılıydı. İlginçtir ki, aşı parçacıklarının boyutu bu malzemelerin kaderini bir kez LN'lerde değiştirdi: nano ölçekli parçacıklar hücreler tarafından doğrudan alımın arttığını gösterirken, daha büyük mikropartiküller hücre dışı LN ortamında kaldı ve LN yerleşik antijen sunan hücreler tarafından alınan kargoyu(örneğin adjuvan) serbest bıraktı5. Bu veriler, i.LN enjekte edilen biyomalzemelerin boyutunu kontrol ederek yeni aşılar için yararlanabilecek iki yol olduğunu göstermektedir.
Bu makalede biyobozunur lipid stabilize polimer parçacıkları (mikro ve nano ölçekli) modifiye çift emülsiyon stratejisi kullanılarak sentezlenir5,11. Partikül özellikleri lazer kırınımı ve mikroskopi ile karakterizedir. Bu parçacıklar daha sonra yaygın, toksik olmayan bir izleyici boyası14kullanılarak cerrahi olmayan olarak tanımlanan kasık LN'lerine doğrudan enjekte edilir. LN'lerin histoloji veya akış sitometrisi ile enjeksiyon sonrası analizi, parçacıkların LN ortamında dağılımını doğrulamak ve zaman içinde parçacıkların hücresel alımını ve tutulmasını izlemek için kullanılabilir. Histolojik işleme ve akış sitometrisini ayrıntılı olarak açıklayan protokoller için, okuyucular son JoVE makalelerine ve dergi raporlarına atıfta bulunulur15-22. Tipik sonuçlar, güçlü, verimli bağışıklık yanıtları elde etmek veya hedef patojenler için bağışıklığı uyarlamak için yararlanılabilen bu depoların yerel LN hedeflemesini göstermektedir.
Protokol
Bu protokoldeki tüm hayvan çalışmaları Federal, Eyalet ve yerel yönergelere uygun olarak ve Maryland Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) tarafından incelenen ve onaylanan protokoller kullanılarak tamamlanmıştır.
1. Lipid stabilize Mikro ve Nanopartiküllerin Sentezi
- 7 ml'lik cam şişelerde DOPC, DSPE-PEG ve DOTAP lipitlerini 60:20:20 molar oranında birleştirerek ana lipit karışımını hazırlayın.
- Tek bir numuneyi sentezlemek için: Sırasıyla DOPC, DSPE-PEG ve DOTAP'ın 242,9 μl, 287,4 μl ve 71,9 μl'sini 2 ml cam serolojik pipetler kullanarak şişeye aktarın.
- Birden fazla örneği sentezlemek için: Yukarıdaki her lipit hacmini numune sayısıyla çarpın ve tek bir şişede birleştirin, ardından bu lipit karışımının eşit aliquotlarını hazırlanacak her örneğe karşılık gelen şişelere aktarın.
- Lipitleri 10 dakika boyunca hafif bir azot gazı akışı altında kurulayın veya bir gecede vakumlu fırına yerleştirin.
- Tek, boş 20 ml'lik bir cam şişede, 16 mg/ml polimer stok çözeltisi oluşturmak için her parçacık örneği için 5 ml dikloromethanede 80 mg PLGA çözün.
- Kurutulmuş lipitleri, kapağı ve girdabı içeren şişelere 30 saniye boyunca 5 ml polimer çözeltisi ekleyin.
- Mikropartikülleri sentezlemek için:
- Polimer, lipid ve diğer suda çözünmeyen kargoyu içeren organik fazı bir sonicator kullanarak 12 W'ta buz üzerinde sonicating başlayın.
- 1 mg peptit, protein veya diğer suda çözünür kargo içeren 500 μl damıtılmış H2O veya H2O eklemek için bir pipet kullanarak yağdaki su (w/o) emülsiyonunu oluşturun.
- Buz üzerinde 12 W'ta 30 saniye boyunca sonicating devam edin, tam emülsifikasyon sağlamak için şişeyi yukarı ve aşağı ve yan yana sallayın.
- W/o emülsiyonunu 150 ml'lik bir beherde 40 ml H2O'ya dökerek sudaki su (w/o/w) emülsiyonunu oluşturun.
- Dijital homojenizatör kullanarak 16.000 rpm'de 3 dakika homojenize edin.
- Manyetik bir karıştırma çubuğu ekleyin, kabı bir karıştırma plakasına aktarın ve fazla çözücüyü çıkarmak için w /o/w emülsiyonun gece boyunca karıştırmasına izin verin.
- Nanopartikülleri sentezlemek için:
- Polimer, lipid ve diğer suda çözünmeyen kargoyu içeren organik fazı 14 W'ta buz üzerinde sonicating başlayın.
- 1 mg peptit, protein veya suda çözünür kargo içeren 500 μl damıtılmış H2O veya H2O eklemek için bir pipet kullanarak w/o emülsiyonunu oluşturun.
- Buz üzerinde 14 W'ta 30 saniye sonicating devam edin.
- W/o emülsiyonunu 150 ml'lik bir beherde 40 ml H2O'ya dökerek ve buz üzerinde 16 W'da 5 dakika sonicating yaparak w/o/w emülsiyonunu oluşturun. Tam emülsifikasyon sağlamak için şişeyi sonicator ucunun etrafında yukarı ve aşağı ve yan yana hafifçe sallayın.
- Manyetik bir karıştırma çubuğu ekleyin, şişeyi bir karıştırma plakasına aktarın ve fazla çözücüyü çıkarmak için w/o/w emülsiyonun gece boyunca karıştırmasına izin verin.
- Ertesi sabah, parçacıkları yıkayın ve toplayın:
- Emülsiyon'u 40 μm Naylon ağ hücre süzgecinden 50 ml konik bir tüpe dökün.
- Mikropartiküller için 5.000 x g'da 5 dakika veya nanopartiküller için 24.000 x g'da 5 dakika santrifüj parçacıkları.
- 1 ml H2O'da yeniden dirılarak parçacıkları dekant süpernatant ve yıkama.
- Askıya alınan parçacıkları 1,5 ml'lik bir mikrosantrifüj tüpüne aktarın.
- Mikropartiküller için 5.000 x g'da 5 dakika veya nanopartiküller için 24.500 x g'da 5 dakika santrifüj.
- Süpernatantı çıkararak, 1 ml H 2 O'da yeniden oluşturarak ve1.6.5adımında olduğu gibi santrifüjle parçacıkları iki kez daha yıkayın. Yıkadıktan sonra, parçacıkları hemen kullanım için 1 ml H2O'da askıya alın veya genişletilmiş depolama için liyofilize edin.
2. Sentez Veriminin Ölçülen
- Boş bir 20 ml cam şişeye önceden ağır bas. Karıştırmak için bir mikropipette ile yukarı ve aşağı pipetledikten sonra önceden ağır basılan şişeye 100 μl parçacık süspansiyonu ekleyin.
- Parçacıkları liyofilize edin veya yumuşak bir azot akışı altında kurutun.
- Kurutulmuş polimer içeren şişeyi tartın. Kurumuş parçacıkları içeren şişenin kütlesinden şişenin orijinal ağırlığını çıkararak şişedeki partikül verimini belirleyin.
- Şişedeki parçacık kütlesini seyreltme faktörü ile çarparak genel parçacık verimini belirleyin. Yüzde verimini belirlemek için parçacık kütlesini maksimum teorik giriş kütlesine bölün ve % 100 ile çarpın.
3. Parçacık Boyutunun Belirlenmesi
- Deiyonize su ile doldurup pamuk uçlu çubukla silerek birlikte verilen cuvette tarzı cam fraksiyon hücresini temizleyin. Temizlenmiş fraksiyon hücresine 10 ml damıtılmış H2O aktarın, manyetik mikro karıştırma çubuğu ekleyin ve fraksiyon hücresini parçacık boyutu analizörünün hücre montajına yükleyin.
- Fraksiyon hücresinde tam karıştırma elde etmek için parçacık analizöründeki manyetik karıştırma hızını ayarlayın ve bölme kapısını kapatın.
- Enstrüman yazılımı arabirimini kullanarak lazerleri kesir hücresine hizalayın.
- Yalnızca damıtılmış H2O içeren kesir hücresiyle taban çizgisi okumasını kaydetmek için enstrüman yazılımı arabirimini kullanın.
- Pipet orijinal parçacık süspansiyonu karıştırmak için bir mikropipette ile yukarı ve aşağı.
- Pipet fraksiyon hücresine 10 μl parçacık süspansiyonu (tipik olarak yaklaşık 0,5 mg). Hücreye eklenen parçacık numunesinin hacminin, cihaz yazılımı arayüzünde belirtildiği gibi uygun aralıkta sinyal gücü oluşturmak için yeterli olduğundan emin olun. Gerekli parçacıkların gerçek kütlesi yüzde verimine ve parçacık örneğinin optik özelliklerine bağlıdır.
- Plga için 1.60 kırma indeksi kullanarak parçacık boyutu analizör bölmesi kapısını kapatın ve parçacık boyutunu ölçün.
- Sayı temeli kullanarak parçacık çapını hesaplamak için yazılım arayüzünü kullanın.
4. Parçacıkların Görselleştirilmesi
- Pipet parçacık süspansiyonu karıştırmak için mikropipette ile yukarı ve aşağı. Parçacık süspansiyonunu deiyonize suda 1 mg / ml'ye seyreltin.
- Kabarcık oluşumunu önlemek için 3 μl seyreltilmiş parçacık süspansiyonu ekleyerek ve bir kapak kapağını 45 ° açıyla monte ederek bir mikroskop slaytı hazırlayın. Her floresan kargo için uygun filtre setlerini kullanarak slaydı mikroskop aşamasına ve görüntüye yerleştirin.
5. I.LN için Farelerin Hazırlanması. enjeksiyon
- İzleyici boya çözeltisi hazırlayın:
- 10 mg boya tozunun 10 ml damıtılmış H2O ile çözünmesiyle% 0,1 (w/v) izleyici boyası çözeltisi hazırlayın.
- Boya çözeltisini 0,2 μm şırınna filtresi kullanarak bir cam şişeye sterilize edin.
- Enjeksiyondan bir gün önce, IACUC onaylı bir hayvan protokolüne göre izofluran kullanarak fareyi uyuşturur. Anestezi derinliğini değerlendirmek için, bir parmak sıkışma refleks testi gerçekleştirin ve dakikada yaklaşık 100-140 nefes solunum hızı sağlamak için nefes alma hızını izleyin.
- Fare uyuşturulurken saçlarını kuyruk ve arkadaki makas kullanarak tıraş edin. Saçı hayvanın ventral tarafından ve yanal olarak arka bacağın (kalça) ekleminin hemen üstündeki sırt tarafına çıkarın.
- İzleyici boya enjekte et.
- Her boya enjeksiyonu için, 10 μl boya çözeltisini bir mikrosantrifüj tüpüne aktarmak için bir mikropipette kullanın ve 10 μl'nin tamamını 1 ml şırıngaya bağlı 31G iğneye epire edin.
- Saçın kırpıldığı kuyruk tabanının her iki tarafına deri altından 10 μl boya çözeltisi enjekte edin, enjeksiyonlar arasında yeniden yükleyin.
- Pamuklu çubuklar yoluyla hafif bir tüy döken krem uygulayarak kalan saçları çıkarın. Arka uyluk ve karın arasındaki bölgeyi kaplayıp kaplayıp kaplamayı unutmayın.
- Depilatör kremin ciltte 3 dakika kuluçkaya yatmasına izin verin. Kuluçkadan sonra, ılık H2O ile ıslak eldivenli el ve cildin içine depilatory kremi hafifçe sürün.
- Eldivenli eli ılık H2O ile ıslatarak ve kuyruk tabanını ve arka ayakları ovalayarak hemen depilatör kremi çıkarın. Aşırı depilatory çıkarılana kadar tekrarlayın, tahrişi önlemek için el ıslak tuttuğunuzdan emin olun.
- Yumuşak bir bezi veya kağıt havluyu ılık H2O ile ıslatarak ve farenin alt kısmını silerek tek bir hareketle fareden artık depilatory'i çıkarın. Farenin aşınmasını veya cilt hasarını önlemek için bir ovma hareketinden kaçının.
- Farenin bir ısı lambası altında iyileşmesine ve tutmaya dönmesine izin verin.
6. I.LN. Parçacıkların Enjeksiyonu
- Ertesi gün, IACUC onaylı bir hayvan protokolüne göre izofluran kullanarak fareyi uyuşturun.
- Her kasık lenf düğümüne izleyici boyasının drenajını doğrulamak için fareyi inceleyin. Lenf nodu arka uyluk ve karın yakınında karanlık bir nokta olarak görünmelidir.
- Parçacık enjeksiyonu çözeltisi hazırlayın:
- İstenilen enjeksiyon konsantrasyonunda damıtılmış H2O'daki parçacıkları yeniden diriltir. Her enjeksiyon için, 10 μl parçacık çözeltisini bir mikrosantrifüj tüpüne aktarmak için bir mikropipette kullanın.
- 10 μl'nin tamamını 1 ml şırıngaya bağlı 31G insülin iğnesine epire edin.
- Enjekte parçacık dozu:
- LN'yi görselleştirdikten sonra, cilt alay hareketini çekmek ve enjeksiyon hacminin kontrollü bir şekilde yerleştirilmesine izin vermek için başparmak, işaret parmağı ve orta parmak kullanarak LN çevresindeki cildi sıkılaştırın.
- LN'ye iğneyle cilde 90° açıyla yaklaşın ve boyalı LN üzerinden 1 mm derinliğe kadar cilde nüfuz edin.
- Tüm birimi yavaşça enjekte edin. Enjeksiyon sırasında, görünür LN büyütme ile enjeksiyonu onaylamak için cilt boyunca LN hacmini gözlemleyin.
- Farenin bir ısı lambası altında iyileşmesine izin verin ve tutmaya geri dönün veya ek testler gerçekleştirin.
İlgili analiz teknikleri için (örneğin histoloji, akış sitometrisi) bkz.
Sonuçlar
Bu yazıda sunulan protokoller için beklenen sonuçlar üç kategoriye ayrılabilir: parçacık sentezi, hayvan hazırlama ve parçacık enjeksiyonu.
Şekil 1, amfifilik lipitler tarafından stabilize edilen biyobozunur polimer parçacıklarının sentezini ve karakterizasyonunu tasvir eder. Emülsiyon/solvent buharlaşma sentez protokolünün sonuçları (Şekil 1A) üretilen nihai emülsiyonların görsel incelemesi ile nitel olarak değerlendirilebilir; parçacık partileri homojen, opak bir görünüme sahip kararlı emülsiyonlar olmalıdır. Komplikasyonlar, genellikle lipid stabilizatörlerinin yanlış depolanması nedeniyle krem veya flokülasyon yapan emülsiyonları içerir. Bu dengesizliği önlemek için lipitler -80 °C'de susuz bir durumda veya azotla temizlenmiş kapalı bir şişede saklanmalıdır. Parçacık sentezinin nicel değerlendirmesi, boyut dağılımını analiz etmek için lazer kırınımı veya dinamik ışık saçılımı kullanılarak yapılabilir (Şekil 1B). Beklenen sonuçlar, eşit bir parçacık popülasyonu gösteren sıkıca dağılmış, monomodal parçacık boyutlarını içerir. Bu yazıda açıklanan sentez parametreleri, nanopartiküller ve mikropartiküller için sırasıyla yaklaşık 100 nm veya 3 μm merkezli ortalama dağılımlar oluşturur. Parçacık sentezinin daha nitel değerlendirmesi, yukarıdaki protokolün birden fazla floresan kargo sınıfını içerecek şekilde değiştirilmesiyle elde edilebilir. Şekil 1C'de,floresan peptit (FITC, yeşil), lipofilik boya (DiD, kırmızı) ve kaplama görüntüsü (sarı) ile yüklenen mikropartiküllerin mikroskopi görüntüleri, istenen boyut aralığında parçacıkların oluşturunu ve parçacığın hacmi içinde peptidin kapsüllendiğini doğrular.
Şekil 2'nin ilk iki paneli, bu makalede açıklanan i.LN. enjeksiyon stratejisi için hayvan hazırlığının beklenen sonuçlarını özetlemektedir. Metodoloji, sonraki i.LN. parçacık enjeksiyonunun yerini belirlemek için toksik olmayan bir izleyicinin periferik enjeksiyonu ile kasık LN'lerinin işaretlenmesini içerir (Şekil 2A)5. Belirtildiği gibi, kuyruk tabanında deri altı enjeksiyonunu takiben izleyici boyasının drenajı kasık LN'lerinin görselleştirilmesini sağlayacaktır (Şekil 2B)5. Onaylı depilatör kremlerin yutulması fareler için tehlike oluşturabilir. Bu nedenle, pençelere ve farelerin ventral tarafına özellikle dikkat ederek uygulanan tüm kremleri iyice çıkarmaya özen edilmelidir. Depilatory, ıslak, yumuşak bir bez veya ıslak kağıt havlu kullanılarak tek ve pürüzsüz bir hareketle çıkarılmalıdır. Farelerin açıkta kalan cildinde aşınmalara yol açabileceğinden, kremi çıkarmak için sürtünmekten kaçının.
Kasık LN'sine teslimatın lokalinin onaylanması gözlem veya histoloji ile değerlendirilebilir. LN hacmi, başarılı enjeksiyonun bir göstergesi olarak enjeksiyon sırasında görsel olarak izlenebilir. Beklenen sonuçlar, bitişik dokulara veya hücrelere önemli bir sızıntı olmadan LN yapısı boyunca verimli kargo dağıtımını içerir. Ayrıca, enjekte edilen sıvı LN'deki izleyiciyi yerinden ettikçe/seyreltdikçe, enjeksiyondan sonra boya konsantrasyonu / renklendirme daha az yoğun hale gelmelidir. Dokunun gözlemi, sıvı enjeksiyonu nedeniyle bozulmamış, ancak genişlemiş bir LN ortaya açmalıdır. Potansiyel zorluklar arasında çok hızlı enjekte etmek veya LN'yi kaçırmak yer almaktadır, her ikisi de hacmin çevredeki deri altı dokusuna elüasyonuna neden olabilir. Bu istenmeyen sonuçlar, parçacık süspansiyonun enjeksiyon için hedeflenen düğümlerden uzak hücrelere ve dokuya yayıldığının gözlemlendiği nekropsi veya histoloji ile doğrulanabilir. Buna karşılık, beklenen bir sonuç, LN yapısı içindeki parçacıkların çevrelenmesi nedeniyle genişlemiş bir kasık LN'nin tanımlanması olacaktır. Ekscise LN'lerin histolojik işlenmesi, Şekil 2C ve 2D'degösterildiği gibi, lenfoid dokuya kargonun teslimini kesin olarak doğrulayabilir. Şekil 2'deki parçacıkların, enjeksiyon sırasında, histolojik işlem ve floresan mikroskopi sırasında kargonun görselleştirilmesine izin vermek için floresan kargoyu içerdiğini unutmayın.
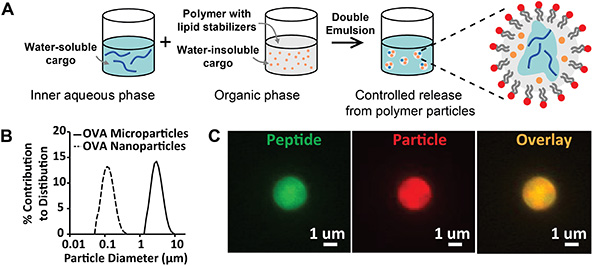
Şekil 1. Lipid Stabilize Parçacıkların Sentezi ve Karakterizasyonu. A)Emülsiyon/solvent buharlaşması ile hazırlanan lipid stabilize partiküllerin sentezini açıklayan şematik diyagram. B)Mikropartiküllerin (katı çizgi, çap = 2,8 μm) ve nanopartiküllerin boyut dağılımları (kesik çizgi, çap = 113 nm). C) Floresan etiketli peptit ve floresan parçacık boyası ile yüklü parçacıkların floresan mikroskopi görüntüleri. Etiketler: peptit (yeşil) ve parçacık (kırmızı). Daha büyük resmi görüntülemek için burayı tıklatın.

Şekil 2. I.LN. LN içinde Biyobozunur Parçacıkların Enjeksiyonu ve Dağılımı. A) i.LN. enjeksiyonu için metodoloji. B)Bir faredeki LN'lerin cilt (üst görüntü) ve nekropsi (alt görüntü) takip edilmesi5. C) Floresan etiketli polimer mikropartiküllerin (parçacıklar, yeşil; T hücreleri, kırmızı; B hücreleri, mavi). D) Enjeksiyondan 24 saat sonra LN'lerde floresan etiketli nanopartiküller (50 nm, sol görüntü) ve mikropartiküller (6 μm, sağ görüntü). Daha büyük resmi görüntülemek için burayı tıklatın.
Tartışmalar
Bu protokolde açıklanan teknik, aşıların LN'lere ve LN yerleşik antijen sunan hücrelere kontrollü olarak ulaştırılmasını sağlar. Biyomalzeme kapsüllü kargo LN içinde yerelleştirilebilir ve LN mikroçevrimine teslim edilen bir veya daha fazla kargo türünün dozlarının manipülasyonunu sağlar. Polimer parçacıklarından lokalizasyon ve kontrollü salınımın, geleneksel yaklaşımlara göre önemli ölçüde daha düşük dozlarda güçlü bir hücresel ve humoral immün yanıt ürettiği gösterilmiştir. Ayrıca, biyomalzeme taşıyıcı boyutunun manipülasyonu yoluyla, hücresel işlemenin birincil modu nanopartiküllerin doğrudan alınması veya daha büyük mikropartiküllerden hücre dışı kargo salınımı arasında modüle edilebilir5. Bu sonuçlar, terapötik aşı dağıtımı için bir platform olarak i.LN. biyomalzeme teslimatının fizibilitesini ortaya oturtur.
PLGA parçacıklarının emülsiyon/solvent buharlaşması ile sentezi ilaç dağıtım uygulamalarında yaygın olarak23,24. Bu nedenle, bu teknikle ilişkili potansiyel zorluklar çoğunlukla LN hedef sahasında aşıların başarılı bir şekilde tanımlanması ve birikmesi ile ilgilidir. İzleyici boya kullanımı hedeflenen kasık LN'lerinin görselleştirilmesini kolaylaştırsa da, cildin altındaki hedef boyut ve derinlik küçüktür. Bu nedenle, yazarlar farelerin hazırlanmasını ve enjeksiyonlarını uygulamak için zaman ve fare tahsis etmeyi önerir. Hayvan hazırlığı sırasında(yani tıraş ve depilasyon uygulaması), bacağın karınla olan açısının cildi makaslardan yaralanmaya daha yatkın hale getirdiği hayvanın ventral tarafındaki fareleri kesmemeye özen edilmelidir. Ek olarak, hayvanların normal bakım davranışı sırasında kremi yutmasını önlemek için tüm epilasyon ılık suyla çıkarılmalıdır. LN enjeksiyonlarını uygulamak için, daha yüksek bir izleyici boya konsantrasyonu uygulanabilir ve hayvanlar ötenaziye tabi edilebilir ve daha sonra birden çok kez enjekte edilebilir. Enjeksiyon fareleri nekropsilenebilir ve enjekte edilen hayvanlardan gelen LN'lerin büyüklüğü, seçilmemiş bir kontrol LN ile karşılaştırılabilir. Bu tekniğin bir sınırlaması, LN yapısına yüklenebilen enjeksiyon hacminin fiziksel sınırıdır. Protokolümüz farelerde 10 μl enjeksiyon hacmi önermektedir, ancak diğer çalışmalar en az 20 μl kadar yüksek enjeksiyon hacimleri bildirmektedir.
Belirtildiği gibi, parçacıkların fiziksel özelliğini(yani boyutunu) değiştirmek, LN dokusundaki biyomalzemeler ve kapsüllenmiş kargolar tarafından indüklenen yolu veya sonuçları değiştirmek için etkili bir mekanizmadır. Emülsiyon/çözücü buharlaştırma protokolü, yüzey yükü veya işlevselliği ve biyobozunurluk/kargo salınımı oranı23,24gibi fiziksel veya kimyasal özellikleri değiştirmek için kolayca değiştirilebilir. Örneğin, salınım kinetiği alternatif polimer bileşimleri aracılığıyla ayarlanabilir ve yüzey fonksiyonu modifiye lipid bileşimleri veya poli (vinil alkol) kullanılarak değiştirilebilir. Parçacıklara yüklenen kargo, hedef patojenler için farklı antijenler veya adjuvanlar içerecek şekilde kolayca manipüle edilebilir. Bu yaklaşımın avantajı, i.LN. teslimatının biyomalzemelerden kargonun yerel, kontrollü salınımı ile birleştirilmesiyle elde edilir. Bu sinerji, dakika dozları kullanarak ve spesifik olmayan / sistemik yan etkileri azaltılmış adaptif bağışıklık yanıtları verimli bir şekilde üretmek için yararlanılabilir bir platform oluşturur.
Açıklamalar
Bu makalelerin üretim maliyetleri ve erişim ücretleri kısmen HORIBA, Ltd. tarafından desteklenmiştir.
Teşekkürler
Bu çalışma kısmen PhRMA vakfı ve Maryland Üniversitesi, College Park'tan bir Araştırma ve Akademik Ödülü tarafından finanse edildi. Prof. DarrellIrvine'e, "Lenf nodu mikroçevresinin adjuvan salınımlı polimer parçacıklarının intranodal enjeksiyonu yoluyla yerinde mühendisliği" tamamlanmasında yapılan ilk çalışmaların desteği için teşekkür ederiz. 5
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1,2-dioleoyl-sn-glycero-3-phosphocholine1,2-dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Avanti Polar Lipids | 850375 | 10 mg/ml stock in chloroform |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[amino(polyethylene glycol)-2000] ammonium salt (DSPE-PEG) | Avanti Polar Lipids | 880128 | 10 mg/ml stock in chloroform |
| 1,2-Dioleoyl-3-trimethylammonium-propane chloride salt (DOTAP) | Avanti Polar Lipids | 890890 | 10 mg/ml stock in chloroform |
| Polylactic-co-glycolic acid (PLGA) | Sigma-Aldrich | P2191 | Lactide:Glycolide (50:50). MW 30,000-60,000 |
| Dichloromethane (DCM) | VWR | BDH1113 | |
| Isoflurane | Vetone | 502017 | |
| Nair | Nair | ||
| Evans blue tracer dye | VWR | AAA16774-09 | |
| U-100 BD Ultra-Fine Short Insulin Syringes, 31 G 5/16 in needle | VWR | BD328418 | |
| Single-Use Needles, BD Medical, 21 G, 1.5 in needle | VWR | BD305167 | |
| Syringes with BD Luer-Lok Tip, BD Medical, 1 ml | VWR | BD309628 | |
| Falcon Cell Strainers, Sterile, Corning, 40 µm | VWR | 21008-949 | |
| Vybrant DiD Cell-Labeling Solution | Invitrogen | V-22887 | |
| Fluoresbrite YG Microspheres 6.00 µm | Polysciences | 17149 | |
| Fluoresbrite YG Microspheres 0.05 µm | Polysciences | 17156 | |
| Ovalbumin, Purified | Worthington Biochemical | LS003056 | |
| Qsonica Sonicator Ultrasonic Processor Q125 | Qsonica | Q125 | 1/8 in diameter microtip probe |
| Ultra-Turrax T 25 digital homogenizer | IKA | YO-04739-22 | 10 G dispersing element |
| Fluorescent Microscope | Olympus | IX-83 | |
| Laser Diffraction Particle Size Distribution Analyzer | Horiba | LA-950 | Including provided cuvette-style glass fraction cell |
| Professional 8685 Peanut Classic Clippers | Wahl |
Referanslar
- Swartz, M. A., Hirosue, S., Hubbell, J. A. Engineering Approaches to Immunotherapy. Sci. Transl. Med. 4, (2012).
- Adamina, M., et al. Intranodal immunization with a vaccinia virus encoding multiple antigenic epitopes and costimulatory molecules in metastatic melanoma. Mol. Ther. 18, 651-659 (2010).
- Ribas, A., et al. Intra-Lymph Node Prime-Boost Vaccination against Melan A and Tyrosinase for the Treatment of Metastatic Melanoma: Results of a Phase 1. Clinical Trial. Clin. Cancer Res. 17, 2987-2996 (2011).
- Senti, G., et al. Intralymphatic allergen administration renders specific immunotherapy faster and safer: a randomized controlled trial. Proc. Natl. Acad. Sci. U.S.A. 105, 17908-17912 (2008).
- Jewell, C. M., Lopez, S. C. B., Irvine, D. J. In situ engineering of the lymph node microenvironment via intranodal injection of adjuvant-releasing polymer particles. Proc. Natl. Acad. Sci. U.S.A. 108, 15745-15750 (2011).
- Johansen, P., et al. Antigen kinetics determines immune reactivity. Proc. Natl. Acad. Sci. U.S.A. 105, 5189-5194 (2008).
- Randolph, G. J., Angeli, V., Swartz, M. A. Dendritic-cell trafficking to lymph nodes through lymphatic vessels. Nat. Rev. Immunol. 5, 617-628 (2005).
- Irvine, D. J., Jewell, C. M. Ch. 132. Comprehensive Biomaterials. Ducheyne, P., et al. , (2011).
- Moon, J. J., Huang, B., Irvine, D. J. Engineering Nano- and Microparticles to Tune Immunity. Adv. Mater. 24, 3724-3746 (2012).
- Reddy, S. T., et al. Exploiting lymphatic transport and complement activation in nanoparticle vaccines. Tissue Eng. Part A. 14, 734-735 (2008).
- Bershteyn, A., et al. Polymer-supported lipid shells, onions, and flowers. Soft Matter. 4, 1787-1791 (2008).
- Johansen, P., et al. Direct intralymphatic injection of peptide vaccines enhances immunogenicity. Eur. J. Immunol. 35, 568-574 (2005).
- Mohanan, D., et al. Administration routes affect the quality of immune responses: A cross-sectional evaluation of particulate antigen-delivery systems. J. Controlled Release. 147, 342-349 (2010).
- Harrell, M. I., Iritani, B. M., Ruddell, A. Lymph node mapping in the mouse. J. Immunol. Methods. 332, 170-174 (2008).
- He, H., Courtney, A. N., Wieder, E., Sastry, K. J. Multicolor Flow Cytometry Analyses of Cellular Immune Response in Rhesus Macaques. J. Vis. Exp. , 1743(2010).
- Matheu, M. P., Parker, I., Cahalan, M. D. Dissection and 2-Photon Imaging of Peripheral Lymph Nodes in Mice. J. Vis. Exp. e265. , 265(2007).
- Salmon, H., et al. Ex vivo Imaging of T Cells in Murine Lymph Node Slices with Widefield and Confocal Microscopes. J. Vis. Exp. , 3054(2011).
- Donaldson, J. G. in Current Protocols in Immunology: Immunofluorescence Staining. , John Wiley & Sons, Inc. (2001).
- Hofman, F. in Current Protocols in Immunology: Immunohistochemistry. , John Wiley & Sons, Inc. (2001).
- Holmes, K., Lantz, L. M., Fowlkes, B. J., Schmid, I., Giorgi, J. V. in Current Protocols in Immunology: Preparation of Cells and Reagents for Flow Cytometry. , John Wiley & Sons, Inc. (2001).
- Sharrow, S. O. in Current Protocols in Immunology: Overview of Flow Cytometry. , John Wiley & Sons, Inc. (2001).
- Sharrow, S. O. in Current Protocols in Immunology: Analysis of Flow Cytometry Data. , John Wiley & Sons, Inc. (2001).
- Anderson, J. M., Shive, M. S. Biodegradation and biocompatibility of PLA and PLGA microspheres. Adv. Drug Deliv. Rev. 28, 5-24 (1997).
- Danhier, F., et al. PLGA-based nanoparticles: an overview of biomedical applications. J. Controlled Release. 161, 505-522 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır