Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Lignin Aşağı düzenleme
Bu Makalede
Özet
Bir çift sarmallı RNA girişimi (dsRNAi) tekniği mısır sinamoil koenzim alt bitki lignin içeriğine A redüktaz (ZmCCR1) geni aşağı regüle etmek için kullanılır. Lignin hücre duvarından aşağı-regülasyon mikroskopik analiz ile görselleştirilmiştir ve Klason yöntemi ile ölçülür. Yarı selüloz ve kristalin selüloz içinde Bileşim değişiklikler analiz edilmiştir.
Özet
Biyolojik dönüştürme işlemleri sırasında alternatif biyoenerji kaynak gibi lignoselülozik biyokütle kullanımını kolaylaştırmak için, ön-muamele aşaması, hücre duvarı karbonhidrat örgütleri, bitki hücre duvarının yapısını açmak için gereklidir. Lignin, bir çok hücre duvarı tiplerinde mevcut olan bir polifenolik madde, enzim erişmek için önemli bir engel olarak bilinir. Bitkinin yapısal bütünlüğü ve savunma sistemi ile karışmaz bir düzeye lignin içeriğine azalma biyoetanol üretim maliyetlerini azaltmak üzere önemli bir adım olabilir. Bu çalışmada, genetik olarak, iki iplikçikli bir RNA girişimi tekniği ile linyin biyosentez-ilişkili genlerin biri, sinamoil-CoA redüktaz (ZmCCR1) aşağı-regüle var. ZmCCR1_RNAi yapısı, partikül bombardımanı yöntemiyle mısır genomuna entegre edildi. Transgenik mısır bitkileri içinde olmadan vahşi tipli kontrol bitkileri ile karşılaştırıldığında normal büyüdütransgenik bitkiler, yaprak orta kaburga, kabuklar kahverengi-renklenmenin görüntüleme hariç, biyokütle büyümesi ya da savunma mekanizmaları ile terfering ve kaynaklanıyor. Mikroskobik analizler, histolojik analiz ile bağlantılı olarak, yaprak sklerenkima elyaf inceltilmiş, ancak diğer büyük damar sistemi bileşenlerinin yapısı ve boyutu değiştirilmediğini olduğunu ortaya çıkardı. Transjenik mısırda lignin içeriği% 7-8,7 azaltıldı, kristalli selüloz içeriği lignin azalmaya karşılık olarak artan ve yarı selülozlar değişmedi. Analizler karbon akış selüloz biyosentezlerine linyin kaymıştır olabilir gösterebilir. Bu makalede, RNAi teknolojisi ile mısırdaki lignin içeriği aşağı regüle etmek için kullanılan prosedürleri çizer, ve hücre duvarı kompozisyon hücre duvarı yapısına değişikliklerin etkisini doğrulamak için kullanılır analizleri.
Giriş
Lignoselülozik biyokütle biyoyakıt üretim nedeniyle, ABD 1 bugünkü bolluk oldukça tercih edilir ve tarım ve orman artıklarının sürdürülebilir hasat durumunda, gıda ve hayvan yemi üretimi için kullanılan tarım doğrudan rekabet yeteneği. Ancak, şu anda ABD'de üretilen biyoyakıt ana kaynağı olan mısır tahıl, aksine, lignoselülozik malzemeler çok daha karmaşık ve zor yıkmak için vardır. Uzun zincirli karbonhidratlar, selüloz ve hemiselüloz, lignoselülozik malzemelerin fermantasyon sırasında şekerlerin başlıca kaynaklarıdır, bitki hücre duvarlarının, aynı zamanda, çok çeşitli lignin içeren, bitkinin patojen saldırısına karşı dayanıklılık, savunma sağlayan bir fenilpropanoid polimer, ve hidrofobiklik ek olarak, duvarları hücre. Bitki gelişimi ve yaşamı için gerekli olsa da, lignin da selüloz ve hemicellu başarılı enzimatik dönüşümü için önemli bir engel sunulurçözünür şekerlerin kaybetmek. Yüksek lignin içeriği ile malzemeler genellikle (biyolojik dönüşüm yollar aracılığıyla) biyoyakıt ve işleme özellikleri ve ürün kalitesi üzerinde olumsuz etkileri nedeniyle hamuru ve kağıt endüstrisi için daha az arzu malzemelerdir. Bu nedenle, ürün yapısal mukavemet ve savunma sistemleri ile karışmaz bir seviyede linyin azaltılması için bitkisel maddelerin genetik manipülasyon lignoselülozik biyoyakıt ve kağıt hamuru ve kağıt endüstrisi hem de üretim maliyetlerinin azaltılması için önemli olabilir.
Mısır (Zea mays) olarak, lignin kovalent ferulat ve diferulate köprü 2 üzerinden birincil hücre duvarında, yarı selüloz ile çapraz-bağlanır. Lignin-hemiselüloz karmaşık ikincil hücre duvarına bütünlüğü ve mukavemeti veren karmaşık bir matris oluşturan, hidrojen bağları yoluyla, selüloz mikro-iplikçiklerinin bağlanır. Bitki hücre çeperlerinin mekanik mukavemeti büyük ölçüde li türüne göre belirlenirgnin 3-5 alt birimleri. Daha önceki çalışmalarda, lignin alt birimlerinin oranlarını değiştirerek enzimatik sindirilme 6-11 net bir eğilim göstermiştir. Ancak, lignin içeriğine azalma genel olarak dönüşüm 12,13 bir gelişme olduğunu göstermektedir ve endocellulases, selobiyohidrolazlar ve B-glukosidazlar β 14 de dahil olmak üzere hidrolitik enzimler ile bitki malzemesinin sindirilebilirliğini artan bir anahtar olabilir.
Transkript ekspresyon seviyesini düzenlemek için genetik mühendisliği yaygın ürün özelliklerini geliştirmek için tatbik edilmiştir. Anti-sense ve 15 ortak bastırma teknolojileri, 16 dahil olmak üzere gelişmiş teknikleri, aşağı-regülasyonu, hedef genlerin etkili sağlar. Tam gen knock-out ayrıca bir saç tokası yapısı 17, intron-eklenmiş RNA 'yı kodlayan gen yapısı kullanılarak elde edilmiştir. Ayrıca, çift sarmallı RNA girişimi (dsRNAi) tekniği örneğin, güçlü ve etkili bir gen ekspresyonu ortamhedefleme transkript veya bozunma için baskı ya da çalışır tor, hedef mRNA 18 bastırma etkileri geniş bir yelpazede indüklemek için güçlü bir yol temin etmektedir. Gen susturma teknikleri çeşitli sınırlamalar göstermektedir. Bu teknikler tam transkripsiyon seviyesini düzenler yok ve diğer homolog genlerin beklenmedik susturulması etkilere neden olabilir.
Bu yöntemde, biz dsRNAi mısır genomu içine inşa gerçekleştirmek için partikül bombardımanı kullanılabilir. Bugüne kadar, bitki türlerinin geniş bir dizi başarılı bir partikül bombardımanı, Agrobacterium'un aracılık ettiği dönüşüm, elektroporasyon, mikro-enjeksiyon ve yöntemlerle dönüştürülmüştür. Bu en etkili olduğu için, mısır genetik transformasyonu olarak, partikül bombardımanı yöntemi, tüm diğer yöntemlere göre avantajlıdır. Partikül bombardımanı bakteri bağımlı değildir, bu yöntem, böyle bir genin gen türünün büyüklüğü ya da biyolojik kısıtlamaların serbesttirigin, ya da bitki genotipi. Fiziksel transgen dağıtım sistemi, yüksek transformasyon verimi 19 at, kloroplast içine bitki genomlarına ve bazı durumlarda tanıtılan yüksek molekül ağırlıklı DNA ve çoklu genleri sağlar. Yaprak orta nervürün vasküler sistemdeki lignin azalma numunelerin topografya ve bileşimin incelemek için yararlı olan, taramalı elektron mikroskobu (SEM) ile görselleştirilebilir.
Mısır bitkilerinde, sinamoil-CoA redüktaz iki (ZmCCR1: X98083 ve ZmCCR2: Y15069) genlerin mısır genomunda 20 bulundu. Sinamoil-CoA redüktaz sinnamil aldehid içine hidroksisinamoil-CoA esterleri dönüşümünü katalize eder. Gen, tüm lignifying dokularda ifade edilir, çünkü bu enzim aşağı regüle etmek üzere ZmCCR1 geni seçtik. Dizileri olduğu ortaya çıktı, çünkü ZmCCR1 geninin 3 'terminalinde 523 nükleotid, bir dsRNAi oluşturmak için seçilmiştirZmCCR2 olanlar ile karşılaştırıldığında daha farklı. Böylece, yapı, tam dsRNAi 21 susturma hedef dışı kaçınarak, sadece ZmCCR1 bağlamak olacaktır. A ZmCCR1_RNAi yapı içinde sitoplazmik ifade sistemi ImpactVector1.1-etiketine tasarlanmış (IV 1.1), yeşil doku spesifik promotör ihtiva eden, ribuloz-1, 5-bifosfat karboksilaz oksijenaz (Rubisco).
DsRNAi transgenik bitkileri üzerinde inşa etme etkilerini araştırmak için, lignin içeriği hesaplandı. Klason (asitte çözülmeyen) lignin ölçümü 22 ligninin bazı çözünür asit lignin miktar deterjan yöntemleri ile karşılaştırıldığında daha doğru olduğu bilinmektedir. Bu nedenle, Klason lignin transjenik mısır sapı ölçülmüştür. Bu prosedür, çözünür monosakaritler 23 içine polimerik karbonhidrat dönüştüren iki aşamalı bir asit hidrolizi oluşur. Hidrolize biyokütle sonra asit çözünür ve çözünmez Materi içine kısımlara ayrılmıştırals ve asit çözünmeyen lignin önceki çalışmalara 23,24 göre ölçülmüştür. İdeal olarak, lignin analiz öncesi sonuçlar engelleyebilir çözünür maddeleri uzaklaştırmak amacıyla, hidroliz aşaması, ve tortu içinde mevcut olan herhangi bir kül hesaba lignin tortusunun bir post-yanma hidroliz için su ve etanol ile ekstraksiyon içermelidir. Bu adımlar olmadan, numunenin lignin içeriği yapay şişirilmiş olabilir. Tam bir yöntem ancak bizim deneyler için biz nedeniyle test için mevcut malzemenin küçük bir hacimde bu adımların hem de gerçekleştirmek için koyamadık, burada sunulmaktadır
Diğer iki hücre duvarı bileşenleri, selüloz ve hemiselüloz da lignin aşağı-regüle transgenik mısır hatları analiz edilmiştir. Bu rapor edilmiş olduğu, ya da fenilalanin amonyak-liyaz (PAL) 25, 4-kumarat aşağı-regüle edilmiş transjenik bitkiler: CoA ligaz (4CL) 26, bir ya da sinamillcohol dehidrogenaz (CAD) 27 diğer hücre duvarı yapısal bileşenlerinde bir artış göstermektedir. Çalışmalarımızda, bir ilk adım olarak, kristalin selüloz Updegraff yöntemi 28 kullanılarak ölçülmüştür. Bu yöntem, ilk olarak selülolitik bakteri ve mantar çok sayıda selüloz belirlenmesi için geliştirilmiştir. Hemiselüloz, lignin ve xylosans çıkarmak için kısa bir süre, öğütülmüş mısır stokları Updegraff maddesi (su: nitrik asit asetik asit) ile muamele edilmiştir. Kristalin selüloz tamamen SO 4 H 2 eklenerek Saeman hidrolizi yoluyla glikoza hidrolize edildi. Kristalin selüloz daha sonra kolorimetrik anthrone yöntemi 29 kullanılarak analiz edilmiştir. Hemiselüloz içeriği değiştirilmiş olmadığını doğrulamak için, öğütülmüş saplarından monosakarit ekstreler trifloroasetik asit kullanılarak hidroliz alditol asetat yöntemi kullanılarak derivatize edilir ve daha sonra gaz kromatografisi (GC) 30 ile analiz edilmiştir. Kristal cel için detaylı prosedürlerlulose içeriği ve matris polisakaritler bileşim analizleri Foster vd de tarif edilmektedir. (2010) 31.
Burada, lignin için kullanılan prosedürleri açıklamaktadır aşağı-regülasyonu bir RNAi teknolojisi, partikül bombardımanı dönüşüm ve biyoyakıt için fermentabl şekerlerin içine mısır lignocellulosic biyokütle hızlandırılmış yapı sökümüne lignin analizi ile mısırda.
Protokol
1.. ZmCCR1 ve Aşağı-regülasyon için kullanılır dsRNAi Yapıların Hazırlanması
- Bir dsRNAi knock-out ZmCCR1 geni oluşturmak yapmak için gerekli enzimi bölgelerine dahil Tasarım genine. İki primer setleri ZmCCR1 cDNA fragmanı, iki bölümleri amplifiye edilmesi için dizayn edilmiştir:. 1271 nükleotidinden 748 bir 523 bp fragmanı, ve 1271 nükleotidinden 986 bir 285 bp fragmanı ZmCCR1 cDNA Arizona Genome Enstitüsü (AGI) sağlanmıştır. Daha fazla bilgi, Şekil 1 'de tarif edilmiştir.
- ZmCCR1_748F_BglII primerler (5'-AGATCTACATCCTCAAGTACCTGGAC-3 ') ve ZmCCR1_1271R_NcoI (5'-CCATGGTTTACACAGCAGGGGAAGGT-3') kullanılarak ZmCCR1 şablonundan cDNA, polimeraz zincir reaksiyonu (PCR) ile büyük fragmanı yükseltin. ZmCCR1_986F_BglII primerler (5'-AGATCTGGAAGCAGCCGTACAAGTTC-3 ') ve bir ZmCCR1_1271R_SacI (5R kullanılarak küçük fragmanının (285 bp) büyütmek17;-GAGCTCTTTACACAGCAGGGGAAGGT-3 ').
- Bireysel üreticinin talimatları izlenerek pGEM-T Kolay içine parçalarını birbirine bağlamak.
- Her biri tek tek transformantlardan mini hazırlık plazmid DNA izole gerçekleştirme pGEM-T ticari bir mini hazırlık kiti kullanılarak plazmid oluşturur.
- Her iki Digest BglII ve Ncol ile iki pGEM-T :: ZmCCR1 (523 bp) ve ImpactVector (IV) -1,1 (sitoplazma ekspresyon vektörü).
- IV-1.1 arıtıldı sindirilmiş jel içine geniş sindirilmiş jel ile saflaştırılmıştır ZmCCR1 fragmanının (523 bp) Arter.
- IV-1.1 :: ZmCCR1 (523 bp) içine küçük fragmanı eklemek için Bglll ve SacI her ikisi ile pGEM-T :: ZmCCR1 (285 bp) ve IV-1.1 :: ZmCCR1 (523 bp) Digest.
- IV-1.1 arıtıldı sindirilmiş jel :: ZmCCR1 (523 bp) içine küçük sindirilmiş jel ZmCCR1 parçası (285 bp) Arter.
- 523 bp ve 285 bp parçalanmasına hem de Cloneters çevrilmiş tekrar parçalarının ortasında bir 238 bp ara parçası (bkz. Şekil 1) ile, bir 285 bp ters çevrilmiş tekrar dizisine sahip ZmCCR1 RNAi oluşturmak için IV-1.1 içine ts.
- Bu Escherichia coli (E. coli) içine inşa aktarın büyüyebilir ve mısır genetik transformasyonu için yeterli plazmid DNA elde etmek için bir Midi-prep boyutu plazmid DNA izolasyon gerçekleştirin.
2.. Genetik Dönüşüm mısır
- Tungsten Parçacıklarının Hazırlanması
- Bir 1.5 ml bir tüp içinde tungsten boncuklar, 60 mg (M10) koyun ve 2 dakika boyunca karıştırın% 70 etanol, 1 ml ile yıkayın. 23 ° C'de 10 dakika boyunca inkübe edilir, daha sonra 2 dakika boyunca 18894 x g'de santrifüj ve supernatant atın.
- 2 dakika boyunca santrifüj ve supernatant atarak, 1 ml% 100 etanol ile 3 kez yıkayın. 60 mg / ml mikropartikül konsantrasyonu getirmek için steril% 50 gliserol, 1 ml ilave edilir.
- Bombardıman için DNA'nın hazırlanması
- Pl1.5 ml tüp içine% 50 gliserol içinde hazırlanan tungsten boncuk 50 ul (3 mg) as. IV-5 ul 1.1 (1 ug) :: ZmCCR1 RNAi plasmid DNA, 2.5 M CaCI2 ve 50 ul 0.1 M spermidin ve 20 ul ekle. Yukarıda kısaca reaktifler her ilave arasında Vortex.
- Vortex 30 saniye boyunca 18,894 xg tungsten boncuk-DNA karışımı kısaca ve santrifüj. Süpernatantı dökün ve% 70 etanol içinde 140 ul pelet tekrar süspansiyon. Sıvı çıkarın ve atın. % 100 etanol içinde 140 ul ekleyin. Sıvı çıkarın ve atın.
- % 100 etanol içinde 48 ul ekle. , Bombardıman öncesi kadar 4 saat boyunca, kullanıma veya buz üzerinde saklayın.
- Bombardıman
- 32 (osmotium olarak), en az 4 saat önce bombardımana N6OSM ortamı ihtiva eden 100 mm Petri tabaklarda ortasında (Iowa State University mısır dönüşüm Merkezi'nden Resim) 3-5 cm çapında bir Hi-II mısır embriyojenik calli yerleştirin.
- Preparüreticinin talimatlarına uygun olarak 33 e PSD-1000/He Particle Delivery cihazı.
- % 70 etanol ile oda duvarı sterilize edin. Steril tespit kapağı içine steril 650 psi kopma diski yerleştirin. Bir makro taşıyıcı, kuru kısaca yüzeyi üzerine M10-DNA çözeltisi 5-6 ul yayıldı. Yük macrocarrier ve microcarrier lansman montaj içine ekranı durdurma.
- Durdurma ekranı (L2 = 6 cm) ve kapalı kapı seçilen bir mesafede odası içinde bir mikro başlatmak montaj ve mısır kalus yerleştirin. Bir tel örgülü elek karşı 27 psi'lik bir vakumda hızlandırılması.
- Patlama diski patlamaları ve helyum basıncı göstergesi sıfıra düşene kadar yangın düğmesine basın. Yangın düğmesini bırakın.
- 27 ° C'de karanlıkta 16 saat boyunca N6OSM (ozmotik ortamı) 32 içeren bir Petri kabındaki bombardıman kalus inkübe On parçalar halinde kalus kırmak ve N6E (kallus indüksiyon ortamı) için Petri tabaklarında 32 aktarmak ve 5 gün için inkübe in, 27 ° C de karanlık.
- Seçim
- N6E on 5 gün sonra, N6S ortamı (seçim ortamı) 32 üzerine kalus aktarın. Alt kültür seçim ortamı üzerinde kalus tüm kalus yapısının bozmadan 8-12 hafta süreyle her 30 günde.
- 8-10 hafta sonra, beyaz hızlı büyüyen sektörler olmayan çoğalan ve kısmen nekrotik anne kallusların dışarı büyüyecek. Beyaz hızlı büyüyen dokuları tüketim ve taze seçim ortamına (N6S) 32 onları altkültürü ve yukarıdaki gibi inkübe devam ediyor.
- Yenilenme
- Rejenerasyon ortamında 32 üzerine beyaz ve hızlı büyüyen embriyonik calli aktarın ve 1 hafta boyunca yukarıdaki gibi inkübe edin. 25-27 ° C de 16 saat gün ışığı ve 8 saat karanlık bir döneme yenileyici embriyonik Kalusların Anahtarı
- Rejenerasyon köklenme üzerine 3-4 hafta sonra bir cam test tüpünde 32 vurur transfer ortamı, yukarıdaki gibi inkübe devam etmektedir. Önemli r sonraoot geliştirme toprak ile 4 "tencere Güller nakli ardından, musluk altında dikkatle kökleri yıkayın, görünür. Nemli tutmak için plastik torba ile tencere örtün. 2 gün küçük delik plastik torbalar yaptıktan sonra. 5-6 gün sonra plastik torbalar kaldırmak. 5-6 gün için yukarıdaki gibi inkübe devam edin.
- Sera
- Toprak ile 18 "tencere içine fidan aktarın ve tam yaz güneş ışığı veya sera ışığında korumak. Ilk tohumları T 1 nesil ait ise ilk rejenere bitkiler T 0 denir.
3.. Histolojik Assay
- % 10 nötr tamponlu formalin içinde 5 ml mısır yaprak orta kaburga düzeltildi.
- İşlem ve vakum bir doku işlemcisi kullanılarak bir doku işlemcide parafin ile sızmak.
- Bir Histocentre III gömme istasyonu kullanılarak parafin içinde dokuları gömün.
- Kenarlarından fazla parafin çıkarın kez blokks soğutulur.
- Bir mikrotom kullanılarak bir mikrotom ile 4-5 mikron at bölümü örnek.
- Mikroskop slaytlar ve 2-24 saat süreyle 56 ° C inkübatör üzerine kuru bölümleri yerleştirin. Emin olun bölümleri tamamen slayt yapıştırılır.
- 23 ° C'de 5 dakika boyunca iki kez değiştirilerek ksilen içinde Deparaffinize bölümler
- Hidrat 2 dakika boyunca% 100 etanol iki değişiklik ve 23 ° C'de 2 dakika boyunca% 95 etanol içinde iki değişiklik üzerinde kaydığı
- 2 dakika için akan musluk suyu altında bölümleri durulayın.
- 1-2 dakika boyunca% 0.05 toluidin mavisi O ile leke ve GKD 2 O. ile kısaca durulayın
- Işık mikroskobu ile immersiyon ve görselleştirme ile numuneler üzerinde bir lamel yerleştirin.
- Taramalı Elektron Mikroskobu (SEM)
- % 4 glutaraldehid çapraz kesit mısır yaprak orta kaburga saptamak ve 1-2 saat boyunca 4 ° C'de 0.1 M sodyum fosfat tampon maddesi (pH 7.4).
- Kısaca tamponunda örnekleri durulama, bunları bir in susuz10 dakika, 3x her derece ve% 100 etanol ile 10-15 dakika boyunca etanol serisi (% 25,% 50,% 75 ve% 95).
- Geçiş sıvı olarak sıvı karbon dioksit kullanılarak, bir kritik nokta kurutucuda susuz enine mısır yaprak orta kaburga kurutun.
- Yüksek vakum karbon sekmelerini kullanarak alüminyum dallarda kurutulmuş örnekleri monte
- Coat mısır yaprak orta kaburga argon gazı ile temizlenmiştir, bir püskürtme kaplayıcıda altın (yaklaşık 20 nm kalınlıkta) ile alüminyum lamı üzerine yerleştirildi.
- Bir JEOL JSM-6400V (lantan heksaborattan elektron verici) tarama elektron mikroskobunda kaplanmış örnekleri inceleyin.
- Dijital görüntüler bir analiz Pro yazılımı (sürüm 3.2) kullanılarak resimde edildi.
4. Klason Lignini Ölçüm
- 2 mm elekten Mill örnekleri.
- Her numunenin nem içeriğini tespit etmek ve değeri kaydetmek için bir nem analiz cihazı kullanın.
- • Her bir numune, 1.5 g tartılır ve kütle kaydedin. DXtract otomatik bir çıkarıcı solvent (ekstraksiyon başına 3 döngüleri, döngü başına ~ 14 dakika) ya da Soxhlet cihazı (ekstraksiyon başına 8 saat) kullanılarak ikinci bir ekstre için, etanol, ardından birinci çıkarılması için su ile örnekler. (Not: Bu adım, belirgin Klason lignin içeriğini artırmak, asit hidrolizi sırasında yoğunlaştırmak ve doğru lignin ölçüm engelleyebilir çıkarıcılar kaldırır.)
- Gece boyunca, 45 ° C'de ekstre örnekleri kurutun ve sonra her bir desikatöre serin ve tekrar tartmak için izin verir.
- 30 ° C'ye kadar bir kuluçka ayarlama (Örnek başına kopyaların önerilir) vidalı kapaklı yüksek basınç tüpleri içine her kuru ekstre numunenin 0.3 g ölçülür ve en yakın 0.1 mg ağırlıkları kaydedilir. Her bir basınç borusu 72, H% 2 3 ml SO 4 ekleyin.
- Bir cam veya teflon tavada çubuk kullanılarak örnek karıştırın. Su ilave edildi, inkübasyonu takiben kadar boru içinde karıştırma çubuğu bırakın.
- Bir inkübatör şişe yerleştirin se30 ° C ve 60 dakika boyunca 150 rpm t. 1 saat sonra% 4 asit konsantrasyonunun seyreltilmesi ve bir karıştırma çubuğu ile karıştırmak için iyonu giderilmiş suyun 84 ml. Su hattı üzerinde şişenin yüzüne numunenin büyük miktarda bırakmak için dikkatli olun.
- Sıkıca tüm şişeler üzerinde stoperleri mühür ve metal raf veya büyük çanakların içine koyun. 1 saat boyunca bir sıvı sterilizasyon çevrimi kullanılarak 121 ° C'de otoklav. Onları açmadan önce oda sıcaklığına kadar soğumasını bekleyiniz.
- En az 4 saat boyunca 575 ° C'de bir fırın içinde filtre potalar ön kül. Potalar en az bir saat için bir desikatörde soğumasını bekleyin.
- Vakum pota güvenli bir lastik adaptörü kullanarak, ayrı bir krozeden her tüpten çözüm filtre. Tüp kalan parçacıklar durulamak için deiyonize su kullanın.
- 4 saat içinde, en az 105 ° C de lignin tortu kurutun. Kuru pota ve tortu ağırlığını kaydedin.
- 575 ° C kullanıyorsanız, ön-Yangın bir Bunsen beki üzerinden örnekler hiçbir duman ya da kül ve daha sonra 24 saat boyunca fırında yerleştirin veya programlanabilir bir fırın kullanıyorsanız,-kül öncesi ve aşağıdaki programı kullanmayın sonu:
- 105 ° C, oda sıcaklığı ve ikinci rampa 12 dakika için tutun.
- 10 ° C / dk 'da 250 ° C'ye yükseltmek ve 30 dakika için tutun.
- 20 ° C / dk 'da 575 ° C'ye kadar rampa ve en az 180 dakika için tutun.
- Fırından potalar çıkarın ve bir kurutucuda serin. Pota ve kül tartılır.
- Aşağıdaki denklem kullanılarak asit çözünmeyen tortu hesaplayın:
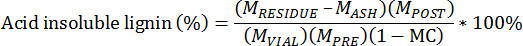
Önceden ekstre biyokütle M PRE = Kütle
Post-ekstre biyokütle M POST = Kütle
Ekstre biyokütle M VIAL = Kütle şişeye ilave
Pota ve lignin resid M BAKİYENİN = Kütleue
Pota ve kül M ASH = Kütle
Önceden çıkarılır biyokütle, toplam ağırlık bazında MC = nem içeriği
5. Karbonhidrat Analizi
- Hücre duvarı karbonhidrat Foster vd dayalı analizler. (2010) protokol 31 gerçekleştirin. Kısaca, dondurularak kurutuldu, bitkisel maddeden elde edilen alkol çözülmeyen bir tortu hazırlayın. Daha sonra trifloroasetik asit ile hidrolize malzeme ve bunlara karşılık gelen alditol asetatlar için çözündürülmüş monosakkarit türevleri maç. Bir dörtlü kütle spektrometresi bağlı gaz kromatografisi (GC) ile, bu uçucu türevleri analiz edin.
Sonuçlar
Biz, RNAi ile mısır bitkilerinde lignin içeriğinde bir azalma göstermiştir. Partikül bombardımanı bir dönüştürme yöntemi yaklaşık% 30 trnasformation verimi vermiştir. ZmCCR1 gen susturma sürekli T0-T2 kuşak gözlenmiştir. Lignin azaltılmış transgenikler yaprak orta kaburga, kabuğu ve kök kahverengi renklenme görüntülenmesi dışında Yabanitip mısır bitkilerine benzer büyüdü. Histolojik deney, mutant çizgiler mısır yaprak orta nervür 18 sklerenkima liflerin hücre...
Tartışmalar
Hücre duvarı polisakaritler bitki mikrobiyal selülazların erişim fenolik polimer 23 ile ilişkili için derecesine büyük ölçüde bağlıdır. Şeker fermente için lignocellulosic biyokütle dönüşüm oranı negatif bitki secondadry hücre duvarlarında biriken lignin içeriği ile ilişkilidir. Bu ilişki, bu tür hidrofobik 24, kimyasal heterojen olarak lignin fiziksel özellikleri atfedilen ve düzenli olarak hidrolize edilebilir intermonomeric yokluğunun 25 Bağlantılar ...
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
Mikroskopik görüntüleme Gelişmiş Mikroskopi için Michigan State University Center hizmetleri aracılığıyla yapılmıştır. Mısır kallus Iowa State University mısır dönüşümü Merkezi'nden satın alınmıştır. Yazarlar karbonhidrat analizi yaptığı teknik yardım için MSU Bitki Araştırma Laboratuvarı Jeffrey R. Weatherhead teşekkür etmek istiyorum. Bu araştırma cömertçe Michigan Mısır Pazarlama Programı (CMPM) ve Bitki Biyoteknoloji Araştırma Konsorsiyumu (CPBR) tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| N6OSM (Osmotic medium) | Made in-house | ||
| N6E (Callus induction) | Made in-house | ||
| N6S media (Selection media) | Made in-house | ||
| Regeneration medium | Made in-house | ||
| Rooting medium | Made in-house | ||
| 10% Neutral buffered formalin (1 L) | Made in-house | ||
| Bio-Rad PSD-1000/He Particle Delivery device | Hercules, CA, United States | ||
| Zeiss PASCAL confocal laser scanning microscope | Carl Zeiss, Jena, Germany | For brightfield microscopy, the images were recorded using a Zeiss (Jena, Germany) PASCAL confocal laser scanning microscope with a 488 nm excitation mirror, a 560 nm emission filter, and a 505-530 nm emission filter. Image analysis was performed using Laser scanning microscope PASCAL LSM version 3.0 SP3 software. | |
| Excelsior ES Tissue Processor | Thermo Scientific, Pittsburgh, PA, United States | ||
| HistoCentre III Embedding Station | Thermo Scientific, Pittsburgh, PA, United States | ||
| Microtome Model Reichert 2030 | Reichert, Depew, NY, United States | ||
| Emscope Sputter Coater model SC 500 | Ashford, Kent, England | ||
| JEOL JSM-6400V Scanning Electron Microscope | JEOL Ltd., Tokyo, Japan | ||
| Fitzpatrick JT-6 Homoloid mill | Continental Process Systems, Inc., Westmont, IL | ||
| MA35 Moisture Analyzer | Sartorius | ||
| Critical point dryer, Balzers CPD | Leica Microsysstems Inc, Buffalo Grove, IL, United States | ||
| Screw-top high pressure tubes | Ace Glass, Vineland, NJ | #8648-27 | |
| Screw-top high pressure tube plugs | Ace Glass, Vineland, NJ | #5845-47 |
Referanslar
- Ralph, J., Grabber, J. H., Hatfield, R. D. Lignin-ferulate cross-links in grasses - Active incorporation of ferulate polysaccharide esters into ryegrass lignins. Carbohydrate research. , 275-178 (1995).
- Park, S. -. H. . Expediting cellulosic biofuels agenda: Production of high value-low volume co-products and lignin down-regulation of bioenergy crops [Ph.D. thesis]. , (2011).
- Boerjan, W., Ralph, J., Baucher, M. Lignin biosynthesis. Annual review of plant biology. 54, 519-546 (2003).
- Gibson, L. J. The hierarchical structure and mechanics of plant materials. Journal of the Royal Society, Interface / the Royal Society. 9, 2749-2766 (2012).
- Dien, B. S., et al. Enhancing alfalfa conversion efficiencies for sugar recovery and ethanol production by altering lignin composition. Bioresource technology. , 102-6486 (2011).
- Fu, C. X., et al. Downregulation of Cinnamyl Alcohol Dehydrogenase (CAD) Leads to Improved Saccharification Efficiency in Switchgrass. Bioenerg Res. 4, 153-164 (2011).
- Grabber, J. H., Ralph, J., Hatfield, R. D., Quideau, S. p-hydroxyphenyl, guaiacyl, and syringyl lignins have similar inhibitory effects on wall degradability. Journal of agricultural and food chemistry. 45, 2530-2532 (1997).
- Li, X., et al. Lignin monomer composition affects Arabidopsis cell-wall degradability after liquid hot water pretreatment. Biotechnology for biofuels. 3, (2010).
- Mansfield, S. D., Kang, K. Y., Chapple, C. Designed for deconstruction--poplar trees altered in cell wall lignification improve the efficacy of bioethanol production. The New phytologist. 194, 91-101 (2012).
- Studer, M. H., et al. Lignin content in natural Populus variants affects sugar release. Proceedings of the National Academy of Sciences of the United States of America. 108, 6300-6305 (2011).
- Chen, F., Dixon, R. A. Lignin modification improves fermentable sugar yields for biofuel production. Nature. 25, 759-761 (2007).
- Ziebell, A., et al. Increase in 4-coumaryl alcohol units during lignification in alfalfa (Medicago sativa) alters the extractability and molecular weight of lignin. The Journal of biological chemistry. 285, 38961-38968 (2010).
- Park, S. -. H., et al. The quest for alternatives to microbial cellulase mix production: corn stover-produced heterologous multi-cellulases readily deconstruct lignocellulosic biomass into fermentable sugars. Journal of Chemical Technolog., and Biotechnology. 86, 633-641 (2011).
- Mol, J. N., et al. Regulation of plant gene expression by antisense RNA. FEBS letters. 268, 427-430 (1990).
- Adamo, A., et al. Transgene-mediated cosuppression and RNA interference enhance germ-line apoptosis in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 109, 3440-3445 (2012).
- Smith, N. A., et al. Total silencing by intron-spliced hairpin RNAs. Nature. 407, 319-320 (2000).
- Park, S. -. H., et al. Downregulation of Maize Cinnamoyl-Coenzyme A Reductase via RNA Interference Technology Causes Brown Midrib and Improves Ammonia Fiber Expansion-Pretreated Conversion into Fermentable Sugars for Biofuels. Crop Sci. 52, 2687-2701 (2012).
- Altpeter, F., et al. Particle bombardment and the genetic enhancement of crops: myths and realities. Mol Breeding. 15, 305-327 (2005).
- Pichon, M., Courbou, I., Beckert, M., Boudet, A. M., Grima-Pettenati, J. Cloning and characterization of two maize cDNAs encoding cinnamoyl-CoA reductase (CCR) and differential expression of the corresponding genes. Plant molecular biology. 38, 671-676 (1998).
- Mansoor, S., Amin, I., Hussain, M., Zafar, Y., Briddon, R. W. Engineering novel traits in plants through RNA interference. Trends in plant science. 11, 559-565 (2006).
- Hatfield, R. D., Jung, H. -. J. G., Ralph, J., Buxton, D. R., Weimer, P. J. A comparison of the insoluble residues produced by the Klason lignin and acid detergent lignin procedures. J Sci Food Agr. 65, 51-58 (1994).
- Sluiter, J. B., Ruiz, R. O., Scarlata, C. J., Sluiter, A. D., Templeton, D. W. Compositional analysis of lignocellulosic feedstocks. 1. Review and description of methods. Journal of agricultural and food chemistry. 58, 9043-9053 (2010).
- Sluiter, A., Hames, B., Ruiz, R., Scarlata, C., Sluiter, J., Templeton, D., Crocker, D. Determination of structural carbohydrates and lignin in biomass. Laboratory Analytic Procedure. , (2008).
- Bate, N. J., et al. Quantitative Relationship between Phenylalanine Ammonia-Lyase Levels and Phenylpropanoid Accumulation in Transgenic Tobacco Identifies a Rate-Determining Step in Natural Product Synthesis. Proceedings of the National Academy of Sciences of the United States of America. 91, 7608-7612 (1994).
- Hu, W. J., et al. Repression of lignin biosynthesis promotes cellulose accumulation and growth in transgenic trees. Nature. 17, 808-812 (1999).
- Lapierre, C., et al. Signatures of cinnamyl alcohol dehydrogenase deficiency in poplar lignins. Phytochemistry. 65, 313-321 (2004).
- Updegraff, D. M. Semimicro determination of cellulose in biological materials. Anal Biochem. 32, 420-424 (1969).
- Yemm, E. W., Willis, A. J. The estimation of carbohydrates in plant extracts by anthrone. The Biochemical journal. 57, 508-514 (1954).
- Filomena, A. P., Cherie, W., Geoffrey, B. F., Antony, B. Determining the polysaccharide composition of plant cell walls. Nature. 7, 1590-1607 (2012).
- Foster, C. E., Martin, T. M., Pauly, M. Comprehensive Compositional Analysis of Plant Cell Walls (Lignocellulosic biomass) Part II: Carbohydrates. J. Vis. Exp. (e1837), (2010).
- Department of Agronomy, Iowa State University. Particle bombardment of Hi II immature zygotic embryos and recovery of transgenic maize plants. , (2005).
- Cano-Delgado, A., Penfield, S., Smith, C., Catley, M., Bevan, M. Reduced cellulose synthesis invokes lignification and defense responses in Arabidopsis thaliana. The Plant journal : for cell and molecular biology. 34, 351-362 (2003).
- Boudet, A. M., Kajita, S., Grima-Pettenati, J., Goffner, D. Lignins and lignocellulosics: a better control of synthesis for new and improved uses. Trends in plant science. 8, 576-581 (2003).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır