Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Bir nanometre Hassasiyet Floresans Görüntüleme (Fiona)
Bu Makalede
Özet
Tek flüoroforlar FIONA'sı kullanarak nanometre hassasiyetle lokalize edilebilir. Burada FIONA tekniğin bir özet bilgi ve nasıl Fiona deneyleri tarif edilir.
Özet
Bir nanometre doğruluk (Fiona) ile floresan görüntüleme xy düzleminde nanometre hassasiyetle tek florosforlar lokalize için basit ama kullanışlı bir tekniktir. Burada FIONA tekniğin bir özeti ve rapor edilir FIONA'sı kullanılarak yapılmıştır araştırma örnekleri kısaca tarif edilmektedir. İlk olarak, nasıl optik hizalama hakkında ayrıntılar yani Fiona deneylerde, toplam iç yansıma floresan mikroskobu (TIRFM) için gerekli ekipman kurmak, tarif edilir. O kadar bir kuantum nokta ile işaretlenmiş tek bir tepe bölümü kesik miyozin Va motorun 36 nm Adım boyutunu ölçmek için FIONA kullanılması, ardından uygun olan protokolü kullanılarak immobilize Cy3 DNA tek molekülleri lokalize basit Fiona deneyi yürütmek için görüntülenmiştir. Son olarak, kalın örnekleri FIONA uygulama genişletmek için son çaba bildirilmiştir. > (Bu bir suya daldırma objektif kullanılarak, olduğu gösterilmiştir ve kuantum noktaları, sol-jel ve tavşan gözü kornealar derin batırılmış200 um), 2,3 nm yeri hassas elde edilebilir.
Giriş
1882 civarında, Ernst Abbe bir görünür ışık mikroskobu çözünürlüğü olduğu bulundu ~ λ / 2NA, (λ dalga boyu ve NA sayısal açıklık olduğu) 1,2 ~ 200 nm veya. Bu nedenle, bu boyutundan daha küçük bir amacı, bir optik mikroskop bir kırınım sınırlı bir leke olarak görülecektir. Bununla birlikte, daha yüksek bir hassasiyet ile 3, bir nokta merkezini, nesnenin konumunu belirlemek mümkündür. Bir nanometre doğruluk (Fiona) ile floresan görüntüleme xy düzleminde 4 nanometre hassasiyetle tek florosforlar lokalize için basit ama kullanışlı bir tekniktir. Lokalizasyon hassasiyet, σ μ (yani, ortalamanın standart hatası) toplandı, fotonların sayısına bağlıdır 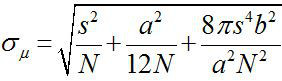 N foton sayısı olduğu, s floresan noktanın standart sapmasıdır, a,piksel görüntü detektörünün büyüklüğü, ve b, 3,4 arka standart sapmasıdır. ~ 10.000 fotonları yayan bir flüorofora için, Fiona ~ 1 nm hassasiyet 4 elde edebilirsiniz.
N foton sayısı olduğu, s floresan noktanın standart sapmasıdır, a,piksel görüntü detektörünün büyüklüğü, ve b, 3,4 arka standart sapmasıdır. ~ 10.000 fotonları yayan bir flüorofora için, Fiona ~ 1 nm hassasiyet 4 elde edebilirsiniz.
FIONA hassas bir şekilde sabit bir yayıcı konumunu, ya da (yeterince hızlı alınabilir görüntü varsayılarak) hareketli bir belirlemek için kullanılabilir. Fiona filmin kareleri sırayla uygulanan ve böylece tek bir molekülün 4 8 hareketini takip edilebilir. Foto-koruyucu reaktifler örnek ışıkla olmamasını sağlamak için gerekli olabilir. Ayrıca, flüoresan nesnenin kendisi herhangi bir boyutta olabilir, örneğin kısıtlayıcıları kırınım daha küçük ya da daha büyük, kendi zar üzerinde dağıtılmış çok sayıda floresan proteinleri ile bir organel (~ 1 mm) teşekkül edebilir. Fiona hala ortalama merkezden-of-kütlesinin çok doğru (nanometre) ortalama verim kullanma. FIONA tarafından yerelleştirme hassasiyetle büyük bir gelişme nanome çözme sağlarzaman içinde tert-ölçekli hareketleri. Bu moleküler uzunluk ölçüsü 4 8 içine mikroskopi itti.
Onun icadından bu yana, Fiona çeşidi geliştirilmiştir. Örneğin, parlak-alan bir-nanometre doğruluk (bFIONA) 9, FIONA hafif bir varyantı, görüntüleri ile görüntüleme ve iletilen ışık ile böyle Melanozomlar in vivo (pigment melanin içeren koyu nesneler) gibi yoğun nesneleri lokalize. Buna ek olarak, birden fazla boyayı Fiona gidermek için kullanılmıştır. Örneğin, ışıkla ağartma (karides) ile birlikte tek bir molekül yüksek çözünürlüklü bir 10,11 veya tek molekül yüksek çözünürlüklü ko (SHREC) 12 yaklaşık 10 nm olan, iki boya çözmek için geliştirilmiştir. (Bu kararın bu bir arayla aynı boyaları söyleyebilirim ne kadar doğru, yani dikkat edin.) Daha yakın zamanlarda, Fiona analizi bazı süper çözünürlük mikroskopi yerelleştirme sürecine katkıda böyle Stokastik optik reco gibinstruction mikroskobu (STORM) 13-15 ve geçici koyu flüoroforlar heyecan ve floresan lokalize edildiği fotoaktif localisation mikroskobu (PALM) 16,. Defalarca heyecanlı oldukça düşük boyaların yoğunluğu (az bir başına kırılma sınırlı nokta), ve daha sonra FIONA her bunların analiz, floresan toplayarak, tek bir yüksek çözünürlüklü haritayı kurabilirsiniz. Çözünürlüğü sonra sadece her bir boya dışarı koyar fotonların sayısı, yanı sıra satın alma sırasında (örneğin dahil, mikroskop sahne) numune sabit tutmak gibi şeyler sınırlıdır.
Bu makalede, bir Fiona tekniğin bir özeti ve kısaca Fiona bildirilmektedir kullanılarak yapılmıştır araştırma örneklerini tarif eder. İlk olarak, nasıl optik hizalama hakkında ayrıntılar yani Fiona deneylerde, toplam iç yansıma floresan mikroskobu (TIRFM) için gerekli ekipman kurmak, tarif edilir. Sonra nasıluygun protokolleri kullanarak hareketsiz Cy3-DNA tek moleküllerini lokalize basit Fiona deneyi yürütmek, gösterilmektedir. Bundan sonra, Fiona'yla kullanımı kuantum nokta ile işaretlenmiş tek bir tepe bölümü kesik miyozin Va motorun 36 nm aşaması boyutunu ölçmek için sunulmuştur. Miyozin Va aktin filamentler boyunca translocating Hücresel kargo taşıyan bir temel süreçsel motoru proteindir. Burada Va kesik oluşturmak miyozin adım boyutuyla ilgisiz etki ayrılması için kullanılan ve bir FLAG etiketi C-terminaline ilave Anti-Flag antikorları ile işlevselleştirilmiş kuantum noktaları ile etiketleme kolaylığı sağlamak için. Bu deney miyozini yavaşlatmak ve her karede iyi bir foton sayısı almak için yeterince uzun pozlama süreleri kullanımına izin düşük ATP altında yapılır. Herhangi yeterince parlak floresan etiket aşağıdaki protokolde ikame edilebilir. Son olarak, kalın örnekleri FIONA uygulamasını uzanan son çaba bildirdi. Proof-of-prensip olarak, kuantum noktalar batırılmışSol-jel ve tavşan gözü kornealar ve sonra yansıması ve FIONA'sı kullanılarak lokalize. Görüntüleme için, NA ile 60X su daldırma objektif bu hedefi daha önceden kullanılan 100X immersiyon yağı hedefi daha uzun çalışma mesafesi vardır, çünkü 1.2 kullanıldı =. Objektifine büyütmede kaybını telafi etmek için fazladan bir büyütme merceği (3.3X veya 4.0x) emisyon yoluna yerleştirilen edilmiştir. Buna ek olarak, epi-floresans (değil TIR) mikroskopisi kalın örneklerde derin bölgeleri ulaşmak için kullanılması gerekir. Bu sol-jel ve 2-3 nm hassasiyetle lokalize edilebilir tavşan gözü kornealar (Z> 200 mikron) derin batırılmış kuantum noktalar gösterilmiştir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Etik Açıklama: tavşanlardan Kornea dokusu Illinois Kurumsal Hayvan Bakımı ve Kullanımı kılavuzların Üniversitesi doğrultusunda toplanmıştır.
1. TIRFM Kur
NOT: lazer güvenlik gözlük Tüm zaman giyin.
- Malzeme Listesi'nde yer gerekli tüm optik bileşenleri mevcuttur ve uyum için hazır olduğundan emin olun. Gerekirse, diğer şirketlerden eşdeğer fonksiyonları ile değiştirmeleri kullanın. Aynalar ve lensler kullanımı lazer eşleşen anti yansıtıcı (AR) kaplamalar olmalıdır emin olun.
- Mikroskop arka bağlantı noktası merkezinin yüksekliği tüm optik bileşenlerin yükseklikleri ayarlayın.
- Lazer, lazer çekim ve ND filtre (ler) monte edin. Görünür ışın tutarken mümkün olduğunca düşük lazer gücü aşağı zayıflatmak ND filtreleri kullanın. Uygun altıgen tuşları ile vidalarını sıkın.
- Bir ışın yolu planlamak ve optik masaya bant veya işaretleyici (nokta ile işaretleyinŞekil 1'de ted mavi çizgiler). Kolaylık olması açısından, optik masaya delik hattı boyunca düz bir koridor tutun.
- Yer ayna M1 ilk dik açı fırsatta (Şekil 1). Planlanan ışın yolunun ikinci düz bir bölüm boyunca iki süsen yerleştirin. Konumunu ve lazer süsen geçer şekilde M1 eğimini hem ayarlayın.
- Yer ayna M2 ikinci dik açı fırsatta (Şekil 1). Yolun üçüncü düz kesit boyunca 10X ışın genişletici (L1 ve L2, Şekil 1) yerleştirin. Işın genişletici optik masa ve planlanan ışın yolu hem de paralel olduğunu eğme gibi ayarlayın.
- Lazer, ışın her iki lenslerin merkezleri ile düz bir şekilde gider M1 ve M2 yinelemeli gibi ayarlayın. Genişletilmiş ışın demeti profili Gauss olmayan kırkılmış kadar bu adımı tekrarlayın.
- (L1 ışınını ortalamak için Fi M1 ayarlayınsaat'in 1) ve M2 yinelemeli L2 kiriş (Şekil 1) merkezi. Kötü bir ışın profili, genellikle lazer kesilmiş olduğu anlamına gelir; Göz ile ışın profilini kontrol etmek için ışın genişletici sonra ışın engellemek için beyaz bir parça kağıt kullanın. Yüksek hassasiyetli analizi için, optik bir ışın profilcisini kullanmak.
- Işın collimated öyle ki L1 ve L2 arasındaki mesafeyi ayarlayın. Tekrarlayın Adım 1.8 ve 1.9 gerekirse.
NOT: kiriş boyutu mesafe ile değişmez zaman, kiriş bir TIRFM kurulum için yeterli collimated. Ayrıca ışın kolimasyon artırmak için, bu tür bir makaslama interferometre gibi araçlar kullanılabilir. Genişlemesinden sonra tipik bir kiriş boyutu ~ 20 mm'dir. - Shutter, lazer. Mikroskop objektif sökün ve bir floresan hizalama hedef vida. Yer M3 ve M4 (Şekil 1) mikroskop portuna ve taret içindeki renkli aynadan üzerine genişletilmiş ışını doğrudan yansıtır. Lazer ışını t sıçrar emin oluno dikroik ve tavana doğru.
- Floresan hedef ışınının parlak bölümünü ortalamak için M3 ayarlayın ve M4 ışın eğim dikey olarak ayarlamak için.
- Shutter, lazer ve geri hedefini vida. Önceki adımda hizalama yapılırsa iyi hedefini çıkan simetrik bir nokta olmalıdır. İnce ayar M3 ve M4 eğilmeler amacı dışında lazer gücü ve ışın profili optimize etmek.
- Mikroskop bir EMCCD kamera monte ve bir bilgisayara kamera bağlamak. Kamera için yazılımını başlatın.
- Mikroskop floresan örnek (Flüoroforlann çözelti) monte edin. Kameradaki parlak floresan noktada bak. Odak değiştiğinde nokta ekranda kaymamasını kontrol edin.
- L3 odak uzunluğu (~ 30 cm) eşittir hedefi arka odak düzlemi bir mesafede XYZ çeviri sahnede TIR lens (L3, Şekil 1) yerleştirin. L3 pozisyonunu ayarlayınve lazer lens merkezinden geçer ki.
- Kiriş paralelleştirilmesini ayarlamak için ışın yolu boyunca L3 Çevir. Kiriş hala monitörde merkezli ve şekli simetrik olduğundan emin olun.
NOT: TIR lens odak uzunluğunun azaltılması ile örnek düzlem artar aydınlatma alanı. Genel olarak, set-up sığabilir küçük odak uzunluğunu kullanın. - Amacın kirişi yatırmak için ışın yoluna dik, L3 çevirir. TIR elde edilir, öyle ki, TIR lens tercüme edin. Iyi SNR almak için EMCCD kamera ve ince ayar L3 ile floresan boncuk örneği gözlemleyin.
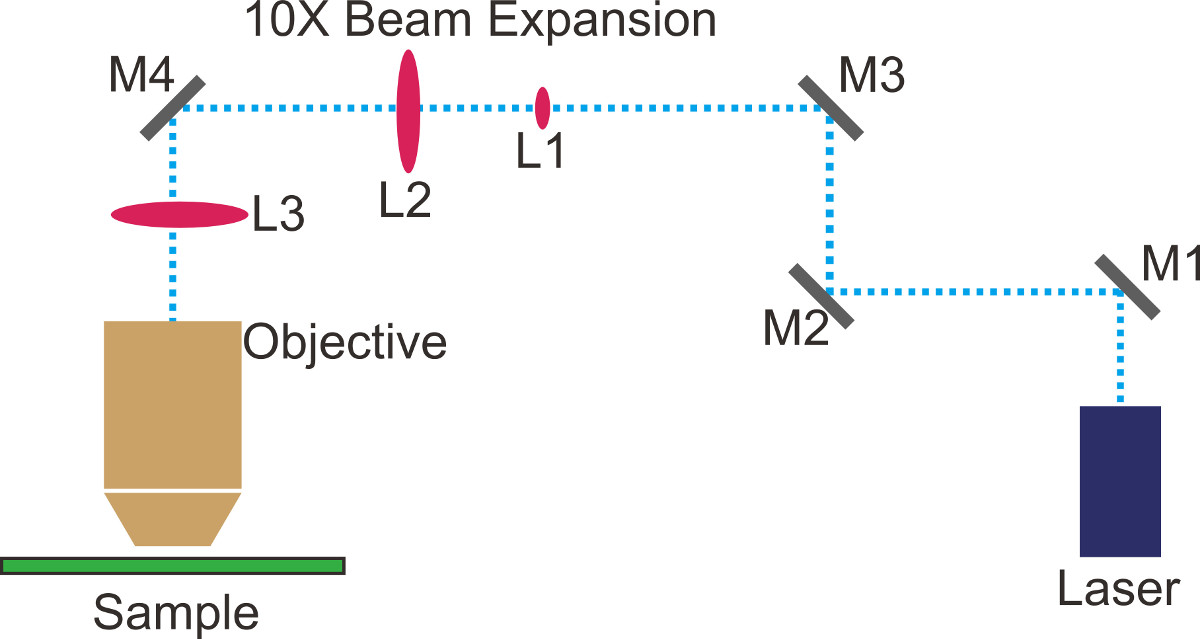
Toplam iç yansıma floresan mikroskobu (TIRFM) için 1. Optik yapılandırmasını Şekil.
Cy3 DNA 2. FIONA
- Cyalın mikroskop slaytlar ve lamelleri: GKD 2 O ve izopropanolle mikroskop slaytlar ve lamelleri durulayın ve azot gazı ile kurulayın; Ar plazma altında 5 dakika boyunca plazma temizleyici slaytlar ve lamelleri yerleştirin.
- (Şekil 2 kabataslak) örnek odalarını Construct.
- Bankta bir doku yerleştirin ve sonra doku üstüne objektif bir parça kağıt koyun. Objektif kağıt üzerinde slayt yerleştirin. Slayt temiz tarafı yukarı olduğundan emin olun.
- Merkezinde 3-5 mm arasında bir boşluk bırakarak, uzun kenarları boyunca slayt üzerine çift taraflı bant ile iki şerit uygulanır. Slayt üstüne temizlenmiş lamel yerleştirin. Lamel temiz tarafı slayt baktığından emin olun.
- Çift taraflı bant üzerinde aşağı basmak için pipet kullanın. Bant sadece coverslip altında kalacak şekilde slayt aşırı bandı çıkarmak için bir jilet kullanın.
Not: bölmesinin açık uçları açık bırakılır ve benzeri gibi giriş ve çıkış hizmet verirlerlet. Kamara hacmi birkaç mikrolitredir.

Tipik bir örnek odasının Şekil 2. Eskiz: (a) en görünüşüdür. (B) sağdan Yandan görünüm; Ön (c) yan görünüşüdür.
- Örnek odalarının iç yüzeyleri üzerinde Cy3 DNA hareketsiz.
- T-50 tamponu (10 mM Tris-HCI pH 8.0, 50 mM NaCI) hazırlayın. 1 mg / ml nihai konsantrasyonda, T-50 BSA-biyotin hazırlayın. 10 mg / ml nihai konsantrasyonda, T-50 BSA çözülerek T50-BSA tamponu hazırlayın.
- 0.5 mg / T50-BSA tamponu ml NeutrAvidin hazırlayın. 5-10 pM nihai konsantrasyonda biyotinile Cy3 etiketli DNA T50-BSA içinde (Cy3-DNA) hazırlayın.
- Örnek odasına pipetle 10 ul BSA-biyotin (1 mg / ml). 5 dakika bekleyin.
- 40 ul T50-BSA ile bölmesi yıkayın. Örnek odasına pipetle 10 ul nötravidin (0.5 mg / ml). 5 dakika boyunca inkübe edin.
- 40 ul T50-BSA ile bölmesi yıkayın. Numune bölmesindeki balona, 20 ul Cy3 ile DNA arasında değişir. 5 dakika boyunca inkübe edin ve daha sonra 80 ul T50-BSA ile bölmesi yıkayın.
- Resim Cy3 DNA TIRFM altında, bir molekülleri.
- 50 ul 6-hidroksi-2,5,7,8-, 1 ul Protocatechuate-3,4-dioksijenazı (PSD, 5 uM), 4 ul protokateşuik asit (ABA, 62.5 mM) ile muamele görüntüleme tamponu (100 ul) hazırlayın tetrametilkroman-2-karboksilik asit (T-50 olarak Trolox®, 2 mM) ve 45 ul T50-inkübe edilmişlerdir.
- Ve 30 ul görüntüleme tamponu Pipet 8-10 dakika bekleyin.
- Yeşil lazer (532 nm) ile donatılmış bir TIRFM üzerinde görüntüleme için örnek montaj, 100X immersiyon yağı objektif (1.45 NA) ve bir EMCCD kamera.
- 1,0 için örnek bir film Edinme 100'e 100 ile 500 msn ve 25 EM kazanç pozlama süresini ayarlayın00 kare.
- Cy3-DNA kaydedilen görüntülerde Fiona veri analizi yapın.
- Etkin piksel boyutunu belirlemek (yani nanometre piksel dönüşüm faktörü) fiziksel piksel boyutunu bölerek toplam büyütme (herhangi bir ekstra büyütmelerle çarpılır mikroskop objektif büyütme) tarafından (EMCCD kamera özellikler sayfasında okur).
- CCD hassasiyetini görüntü alımı sırasında kullanılan (yani, CCD kamera özellikler sayfasında okumak, A / D sayımı, başına elektronlar) elektron çarpanı (EM) kazanç bölerek sayıları foton piksel yoğunluğunun gelen dönüşüm faktörünü belirlemek.
- Derleme ve Fiona analiz için FIONA.pro çalıştırın. Girişi (Adım 2.5.1 'dan itibaren) etkin piksel boyutu ve (Adım 2.5.2' dan itibaren) foton sayısına yoğunluğundan dönüşüm faktörü, elde edilen görüntüyü almak için bu IDL programı kullanın ve Fiona analiz için noktalar seçin.
Not: Sonunda, programmingm irade çıktı 2B Gauss fonksiyonlarının yanı sıra, toplam foton numaraları ve yerelleştirme hassasiyetle uydurma sonuçları. Tipik bir sonuç temsilcisi sonuçları ve Şekil 4c-4d bölümünde gösterilir. - Derleme ve foton sayımı karakterize etmek phcount.pro çalıştırın. (Adım 2.5.2 'dan itibaren) foton sayısına yoğunluğundan alınan görüntü ve girişe dönüşüm faktörü ithal etmek, ışıkla önce flüorofora tarafından yayılan fotonların ortalama sayısını ölçmek için bu IDL programı kullanın.
NOT: Program daha sonra, (manuel seçim bir seçenek) otomatik floresan noktalar tespit çerçeve sayıda fonksiyonu ve çıkış olarak foton sayımı izlerini foton sayısı hesaplar.- Kötü izleri atın ve temel düzeltme için ışıkla sonra kare aralıkları belirtin. Sonunda, program çıktısı tüm noktalar için toplam foton numaralarının listesi değildir atılır olacaktır. Daha sonra foton sayıları dağılımını çizmek ve dağılımının uygunBir üslü ile yon ortalama foton numarasını elde etmek. Tipik bir sonuç temsilcisi sonuçları bölümünde gösterilen ve 4e-4f Rakamlar edilir.
3. Fiona Uygulamalı Nanometre Ölçeğinde Motor (örneğin, Aktin üzerinde miyozin) Dynamics belirlememize
- Aktin polimerize Fiona deneyden bir gün önce (yani F-aktin hazırlamak).
- Genel aktin tamponu ile mi, 10 mg / G-aktin (monomer) ve biyotin G-aktin (monomer) sulandırın. De tamamen çözülmüş olduğundan emin olun, ve buz üzerinde hem tutmak için karıştırın.
- 1.5 ml mikrosantrifüj tüpü içinde 1.7 ul biyotin, G-aktin 10 ul, G-aktin (monomer) karıştırın. 100 ul buz gibi soğuk tampon aktin polimerizasyonu ekleyin.
- 4 ° C'de bir gece beklettikten sonra (F-aktin oluşturulan) ve daha sonra 1 ml bir toplam hacme GKD 2 O ekleyin.
- Deneylerde daha sonra kullanılmak üzere 4 ° C 'de aktin filamanlarını (F-aktin) saklayın.
NOT: Filamentler parçalanır ve zaman içinde kısaltmak, ancak en az iki hafta boyunca kullanılabilir olacaktır.
- Görüntüleme için örnek hazırlayın.
- (Protokol 2.1 ve 2.2 'de tarif edildiği gibi), bir numune haznesi yapın. Ile kombine edilmiştir 2 O 1 mg / ml BSA, 20 ul biyotinile edilmiş Pipet 10 dakika boyunca inkübe edin. 30 ul GKD 2 O. ile durulayın
NOT: Bu bloklar, cam yüzeyi ve aktin filamentler bağlanması için biotin belirlemektedir. Biyotinile edilmiş, poli-L-lisin - polietilen glikol (PEG-PLL) ile aynı fonksiyonu görür. - 0.5 mg / ml nötravidin Pipet. 2 dakika boyunca inkübe edin ve daha sonra 30 ul M5 tamponu ile bölmesini yıkayın.
- Hazırlanan F-aktine Pipet nihai konsantrasyon ~ 0,004 mg / ml ila genel aktin tamponu içinde 25 kez seyreltilmiştir. , 10 dk bekleyin 30 ul tamponu ile odasını durulayın.
- A bir nihai konsantrasyonu o M5 tamponu (20 mM HEPES (pH 7.6), 2 mM MgCI2, 25 mM KCI, 1 mM EGTA) içinde FLAG etiketleri ile 30 kat seyreltiniz Va miyosinf 250 nM. (Üreticisinden kullanma kılavuzuna göre Qdot705 Antikor Birleşme Kit kullanarak Anti-FLAG antikorlar ve Qdot705 gelen konjuge ~ 1 mcM) 1 ul Anti-FLAG-Qdot705 ile 1 ul miyozini karıştırın. 10 ul doldurmak için 8 ul M5 ekleyin. Pipet ve aşağı yukarı iyice karıştırın. Buz üzerinde 10 dakika süreyle inkübe edin.
NOT: Bu ~ 25nM miyosin konsantrasyonda kullanıldığında, 1 ila 4, motor kuantum noktaları bir karışımını verir.
- (Protokol 2.1 ve 2.2 'de tarif edildiği gibi), bir numune haznesi yapın. Ile kombine edilmiştir 2 O 1 mg / ml BSA, 20 ul biyotinile edilmiş Pipet 10 dakika boyunca inkübe edin. 30 ul GKD 2 O. ile durulayın
- Aktin üzerinde yürüyen miyozin görüntüleme.
- Karıştırılarak görüntüleme tamponu (100 ul) hazırlayın 84 ul M5, BSA (1 mg M5 tampon / ml BSA), 1 ul ATP (GKD 2 O 50 uM), 2 ul DTT (500mM GKD 2 O), 1 CK ul (500 U / ml), 5 ul CP (200 mM), 1 ul PCD, 4 ul PCA, 1 ul miyozin Qdot sonra 2.5 nM miyozin konsantrasyonu ve 1 ul BME için başka bir 10-kat seyreltilmiştir.
- 20 ul görüntüleme tamponu Pipet odasını örnek ve 8-10 dakika inkübe.
- Görüntü T örnek30 msn pozlama IRF mikroskop. En az 1000 kare edinin. Gerekirse Adım 3.3.1 miyozin-Qdot seviyesini ayarlayın.
- Veri analizi yapın ve miyozin yürüme adım boyutunu bulabilirsiniz.
- ImageJ 17 video dosyasını açın ve hareketli bir nokta etrafında video kırpmak. Spot asla kenarının 20 piksel içinde alır yeterince büyük bir alanı kırpmak ve video başka noktalar vardır emin olun. Bu noktada doğrusal bir yolda hareket emin olun.
- X oluşturmak için video aracılığıyla noktayı izlemek ve y her ve videonun her karesine Fiona analizi (Adım 2.5.3) uygulayarak, piksel, zaman içinde koordinatları.
- Önceki bölümde açıklandığı gibi, nanometre pikselleri dönüştürün.
- Zamanın bir fonksiyonu olarak başlangıç konumundan yer değiştirme hesaplayın.
- Miyozin yürüyüş adımları edinmek için deplasman t-testi çalıştırın.
Not: t-testi (step_t_test.zip) için sunulan program IDL ve con kodlanmıştırklasörde bulunan 14 altrutinlerin ibarettir.- IDL altrutinlerin tüm açın ve iki kez tüm derlemek. Sonra mtltyanalysis_ttest.pro çalıştırın ve tek bir sütunda sadece uzaklık verilerini içeren bir metin dosyasını seçin. Bir çıkış Excel dosyası ham veri, uyum ve adım boyutunu içeren, oluşturulur.
- Adım boyutu sütundaki tüm sıfır değerleri silin. Kökeni veya MATLAB kullanarak adım boyutları dağılımını çiziniz. Histograma bir Gauss takın.
Not: sıfır arasında değişen aşamalı bir adım yok önceki çerçeveden alınır anlamına gelir, çünkü sıfır değerleri Adım boyutları silinmesi gerekir. (Şekil 5'de gösterildiği gibi) uygun 36 nm civarında bir tepe noktası verir.
FIONA 4. Numune Hazırlama Kalın
- Sol-jel kapsüllü kuantum noktalar hazırlayın.
- Karıştırın 4.5 mi TMOS, 1 mi GKD 2 O ve 100 ul HCI (120 mM) getirilmiştir. Ultrasonik temizleyici sp 30 dakika boyunca buz üzerinde karışımın sonikasyonMalzeme Listesi ecified (frekans = 40 kHz, ısıtıcı = off). Çözüme her 10 dk karıştırın.
- 1.5 mi HEPES (50 mM, pH = 7.2) içinde 1.5 ul Qdot605 seyreltin. Önceki adımdaki 1.5 ml TMOS ile çözüm karıştırın.
- Bir cam alt çanak içine karışımı dökün. 1. 5 saat boyunca 4 ° C'de cam alt Parafilm ile çanak ve mağaza mühür.
- Numune çanağı PBS içerisinde 2 ml% 1 BME ekleyin ve görüntüleme önce 30 dakika oda sıcaklığında inkübe edin.
- Kuantum noktaları ile boyandı kornea örnek hazırlayın.
NOT: Tavşan gözler Dr Marina Marjanovic gelen hediyeler vardı.- Gözlerden kornea ayırın ve 3 mm x 3 mm parçalar halinde kesin.
- 1 ml PBS içinde 1 ul streptavidin-Qdot 605 seyreltin. 4 ° C'de 1 nM Qdots çözeltisi ile kornea doku inkübe 1 saat boyunca ° C. PBS ile doku yıkayın.
- Temiz bir cam slayt ve # 1.5 lamel alın. , Uzun kenarı boyunca cam slayt üzerine çift taraflı bant 4 katmanları koymaknd önceki bant çift taraflı bant paralel başka bir 4 kat koymak ve aralarında yaklaşık 1 cm bir kanal bırakın. Kanalın ortasında içinde önceki aşamada elde edilen doku koyun ve bir lamel ile örtün.
- Yavaşça lamel tarafta basın o kasetleri sopa yapmak. Görüntüleme önce 50 ul PBS ile kanal ıslatın.
- Sol-jel ve korneada Görüntü kuantum noktalar.
- Kalın örneklerinde Fiona görüntüleme için, 0.27 mm veya 0.28 mm çalışma mesafesi ile 60X su daldırma hedefi çalışma mesafesi ile 60X su daldırma objektif kullanın.
- Mikroskop örnek monte edin. Bu epi-floresan modu ulaşacak şekilde TIRF lens ayarlama (yani, lazer ışını lamel karşı açı objektif çıkar). Ekstra bir büyütme merceği (3.3X veya 4.0x) takın.
- Istenen z konumuna (örneğin> 200 mikron) için hedefi odak düzlemini hareket ettirin. Hareketsiz rekor görüntülerinumunede kuantum noktalar.
- Bu protokolün 2.5 bölümünde açıklandığı gibi Fiona analizi yapın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Tipik amaç tipi TIRFM kurulumu, Şekil 3 'de gösterilmiştir. İlk olarak, yüzey hareketsizleştirilmiş Cy3 DNA örneği görüntülenmiştir. Tipik bir görüntü Şekil 4a'da gösterilmektedir. Görüntü EM kazanç = 50 ve CCD hassasiyet = kamera için 12,13 ile, pozlama süresi ile 0.5 sn alınmıştır. Tek bir Cy3 ile DNA molekülünün bir nokta-yayılmış bir fonksiyonu (PSF) Şekil 4b'de gösterilmiştir renk çubuğu piksel yoğunluğunun öl?...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Fiona 1 msn 4 8 aşağı nanometre hassas ve zamansal çözünürlüğe sahip bir floresan yayıcı (organik flüorofor ya da kuantum nokta) konumunu lokalize bir tekniktir. Yeterli fotonlar toplandığı zaman, bu tekniğin çok daha doğru kırılma sınırı (~ 200 nm) daha floresan emitörün konumunu belirlemek için izin verir ve bu nedenle bu tekniği geleneksel / konvansiyonel optik mikroskopi 4 ile görülmemiştir ne gözlemlemek için bir yol açar - 8. Onun icadından bu yana...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar hiçbir rakip mali çıkarlarının olmadığını beyan ederim.
Teşekkürler
Bu çalışma NIH Hibe 068.625, NSF Bağış 1063188 ve 0822613. Özel teşekkür tavşan gözlerinde hediye için İleri Bilim ve Teknoloji Beckman Enstitüsü'nün Dr Marina Marjanovic gitmek Yaşayan Hücrelerinin Fizik Merkezi tarafından desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Double-sided tape | 3M | ~75 µm thick | |
| EMCCD camera | Andor Technology | DU-897E-CS0-#BV | |
| Ultrasonic cleaner | Branson | 2510 | |
| Fluorescence filter set | Chroma | 49016 | |
| Actin polymerization buffer | Cytoskeleton | BSA02 | |
| Biotin G-actin | Cytoskeleton | AB07 | |
| G-actin | Cytoskeleton | AKL95 | |
| General actin buffer | Cytoskeleton | BSA01 | |
| Laser shutter (with driver) | Electro-Optical Products Corp. | SH-10-MP | |
| IDL | Exelis Visual Information Solutions | ||
| Neutravidin | Fisher Scientific | PI-31000 | |
| Coverslip | Fisherbrand | 22X30-1.5 | 0.16-0.19 mm thick |
| Microscope slide | Gold Seal Microslides | 30103X1 | 0.93-1.05 mm thick |
| Plasma cleaner | Harrick Plasma | PDC-001 | |
| Glass bottom dish | In Vitro Scientific | D35-20-1.5-N | |
| Cy3-DNA oligos | Integrated DNA Technologies | 5'-Cy3/GCCTCGCTGCCGTCGCCA-3'Bio | |
| Fluorescent beads | Invitrogen | T-7280 | |
| Qdot 605-streptavidin | Invitrogen | Q10101MP | |
| Qdot605 | Invitrogen | Q21301MP | |
| Qdot705 | Invitrogen | Q22021MP | |
| Qdot705 Antibody Conjugation Kit | Invitrogen | Q22061MP | |
| MATLAB | MathWorks | ||
| Optical table | Newport Corp | RS4000 Series | |
| 60X Objective | Nikon | Plan Apo VC 60x WI | |
| 100X Objective | Olympus | PlanApo 100X/1.45 Oil ∞/0.17 | |
| 60X Objective | Olympus | UPlanApo 60X/1.20W | |
| Inverted microscope | Olympus | IX71/IX70/IX81 | |
| Origin | OriginLab | ||
| Anti-FLAG antibody | Sigma Aldrich | F7425-.2MG | |
| ATP | Sigma Aldrich | A7699 | |
| BME | Sigma Aldrich | 63689-25ML-F | |
| BSA | Sigma Aldrich | A7906 | |
| BSA-biotin | Sigma Aldrich | A8549-10MG | |
| CK | Sigma Aldrich | C3755 | Creatine Phosphokinase from rabbit muscle |
| CP | Sigma Aldrich | P1937 | Phosphocreatine di(tris) salt |
| DTT | Sigma Aldrich | 43815 | DL-Dithiothreitol |
| EGTA | Sigma Aldrich | E3889 | Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid |
| HCl | Sigma Aldrich | 93363-500G | |
| HEPES | Sigma Aldrich | H0887 | |
| KCl | Sigma Aldrich | P9333 | |
| MgCl2 | Sigma Aldrich | M1028 | |
| NaCl | Sigma Aldrich | S7653 | |
| PCA | Sigma Aldrich | 03930590 | Protocatechuic acid |
| PCD | Sigma Aldrich | P8279 | Protocatechuate-3,4-dioxygenase |
| TMOS | Sigma Aldrich | 341436-25G | Tetramethyl orthosilicate |
| Tris-HCl | Sigma Aldrich | 93363 | |
| Trolox | Sigma Aldrich | 238813 | 6-hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid |
| 1” diameter broadband dielectric mirrors with mounts | Thorlabs | BB1-E02, KM100 | Quantity: 2 |
| ½” diameter posts | Thorlabs | TR4 | Quantity ≥ 6 |
| 10X beam expander | Thorlabs | BE10M-A | |
| 2” diameter f = 300 mm lens with mount | Thorlabs | LA1256-A, LMR2 | TIR lens |
| Fluorescent alignment target | Thorlabs | VRC2SM1 | |
| Laser safety goggles | Thorlabs | LG3 | |
| ND filter(s) | Thorlabs | FW1AND | |
| Optical beam profiler | Thorlabs | BP209-VIS | |
| Post-mounted iris diaphragm | Thorlabs | ID25 | Quantity: 2 |
| Shearing interferometer | Thorlabs | SI100 | |
| XYZ translation stage, ½” travel | Thorlabs | T12XYZ | |
| Laser | World Star Technologies | TECGL-30 | 532 nm, 30 mW |
Referanslar
- Abbe, E. The Relation of Aperture and Power in the Microscope. Journal of the Royal Microscopical Society. 2 (3), 300-309 (1882).
- Abbe, E. The Relation of Aperture and Power in the Microscope (continued). Journal of the Royal Microscopical Society. 2 (4), 460-473 (1882).
- Thompson, R. Precise Nanometer Localization Analysis for Individual Fluorescent Probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Yildiz, A., et al. Myosin V Walks Hand-Over-Hand: Single Fluorophore Imaging with 1.5-nm Localization. Science. 300 (5628), 2061-2065 (2003).
- Yildiz, A., Tomishige, M., Vale, R. D., Selvin, P. R. Kinesin Walks Hand-Over-Hand. Science. 303 (5658), 676-678 (2004).
- Yildiz, A., et al. Myosin VI Steps via a Hand-over-Hand Mechanism with Its Lever Arm Undergoing Fluctuations when Attached to Actin. Journal of Biological Chemistry. 279 (36), 37223-37226 (2004).
- Yildiz, A., Selvin, P. R. Fluorescence Imaging with One Nanometer Accuracy: Application to Molecular Motors. Accounts of Chemical Research. 38 (7), 574-582 (2005).
- Toprak, E., Yildiz, A., Hoffman, M. T., Rosenfeld, S. S., Selvin, P. R. Why kinesin is so processive. Proceedings of the National Academy of Sciences. 106 (31), (2009).
- Kural, C., et al. Tracking melanosomes inside a cell to study molecular motors and their interaction. Proceedings of the National Academy of Sciences. 104 (13), 5378-5382 (2007).
- Gordon, M. P., Ha, T., Selvin, P. R. Single-molecule high-resolution imaging with photobleaching. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6462-6465 (2004).
- Qu, X., Wu, D., Mets, L., Scherer, N. F. Nanometer-localized multiple single-molecule fluorescence microscopy. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11298-11303 (2004).
- Churchman, L. S., Ökten, Z., Rock, R. S., Dawson, J. F., Spudich, J. A. Single molecule high-resolution colocalization of Cy3 and Cy5 attached to macromolecules measures intramolecular distances through time. Proceedings of the National Academy of Sciences of the United States of America. 102 (5), 1419-1423 (2005).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-Dimensional Super-Resolution Imaging by Stochastic Optical Reconstruction Microscopy. Science. 319 (5864), 810-813 (2008).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Meth. 3 (10), 793-796 (2006).
- Bates, M., Huang, B., Dempsey, G. T., Zhuang, X. Multicolor Super-Resolution Imaging with Photo-Switchable Fluorescent Probes. Science. 317 (5845), 1749-1753 (2007).
- Betzig, E., et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313 (5793), 1642-1645 (2006).
- Abramoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics international. 11 (7), 36-42 (2004).
- Enderlein, J., Toprak, E., Selvin, P. R. Polarization effect on position accuracy of fluorophore localization. Optics Express. 14 (18), 8111-8120 (2006).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative comparison of algorithms for tracking single fluorescent particles. Biophysical Journal. 81 (4), 2378-2388 (2001).
- Rasnik, I., McKinney, S. A., Ha, T. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3 (11), 891-893 (2006).
- Zhuang, X., et al. A Single-Molecule Study of RNA Catalysis and Folding. Science. 288 (5473), 2048-2051 (2000).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An Oxygen Scavenging System for Improvement of Dye Stability in Single-Molecule Fluorescence Experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır