Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kerevit ve yüzgeç Sistemi: Sinir Kordon ve Motorlu Pattern Extracellular Recordings ve Diseksiyon için Pratik Kılavuzu
Bu Makalede
Özet
Here we describe the dissection of the crayfish abdominal nerve cord. We also demonstrate an electrophysiological technique to record fictive locomotion from swimmeret motor neurons.
Özet
Burada kerevit karın sinir kordonu diseksiyonu göstermektedir. Hazırlık son iki göğüs gangliyonları (T4, T5) ve karın ganglionlar zincirini (A6 A1) içermektedir. Yüzgeç sistemi: ganglion Bu zincir pleopods (swimmerets) koordineli lokomosyon sürücüler santral sinir sistemi (MSS) kısmını kapsamaktadır. Bu kerevit her yüzgeç ritmik alternatif aktivite 1-3 üretir kendi bağımsız desen üreten çekirdek tarafından tahrik beş yılı aşkın bir süredir bilinmektedir. motor nöronlar, her yüzgeç ve kas anatomik ve fonksiyonel olarak farklı popülasyonlar 4 iki içermektedir innerve. Bir yüzgeç geri çekilmesi (güç inme, PS) sorumludur. Diğer yüzgeç protraksiyonuna (dönüş inme, RS) sürücüler. Yüzgeç sisteminin motor nöronlar kendiliğinden in vivo olarak kaydedilen model ile aynı olan bir hayali motor modelini üretmek mümkün 1.
Bu raporun amacı, ritim üreten ağları ve öğrencilerin pratik laboratuar dersleri için bağımsız microcircuits koordinasyonu çalışmak için ilginç ve kullanışlı bir model sistemini tanıtmaktır. sağlanan protokol, ganglionlar izole zincirinin çivileme ganglionlar desheathing ve izole sinir sisteminden ekstraselüler swimmerets kurgusal motorlu desen kayıt, kerevit karın sinir kordonu diseksiyon için adım adım yönergeler içerir.
Ayrıca, biz dendritler hücre kaydedilen yüzgeç nöronların aktivitesini izleyebilirsiniz. İşte biz de kısaca bu teknikleri tanımlamak ve bazı örnekler sunmak. Ayrıca, yüzgeç nöronların morfolojisi çeşitli boyama teknikleri kullanılarak değerlendirilebilir. Burada boya dolu nöronlar ve yüzgeç motor nöron havuzları Dolgularda (iyontoforez ile) hücre içi örnekler sunmak. Bizim laboratuvardaBiz hücresel düzeyde microcircuits arasındaki kurgusal lokomosyon, MSS aktivitesine duyusal geribildirim etkisi ve koordinasyon temel fonksiyonlarını incelemek için bu hazırlık kullanın.
Giriş
kerevit swimmerets duruş kontrolünde bir işlevi yerine ve hayvanlar ileri yüzmek ritmik zaman yendi, kendi Burrows veya kadın kendi yumurta 5, 6 havalandırır havalandırın. Sinyal kerevit, Pacifastacus leniusculus ve swimmerets, beşte ikinci gelen çiftler meydana Karın 7 her tarafında bir uzuv ile karın segment. merkezi sinir sistemi hayvanda yanı sıra izole edilmiş sinir kablosu hazırlanmasında yüzgeç hareketini tahrik kendi ritmik motorlu kalıbında üretir. Duyu geri bildirim veya azalan girişi mevcut olduğunda üretilen ritmik motorlu model kurgusal lokomosyon 1, 2 denir. Yüzgeç sisteminde bu motorun model sağlam hayvan ölçülen swimmerets aktivitesi herhangi parametrede farklı değildir.
Her bir yüzgeç hareketi bulunan ve bir c sınırlı bir mikro devre ile tahrik edilirhemiganglion 1 orresponding -. 3 Her mikrodevre beş tanımlanan olmayan çivileme internöronlardan içeren bir desen üreten çekirdek vardır. Onlar işlevsel olarak karakterize edilebilir ya Güç İnme önleyici (IPS) ya da Return İnme önleyici (IRS) 8. Kendi alternatif aktivite karşılıklı inhibisyonu 9 ile tahrik edilir ziyade bu IPS ve IRS internöron, endojen osilatörler değildir. Bu internöron doğrudan yüzgeç motor nöronları inhibe Çünkü, alternatif PS-RS hareketi 10 oluşturulur. Hareket ancak, sadece, aynı zamanda farklı bağımsız microcircuits koordinasyon aktivitesi üretilmesini gerektirir, ancak değildir. Yüzgeç sisteminde bu koordinasyon uzuvlar doğru zamanlarda aktif olmasını sağlar koordine mikro devre ile kurulur. Bu mikrodevreli, her segmentteki 11-15 belirlenmiş üç nöronlar tarafından inşa edilmiştir.
Bu protokol, th sağlare ilk kez bir adım-adım diseksiyonu kılavuz ganglionlar (A6 T4, Şekil 1) zincirini izole etmek. Biz izole karın sinir kablosunu pin ve her ganglion desheathe nasıl gösterir. Bu izole edilmiş sinir sistemi hazırlanırken, yüzgeç hareketten sorumlu nöronlar elektrofizyolojik ve morfolojik deneylerinde kullanılmak üzere hazırdır. Bu protokolün ikinci bölümü yüzgeç motorlu modelinin temel özelliklerini gösterir. Bu hücre dışı kayıt için bir adım-adım kılavuzunu yüzgeç motor nöronların aktivitesini içerir. RS motor nöronların aksonları PS motor nöronların aksonları aynı sinirin posterior dalı ile (Şekil 1) proje ise, sinir N1 ön dalı ile proje 4. Bu nedenle onların faaliyet diferansiyel pim elektrotlar ile bu şubelerden kaydedilebilir.

Şekil 1: karın ganglion 6 (A6) ve T4 şematik diyagram göğüs ganglion 4 (T4) İzole sinir sistemi:. Torasik ganglion 4; T5: Torasik ganglion 5; A1, A2 ... A6 karın ganglion 1, karın ganglion 2 ... karın ganglion 6; N1: sinir N1; N2: sinir N2; N3: sinir N3; PS: Güç-inme; RS: dönüş inme. Yön kısaltmalar: A = ön; P = arka.
Bu diseksiyon prosedürü ve gösterdi elektrofizyolojik tekniği lisans öğrencileri için uygundur ve fizyoloji öğrenci uygulamalı dersler tamamlayabilir. gangliyonların izole zincir sinir sistemi işlevini, koordinasyon veya yüzgeç microcircuits 6 modülasyonunu olarak hareket yeteneği 16, 17 adaptif davranış nöronal kontrol çalışması için deneyler bir dizi kullanılmıştır. kerevit yüzgeç sistemi böylece çok büyük bir miktarını temin ilginç öğretim veya tTüm kerevit ve kurgusal motorlu modelinin dışı kayıt ventral sinir kordonu diseksiyonu ile başlayan fırsatlar yağıyor.
Access restricted. Please log in or start a trial to view this content.
Protokol
Bu diseksiyon prosedürü Avrupa Toplulukları Konseyi 22 Direktifi nd Eylül 2010'da (2010/63 / AB) ile uyumludur.
1. Hazırlık
- Boyutu ≥8 cm her iki cinsten kerevit, Pacifastacus leniusculus (Dana), edinin. Hayvanlar hayati ve karın ve karın uzuvlar sağlam olduğundan emin olun.
- Karapaksla incelemek için özen ve bu manikür sert ve sert olduğunu. Ön ve postmolt hayvanlar yumuşak karapaksla var çünkü birçok parametre değiştirmek deri değiştirme işlemi sırasında deneyler için uygun değildir (örneğin, lokomotor aktivite azalma).
- , Diseksiyon sırasında kullanılan tüm alet ve malzemeleri monte iğneleme ve sinir kordonu desheathing Şekil 2'de gösterilen ve sağlanan takviyeleri listelenen.

Şekil 2: Malzeme ve araçlar çivileme ve sinir kordonunun desheathing, diseksiyon için kullanılır.
(1) buz dolu kova büyük; (2) kerevit tuzlu su; (3) serum dağıtıcı; (4) diseksiyonu mikroskop; (5) diseksiyonu çanak; (6) kuvvetli makas; (7) forseps (8) yaylı makas; Açık sylgard ile kaplı (9) Petri kabı; (10) sabitleme pimleri; (11) Soğuk lamba kaynağı.
2. Brüt Diseksiyon
- 20 dakika - 15 buz üzerinde hayvan anestezisi. Bir kan kaybı aşamasını kapsamaktadır ve numune prosedürü sırasında kerevit tuzlu su ile durulanır düzenli gerekiyor çünkü lavabonun yanında bir laboratuvar tezgah brüt diseksiyon ilk bölümünü yürütmek.
- Hayvan ventral yüzü yukarı tutun ve göğüs (Şekil 3-1) yakın üslerine hem pençeleri kesmek için güçlü makas kullanın. Sol ve sağ uropod (Şekil 3-2) sökün.
- Siyah sylgard ile kaplı diseksiyon çanak hayvan ventral tarafı yukarı yerleştirin. Elevatelson (Şekil 4A) de karın altında buz ekleyerek ve pin tarafından te Cephalothoraksın.
- 60 ml soğutulmuş kerevit tuzlu ~ ile tuzlu dağıtıcı doldurun. Kıskaç ağzının (Şekil 4B) ile, soğuk tuz ile kerevit serpmek. Aşırı tuzlu uropods de kesikler yoluyla tahliye olacak. Eksanginasyonunun sırasında buz ile kerevit Kapak
- Sadece güçlü makas (Şekil 5A) kullanarak hayvanın gözlerine posterior kesilmiş bir tek enine ile hayvan başını kesmek. Şekil 5B belirtildiği gibi baz eklemlerde yakınındaki bütün yürüyen ayakları çıkarın.
- Cephalothoraksın geri kalanından son göğüs kesimleri ile karın ayırın. İkinci yürüme bacak ağzına makas ucu takmadan ve karşı tarafa keserek ikinci yürüyüş bacaklar düzeyinde (göğüs segmenti 3) bir ilk kesim olun. (Şekil 6A-1).
- T ile her iki taraf için bu ilk kesim uzatınO (Şekil 6A-2) cephalothoraks.
- Iç organların bazı görünür hale getirmek için açık hayvan çevirin. Numunenin ön kısmına belirgin sindirim bezi (Şekil 6B-3) itin ve karın boşluğundan üreme organları kaldırmak için forseps kullanabilir.
- Cephalothoraksın (Şekil 6C) ön kısmını çıkarın. Kalan toraks (Şekil 6D-4) her iki tarafta, solungaçları kapağı karapaksla yan kısımlarını kaldırmak için yan keser kullanın. Solungaçları çıkarın ve soğuk tuzlu su ile durulayın örnek.
- Şekil 6E-5'te gösterildiği gibi, sternum levhanın tüm uzunluğu boyunca bir kesim ile diseksiyon devam edin. Pleuron ve swimmerets (Şekil 6E kırmızı işaretler) arasındaki maksimal yanal konumlarda bu kesim olun. Aynı kesim ile diğer tarafta devam edin. Soğuk tuzlu su ile örnek durulayın.
- Bir dissectio altında kalan diseksiyonu yürütmekn mikroskop. Siyah sylgard ile kaplı ve numune kapsar şekilde kerevit tuzlu su ile dolu diseksiyon çanak kerevit karın ventral tarafı yukarı yerleştirin.
Not: Aşağıdaki adımlar (2,12-4,8) sağ elini deneyci için geçerli yönlü talimatları içerir. Aşağıdaki adımları (2,12-6,8) o, soğuk tuzlu su ile, düzenli aralıklarla her 20-30 dakikada bir kerevit tuzlu yerine sağlıklı sinir sistemi tutulması önemlidir. - Posterior telson de ve öne karapaksla kalıntıları böcek pimleri ile örnek Fix. Sola telzon noktaları ve tablo kenarına paralel olacak şekilde örneği yerleştirin.
- Bir yürüyüş bacak açıklığı (Şekil 7A) ile yakala ve numune açık (Şekil 7B beyaz ok) çekmek için sol elinde kaba forseps kullanın. Onların ventral büyük iki dorsal fleksör kas ipliklerini (Şekil 7B-1 ve C-1) belirlenmesi ve kesimŞekil 7B'de gösterildiği gibi, baz.
- Dorsal (kalp) iner sternum arter (Şekil 7C-2), tanımlama ventral, 4. torakal segmentte. Ventral arter oluşturan, sinir kordonu altında projeler önce bu arter, sağ sinir kablosu (Şekil 7C-3) Yukarıdaki yatıyor.
- Sternum arter transect. Şekil 7C'de gösterildiği gibi, makas bir bıçak kullanarak, ilk arteri kaldırın ve ventral bulunan sinir kablosu görünür olduğunda sadece kesti.
- (Sağ tarafına) öne dorsal fleksör kasları Fix. Onlar vizyon bloke olmayacak şekilde bu pimleri ile maksimum gergin pozisyonda yapılmalı ve numune gergin kalır. Dorsal kas teller (Şekil 8-1), ilgili sinirler ilk karın gangliyonları, A1 ve A2, sabit zaman N1, N2, N3 ve görünür (Şekil 8) vardır.
- Spec kapmak için sol elinde forseps kullanınYürüme ayaklarından biri açılışında imen. Aşağıdaki diseksiyon boyunca adımlar açık örneği tutmak için yavaşça çekin.
- Sinir kablosu en uzak konumda sinirleri N3 transect. (Şekil 8-3).
- Şekil 8-4 gösterildiği gibi ventral apodeme yakın fleksör kasları kesin. Sinir kablosu veya sinirler N2 zarar vermemeye özen gösterin.
- Adımları 2.18 ve sinirler N3 için 2,19 ve A5 kalan karın ganglion A2 fleksör kasları tekrarlayın.
- Son karın ganglion anda, A6, ventral apodeme dorsal fleksör kasları kesmek ve örnek olarak Şekil 9'da gösterildiği bakmak gerekir.
- A6 (Şekil 9-1) sinirlere sternal plaka posterior kesin ve ventral bölümünü (Şekil 9-2) tutun. Fleksör kaslar (Şekil 9-3) ile dorsal kısmını atın. Yürüme bacak açıklıkları yoluyla pimleri ile öne sternum plaka Fix,ve posteriora A6.
3. İnce Diseksiyon
- Uzakta yönlendirilmiş ön kısmı ve tablolar 'kenarına doğru arka kısmı ile mikroskop altında örnek yerleştirin.
- Sefalotorasik göğsüne en ön kısımlarını çıkarmak için Şekil 10A'da gösterildiği gibi, forseps kullanın.
NOT: Torasik ganglionlar ve ilişkili sinirler kısmen bacak kas ve sefalotorasik göğsüne kapsamındadır. sefalotorasik sterna birbirinden ve ventral sinir kablosu bulunduğu orta boşluğu yürüme bacak yanal olarak yer alan boşluklar ayıran bir iskelet oluşturur. - Kalan exoskeletal Şekil 10B belirtildiği gibi yapıların -1 ve B2 arasındaki kasları kesin. Kapmak ve ventral sinir kordonu (Şekil 10C) ön ucunu kaldırmak için forseps kullanın.
NOT: sinir kordonu sürecinde zarar görür, böylece NERV toplayıp önlemeke kablosu birden çok kez. - Sinir kablosunu (Şekil 10C-3) kaldırırken yanal göğüs sinirleri kesin. Çivileme için uygun uzunlukta bu sinirleri tutun. Forseps ile tutuklanmıştı ganglionlar, zincirinin sıkılmış kısmını çıkarın, (Şekil 10C-4) T4 tüm doku anterior uzak keserek.
- Sola ön kısmı ile örnek yerleştirin ve A1 odaklanmak. Uygun uzunlukta (maks. 1 cm) onları bağlantılarını için de A1 sinirler N1 N2 ve kesin.
- A2 odaklanın ve sinirleri N1, N2, ve bu segmentin N3 (Şekil 11) tespit. Karın ganglion A2-A5 sinirleri N1 her segmentin (Şekil 11A-1) iki sternum cuticular infoldings arasında ikamet ve kas ile kaplıdır. Posterior sternum cuticular içe katlanması boyunca bir kesim olun. Karın yan kenarının başlayın ve Şekil 11A gösterildiği gibi orta hat doğru devam edin.
- Hedef N1 hala koy isedoku ile kırmızı kas demeti kesen, Şekil 11B (kırmızı ok) gösterildiği, ancak bu sefer ön sternum cuticular infoldings ve sinir N1 hem (Şekil 11B-2).
- Mümkün (Şekil 11C-3) gibi distalde sinir N1 kesin. Sinir N1 tamamen görünür ve anterior ve posterior dalı (Şekil 11C) tespit edilebilir.
- Taraf sinir N1 geçin ve ilk ganglion (Şekil 11D) yakınında, medial başlayan, arka sternum cuticular içe katlanması boyunca kasları kesti. Sinir hala dokusu ile örtülüdür ise, kas demeti kesen, ancak bu sefer ön sternum cuticular infoldings ve sinir N1 hem benzer 11B-2 Şekil. Kadar distalde mümkün olduğunca sinir N1 kesin.
- Uygun uzunlukta (yaklaşık. 0.5 cm) bağlantılarını için bu ganglion sinirler N2 kesin.
- Tekrar A3-A5 sinirler için 3,7-3,11 adımları.
- Ner Cutolarak distalde mümkün (Şekil 12A) olarak ganglion A6 ves. Bu ganglion kaldırın ve sternum plaka ganglionlar zincirini izole başlamak için A6 birden sinirleri kapmak için forseps kullanın.
- Sinir kablosu kaldırırken Şekil 12B (beyaz ok) gösterildiği gibi, ön yönde yavaşça çekin. Bireysel ganglion kaldırılır gibi, sinir kablosu (Şekil 12C), ventral tarafına tutturulabilir, ventral arter çıkarın. Sinir kordonu tamamen izole olduğu kadar bu (nazikçe) kesilmiş çekin dizisi devam edin.
- Açık sylgard ile kaplı ve kerevit tuzlu (Şekil 12D) ile dolu bir Petri kabı ganglionlar izole zincirini aktarın.
4. Petri Dish içine Sinir Kablosu İğneleme
NOT: Sinir kablosunu pin (takviyeleri bakınız) paslanmaz çelik tel kesilmiş küçük işaretçilerine kullanın. Forseps ile biten sadece sinir dokunun ve Squeez yokconnectives veya ganglionlar e.
- Yumuşak streç uygularken, düz bir çizgi olarak ganglion zincirini Pin.
- Yukarı bakacak şekilde sırt tarafında ile Petri kabındaki sinir kablosunu (Şekil 13, siyah çizgi) düzenleyin. ganglionlar ventral tarafı kendi konveksite tarafından tespit edilebilir; sırt tarafı düz. Kenarlarına göğüs sinirleri Pin. Uzunlamasına ekseni boyunca sinir kablosu germe, A6 sinirler ile devam edin.
- Sinir kablosu için 90 ° açıyla A1 sinirleri dışarı Pin.
- A2 geçin ve sinir kablosu (Şekil 1A) 35-45 ° göreli bir açıyla sinirler N2 pin.
- . Şekil 14'de gösterildiği gibi çivileme önce anterior ve posterior dalları sinirleri N1 ayırın sinir N1 arka dalı forseps bir çift ön ve diğer pick up ince forseps iki çift kullanın. Sadece en uzak ucunu almak için özensinir dallarının s. Şimdi dikkatle onları ayrı çekin.
- Sinir kablosu (Şekil 1A) bir 90 ° açıyla sinir N1 ön dalı Pin. Ön N1 şube ve sinir N2 arasındaki sinir N1 posterior dalı Pin.
- Ganglionlar A3-A5 sinirler için adımlar 4,4-4,6 tekrarlayın. Boyuna sinir kordonu streç o yanı sıra çapraz yön sabitleme yaparken.
5. gangliyonlar Desheathing
- Deneycinin elleri hep sallayarak önlemek için kararlı bir düzlem üzerinde dinlenirken böyle bir şekilde hazırlanmasını yerleştirin. Desheath için ganglionlar alttan sinir kablosunu aydınlatır.
- A5 herhangi karın ganglion A1 odaklanın. Ganglion ve sinirler N2 ve N3 (Şekil 15A kırmızı ok) arasında posterior, ganglion kılıf içinden küçük bir yan kesim yapmak için ince yaylı makas kullanın.
- Çok f kullanarak ganglion kılıfı Pick upŞekil 15A-1 'de belirtildiği gibi ine forseps ve bağlaçlar, yukarıda kılıf boyunca enine kesim. Sıkmak veya makas ile sinir kablosunu kesmek için özen gösterin.
- Hala tutarak ve forseps ganglion (Şekil 15B-2 ve -3) lateral sınırları boyunca kesmek devam ile ganglion kılıfı kaldırma. Kılıfını çıkarın. Alternatif olarak sabit, ancak sinir kablosu sıkışmayacak şekilde eklemlerin her iki tarafına da pin.
- Tekrar A5 tüm karın ganglion A1 için 5,2-5,4 adımları.
- Göğüs ganglionlar ve benzer bir şekilde ganglion A6 Desheathe. Ganglion A6 başlangıç anterior ve posterior desheathe yönde devam etmek için. Ganglion zincirinin arka ucuna A6 ganglion kılıfını Pin.
Motor Nöronlar 6. Ekstraselüler Kayıtlar
- I gösterilen hücre dışı kayıtlar için kullanılan tüm alet ve malzemeleri birleştirinn Şekil 16B ve takviyeleri sıraladı. Kayıt kurulumu genel bir bakış Şekil 16A gösterilmiştir. Amplifikatör kayıttan önce en az 30 dakika boyunca ısınmak böylece, bu deney (Şekil 16C) kullanılan tüm elektronik ekipman başlatın. Bilgisayarı açın ve kayıt yazılımı başlatın.
- Mikroskop masaya ganglionlar zincirini yerleştirin ve aşağıdan aydınlatır. Ganglionlar (Şekil 17A ve B) hedef sinir ve yakın bir konumda referans elektrot yakın, ancak yan sylgard içine kayıt elektrodu yerleştirin. Kayıt elektrot (Şekil 17C) etrafında hedef sinir bükün.
- Elektrot ve sinir arasındaki teması sağlamak ve yan (F igure 17D) onu pin, biraz sinir gerin. Modelleme kil kullanılarak mikroskop masaya elektrot kablolarını Fix, böylece istenilen konumda kalmak.
- Kullanınvazelin ve (yuvarlatılmış ucu olan) bir 20 gauge iğne ile doldurulmuş şırınga (Şekil 17E-3) yıkama çözeltisine hedef sinir izole etmek. İlk kayıt elektrot etrafında sylgard bazı vazelin hafifçe sürün. Sonuç bir kayıt elektrotu (Şekil 17E-4) bulunduğu kısımda Sylgard kapsayan vazelin katmanıdır. Doğrudan bu katmanda hava kabarcıkları sinir üzerine kurulamak ve önlemek için dikkat edin.
- Tuzlu (Şekil 17F) yüzey seviyesine kadar her taraftan vazelin ile kayıt elektrodu Seal.
- Olan etkinlik izlenmelidir tüm hedef sinirler için bu işlemi tekrarlayın.
- Kaydetmeye başlayın. Sürekli ya da boşluk serbest edinim modu ve 5 kHz örnekleme hızı kullanın. Aşağıdaki parametrelere dışı amplifikatör ayarlayın; (sinyalini 1.000 kez güçlendirir kazanım yazılım ayarlarında bu büyütme parametresini dahil özen) 1.000 kazanmak bir2.000 Hz (yüksek kesim) 300 Hz (düşük kesim) ve da band geçiren filtre aralığı.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
RS ve PS, bir ganglion motor nöronların eşzamanlı dışı kayıtları ile, bu motor nöron havuzları alternatif etkinliği, kurgusal lokomosyon desen temsil (Şekil 18) izlenebilir.
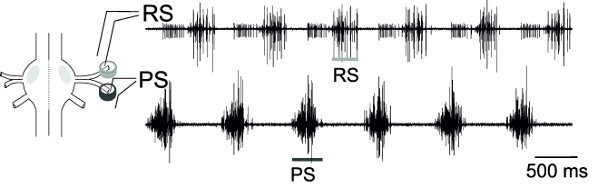
Şekil 18: Bir ganglion ve diferansiyel pim elektrot yerleştirme şematik Hücre dışı SC motor nöronların kayıt (üst iz) ve PS motor nöronlar (düşük iz)..
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Kerevit anatomisi ve karın ganglionlar önce 5, 18, 19, 20 tarif edilmiştir ve önemli sinirlerin kesilmesi önlemek için diseksiyon önce onlarla aşina olmak için tavsiye edilir.
Bu izole sinir kablosu bozulmasını önlemek için 23 ° C'nin altındaki sıcaklıklarda hazırlık tutmak için kritik öneme sahiptir. Bu yıkama çözeltisine, soğuk kerevit tuzlu su ile 20-30 dk değiştirilmesiyle kolayca elde edilebilir. Bu koşullar altında, gangliyonları...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
The authors declare that they have no competing financial interests.
Teşekkürler
Biz bazı rakamlar ile yardımcı olmak için Jos Burgert teşekkür ederiz. Biz Ingo Selbach (ve grubu "Edelkrebsprojekt NRW") deney hayvanları ile laboratuvar tedarik çabalarıyla minnettarız. Biz yazının ilk sürümlerini kontrol Anna C. Schneider teşekkür ederim. Bu araştırma Emmy Noether DFG hibe SM 206 / 3-1 ve kadın öğretim üyeleri için Köln Üniversitesi başlangıç hibe ile desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 4-channel extracellular amplifier: MA 102 | Amplifier | Elektroniklabor, Zoologie, Universität zu Köln, Germany | |
| air-table | Technical Manufacturing Corporation (TMC) a unit of AMETEK Ultra Precision Technologies, Peabody, MA, USA | 63-534 | |
| Axon Digidata 1440A | Digitizer | Axon Instruments, Molecular Devices Design, Union City, CA | DD1440A |
| big bucket | |||
| Clampex & Clampfit | pClamp 10, recording and analysis software | Molecular Devices Design, Union City, CA | pClamps 10 Standard |
| cold lamp source | with flexible light guide (fiber optic bundle) | Euromex microscopes holland, Arnhem, BD | LE.5211 & LE.5235 |
| computer and monitor | equipped with recording software | ||
| container and pipette for liquid waste | |||
| crayfish saline | contains (in mM): 5.4 KCl, 2.6 MgCl2, 13.5 CaCl2, and 195 NaCl, buffered with 10mM Tris base and 4.7mM maleic acid; aerated for 3 hours. Adjust at pH of 7.4. | ||
| dextran, Texas Red (3000MW, lysine fixable) | fluorescent dye, lysine fixable | Life Technologies GmbH, Darmstadt, Germany | D3328 |
| dissection dish | (l x w x h) 15x7x5 cm; linned with black silicone | ||
| faraday cage | |||
| fixing pins | |||
| forceps (biology, Dumont #5) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11252-20 |
| forceps (biology, Dumont #55) | Forceps: Biology, tip 0.05 x 0.02 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11255-20 |
| forceps (electronic, Dumont #5) | Forceps: Standard, tip 0.1 x 0.06 mm, length 11cm, INOX | Fine Science Tools (FST), Germany | 11251-20 |
| intracellular electrode | Borosilicate glass capillaries (outer/inner diameter: 1mm/0.5mm), with filament | Sutter Instruments, Novato, CA | BF100-50-10 |
| Leica S8 Apo StereoZoom | Dissection Microscope Zoom 1x - 8x | Leica, Germany | 10446298 |
| microscope table | |||
| mirror | to illuminate preparation from below | ||
| modeling clay | |||
| Olympus SZ61 | Dissection Microscope Zoom 0.67x - 4.5x | Olympus, Germany | |
| petri dish | 94 x 16 mm; lined with clear silicone | Greiner bio-one, Germany | 633180 |
| ring scissors | ThoughCut, cutting edge: sharp/blunt, straight: 13cm | Fine Science Tools (FST), Germany | 14054-13 |
| spring scissors or alternative: Vannas spring scissors | cutting edge: 8 mm, tip diameter: 0.2mm, straight: 10cm or cutting edge 2.5 mm, tip diameter 0.075 mm, straight: 8cm | Fine Science Tools (FST), Germany | 15024-10 or 15000-08 |
| student Vannas spring scissors or alternative: Moria Spring Scissors | cutting edge: 5mm, tip diameter: 0.35mm, straight: 9cm or cutting edge: 5mm, tip diameter 0,1 mm, straight: 8 cm | Fine Science Tools (FST), Germany | 91500-09 or 15396-00 |
| sylgard | 184 Silicone Elastomer Base and Curing Agent; for black sylgard add activated carbon | Dow Corning, Midland, MI, USA | |
| syringe filled with petroleum jelly and equipped with a 20 gauche needle with rounded tip |
Referanslar
- Hughes, G. M., Wiersma, C. A. G. The Co-Ordination of Swimmeret Movements in the Crayfish, Procambarus-Clarkii (Girard). J Exp Biol. 37 (4), 657-670 (1960).
- Mulloney, B., Smarandache, C. Fifty Years of CPGs: Two Neuroethological Papers that Shaped the Course of Neuroscience. Front Behav Neurosci. 4, 45(2010).
- Murchison, D., Chrachri, A., Mulloney, B. A Separate Local Pattern-Generating Circuit Controls the Movements of Each Swimmeret in Crayfish. J Neurophys. 70 (6), 2620-2631 (1993).
- Mulloney, B., Hall, W. M. Functional organization of crayfish abdominal ganglia. III. Swimmeret motor neurons. J Comp Neurol. 419 (2), 233-243 (2000).
- Davis, W. J. Lobster Righting Responses and Their Neural Control. Proc R Soc Ser B-Bio. 170 (1021), 435-456 (1968).
- Mulloney, B., Smarandache-Wellmann, C. Neurobiology of the crustacean swimmeret system. Prog Neurobiol. 96 (2), 242-267 (2012).
- Huxley, T. H. The crayfish: An introduction to the study of zoology. , MIT Press. Cambridge, MA. (1980).
- Smarandache-Wellmann, C., Weller, C., Wright, T. M., Mulloney, B. Five types of nonspiking interneurons in local pattern-generating circuits of the crayfish swimmeret system. J Neurophys. 110 (2), 344-357 (2013).
- Skinner, F. K., Mulloney, B. Intersegmental coordination of limb movements during locomotion: mathematical models predict circuits that drive swimmeret beating. J Neurosci. 18 (10), 3831-3842 (1998).
- Mulloney, B. During fictive locomotion, graded synaptic currents drive bursts of impulses in swimmeret motor neurons. J Neurosci. 23 (13), 5953-5962 (2003).
- Smarandache-Wellmann, C., Grätsch, S. Mechanisms of coordination in distributed neural circuits: Encoding coordinating information. J Neurosci. 34 (16), 5627-5639 (2014).
- Mulloney, B., Hall, W. M. Local commissural interneurons integrate information from intersegmental coordinating interneurons. J Comp Neurol. 466 (3), 366-376 (2003).
- Mulloney, B., Harness, P. I., Hall, W. M. Bursts of information: Coordinating interneurons encode multiple parameters of a periodic motor pattern. J Neurophys. 95 (2), 850-861 (2006).
- Smarandache, C., Hall, W. M., Mulloney, B. Coordination of Rhythmic Motor Activity by Gradients of Synaptic Strength in a Neural Circuit That Couples Modular Neural Oscillators. J Neurosci. 29 (29), 9351-9360 (2009).
- Smarandache-Wellmann, C., Weller, C., Mulloney, B. Mechanisms of Coordination in Distributed Neural Circuits: Decoding and Integration of Coordinating Information. J Neurosci. 34 (3), 793-803 (2014).
- Chrachri, A., Neil, D., Mulloney, B. State-Dependent Responses of 2 Motor Systems in the Crayfish, Pacifastacus leniusculus. J Comp Physiol A. 175 (3), 371-380 (1994).
- Chrachri, A., Neil, D. M. Interaction and Synchronization between 2 Abdominal Motor Systems in Crayfish. J Neurophys. 69 (5), 1373-1383 (1993).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) II. Synaptic Neuropils. J Comp Neurol. 234 (2), 182-191 (1985).
- Skinner, K. The Structure of the 4th Abdominal-Ganglion of the Crayfish, Procambarus-Clarki (Girard) I. Tracts in the Ganglionic Core. J Comp Neurol. 234 (2), 168-181 (1985).
- Mulloney, B., Tschuluun, N., Hall, W. M. Architectonics of crayfish ganglia. Microsc Res Techniq. 60 (3), 253-265 (2003).
- Braun, G., Mulloney, B. Cholinergic modulation of the swimmeret motor system in crayfish. J Neurophys. 70 (6), 2391-2398 (1993).
- Davis, W. J. Motoneuron Morphology and Synaptic Contacts - Determination by Intracellular Dye Injection. Science. 168 (3937), 1358-1360 (1970).
- Altman, J. S., Tyrer, N. M. Filling Selected Neurons with Cobalt through Cut Axons. Neuroanatomical Techniques. Strausfeld, N. J., Miller, T. A. , Springer. New York, NY. 373-402 (1980).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır