Method Article
Farelerde Miyokard İnfarktüsü Oluşturan Minimal İnvaziv Cerrahi Prosedür
Bu Makalede
Özet
A highly reproducible model for myocardial infarction in mice with minimal invasive manipulations is described. The model can be easily performed, resulting in a high reproducibility and survival rate. Thus, the described model will reduce the number of required animals as requested by the 3R principle (Replacement, Refinement and Reduction).
Özet
Miyokard infarktüsü hala son yıllarda stent geliştirme alanında önemli ilerlemelere rağmen, batı ülkelerinde ölüm ana nedeni olmaya devam etmektedir. Altında yatan mekanizmaların aydınlatılması ve yeni tedavi stratejilerinin geliştirilmesi için, geçerli hayvan modellerinde durumu zorunludur. Biz miyokard enfarktüsü mücadele in vivo koşullarda altında kalp ve damar hastalıkları patomekanizmaların yeni anlayışlar gerektiğinden, hayvan modelinin geçerliliği önemli bir yönüdür. Bununla birlikte, hayvan koruma, bu bağlamda oldukça önemlidir. Bu nedenle, bir yüksek tekrarlanabilirlik ve hayvanların hayatta kalma oranını garanti farelerde miyokard infarktüsü minimal invaziv ve basit bir model kurmak. Böylece, bu modeller hayvan deneyleri için 3R prensibi gereksinimlerini (Yedek, Sadeleştirme ve Azaltma) yerine getirir ve cardiov için terapötik stratejilerin daha gelişmekte için gerekli olan bilimsel bilgileri teminascular hastalıkları.
Giriş
Miyokard infarktüsü sanayileşmiş ülkelerde başlıca ölüm nedenlerinden biridir. Tanı ve tedavi yaklaşımlarının yadsınamaz gelişmelere rağmen, kalp damar hastalıkları hala mortalitenin en önemli nedenidir. Geliştirilmiş yaşam beklentisi ve yaşam ile ilgili riskleri göz önüne alındığında, kardiyovasküler hastalıkların görülme sıklığında sürekli bir artış gelecekte bekleniyor. Bu nedenle, kardiyovasküler hastalığın tedavisi için yeni yaklaşımlar kurmak ve doğrulamak için bir ihtiyaç vardır. İnsan çalışmaların bilgi sınırlamalar muzdarip, bu çalışmalar genellikle açıklamak ve bu önemli sağlık problemlerine çözümler sunmak yerine getiremediğini, moleküler düzeyde mekanizmaları anlamak için yeterli değildir.
Ayrıca, temel araştırma laboratuarda kardiyovasküler hastalık mekanizmalarını üretmek için karmaşıklığı ve zorluk nedeniyle sınırlıdır. Bu nedenle, kardiyo patofizyolojisi hakkındaki bilgilerimizi artırmak içindamar hastalıkları, bu hayvan modelleri 1,2 doğrulamak için gereklidir. Bununla birlikte, hayvan deneylerinde, çok sayıda neden gerekli olan farklı zaman noktalarında, miyokardiyal enfarktüs, analizden sonra iyileşmesinde rol oynayan moleküler olayların her kaskadlar tespit etmek.
Miyokard infarktüsü deneyleri genelde hayvan modelleri kullanılarak yapılmaktadır. Küçük hayvanlarda 3-11 miyokard infarktüsü uyaran büyük hayvan modellerinde daha hücresel ve moleküler olayları incelemek için kullanılan en uygun ve verimli bir modeldir. Dahası, hiçbir diğer türler fareler 12 olarak transgenik ya da nakavt suşları kullanılabilirliğini sunuyor. Bu fare modelleri 13,14 (stent restenozu, ateroskleroz gibi) kalp damar rahatsızlıkları da dahil olmak üzere diğer hastalıklar, son derece yararlıdır. Buna ek olarak, düşük gebelik dönemi ve yavru sayısının yüksek miyokard INFA moleküler mekanizmaları incelemek için en cazip sistem olarak fare modelleri nitelemekrction 12.
Bununla birlikte, farelerde kalp boyutu mikrocerrahi sırasında manipülasyon yüksek hassasiyet bekliyor. Böyle nitelikli ve vasıflı personel cerrahi öğretmek bir zaman tüketen ve iş yoğun bir süreçtir. Bu nedenle, biz burada böyle farelerde karmaşık miyokard infarktüsü modeli gerçekleştirmek için öğrenci veya teknisyen olarak bile ortalama niteliklere sahip işbirlikçileri, rehberlik ipuçları ve püf noktaları da dahil olmak üzere ayrıntılı bir mikrocerrahi prosedürü sunuyoruz.
Başlangıçta, entübasyon trakeotomi kullanmadan kısa bir kanül vasıtası ile gerçekleştirilir. Torasik kesi kaburga ve / veya çevre dokulara yaralanması kaçınarak, interkostal bölgede yer almaktadır. Bu alt-adım hızlı toparlanma ve iyileşme 15 sağlamak için büyük önem taşımaktadır. hala önemli bir enfarktüs büyüklüğünü korurken bağ, yüksek hayatta kalma oranı, kronik iskemi ve iskemi / reperfüzyon modelleri için diferansiyeli yapılır. Deneyimlerimiz tha gösteriyoripek sütür kullanılarak t kriyo-yaralanmalar 16 kıyasla daha yüksek bir tekrarlanabilirlik sağlar.
Sonuç olarak, burada tarif edilen yöntem, küçük hayvanlarda hem kronik iskemi ve iskemi / reperfüzyon modellerinde uygulanabilir. Bu prosedürde sunulan ipuçları ve püf noktaları, küçük hayvan modellerinde uygulamak bile düşük ya da ortalama yeterlilik ile personel sağlamak içindir.
Protokol
NOT: Bu yazıda sunulan deneyler Alman düşüğe ve Avrupa hayvan bakımı kurallarına uygun şekilde yapılmaktadır. hayvanlar Dr. R. Tolba ve Dr A. Teubner (hayvan refahı memuru) gözetiminde, Laboratuar Hayvan Bilimi Enstitüsü, Universiy hastane Aachen, Almanya Hayvan tesisinde yetiştirilmektedir.
1. Hayvan Bakımı
- Gıda ve uzman veteriner kontrol ve tedaviye uygun erişimi sağlama uzmanlaşmış bakım ünitesinde fareler tutun. Hayvanlar taşınmış veya dışarıdan satın alınması halinde, prosedür girmeden önce bir haftalık konaklama temin edebilirsiniz.
2. Entübasyon
- , 8-10 haftalık erkek C57BL / 6 vahşi tip fareler anestezi 100 mg / kg ketamin ve 10 mg / kg ksilazin intraperitonal enjeksiyonu ile 25-27 gr. Ayak tutam refleksleri ile anestezi düzeyini izleyin. İşlem sırasında kuruluğunu önlemek için gözleri veteriner merhem yerleştirin.
- kurumun hayvan bakımı yönergeleri izleyerek, cerrahi prosedür başlamadan önce buprenophine 0.1 mg / kg vücut ağırlığı subkutan ile ağrı tedavisi yönetin.
- Steril malzeme ve araçları kullanarak ameliyat sırasında enfeksiyonları önlemek için steril koşullarda korunmasını sağlamak.
- Isıtılmış ameliyat masasında sırtüstü pozisyonda anestezi fare yerleştirin. Küçük bir jilet kullanarak ventral boyun bölgesinde ve göğüs kafesinin sol yarısında hem saç kaldırmak ve kesi öncesinde% 70 alkol ile dezenfekte edin.
- Boyun merkezinde cerrahi makas kullanılarak 0.5 sm'lik bir küçük ortalama kesisi. Deri altında, steril kavisli forseps ile 2 yağlı organları geçmesi ve kaplama kas açıklık yoluyla stereomicroscope altında trakea görselleştirmek.
- Stereomikroskopta (Şekil 1A) kullanarak sözlü görünüme altında trakea içine entübasyon kanül tanıtın. Bir uçtan bir uca, metal kanül ayırtşeffaf doku ugh. Ve her an (Şekil 1B) çalışma sırasında, konumunu ve yerini.
- Küçük hayvan ventilatöre kanül bağlayın ve havalandırma ayarları Kullanıma göre ayarlamak ilkelerine uygun (100-150 ul ve min başına 100-150 arasında bir solunum hızı arasındaki tidal hacim) üretmektedir.
3. Miyokard Enfarktüsü İndüksiyon
- Xiphoid sol axila arasındaki çizginin ortasında bir cilt kesisi az 0,5 cm gerçekleştirin. Altta yatan kaburga kas tabakası ayırmak için forseps kullanabilir.
- Göğüs boşluğu 17 açılana kadar küçük bir makas kullanarak kaburgalar arasında küçük bir kesi yapın. Kronik enfarktüs, 4. interkostal alana (Şekil 1D) 'de, 5. interkostal alana (Şekil 1C) ve / veya iskemi / reperfüzyon modeli için kesi gerçekleştirmek: daha kolay bir yöntem numarası 2 inci ve aşağıdan 3 th interkostal boşluk, sırasıyla).
- Göğüs boşluğu açmak ve kalp görselleştirmek için kesi içine Ekartörleri yerleştirin.
- Dikkatle aşırı fibrotik süreçleri engellemek için perikard çıkarın.
- Derin konumlandırılmış açık kırmızı gemisi olarak sol inen koroner arter (LAD) gözünüzde canlandırın. LAD görüntülenmiştir edilemezse, tekrarlanabilir artırmak için bazı referans noktaları göz önünde bulundurun.
- Kronik enfarktüs modeli için, Şekil 1C gösterildiği gibi referans olarak ven sahip (kulak kepçesi ve apeks arasında) kalbin ventral tarafında ortasında bitişik harfleri yerleştirin. Bir transmural anterior ve posterior enfarktüsü elde etmek için 0/7 ipek sütür kullanılarak arter hem dallarını Bind. Gri renkli ligature konumunu gösterir (Şekil 1 C) eğer ihtiyaç duyulursa tekrarlanabilir.
- Iskemi / reperfüzyon modelinde, LAD ana gövdenin (Şekil 1D) üzerinden, kulak kepçesi altında bitişik harfleri yerleştirin. ligçalıçtırdıgınızda kap bütünlüğünü korumak için, bir silikon tüpe yer almaktadır. gri renk Enfarktüslü alanı gösterir ve tüm kalp (Şekil 1D) görünmelidir. Iskemi döneminde kaburga temporal sütür koyun ve doku kurumasını önlemek için bir kompres kullanarak nemlendirin. Iskemi sonrasında silikon tüp kaldırmak ve reperfüzyon görselleştirmek için küçük makas ile dikiş kesti.
- Prosedürün başında kullanılan anestezik ve analjezik (2.1 ve 2.2 adımları) yanında, hayvanın uygun konfor sağlamak ya da kurumun hayvan bakım kurallara uymayı ameliyat sırasında% 0.5 izofluran kullanın.
4. Sütür ve Kurtarma
- Sıcak izotonik tuz çözeltisi ile doldurularak toraks kalan havayı ortadan kaldırın.
- 3 dikiş 0/6 (Şekil 2A ve 2B'de gösterildiği gibi) ile boğaz kapatın. Olarak sağlamak için, 90 ° 'lik bir açı ile medial dikiş yerleştirinŞekil 2'de gösterildiği gibi, kaburgaların kapatma ealed (Şekil 2A, B).
- 2 dikiş (Şekil 2C) ve 3-4 sütür 0/6 (Şekil 2D) ile deri ile kas tabakası kapatın. Daha fazla ekokardiyografik ölçüm için uygun bir pencere elde etmek için ayrı ayrı bu sütürler gerçekleştirin.
- Ventilatörden entübasyon kanül ayırın ve spontan bir nefes sağlar. Daha sonra kimlik, yerel sistem (Kurumunuzdan hayvan refahı memuru sor) kullanarak fare işaretleyin.
- O uyanana kadar kırmızı lamba altında sol tarafta fare yattı. Yeterli bilinci yerine kadar gözetimsiz bir hayvan bırakmayın. Tamamen iyileşene kadar diğer hayvanların şirket olmak için ameliyat geçirmiş bir hayvan izin vermeyin.
- Kurumunuzun hayvan bakımı yönergeleri izleyerek, önümüzdeki 3 gün boyunca buprenophine 0.1 mg / kg vücut ağırlığı, deri altından ile ağrı tedavisi yönetin.
Miyokard İnfarktüsü 5. Analizi
- Ejeksiyon fraksiyonu, fraksiyonel kısalma, kalp debisi ve kalp boyutları: Düzenli ekokardiyografi (Şekil 3A) vasıtasıyla kalp fonksiyonlarının izlenmesi.
- 100 mg / kg ketamin ve 10 mg / kg ksilazin intraperitonal enjeksiyonu ile hayvanlar anestezisi. Refleksleri eksikliği tarafından ameliyat öncesi uygun anesthetization onaylayın.
- Göğüs boşluğu açın ve yoğun steril PBS solüsyonu yıkama kalan kanda yerleştirerek, kalp tüketim.
- Gerekirse, göğüs boşluğundan, ya da kalbin çıkarıldıktan sonra infracted bölgelerin yaralanma kaçınarak kalp doğrudan kan toplamak.
- Yıkandıktan sonra, doymuş KCl çözeltisi içinde Diastola kalp stop (steril PBS içinde 3M KCl süzülmüş). Histolojik analiz için% 10 formalin içinde kalbi düzeltmek ve Adım 5.7 ile devam edin.
- Gerekirse, arabayı canlılığını ölçmekEvans-Mavi / Triphenyl tetrazolyum klorür (TTC) boyama ile kardiyak hücreleri. Yıkamadan ilk yerde bitişik harfleri yeniden sonra, aort kanülü kullanılarak 200 ul% 1 Evans mavi solüsyonla kalp serpmek ve -20 ° C'de küçük bir plastik torba içinde kalp dondurma.
- 2 saat sonra, keskin bir bıçak kullanılarak 5 enine kaydırmaları ve imal tarafından tarif edildiği gibi, 37 ° C'de TTC çözeltisi 10-15 dakika boyunca inkübe. % 10 formalin içinde 10 dakika süreyle slaytlar saptamak ve daha fazla analiz için mikroskopik slaytlar arasında koydu.
- Enine bölümlendirilmeleri gerçekleştirmek için, ucunda kalbi konumlandırarak, parafin kalp dokusu gömün. 5 um'lik bir seri bölümüne gerçekleştirin. İlk 20 bölümden toplayın ve bir sonraki 300 mikron atın. Mitral kapak seviyesi ulaşılıncaya kadar bölüm protokolü devam (Şekil 3A, B). Seri kesitler dışında tüm kalp boyunca 400 mikron toplanır ve f lekeli olabilirveya kalitatif ve kantitatif analiz.
- Gomori en tek-adım 6-8 boyama kullanarak enfarktüs boyutunu ölçün.
- Her zamanki immünohistolojik boyama kullanarak seri bölümde anjiogenezisi, kollajen içeriği veya iltihap hücreleri işe analiz edin.
Sonuçlar
miyokard enfarktüsü prosedürü 25-30 dakika içinde meydana gelir ve% 10 mortalite oranını gösterir. Ameliyattan sonra, fareler sonraki 15 dakika içinde anestezi kurtarmak. Hiçbir fiziksel bozukluk işletilen fare gözlendi. Tamir işlemleri inflamatuar aşamasında rahatsız Ancak, post-kronik miyokard enfarktüsü sonrası kalp rüptürü riski daha yüksek bir hafta var. Kalp pompalama sırasında önemli ölçüde boyutlarını değiştirmek mümkün olduğundan, tüm toplanan kalpleri Diastola örneğin, aynı pozisyonda durdurulması için, önemlidir. Bu, doymuş KCI çözeltisi ile kalp perfüze ile elde edilebilir. Hücre-dışı K + konsantrasyonu blokları iyonik pompalar artan kalp aktivitesinin diyastolik durması ile sonuçlanan kardiyak hücreler membran dinlenme potansiyelini azaltır.
enfarktüs alanı ultrason analizi (Şekil 3A, alt panel) görülebilir. KıyaslaNormal miyokard, iskemik bölgeler ince ve hipokinetik (Şekil 3A, üst panel) görünür. Kullanılan modele bağlı olarak, enfarktüs boyutu değişir. İskemi / reperfüzyon, ince, orta duvar indükler ve kalp (Şekil 3C) içinde ise, kronik enfarktüs modeli, apeks (Şekil 3B), dairesel, transmural enfarktüs indükler. Enfarktüs boyutunu belirlemek için birçok yöntem vardır. Amaç kalp canlılığı üzerinde doğrudan etkisi analiz ise, 18 boyama bir Evans-Mavi / TTC miyokardiyumun herhangi bir değişiklik görmek mümkün, en az 2 saat reperfüzyon sonrasında yapılması gösterilir. Bölümler boyama hemen sonra (Şekil 3B, orta panel) analiz edilebilir veya 2-3 gün (Şekil 3C, orta panel) için formalin içerisinde, cam slaytlar arasında tutulabilir. mavi alan iskemi etkilenmez sağlıklı miyokardı, temsil eder. kırmızı alan th içinde canlı miyokard temsile iskemik alanı (risk miyokard), beyaz alan ölü dokuyu temsil eder. Genellikle, enfarktüs boyutu risk alanından yüzdesi olarak ifade edilir.
işlemleri biçimlenme sonra elde edilen, olgun yara kolayca Gomori en tek-aşamalı bir boyası ile immunohistolgy ile ölçülebilir. Blue lekeli enfarkte ve kırmızı lekeli sağlıklı ventriküler alanları (Şekil 3B ve C, sağ panel), mitral kapak kadar her düzeyde ilk bölümünde belirlenmiştir. , Farklı seviyelerde LAD bağlanması ile değişimini önlemek için, tüm bölümünden enfarktüsü olarak kabul edilir ve toplam sol ventrikül hacminin bir yüzdesi olarak ifade edilir. Kronik enfarktüs modelinde ve% 10-15 iskemi / reperfüzyon modelinde sonra% 15-20 arasında bir enfarktüs hacmi elde edilebilir. Bundan başka, kronik enfarkt modeli abartılı şekilde genişleme neden olacaktır, iskemi / reperfüzyon modelinde gözlemlenmemiştir (Şekil 3B ve C right panel).
Gibi kullanılabilir geleneksel boyama işlemleri: CD31 anjiyojenezi ortaya çıkarmak için kullanılan boyama (kırmızı, Şekil 4A) veya düz kas aktini boyama miyofibroblastlar (yeşil, Şekil 4B) belirlemek gerekmektedir. Çift floresan boyama, aynı zamanda kardiyomiyositlerin mevcut olmaması otomatik immünofloresan (Şekil 4C) verir, enfarktüs alanında farklı hedef molekülleri tanımlamak için uygulanabilir.
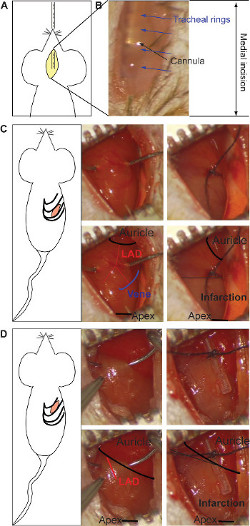
Şekil 1: Medial insizyon ve entübasyon en kanül (A) ekleme. doku (B) açıklık yoluyla metal kanül stereomicroscopic görselleştirme. trakea halkaları (mavi oklar) ve kanül (siyah ok) işaret edilmektedir. Kronik enfarktüs mo için interkostal insizyondel ve LAD bağ (C). bağ referans olarak (mavi şematik, alt panel) ven ucunu alarak (kulak kepçesi ve apeks, alt panelde siyah arasında) kalbin ortasında yer almaktadır. Arterin iki kol (alt panelde kırmızı) bağlı olması. gri renk Enfarktüslü alanı gösterir ve kalbin (sağ alt panel) alt yarısı kısmında görünür. iskemi / reperfüzyon modeli için bağ, bir silikon tüpe (sağ taraf) (D) üzerindeki LAD ana gövdesini (alt panel kırmızı) bağlanma, kulak kepçesi altında yapılır. gri renk, tüm kalp (sağ alt panel) üzerindeki mevcut infracted alanı gösterir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
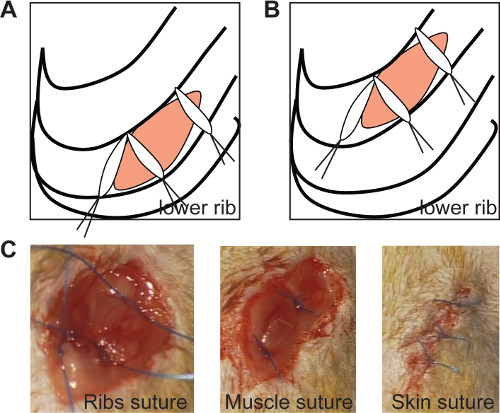
Şekil 2: kaburga dikiş contalar göğüs medial dikiş hem kronik (A) 90 ° 'lik bir açı ile konumlandırılmıştır halinde insizyon ve iskemi / reperfüzyon (B, sol panel) kaburga dikiş., in vivo görüntüleme (Cı, sol panel ), kas sütür (C orta panel) ve cilt sütür (C sağ panel). Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
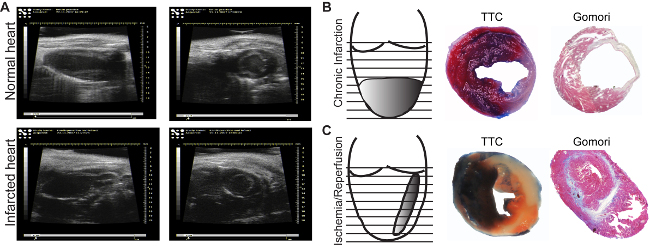
Şekil 3: Ekokardiyografik görüntüler. Normal (A, üst panel) ve enfarkte alanlar (A, alt panel) görüntüleri, uzun eksende edinilen (boyuna, sol paneller) veya kısa eksen (enine, sağ paneller) 'de .. İnfarkt kronik dikilen tarafından uyarılan(B) ve reperfüzyon (C) ile, ardından bir saat iskemi. Evans Mavi / TTC lekelemesi perfüze (mavi) tanımlanmasını / perfüze olmayan alanlar gibi canlı (kırmızı) / ölü (beyaz) miyokard (B, C, orta paneller) sağlar. Gomori en tek adım boyama enfarkte alanlar (mavi) belirlenmesini sağlar ve normal bölgeler (kırmızı) (B, C, sağ paneller) onları ayırır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
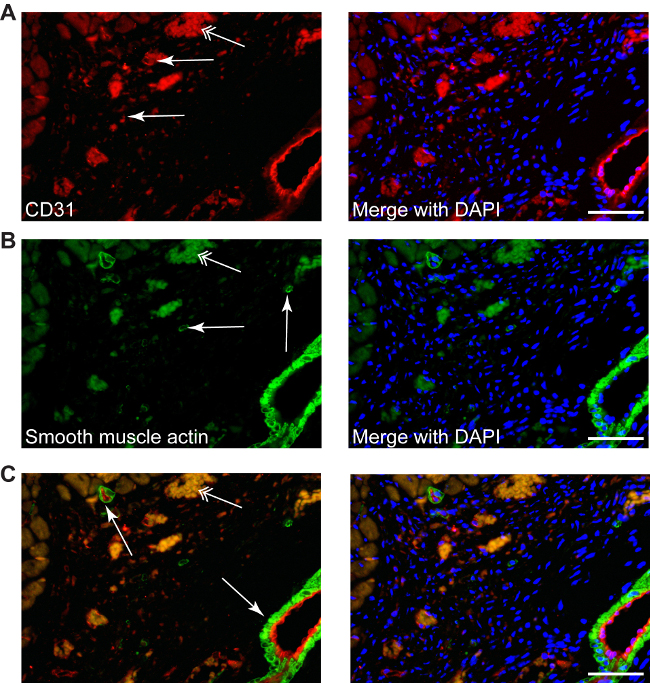
Şekil 4: Farklı renklendirmeler gibi tarif edilen yeni-anjiyogenez ile CD31 (A, kırmızı, basit oklar) veya miyofibroblastlar için düz kas aktini (B, g, infracted bölgede gerçekleştirilebilirReen basit oklar) yanı sıra çift boyama (Cı-CD31-kırmızı / düz kas aktin-yeşil)) çekirdek (mavi DAPI ile karşıt. Miyofibroblastlar daima endotel tabakasının (C oklar) eşlik küçük ya da büyük arterlerden düz kas hücreleri, kolayca ayırt edilebilir. Çift oklar eritrosit otofloresans etmektedir. Ölçek 50 mikron barlar.
Tartışmalar
İşlem sırasında, bazı kritik noktalara dikkat edilmesi vardır: entübasyon, açılış göğüs boşluğu ve LAD bağ. ilk kritik adım denemelerinde önce hayvanın entübasyon olduğunu. Birçok grup trakea içine doğrudan kanül eklemek için fare ve ışık kaynağı sabitleme için dikey destek kullanıyorsunuz. Bu yöntem, belirsizlik trakea içine kanül doğru takılmasını ilişkin vardır ve acemiler tarafından en başarısız eğilimli. Küçük bir kesi yapmak, kanül konumu dolayısıyla varsayılan oranını azaltarak, tüm manevra sırasında kontrol edilebilir. Ayrıca, trakeotomi böylece komplikasyonların azaltılmasında ve çalışma süresini azaltarak, aştı.
Bir sonraki adım, kritik göğüs boşluğunun açılması olduğunu. median sternotomi hayvanların kurtarma geciktirerek yüksek risk manevrasını temsil eder. 2-3 kaburgaların 15 kesim ima yanal sol kesi , eksik toparlanma ve artmış mortalite yol açar. Biz asgari yükü sunan kaburga arasındaki modeli küçük, ayrık kesi kullanılan. Hayvanlar ameliyattan sonra çok hızlı bir şekilde kurtarmak ve mevcut kusurları veya rahatsız şifa yapamaz. Alt arası costal alan bir referans noktası olarak alınır. Bu göz önüne alındığında, kronik ve iskemi / reperfüzyon modeli için bağ yere doğru ve farklılaştırılmış erişim, ciddi sorunlar yükseltmek değil.
bağ kendisi en kritik adımı temsil etmektedir. sol inen koroner arter görüntülenmiştir zordur ve genellikle olmadan görünümü bağlı olması gerekir. Bu nedenle, bazı anatomik referans noktaları doğru ligasyonu gerçekleştirmek için cerrah yardımcı işaret edilmektedir. Kronik enfarktüs modeli için, bağ majör ön ven (Şekil 2B) biten üstünde, kulak kepçesi ve apeks arasında, kalbin ventral tarafında ortasında yer alıyor. verim contro edilebiliretkilenen bölgelerde gri renk görünümünü görselleştirme ile lled. Enfarktüslü alan anterior görünür ve arka duvarı içermiyorsa, yeni bir dikiş ilk dikiş soluna yerleştirilebilir. LAD ana kök bu bölümünü tespitinde ciddi sorunlar söz konusu değildir, bu nedenle kulak kepçesi 18 altında her zaman görülebilir ve. Ancak, kulak kepçesi kanama riskini önemli sunar ve dikkatle ele alınması gerekir.
prosedür uygun ekipman varlığı ile sınırlıdır. Küçük hayvanlar için bir vantilatör ve uygun anestezi sistemi pahalı ve oda gaz ve havalandırma sistemine bağlantı gerektirir. Dahası, hayvanların yakın bir gözetim prosedürü olası klinik tespit etmek sonra ilk hafta içinde gereklidir. Deney sırasında kalp fonksiyonunu incelemek için, yüksek çözünürlüklü ultrason, karmaşık Langendorf perfüzyon sistemi, ya da küçük intraventriküler kateter ölçümleri gereklidir, invyüksek maliyetler ve ek uzmanlık SORUN.
Miyokard infarktüsü göz önüne alındığında, in vitro olayların karmaşıklığını yeniden kullanılabilir hiçbir alternatif yöntemler var. Ilgi alanına bağlı olarak, Langendorff sisteminde izole kalp ex vivo perfüzyon farklı uyaranlara veya ilaçlara yanıt kontraktilite, kalp fonksiyonlarının ve miyokard canlılığı hakkında bilgi sağlar. Bununla birlikte, kan bileşiklerinin ve bağışıklık sisteminin tüm müdahaleler hariç ve miyokardiyal enfarktüs sonrası yeniden modellendirme ve iyileştirme uzun çalışmalar için endike değildir.
Miyokard enfarktüsü işlemini gerçekleştirdikten sonra, diğer tüm fonksiyonel analiz intraventriküler basınç ölçümlerinde, ultrason (küçük hayvan ultrason sistemleri) veya izole kalp Langendorff-perfüzyon gibi yapılabilir. Ayrıca, tüm biyolojik ve moleküler analizi, ge hücreleri, proteinler, mRNA'lar, microRNA tespit etmek gerçekleştirilebilirnes veya miyokard enfarktüsü için yeni tedavi stratejileri geliştirmek için terapötik hedefler olarak kullanılabilecek diğer biyobelirteçler.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
This work was supported by Interdisciplinary Centre for Clinical Research IZKF Aachen (junior research group to E.A.L.) within the faculty of Medicine at RWTH Aachen University. We are grateful Dr. Rusu and Ashley Christina Vourakis for critical review of the manuscript and Mrs. Roya Soltan for the professional help with immunohistochemistry staining.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Stereomicroscope | Olympus | SZ/X9 | |
| Mouse ventilator | Harvard Apparatus | 730043 | Model Minient 845 |
| Dual Anesthesia System (Tabletop Version) | Harvard Apparatus | Selfcontained isofluranebased anesthesia unit for use on lab tables, with a compact 8" x 11" footprint. | |
| Intubation cannula | Harvard Apparatus | 732737 | |
| Forceps | FST, Germany | 9119700 | standard tip curved 0.17 mm x 0.1 mm |
| Scissors | FST, Germany | 9146011 | straight |
| Vannas scissor | Aesculap, Germany | OC 498 R | |
| Retractors | FST, Germany | 1820010 | 2.5mm wide |
| Retractors | FST, Germany | 1820011 | 5 mm wide |
| Wire handles | FST, Germany | 1820005 | 10 cm |
| Wire handles | FST, Germany | 1820006 | 14 cm |
| Ketamine 10% | CEVA, Germany | ||
| Xylazine 2% | Medistar, Germany | ||
| Bepanthene eye and nose cream | Bayer, Germany | ||
| Silicon tube | IFK Isofluor, Germany | custommade product | diameter 500 µm |
| section thickness 100 µm | |||
| polytetrafluorethylene catheter | |||
| PROLENE Suture 6/0 | ETHICON | 8707H | polypropylene monofilament suture, unresorbable, needle CC1, 13 mm, 3/8 Circle |
| 7/0 Silk | Seraflex | IC 1005171Z | |
| Ultrasound | Vevo, Canada | 770 Vevo |
Referanslar
- Liehn, E. A., Postea, O., Curaj, A., Marx, N. Repair after myocardial infarction, between fantasy and reality: the role of chemokines. J Am Coll Cardiol. 58 (23), 2357-2362 (2011).
- Liehn, E. A., Radu, E., Schuh, A. Chemokine contribution in stem cell engraftment into the infarcted myocardium. Curr Stem Cell Res Ther. 8 (4), 278-283 (2013).
- Alexander, S., et al. Repetitive transplantation of different cell types sequentially improves heart function after infarction. J Cell Mol Med. 16 (7), 1640-1647 (2012).
- Liehn, E. A., et al. Compartmentalized protective and detrimental effects of endogenous macrophage migration-inhibitory factor mediated by CXCR2 in a mouse model of myocardial ischemia/reperfusion. Arterioscler Thromb Vasc Biol. 33 (9), 2180-2186 (2013).
- Liehn, E. A., et al. Ccr1 deficiency reduces inflammatory remodelling and preserves left ventricular function after myocardial infarction. J Cell Mol Med. 12 (2), 496-506 (2008).
- Liehn, E. A., et al. A new monocyte chemotactic protein-1/chemokine CC motif ligand-2 competitor limiting neointima formation and myocardial ischemia/reperfusion injury in mice. J Am Coll Cardiol. 56 (22), 1847-1857 (2010).
- Liehn, E. A., et al. Double-edged role of the CXCL12/CXCR4 axis in experimental myocardial infarction. J Am Coll Cardiol. 58 (23), 2415-2423 (2011).
- Oral, H., et al. CXC chemokine KC fails to induce neutrophil infiltration and neoangiogenesis in a mouse model of myocardial infarction. J Mol Cell Cardiol. 60, 1-7 (2013).
- Projahn, D., et al. Controlled intramyocardial release of engineered chemokines by biodegradable hydrogels as a treatment approach of myocardial infarction. J Cell Mol Med. 18 (5), 790-800 (2014).
- Schuh, A., et al. Novel insights into the mechanism of cell-based therapy after chronic myocardial infarction. Discoveries. 1 (2), e9 (2014).
- Schuh, A., et al. Effect of SDF-1 alpha on Endogenous Mobilized and Transplanted Stem Cells in Regeneration after Myocardial Infarction. Curr Pharm Des. 20 (12), 1964-1970 (2013).
- Zaragoza, C., et al. Animal models of cardiovascular diseases. J Biomed Biotechnol. 2011, 497841 (2011).
- Kanzler, I., Liehn, E. A., Koenen, R. R., Weber, C. Anti-inflammatory therapeutic approaches to reduce acute atherosclerotic complications. Curr Pharm Biotechnol. 13 (1), 37-45 (2012).
- Liehn, E. A., Zernecke, A., Postea, O., Weber, C. Chemokines: inflammatory mediators of atherosclerosis. Arch Physiol Biochem. 112 (4-5), 229-238 (2006).
- Kolk, M. V. V., et al. LAD-Ligation: A Murine Model of Myocardial Infarction. J. Vis. Exp. (32), 1438 (2009).
- Ryu, J. H., et al. Implantation of bone marrow mononuclear cells using injectable fibrin matrix enhances neovascularization in infarcted myocardium. Biomaterials. 26 (3), 319-326 (2005).
- Frobert, A., Valentin, J., Cook, S., Lopes-Vicente, J., Giraud, M. N. Cell-based Therapy for Heart Failure in Rat: Double Thoracotomy for Myocardial Infarction and Epicardial Implantation of Cells and Biomatrix. J. Vis. Exp. (91), e51390 (2014).
- Xu, Z., Alloush, J., Beck, E., Weisleder, N. A Murine Model of Myocardial Ischemia-reperfusion Injury through Ligation of the Left Anterior Descending Artery. J. Vis. Exp. (86), e51329 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır