Method Article
Bakteriyel Yüzey Motilite Tahliller hazırlanması, Görüntüleme ve miktarının belirlenmesi
Bu Makalede
Özet
Swarming motility is influenced by physical and environmental factors. We describe a two-phase protocol and guidelines to circumvent the challenges commonly associated with swarm assay preparation and data collection. A macroscopic imaging technique is employed to obtain detailed information on swarm behavior that is not provided by current analysis techniques.
Özet
Bakteriyel yüzey motilitesi gibi kaynaşıyormuş kadar, genellikle spesifik agar konsantrasyonları ve büyüme ortamı içinde belirli bir besin bazen dahil gerekli plaka tahlilleri kullanılarak laboratuarda incelenir. Böyle açık medya ve yüzey büyüme koşullarının hazırlanması bakteriyel büyüme ancak ince sıvı filmler içinde bu yüzeyler üzerinde bakteri koordineli motilitesini sadece izin elverişli koşulları sağlamak için hizmet vermektedir. Sürüsü plaka ve diğer yüzey hareketlilik plaka testlerinin tekrarlanabilirliği önemli bir sorun olabilir. Özellikle sadece% 0.4 agar aralıkları% -0.8 (ağırlık / hacim), büyük ölçüde sürüsü tahlil sonuçlarını etkileyebilir protokol veya laboratuvar ortamında küçük değişiklikler içinde motilite sergileyen fazla "ılıman diğer canlılar" için. Bu plaka tahlillerinin sıvı-katı-hava ara "Islanabilirlik" ya da su içeriği, genellikle kontrol edilmesi önemli bir değişkendir. Kaynaşıyor değerlendirilmesinde ek bir zorluk o ölçmek için nasılherhangi iki (veya daha fazla) deneyler arasında farklılıklar bserved. İşte hazırlamak ve görüntü sürüsü tahlilleri için detay çok yönlü bir iki-fazlı protokolü biz. Biz genellikle sürüsü tahlil medya hazırlanması ve bu deneylerin verilerinin ölçümü ile ilgili zorlukları aşmak için kurallar içermektedir. Biz özellikle zaman atlamalı optik görüntüleme sağlamak için yeşil floresan protein (GFP), lusiferaz (lux operon) gibi floresan veya biyoluminesan genetik gazetecilere ifade bakteri veya hücresel lekeleri kullanarak yöntemi göstermektedir. Biz ayrıca, aynı deneyde kaynaşan tür rakip etiket için yöntem yeteneğini göstermektedir.
Giriş
Birçok bakteri kendine tahrik çeşitli araçları kullanarak yüzeyler üzerinde hareket. Bazı motilite fenotipleri yarı-katı plaka tahlil bileşimi ile ilişkili sıvı çevre tarafından etkilenen plaka analizleri kullanılarak laboratuvarda araştırılabilir. Yararlı yüzey hareketlilik plaka deneylerinin bir alt ayrıca bir gaz fazı-tipik oda havasını içerir. Yerel çevre katı yüzeye, sıvı ortamda, ve gaz ortamı özellikleri: Buna göre, herhangi bir yüzey hareketlilik tahlil sonucu, üç aşamadan arayüzü dikkatli kontrolünü gerektirir.
Bu gibi bir üç-faz deneyinde en fazla çalışılan motilite modu tarafından sarılmış olarak da bilinir. Motilite swarming yüzeylerde 1 ince sıvı filmlerinin yoluyla flagella tarafından tahrikli olan bakteri hücrelerinin koordineli bir grup hareketidir. Bu, tipik olarak 0.4% -0.8% ihtiva eden yan-katı plaka tahlilleri (ağırlık / hacim) kullanılarak laboratuarda incelenir agar 1. Bir diziİnsan patojenler keşfetmek ve insan ana kolonize için bu hareketlilik davranışı istismar. Örneğin, Proteus mirabilis, üretra yukarı taşımak için motilite swarming ulaşan ve mesane ve böbreklerde 2 kolonize kullanır. Kaynıyordu hareketlilik genelde oluşumunu biyofilm habercisi adım, birçok insan patojenleri 3 patogenezinde temel nedeni olarak kabul edilmektedir.
kaynıyordu fenotip bakteri türleri arasında oldukça çeşitlidir; Deneysel başarı ve uyarlık güçlü, diğerleri 3-5 arasında besin kompozisyonu, Agar tipi ve kompozisyon, sterilizasyon protokolü (örneğin, otoklav), yarı-katı medya kür ve ortam nem (örn, mevsimsel değişiklikler) gibi faktörlere dayanmaktadır. Yüzey motilite yanıtları değişkenliği bu çalışmalar ve önemli etkisi medya ve uygulamayın ortamda karşılaşılan zorlukları vurgulamaktadır. Pseudomonas gibi bir kaynaşan türleri, kaynaşan mot içinGözlenen fenotip ve beraberindeki sürüsü genişleme oranı büyük ölçüde değişir 3 rağmen ility, medya besteleri çeşitli oluşabilir. Kombine, bu faktörler yüzey motilite çalışmaları son derece zorlu yapabilirsiniz. Bir laboratuar olan süreli değişkenliği, bu üç-fazlı tahlilleri etkileyebilir: deneyler, kış kuru hava yaz nemli hava içinde daha iyi ve kötü işlev görebilir. Burada yüzey hareketlilik plaka çalışmaları yaparken en önemli zorluklardan bazılarını aşmak için genel kurallar sunuyoruz.
Bazı yüzey motilite çalışmaları için, belirli fenotip gelişimi büyük ilgi olduğunu. Çoğu, ama hepsi değil, yayınlanmış çalışmalar P. kaynaşıyor incelemek için aeruginosa aşılama merkezinden 3-9 yayılan dalları veya fractalların oluşumunu göstermektedir. P. arasındaki farklar aeruginosa suşu 5,8 belgelenmiştir ama varlığında veya dalları yokluğunun çok specifi atfedilebilirc orta ve protokol bu sürüsü motilite plaka deneyleri için kullanılan. Burada P. dal oluşturan sürüleri teşvik konusunda ayrıntıları içerir aeruginosa. P. Çünkü aeruginosa sadece bir sayıda bakteri kaynıyor, biz de Bacillus subtilis kaynaşan ve Myxococcus ksanthos'ta ve kayma incelemek için yöntemi ayrıntıları içerir. P. gibi aeruginosa, B'ye güncel araştırma subtilis ve M. Xanthos araştırmacı gibi konularda bir dizi sporlanma, motilite, stres yanıt ve geçiş davranış 1,10 yönlerini ayırt çalışıyoruz yayılmıştır. Kaynaşan gruplarında, bu hücrelere özgü davranış (ler) biçimleri ve dinamikleri ölçmek için bir ihtiyaç vardır.
Yüzey hareketlilik veri toplama, analiz ve yorumlama hantal ve nitel olabilir. Biz bölge morfolojisi ve s sürüsü ek sağlayan bakteriyel sürüleri detaylı makroskopik analizi için bir protokol geliştirmiştirize (örneğin, çap), oğul genişleme hızı ve bakteriyel veya biyoürünler yoğunluğu dağılımı 7 ile ilgili niceliksel dinamik bilgi. Ayrıca, bu yöntem bakteri etkileşimleri 8 kapsamlı bir görünümünü elde etmek için mevcut floresan proteinleri, parlaklık, ve boyalar yararlanabilirsiniz yanı sıra bir sürüsü içinde bioproducts sentezini (örneğin, P. aeruginosa 7,8 ramnolipid) izlemek için.
Protokol
1. Sürü Deneyi Ortam Hazırlama ve Aşılama 4,5,7,8,11
- Medya Hazırlık
Not: Aşağıda tarif edilen ortam bileşimi P. için geçerlidir aeruginosa tendril oluşum çalışmaları. P. için Tablo 1 ortam özelliklerini bakınız aeruginosa, B. subtilis ve M. Xanthos yüzey motilite tahlilleri.- Bir manyetik karıştırma çubuğu ile karıştırıldı FAB-eksi 200 ml (NH4) 2 SO4 sürüsü ortamı (Malzeme Tablosu), asil agar 0.9 g ve kasamino asitleri, 0.2 g (Tablo 1) karıştırın. Deneyler arasındaki tutarlılığı artırmak için küçük hacimli (100-300 ml) kullanın.
- 22 dakika, 121.1 ° C pozlama sıcaklığı ve hızlı bir havalandırma seçeneği bir pozlama süresi ile 200 ml ağar / medya karışımı otoklavlayın. otoklav ayarları doğru sterilizasyon ve ağar erimesini sağlar, ancak ağar karameleşmesini önleyecektir.
NOT: Noble Agar karamel eğilimliyönetsel,; bakteriyel hareketlilik karamelize agar üzerinde değiştirilir. - Sterilizasyon döngüsü tamamladı hemen sonra, buharlaşma yoluyla su kaybını önlemek için ortam şişe kapağını kapatın. Ancak, sıkı kapama şişesi üzerinde benzeri etki "mühürleme vakum" a neden olabilir unutmayın.
- Oda sıcaklığında (RT) karıştırılarak 50 ° C'ye kadar soğutun ve ortam steril 1.2 M 2 glikoz ilave edin. Alternatif olarak, (en fazla 15 saat sonra) kullanın ve gösterildiği gibi devam etmeye hazır kadar 60 ° C inkübatör veya su banyosunda ortamı yerleştirin. Medyada kabarcıklarının oluşmasını önlemek için, manyetik karıştırıcı çubuğu kullanarak iyice karıştırın; Hatta swarming engeller agar yüzeyinde kabarcıklar.
Not: gösterildiği gibi, diğer testlerde, bu aşamada gerektiğinde, bu tür ek besin ya da boyalar gibi Otoklava ısıya duyarlı bileşenleri ilave (örneğin, 100 ml başına 8 ul Invitrogen Syto 63 boyanın eklenmesi görüntü M. ksanthos'ta agar erimiş representati içinde) Aşağıda Sonuçları ettik. Bazı boyalar eklenmesi olmayan bir boya kontrolü karşı kontrol edilmelidir temel kaynaşma davranışını etkileyebilir. - Bir laboratuar kaput, kısım 7.5 60 mm çapında polistiren Petri çanağı başına steril ortam ml ve tek bir kat levhaları muhafaza (yığılmış değildir). Daha büyük kaynaşma yüzeyi, kısım 100 mm çapında Petri çanağı başına ortam 25 ml için. Bir çift yatay yüzey üzerinde yemekler doldurmak için önemlidir. Yüzey tesviye olup olmadığını kontrol etmek için bir boğa gözü düzeyi kullanın.
NOT: P. İçin plaka başına belirli bir ortam hacmi kullanarak aeruginosa deneyleri, tutarlılık ve tekrarlanabilirlik artıracaktır. B. için subtilis ve M. Belirli bir ses kısma benzer Xanthos deneyleri, elle dökme sonucu verir.
- Plaka kür
- Küçük plakanın (60 mm), 30 dakika boyunca (kapaksız örneğin) ortaya kaputu (yarı-katı ve kuru artık sıvı ayarlı iki) erimiş agar ortamı tedavisi için olanak sağlar. BüyükPlakalar (100 mm) daha uzun bir kür süresi (Tartışma) gerektirir.
NOT: Alternatif olarak, bazı tahliller kapalı tezgah üstü gecede (20-24 saat) (yani, kapaklar üzerinde) tek bir katmanda (Tablo 1) üzerinde tedavi plakaları gerekebilir. Kaynaşma hem aşırı ve yetersiz neme karşı duyarlıdır. herhangi bir laboratuar nem, hava akımı ve sıcaklık size bakterinin optimal kaynıyordu teşvik kür plaka değişimi gerektirebilir. - Kuruma süresi bitti hemen sonra plakaları aşılamak. Daha fazla kullanım için plakaları saklamayın.
- 10 ul 0.50% karışımı (hacim / hacim) Higgins Suya Siyah Hindistan Mürekkep ve bakteriyel inokulum 11 ile bir test plakası tespit ederek "mürekkep yayılma testi" yapın. Mürekkep / inokulum karışımı medya yüzeyinde (yani damlacık formu tutmaz) kolayca yayılır, ortam kuruması için ek zamana ihtiyaç olacaktır.
NOT: neme özellikle duyarlı olan türlerin (için örneğin, P. aeruginosa), plakalar yeterince kuru olup olmadığını belirlemek için hızlı bir "mürekkep yayılma testi" 11 gerçekleştirin.
- 10 ul 0.50% karışımı (hacim / hacim) Higgins Suya Siyah Hindistan Mürekkep ve bakteriyel inokulum 11 ile bir test plakası tespit ederek "mürekkep yayılma testi" yapın. Mürekkep / inokulum karışımı medya yüzeyinde (yani damlacık formu tutmaz) kolayca yayılır, ortam kuruması için ek zamana ihtiyaç olacaktır.
- Küçük plakanın (60 mm), 30 dakika boyunca (kapaksız örneğin) ortaya kaputu (yarı-katı ve kuru artık sıvı ayarlı iki) erimiş agar ortamı tedavisi için olanak sağlar. BüyükPlakalar (100 mm) daha uzun bir kür süresi (Tartışma) gerektirir.
- Sürü Deneyi Aşılama
- Bir taze (Tablo 1 'e bakınız), 6 ml inoküle. 30 ° C'de suyu kültürü, gece boyunca (≤18 saat) inkübe veya yatay çalkalanarak (240 rpm) ile 37 ° C.
- Gecede suyu kültürünün 1-5 ul, ya da "alay" tarafından tespit ederek sürüsü plakaları aşılamak steril bir diş ile agar almak veya tel aşılama iğne.
NOT: inokulumun sıçrayan olasılığını azaltır ve oğul yüzey alanına ek nem ekleyerek engeller çünkü ikinci yöntemi tercih.
- Sürü Deneyi Kuluçka
- Genel tahlil için, 30 ° sürüsü tahlil plakaları kuluçkayaC veya (B. subtilis ya da 42 ° C, Tablo 1) 37 ° C -bu bakteri özgüdür. Bu aşırı nem kapak değil, agar üzerinde yoğunlaşır bu yüzden inkübasyon sırasında plakalar ters çevirin.
NOT: Sıcaklık fenotip yanı sıra kinetik etkileyebilir. P. aeruginosa sürüleri, 37 ° C'de kuluçka, 30 ° C'de inkübasyon daha hızlı büyüme ve sürüsü genişlemesine yol açar; Ancak, bu sürüleri morfolojisi genellikle sıcaklık bu değişiklikle farklıdır. - Time-lapse görüntüleme için, görüntüleme istasyonu (ayrıntılar için bakınız Tablo 1) içine aktarmak için önce uygun sıcaklıkta sürüsü plakaları inkübe.
NOT: Bu ön-kuluçka görüntüleme sürüleri onların gelişimini başlatmak için ve ya motilitesini swarming için optimal olmayabilir, yeni bir ortama taşınıyor önce kurulmuş haline sağlar.
- Genel tahlil için, 30 ° sürüsü tahlil plakaları kuluçkayaC veya (B. subtilis ya da 42 ° C, Tablo 1) 37 ° C -bu bakteri özgüdür. Bu aşırı nem kapak değil, agar üzerinde yoğunlaşır bu yüzden inkübasyon sırasında plakalar ters çevirin.
Yüzey Motilite Tahliller 7,8 2. makroskopik Görüntüleme
- Time-lapse görüntüleme için, ticari in vivo görüntüleme istasyonu içinde net bir görüntüleme plaka üzerinde ön görüntüleme kuluçka dönemi yeri sürüsü tahlil plakaları sonra. Resim kadar altı, 60 mm çapında ya da dört, bir seferde 100 mm çapında plakalar. Kamera görüntüleme düzlemi altındaki görüntüleri yakalar yana, optik yol 8 tıkalı olmadığından emin böylece plakları ters çevirin. Seçenek olarak ise, deney süresince 30 ° C veya 37 ° C (Tablo 1) de inkübe ve plakalar, belirlenen zaman aralıklarında inkübatör görüntülenmek üzere çıkarın.
- Dik aşılanmış ortamı tutan plaka muadili üstüne Petri yemekleri kapaklarını yerleştirin. Görüntüleme sırasında aşırı kurumasını önlemek ve deney boyunca nem korumak için başka bir açık tepsi kullanarak tüm set kadar içine su ile Petri yemekleri kapaklarını doldurun.
- Im kullanılarak oda sıcaklığında Moleküler Görüntüleme Kullanma (MI) yazılımı 12, koşmak tahlil (ler)Tablo 2'de anlatılan ayarları yaşlanma. time-lapse görüntüleme için gerekli adımları ve özellikleri ile bir protokol kurmak.
3. Veri İşleme ve Yorumlama 7,8
- Görüntü İşleme
- Dosya> Dışa Aktar veya Dışa Aktar Birden> Dosya seç (ler) ihracat ve ihracat konumu: 16-bit TIFF dosyaları olarak toplu ihracat görüntüleri kullanın MI yazılımı.
- Tek bir görüntüyü açmak veya zaman atlamalı serisi almak için ImageJ kullanın:
- Tek bir görüntüyü açmak: Dosya> Aç
- İthalat time-lapse görüntü sırası: Dosya> İçe Dizi, ve "sayısal Sıralama adları" seçeneğini seçin.
- Büyük hızlandırılmış dosyalar için uygun kategorilerde (yani, GFP, TTT, vs.) ihraç görüntüleri yığını "İthalat Sırası" penceresinde "sanal yığını kullan" seçeneğini seçin.
- Gerekirse, 8-bitlik dosyaları 16 bit dosyaları görüntüleri değiştirmek: Görüntü> Yazım> 8-bitlik
NOT: Bazı ImageJ araçları 8-bit görüntüleri gerektirir. - Bir görüntü ya da time-lapse dizisi için yoğunluk sinyali ters gerekip gerekmediğini belirleyin. (Örneğin, floresan etiketli büyüme) görüntüdeki parlak noktaya imleci yerleştirin ve ImageJ araç çubuğundan sinyal yoğunluğu "değer" not. Ardından, plaka alanının dışında bir karanlık nokta imleci ve sinyal yoğunluğu dikkat. Karanlık nokta için sinyal yoğunluğu parlak nokta için yoğunluk daha büyükse, görüntü sinyal yoğunluğu (alt basamakları aşağıda 1-2 izleyin) ters gerekmektedir.
- Yoğunluk sinyalleri haricindekileri: Düzen> Invert
- Görüntü> Arama Tablolar> Invert LUT: arama tablosunu haricindekileri
- Arka plan çıkarma:> Süreci Arkaplan çıkarma ve bir buçuk bir görüntü boyutunun (olan bir piksel yarıçaplı bir "Rolling top yarıçapı" kullanmak, örneğin, 2.000 x 2.000 p 1.000 pikselIxel görüntüsü).
- Yapay bir görüntü ya da time-lapse dizisi renk: Görüntü> Arama Masalar ve liste seçeneklerinden uygun renk seçin.
- İki veya daha fazla kanallı film için, birleştirme ve önceki bir film (Görüntü İşleme, Adım 8) olarak tasarruf renkleri dengelemek. Açık, birlikte ImageJ tüm görüntü yığınları görüntüleri birleştirmek için, ardından Görüntü> Renk> Kanallar Birleştirme seçin ve bir renk kanalına her yığını atayın.
- > Dosya olarak kaydet ve istenilen biçim ve teknik özellikleri seçin: AVI veya QuickTime Movie gibi zaman atlamalı dizisi kaydedin.
- Veri Analizi
- Bakteriyel Yüzey Büyüme Alanı Kazanılması Genişleme Oranı belirlememize
- ImageJ Açık görüntü (ler)
- "Düz" aracı ile bir deney plakasının merkezi boyunca bir çizgi çizmek ve onun uzunluğunu ölçmek, piksel plakanın çapı hesaplamak için: Analiz> Ölçüm
- ImageJ varsayılan ölçü birimi pixel. Bir önceki aşamada elde edilen piksel uzunluğu (60 mm tabak için, örneğin, 60), deney plakasının çapı bölünmesi ile bir dönüştürme faktörü elde edilir.
- Mm piksel bir ölçü birimini değiştirme: Görüntü> Properties
- Bir önceki adımda hesaplanan dönüşüm faktörü "mm" ile "Uzunluk Birimi" ve "Piksel Genişlik", "Piksel Boy" ve "Voksel Derinlik" olarak değiştirin. Birden fazla görüntü arasında bu dönüşüm faktörünü korumak için "Küresel" kutusunu seçin.
NOT: ImageJ kapalı ve yeniden, ya da bir görüntünün görüş alanı değiştirilir ise (yani, bir resim diğerinden daha yakınlaştırılmış), dönüşüm faktörü yeniden hesaplanmalıdır. Seçenek olarak ise, her piksel analiz eder ve daha sonra mm dönüştürülür yapar.
- Bir önceki adımda hesaplanan dönüşüm faktörü "mm" ile "Uzunluk Birimi" ve "Piksel Genişlik", "Piksel Boy" ve "Voksel Derinlik" olarak değiştirin. Birden fazla görüntü arasında bu dönüşüm faktörünü korumak için "Küresel" kutusunu seçin.
- Her çerçeve için, iz ve ou izlemek için araç çubuğundaki "Serbest Seçimler" aracını kullanarak sürüsü alanını ölçmek> Ölçü analiz: sürüsü bir tablo çiziyor ve kullanma alanı ölçmek. Dosya> Farklı Kaydet: Bu, Microsoft Excel veya benzeri programlarda daha fazla analiz için kaydedilebilir bir ölçümler bu log üretecektir
- Bakteriyel Yüzey Büyüme Yoğunluk Kazanılması Yüzey Büyüme Oranı belirlememize
- Arka plan (Görüntü İşleme, Aşama 5) çıkarılır sonra, sürüsü (veri analizi, Aşama 1) maksimum alanı belirlemek için sekansının son çerçeve kullanır.
- Bakteriyel yüzey büyüme etrafında bir kutu çizmek için araç çubuğundan "Oval" seçim aracını kullanın.
- "Gri değerini ortalama"> Set Ölçümler Analiz ve seçin: kullanarak kutunun içinde piksel yoğunluğu ölçümü ortalama ayarlayın.
- Analiz> Ölçüm: dizinin ilk karede giderken, time-lapse dizisi her kare için yoğunluk sinyal ölçümleri elde etmek. Bu Mi fazla analiz için kaydedilebilir bir ölçümler bu log üretecektircrosoft Excel veya benzeri programlar: Dosya> Farklı Kaydet
- Bir önceki bölümde (Veri Analizi, Adım 2) alternatif. Kurulum ImageJ Makro eklenti kullanın ve bir Makro yüzey büyüme yoğunluğu ölçümü komut dosyasını çalıştırın.
- Kur aynı anda birden fazla çerçeve analiz için otomatik ölçüm komut: Plugin> Yeni> Makro ve kutuya verilen komut (aşağıda) yapıştırın ve bir ImageJ Makrolar metin dosyası olarak kaydetmek: Dosya> Kaydet ve "kapsamında ImageJ uygulama klasörüne kaydetmek Makrolar ".
numberOfFrames = N-
için (i = 0; i ('Tedbir') çalıştırın;
çalıştırın ('Sonraki Dilim [>]');
}
NOT: Burada değişken "N" çerçeve belirsiz bir sayıda içindir. - Önce senaryoyu çalışan görüntü dizisindeki kare sayısını yansıtacak şekilde her bir deney için Makrolar eklenti "numberOfFrames" düzenleyin. Kullanımı: Plugin> Makro>Düzen ve tipi dizisindeki kare doğru sayıda ve kaydetmek (Dosya> Kaydet).
- Veri Analizi-Adım 2 alt basamakları 1-3 izleyin ve dizinin ilk karede ise Makrolar eklentisi çalıştırmak: Plugin> Makroları> Çalıştır. Dosya> Farklı Kaydet: Bu, Microsoft Excel veya benzeri programlarda daha fazla analiz için kaydedilebilir bir ölçümler bu log üretecektir
- Kur aynı anda birden fazla çerçeve analiz için otomatik ölçüm komut: Plugin> Yeni> Makro ve kutuya verilen komut (aşağıda) yapıştırın ve bir ImageJ Makrolar metin dosyası olarak kaydetmek: Dosya> Kaydet ve "kapsamında ImageJ uygulama klasörüne kaydetmek Makrolar ".
- Bakteriyel Yüzey Büyüme Alanı Kazanılması Genişleme Oranı belirlememize
Sonuçlar
Plaka hazırlanmasında Değişimi ölçüde motilite swarming etkileyebilir. erimiş agar ortamı döküldükten sonra veya kuruma süresi yüzey motilite tahlilleri ve zamanla bakteri hareketliliği üzerindeki ince sıvı film mevcut etkiler. Besin kompozisyonundaki değişiklikler de birkaç bakteriler için kaynıyordu etkileyebilir. Şekil 1A Hindistan Mürekkep yayılması ve Bacillus subtilis bir başlangıç inokulum yayılmasını üzerine kuruma süresi kısa vadeli etkisini gösterir 11. Şekil 1B kuruma süresi ve Şekil 1C gösterileri etkisini gösterir P swarming tarafından daha sonraki dal gelişimi üzerine amonyum sülfat etkisi [(NH 4) 2 SO 4] aeruginosa 5.
Ölçülebilir veriler çoklu görüntüleme stratejileri kullanarak yüzey hareketlilik bitiş görüntüleri elde edilebilir. Şekil 2 için temsili yüzey büyüme sonuçlarını göstermektedir P. aeruginosa kaynıyordu ve ilişkili GFP floresan görüntü; B. subtilis kaynaşma ve ilişkili biyoışıldama görüntüsü; ve Myxococcus Xanthos yüzey büyüme ve Syto ilişkili kırmızı floresan görüntü hücreleri 64-lekeli.
Sadece muayene ve uç nokta sonuçlarının görüntüleme ötesinde veri toplama Genişleme 3 7 Şekil. Yüzey büyüyen bakteriler için dinamik davranışı (ler) çalışma için izin veren P. bir örneğini göstermektedir aeruginosa (GFP ifade hücreler için görüntülü) kaynıyordu ve ilişkili ramnolipid üretimi P. genişleme oranını göstermek için bu görüntüleri veri -en miktar da görüntülenir (Nil Kırmızı lipit leke kullanılarak görüntülendi) aeruginosa kaynıyordu. Video 1 B. bir time-lapse gösterir subtilis kaynaşma, bir lüks -expressing gerginlik lüminesans kullanarak görüntülü. Video 2 8 P. bir zaman atlamalı gösterir aeruginosa (yeşil-ifade GFP) ve Salmonella enterica serovar Typhimurium (kırmızı-ifade lux).
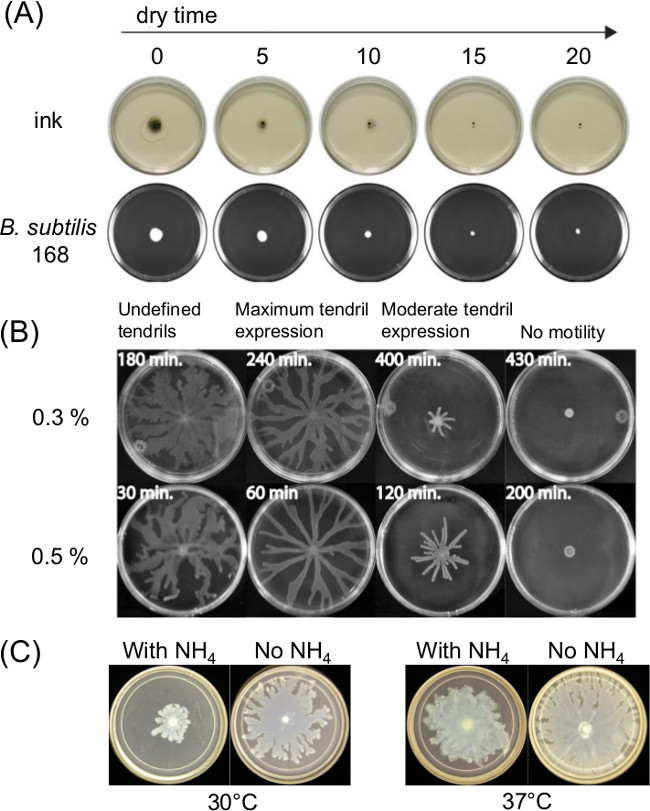
Şekil 1:. Etkisi Agar yüzey nem üzerinde (A) ağar kuruma süresi tahlil sonuçlarını etkileyebilir ve B için inokulum yayılmasını yüzey motilite tahlil hazırlık faktörlerin örnekleri subtilis (Ref 8) P., (B) ağar kuruma süresi aeruginosa ve (C) varlığı veya P. amonyum sülfat yokluğunda (Ref izni ile 5 yayımlanmaktadır) kaynıyor aeruginosa kaynaşma ve dal oluşumu.
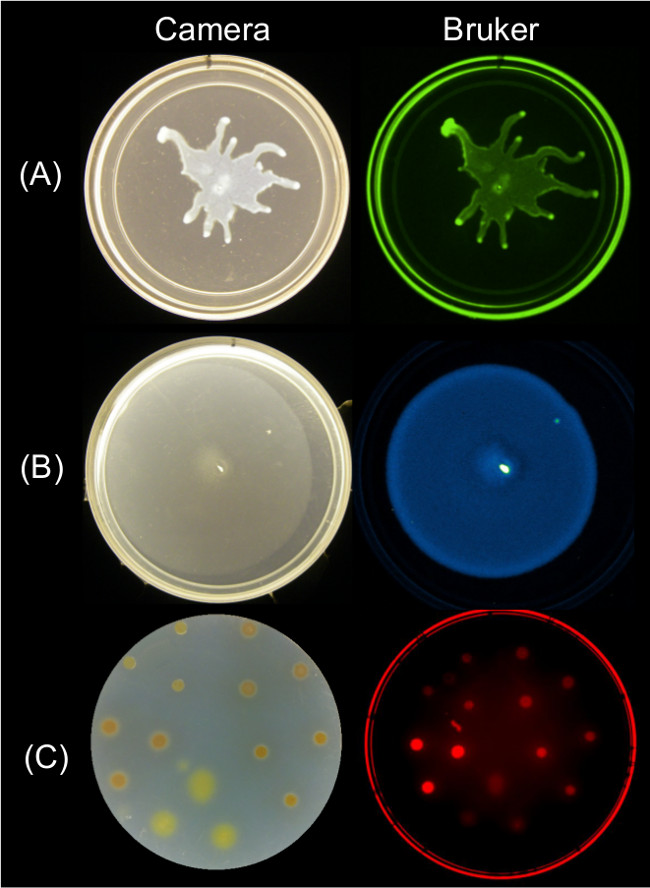
Şekil 2: Alternati(A) P. gösteren bir Bruker görüntüleme istasyonu (solda), bir kameranın yan görüntü ile. Yan ve Bruker görüntü (sağ) kullanarak bakteri görüntüleme yüzeyi büyüme ve hareketlilik için yaklaşımlar A.Ş. aeruginosa ifade GFP-görüntülü, Yeşil Floresan ayarlarını kullanarak (B) B. Syto ile boyandı lüks biyoışıldama muhabiri-görüntülü Lüminesans ayarlarını kullanarak, ve (C) M. Xanthos ifade subtilis Kırmızı Floresan II ayarlarını kullanarak 64-görüntülenmiş. Ayarlama detayları için Tablo 2'ye bakın.
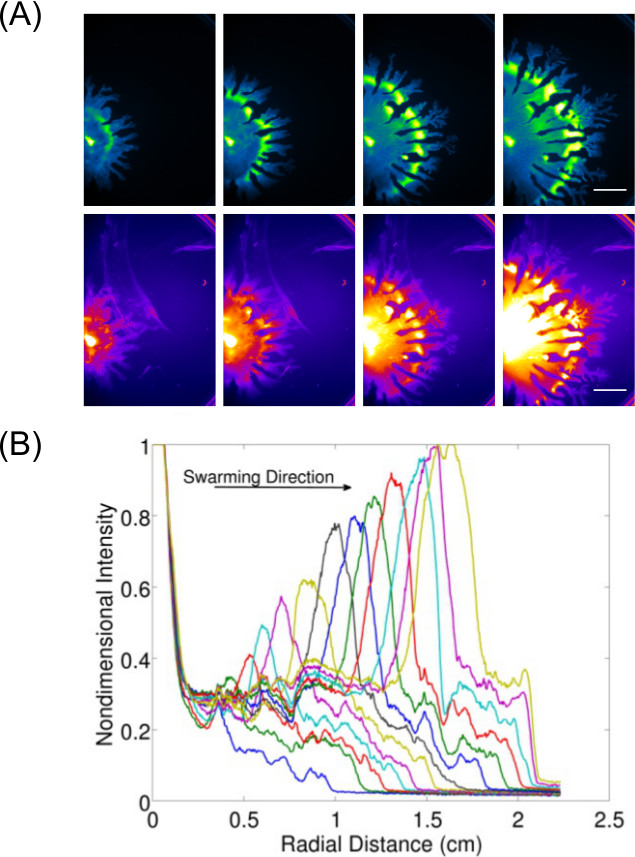
Şekil 3:. Yüzey motilite tahlil nitel ve nicel analiz hücre yoğunluğu dağılımı (A) Time-lapse analizi, ramnolipid üretim (Nil Kırmızı lipit leke Kırmızı Floresan kullanarak görüntülüBen ayarları; Bir P. hücre yoğunluğu dağılımı görüntüleri genleşme oranının ölçek çubuğu = 15 mm) ve (B) 'miktar aeruginosa sürüsü. (Ref izni ile 6 yayımlanmaktadır.)
Video 1. Bir B. Time-lapse görüntüleme subtilis sürüsü. B. subtilis lux ifade ve Lüminesans ayarlarını kullanarak kaydetti. Ayarlama detayları için Tablo 2'ye bakın.
Video 2. Türler arası rekabet time-lapse görüntüleme ile görüntülendi. P. sürüleri aeruginosa (yeşil, GFP ifade ve Yeşil Floresan ayarlarını kullanarak kaydedilmiş) ve S. enterica serovar Typhimurium (kırmızı; expreslux şarkı ve) Lüminesans ayarlarını kullanarak kaydetti. Ayarlama detayları için Tablo 2'ye bakın. (Ref 7 izni ile yeniden yazdırın.)
| P. aeruginosa | P. aeruginosa dal oluşumu çalışmaları | B. subtilis | M. Xanthos | |
| Gece karışım kültürü ortamı | FAB artı 30 mM Glikoz | FAB artı 30 mM Glikoz | 1 POUND = 0.45 KG | CTT |
| Gece karışım kültürü inkübasyon sıcaklığı | 37 ° C | 37 ° C | 37 ° C | 30 ° C'de 30 saat |
| Sürü medya | FAB | FAB eksi (NH 4) 2 SO 4 | % 2 (ağırlık / hacim) LB | CTT |
| Swarm medya: ek bileşenler | 12 mM Glikoz | % 10 (ağırlık / hacim) CAA, 12 mM Glikoz | n / a | SYTO® 64 |
| Agar tipi | Ağar, Noble | Ağar, Noble | Granül Agar | Ağar, Noble Affymetrix |
| Agar konsantrasyonu (ağırlık / hacim) | % 0.45 | % 0.45 | % 0,60 | 1.50% |
| Sürü plaka boyutu | 60 mm | 60 mm | 100 mm | 150 mm |
| Plaka başına ortam hacmi | 7.5 mi | 7.5 mi | El Dökme | El Dökme |
| Sürü medya ayarı / kurutma yöntemi | Hood; Plakalar ortaya | Hood; Plakalar ortaya | Tezgahüstü; Plakalar kaplanmış | Tezgahüstü; Plakalar kaplanmış |
| Sürü medya ayarı / kuruma süresi | 30 dakika | 30 dakika | Gecelik (20 -24 saat) | Gecelik (20 -24 saat) |
| Sürü tahlil inkübasyon sıcaklığı | 30 ya da 37 ° C | 30 ° C | 37 ° C | 30 ° C |
| Zaman atlamalı görüntüleme için inkübasyon | En az 4 saat süre ile 30 ° C | En az 4 saat süre ile 30 ° C | 2 saat süre ile 37 ° C | 12 saat RT |
| Time-lapse yakalama uzunluğu | 24 saat | 24 saat | 10 saat | 66 saat |
| Time-lapse ayarı | 1 kare / 10 dk | 1 kare / 10 dk | 1 kare / 6 dk | 1 kare / 10 dk |
| bir otoklav sonrası eklendi. | ||||
Tablo 1:. Yüzey Motilite Testi Hazırlanması için Teknik yüzey içerirP. motilite deney hazırlama özellikleri aeruginosa, B. subtilis ve M. Xanthos.
| Işaret | Yeşil Floresan | Kırmızı Floresan I | Kırmızı Floresan II | Işıldama |
| Protein ya da boya | Yeşil Floresan Proteini (GFP) | MCherry proteini veya Nil Kırmızı ramnolipid leke | SYTO® 64 | Lux operon'u lusiferaz |
| Eksitasyon dalga boyu (nm) | 480 ± 10 | 540 ± 10 | 590 ± 10 | Kapalı |
| Emisyon dalga boyu (nm) | 535 ± 17.5 | 600 ± 17.5 | 670 ± 17.5 | Filtre yok |
| Pozlama süresi (sn) | 30 | 60 | 60 | 240 |
| f- durdurma | 4.0 | 4.0 | 2.5 | 1.1 |
| FOV (mm) | 190 | 190 | 140 | 120 |
| Odak düzlemi (mm) | 27.5 | 27.5 | 12.2 | 4 |
| Binning (piksel) | Hiçbiri | 2 x 2 | Hiçbiri | 8 x 8 |
Tablo 2: Görüntüleme Şartname kırmızı ve yeşil floresan için Bruker görüntüleme istasyonu özellikleri ve bakteriyel yüzey büyüme ışıma görüntüleme..
Tartışmalar
Sürüsü deneyleri gibi nem ve mevcut besin gibi çevresel faktörlerin, son derece duyarlı bir laboratuvarda tekrarlanabilir swarming sağlanması, zor olabilir. Bir yüzey motilite plaka tahlil en kritik yönü ağar yüzeyde nem. Aşılamadan önce, oğul medya hareketliliği 5 kaynıyordu inhibe gibi yüzey sıvı yüzerek gelen bakteri hücreleri önlemek için yeterince kuru, ama çok kuru olmamalıdır. Kuluçka yeterince nemli ortamda yer almalıdır: çok fazla nem yapay veya artefakt yüzey yayılmasına neden olurken çok az nem, inkübasyon sırasında tahlil kuruma neden olabilir. Bir nem kontrollü inkübatör el olmadıkça, inkübatör ve laboratuvar nem önemli ölçüde değişebilir. Sonuç olarak, inkübatör içinde ek bir su deposu, bir nemlendirici ya da bir nem alıcı Relat tutarken kurutma veya aşırı nem birikimi üzerine önlemek için gerekli olabilir80, yaklaşık% ive nem. Mevsimsel değişiklikler nem önemli ise bu ideal nem bakımı zor ispat edebilir. Bu durumda ise, oğul tahlil protokolü nem mevsimsel değişiklikler için hesap için bazı ayarlamalar gerektirir. Biz sürüsü medya kuruma süresini değiştirerek mevsimsel nem değişiklikleri ayarlamak için basit yolu olduğunu bulduk. Sabit nem izleme, hem içeride hem de kuvöz dışında, tavsiye edilir. Ayrıca, araştırmacıların bu analizlerin tekrarlanabilirlik etkileyebilir onların aletleri, inkübatör, vb terazi, sıcaklık, hacim olarak küçük hatalar veya medya bileşenleri miktarda kalibre ve doğrulamak önerilir.
Ayrıca testte kullanılan levha tipi ve boyutu plaka nem etkiler ve bu nedenle kaynaşan olabilir unutulmamalıdır. Hava geçirmez levhalar aşırı nem, böylece cesaret yüzme hareketliliği kapalı delik yok. Buna karşılık, açık yüzlü levhalar çok fazla nem kaçmasına izin. Bir Petri kabı,sıvı birikimini önlemek için yeterli aşırı nem kapalı kanalları çünkü ideal bir ortam sağlar, ancak kurumasını medya önlemek için yeterli nemi korur. Bu yöntem, yüksek kaliteli görüntüleme için izin veren bir yüzey motilite tahlil protokolü detayları. Agar ortamı, 7.5 ml ile doldurulur görüntüleme 60 mm'lik çapı olan kaplara için açık agar tutmak. Ayrıntılı görüntüleme gerekli değilse, 20 ml kadar hacimleri de tekrarlanabilir sonuçlar sağlayabilir.
Kaynıyordu motilite Agar konsantrasyonlarının geniş bir dizi elde edilebilir olsa da, kaynıyordu için gerekli agar optimal aralık türlerinin bağlıdır. Genel olarak, yüksek ağar konsantrasyonları hareketliliği swarming inhibe, ve dolayısıyla ihtiyaç duyulan zaman bir görüntü hazır sürüsü artar üretmek. P. Ancak optimal kaynaşma çok daha dar bir aralık (0.4-0.5%) meydana bulmak% 1 0,4-0,7 arasında aeruginosa, genel olarak, agar konsantrasyonlarına swarms. Böyle B. Diğerleri, subtilis ve S. bağırsak% 1.5 agar 10 bir% 0.6 agar ile oğul, ve Vibrio parahaemolyticus. Gerekli agar konsantrasyonu da agar marka ve model tarafından belirlenir. Yüksek saflık agarına, Noble agar gibi, güçlü P. kaynaşıyor geliştirmek 13,14 ağar granül üzerinde aeruginosa ve tercih edilir. Ancak, ağar bu saflaştırılmış sürümleri de otoklav sterilizasyon döngüsü sırasında Karamelizasyon daha yatkındır; enstrüman bağlı, kısaltılmış / modifiye sterilizasyon dizisi Noble agar kullanılarak sürüsü ortamı hazırlamak için gerekli olabilir (muhtemelen uzun süre ısıya maruz önlemek için egzoz döngüsünü değiştirmek için).
Ortam bileşimi, aynı zamanda gözlemlenen sürüsü fenotip 3 bir rol oynar. P. aeruginosa kaynıyordu motilite çalışmaları genellikle az besin ortamı kullanılarak yapılmaktadır. Biz FAB tercih orta 4,8 (Malzeme Masa), ancak böyle M9, LB, ya da bu ortak medya küçük farklılıklar gibi diğer medya,başarılı bir şekilde 9,15,16 kullanılmıştır. Filiz oluşumu iyi bir karbon kaynağının ve kasamino asit (CAA) gibi glükoz FAB minimal ortamda elde edilir, ancak burada ek bir azot kaynağı (örneğin, (NH4) 2 SO4) 6,13 yoktur. Dal oluşumu veya morfolojisi çalışmanın ana odak değilse, o zaman FAB minimal ortam (Malzeme Tablosu; Tablo 1) Belirli karbon kaynaklarının ve / veya ek besin etkileri detaylı olarak ele alınabilir ve böylece CAA yoksun tavsiye edilir. Örneğin B gibi diğer türler, subtilis (Burada sunulan), LB ve granül agarda kaynaşan yeteneğine yönlü diğer canlılar vardır. Bu türler tam sürüsü geliştirmek için sadece ~ 10 saat gerektiren, kolayca sürüsü. Bu hızlı swarming oranı, potansiyel zor sürüsü ilerlemesini takip yapar ama bizim protokol çok mümkün izleme gibi yapar. sürüsü zaman atlamalı görüntüleme gerçekleştirmek için yeteneği sağlar substantansiyel özellikle böyle hevesli diğer canlılar gelen, sürüsü veri toplama kolaylığı.
Biz yürütme ve bakteriyel yüzey hareketlilik araştırma röprodüsibilitesini arttırmaya yönelik sağlam, kapsamlı, iki-fazlı protokol ve yönergelere tanıtmak ve başta flagellar-aracılı kaynıyordu incelemek için önemli yönlerini vurgulamıştır. Bu sürüsü tahlil protokolü dahilinde ve araştırma grupları arasında daha fazla tutarlılık ve tekrarlanabilirlik sağlamak için medya kompozisyonu ve yüzey motilite plakaların işlenmesi önemli yönlerini göstermektedir. Bu farklı araştırma çalışmalar arasında karşılaştırma temelini geliştirecek. Buna ek olarak, sunulan yaklaşım ve protokol gibi faktörler işlerini ve örneğin, agar küçük değişiklikler nasıl etkilediğini 4,5 kaynıyordu (olası çözümleri sunan etkileyecek farkında araştırmacıları yaparak çevresel değişikliklere kaynaşma ve yüzey hareketliliği üzerine araştırmalar az duyarlı hale getirmek için araçlar sağlar ). Ayrıca, protokol sağlananDaha önce unquantifiable olan bakteriyel yüzey büyüme birçok özelliklerini ölçmek için bir fırsat sağlar, kaynıyordu makroskobik yönlerini ölçmek.
Biz bu protokol geliştirilmesinde tüm yüzey hareketli bakterileri incelenmiştir değil. Bu nedenle, bu protokol modifikasyonlar burada sunulmamıştır türler için gerekli olacağı tahmin edilmektedir. Bu protokolün etkinliği kullanılan ekipman ve malzemelerin doğal sınırları ile sınırlıdır. Sıcaklık kontrol ekipmanları bir özellik değil çünkü Örneğin, sıcaklık ile ilgili çalışmalar, henüz Bruker görüntüleme istasyonu ile mümkün değildir. Buna ek olarak, (ramnolipidlerin boyanması için, Nil Kırmızısı gibi) boyaların kullanımı kinetik ve konsantrasyon sınırlamaları 8 olabilir. Bu teknik, güçlü işleme ve dijital görüntülerin analizi dayanır; Veri analizi geliştirilmiş otomasyon (örneğin, ek makrolar ImageJ script fonksiyonu kullanarak) analizi için gereken zamanı azaltacakve verilerin yararlılığını genişletin. Son olarak, görüntüleme protokolü sağlamlığı nedeniyle, gelecek uygulamaları, çevre ve patojenik bakteriler tarafından kolonize yüzeylere daha uygun daha az homojen büyüme yüzeyleri incelemek için bu tekniği genişleyen hedeflemelidir.
Açıklamalar
Bu yazı için yayın ücretleri kısmen Bruker Corporation tarafından desteklenmiştir.
Teşekkürler
(; MA ve JDS için R01GM100470 ve 1R01GM095959-01A1) ve NIH hibe # UL1 TR000006 tarafından finanse Indiana Klinik ve Translational Bilimleri Enstitüsü Core Tesisi hibe (; bu iş için kısmi destek Ulusal Sağlık Enstitüsü tarafından sağlanan edildi JDS).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagentsa | |||
| FAB Minimal Media: | Prepare every ~4 weeks. Top to 1 L with nanopure H2O. | ||
| (NH4)2SO4 | Sigma | A4418 | 2 g. Not used in P. aeruginosa tendril formation studies. |
| Na2HPO4 x 7H2O | Sigma-Aldrich | S9390 | 9 g |
| KH2PO4 | Sigma | P5655 | 3 g |
| NaCl | BDH | BDH8014 | 3 g |
| MgCl2 x 6H2O solution (198 g/L) | Fisher Scientific | M33 | 1 ml |
| CaCl2 x 2H2O solution (14 g/L) | Fisher Scientific | C79 | 1 ml |
| Trace metal solution (see below) | n/a | n/a | 1 ml |
| Trace Metal Solution: | Top to 1 L with nanopure H2O. Maintain in a glass bottle, stirring and covered with foil. | ||
| CaSO4 x 2H2O | Sigma-Aldrich | 255548 | 200 mg |
| MnSO4 x H2O | Sigma-Aldrich | M7634 | 20 mg |
| CuSO4 x 5H2O | Fisher Scientific | C493 | 20 mg |
| ZnSO4 x 7H2O | Sigma-Aldrich | Z4750 | 20 mg |
| CoSO4 x 7H2O | Sigma-Aldrich | C6768 | 10 mg |
| NaMoO4 x 2H2O | Sigma | S6646 | 10 mg |
| H3BO3 | Fisher Scientific | A74 | 5 mg |
| FeSO4 x 7H2O | Sigma-Aldrich | F7002 | 200 mg |
| CTT Media: | Prepare as needed. Top to 100 ml with nanopure H2O. | ||
| Tris-HCl, 1 M solution (adjust to pH 8.0) | Amresco | 0234 | 1 ml. Prepare a 1 M stock solution in nano pure H2O. Adjust pH to 8.0 and filter sterilize (0.2 μm pore). |
| K2HPO4, 1 M solution (adjust to pH 7.6) | Sigma-Aldrich | P3786 | 0.1 ml. Prepare a 1 M stock solution in nano pure H2O. Adjust pH to 7.6 and filter sterilize (0.2 μm pore). |
| MgSO4 solution | Fisher Scientific | M65 | 0.8 ml. Prepare a 1 M stock solution in nano pure H2O. Filter sterilize (0.2 μm pore). |
| Casitone | BD Diagnostics | 225930 | 1 g |
| Additional Reagents: | |||
| LB Broth, Lennox | BD Diagnostics | 240230 | 2% (wt/vol) |
| D-(+)-Glucose | Sigma-Aldrich | G5767 | 30 mM for overnight broth cultures; 12 mM for swarm media. Prepare a 1.2 M filter sterilized stock solution in nano pure H2O. Add to media after autoclaving. |
| Casamino acids (CAA) | Amresco | J851 | 0.10% (wt/vol). Recommended for P. aeruginosa tendril formation studies. Add to media prior to autoclaving. |
| Agar, Noble | Sigma-Aldrich | A5431 | 0.45% (wt/vol). Preferred Noble agar for P. aeruginosa surface motility studies. Add to media prior to autoclaving. |
| Agar, Noble | Affymetrix | 10907 | 1.50% (wt/vol). Used in M. xanthus surface motility studies. Not recommended for P. aeruginosa motility studies. Add to media prior to autoclaving. |
| Agar, Granulated | Fisher Scientific | BP1423 | 0.60% (wt/vol) |
| Higgins Waterproof Black India Ink | Higgins | HIG44201 | 0.50% (vol/vol). Mix ink with inoculum to test swarm media surface moisture. |
| SYTO® 64 Red Fluorescent Nucleic Acid Stain | Invitrogen | S-11346 | Use 4 μl (for P. aeruginosa) or 8 μl (for M. xanthus) of SYTO® 64 per 100 ml of molten agar (added after autoclaving). |
| Relevant Materials and Equipment | |||
| Petri dish, sterile, 150 mm x 15 mm (Dia. x H) | VWR | 25384-326 | |
| Petri dish, sterile, 100 mm x 15 mm (Dia. x H) | VWR | 25384-342 | |
| Petri dish, sterile, 60 mm x 15 mm (Dia. x H) | VWR | 25384-092 | |
| In-Vivo Xtream | Bruker | Use for the macroscopic imaging of surface motility studies. http://www.bruker.com/products/preclinical-imaging/opticalx-ray-imaging/in-vivo-xtreme/overview.html | |
| Bruker MI software | Bruker | http://www.bruker.com/fileadmin/user_upload/8-PDF-Docs/PreclinicalImaging/Brochures/MI-software-brochure.pdf | |
| ImageJ software | NIH | http://imagej.nih.gov/ij/ | |
| aSee MSDS of reagents for handeling and disposal information. | |||
Referanslar
- Kearns, D. B. A field guide to bacterial swarming motility. Nature Reviews: Microbiology. 8 (9), 634-644 (2010).
- Burall, L. S., et al. et al.Proteus mirabilis. genes that contribute to pathogenesis of urinary tract infection: Identification of 25 signature-tagged mutants attenuated at least 100-fold. Infection and Immunity. 72 (5), 2922-2938 (2004).
- Shrout, J. D., et al. The impact of quorum sensing and swarming motility on Pseudomonas aeruginosa. biofilm formation is nutritionally conditional. Mol Microbiol. 62 (5), 1264-1277 (2006).
- Kamatkar, N. G., Shrout, J. D. Surface hardness impairment of quorum sensing and swarming for Pseudomonas aeruginosa. PLoS One. 6 (6), e20888 (2011).
- Tremblay, J., Déziel, E. Improving the reproducibility of Pseudomonas aeruginosa. swarming motility assays. Journal of Basic Microbiology. 48 (6), 509-515 (2008).
- Caiazza, N. C., Shanks, R. M., O'Toole, G. A. Rhamnolipids modulate swarming motility patterns of Pseudomonas aeruginosa. Journal of Bacteriology. 187 (21), 7351-7361 (2005).
- Du, H., et al. High density waves of the bacterium Pseudomonas aeruginosa. in propagating swarms result in efficient colonization of surfaces. Biophysical Journal. 103 (3), 601-609 (2012).
- Morris, J. D., et al. Imaging and analysis of Pseudomonas aeruginosa. swarming and rhamnolipid production. Appl Environ Microbiol. 77 (23), 8310-8317 (2011).
- Tremblay, J., Richardson, A. P., Lépine, F., Déziel, E. Self-produced extracellular stimuli modulate the Pseudomonas aeruginosa. swarming motility behaviour. Environmental Microbiology. 9 (10), 2622-2630 (2007).
- Partridge, J. D., Harshey, R. M. Swarming: flexible roaming plans. J Bacteriol. 195 (5), 909-918 (2013).
- Patrick, J. E., Kearns, D. B. Laboratory strains of Bacillus subtilis .do not exhibit swarming motility. Journal of Bacteriology. 191 (22), 7129-7133 (2009).
- . . Molecular Imaging. , (2014).
- Harshey, R. M., Matsuyama, T. Dimorphic transition in Escherichia coli. and Salmonella typhimurium.: surface-induced differentiation into hyperflagellate swarmer cells. Proceedings of the National Academy of Sciences, USA. 91 (18), 8631-8635 (1994).
- Rashid, M. H., Kornberg, A. Inorganic polyphosphate is needed for swimming, swarming, and twitching motilities of Pseudomonas aeruginosa. Proc Nat Acad Sci U.S.A.. 97 (9), 4885-4890 (2000).
- Caiazza, N. C., Merritt, J. H., Brothers, K. M., O'Toole, G. A. Inverse regulation of biofilm formation and swarming motility by Pseudomonas aeruginosa. PA14. Journal of Bacteriology. 189 (9), 3603-3612 (2007).
- Kuchma, S. L., et al. Cyclic-di-GMP-mediated repression of swarming motility by Pseudomonas aeruginosa.: the pilY1. gene and its impact on surface-associated behaviors. J Bacteriol. 192 (12), 2950-2964 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır