Method Article
Bir Cam destekli Planar çift katlı lipid Doğal Öldürücü Hücre İmmünoloji Synapse Süper çözünürlüklü Görüntüleme
Bu Makalede
Özet
We describe here a combination of the glass-supported lipid bilayer technique of forming immunological synapses with the super-resolution imaging technique of stimulated emission depletion (STED) microscopy. The goal of this protocol is to provide users with the instructions necessary to successfully carry out these two techniques.
Özet
The glass-supported planar lipid bilayer system has been utilized in a variety of disciplines. One of the most useful applications of this technique has been in the study of immunological synapse formation, due to the ability of the glass-supported planar lipid bilayers to mimic the surface of a target cell while forming a horizontal interface. The recent advances in super-resolution imaging have further allowed scientists to better view the fine details of synapse structure. In this study, one of these advanced techniques, stimulated emission depletion (STED), is utilized to study the structure of natural killer (NK) cell synapses on the supported lipid bilayer. Provided herein is an easy-to-follow protocol detailing: how to prepare raw synthetic phospholipids for use in synthesizing glass-supported bilayers; how to determine how densely protein of a given concentration occupies the bilayer's attachment sites; how to construct a supported lipid bilayer containing antibodies against NK cell activating receptor CD16; and finally, how to image human NK cells on this bilayer using STED super-resolution microscopy, with a focus on distribution of perforin positive lytic granules and filamentous actin at NK synapses. Thus, combining the glass-supported planar lipid bilayer system with STED technique, we demonstrate the feasibility and application of this combined technique, as well as intracellular structures at NK immunological synapse with super-resolution.
Giriş
immünolojik sinaps (IS) hücre aktivasyonu ve fonksiyonu 1 için kritik bir kavşakta yatıyor. Bu yüzden, antijen sunumu ve hücre-aracılı bağışıklık gerçekleştirildiği birincil ortamdır. sinaps oluşumu erken mikroskobik çalışmalar hücre-hücre konjuge sistemi 2 kullanılmaktadır. Bu yaklaşım ile önemli bir sınırlama böylece sinaptik yapının kendisi gözlemcinin bakış kısıtlayan, olduğu gibi konjügatlann çoğu, 'profilde' inceledi olacak olmasıdır. 1999 yılında, Dustin laboratuar önceki McConnel laboratuar 4,5'ten öncülük olmuştu cam destekli çift katlı lipid (SLB) tekniğini 3, kullanılarak bu sınırlama ele. Proteinler bağlı ve iki boyutta serbest bir şekilde hareket edilebilir olan bir cam-destekli düzlemsel lipit yüzey lehine antijen sunan hücreler (APC'ler) olarak yerleştirilmiş bu yaklaşım. Bu yöntemi kullanarak, Dustin ve arkadaşları t doğrudan yukarı eş başardıkO yüksek çözünürlüklü floresan mikroskobu kullanarak, ilk kez IS yapısı bir "yüz-yüze" bir görünüm elde sinaps.
SLB sisteminin kullanımı ile, IS görüntülenebilir hangi ayrıntı yalnızca geçerli görüntüleme tekniklerinin 6-8 sınırlamaları tarafından sınırlandırılmıştır. Standart aydınlatma tekniklerini kullanarak, minimum çözünürlük (yani, onlar ayırt edilebilir, burada iki farklı nesneler arasındaki minimum mesafe) 9 dayanarak 200 nm vardır. Bu sınır sinaps makyaj çok ince, moleküler ölçekli yapıların görüntüleme engel, ve süper-çözünürlük görüntüleme tekniklerinin gelişmesi 10-12 kadar, bu yapıların görselleştirme elektron mikroskobu kullanılarak sabit hücrelerin görüntüleme sınırlıydı.
Böyle SIM gibi süper-çözünürlük teknikleri, çeşitli son çıkışıyla (yapılandırılmış aydınlatma mikroskopisi), PALM (fotoaktive yerelleştirme mikroskopi), STORM (stokastik optik mikroskop rekonstrüksiyon) ve STED'in 10-12, araştırmacılar şimdi sırayla IS giderek açıklık anlaşılmasını sağladı sahip görülmemiş detay, bu sinaptik yapıları incelemek mümkün. STED'in mikroskopi avantajları 13 daha önce tarif edilmiştir. Burada yeni geliştirilen 660 nm tükenmesi lazer ile donatılmış STED'in mikroskobu ile süper çözünürlüklü görüntüleme tarif. Geleneksel 592 nm tükenmesi lazer ile karşılaştırıldığında, 660 nm lazer floresan boyalar (http://nanobiophotonics.mpibpc.mpg.de/old/dyes/ bakınız), özellikle bu kırmızı fluorophores daha geniş bir seçim sağlar.
Diğer yayınlar, antikor kaplı cam lam 13,14 NK hücre sinaps STED'in görüntüleme tarif edilmiştir. Burada, SLB sistemi NK hücre sinaps çalışma süper çözünürlüklü STED'in mikroskobu ile bir araya getirilmektedir. Bu teknik antikor üzerinde bir avantaja sahiptirGömülü yüzey proteinleri düz bir iki-boyutlu bir yüzeye (xy düzlemi) serbestçe hareket edebileceği bir sıvı mozaik olmanın kaplı slaytlar. Bu daha iyi şekilde, bir hedef hücrenin, organik ve mobil yüzey taklit ve sonuç olarak daha iyi bir fizyolojik olarak uygun bir bağışıklık sinaps oluşumunu tartışıldı.
Bu protokolün amacı SLB sistemi ve süper çözünürlüklü mikroskopi STED'in birleştirerek NK hücrelerinin nasıl görüntüye immünolojik sinaps ayrıntılı bilgi ile son kullanıcıya sağlamaktır. Bu gerekli adımlarla son kullanıcıya sağlayacaktır: lipozomlar hazırlamak, protein gömülü bilayers inşa, lipit bilayers protein yoğunluğu belirlemek ve STED'in mikroskopi kullanılarak süper çözünürlüklü görüntüler elde. Bu teknikler, immünoloji alanında sınırlı değildir ve geniş ölçüde çeşitli disiplinler boyunca kullanılabilir.
Protokol
Lipozomların hazırlanması 1.
- 1,2-dioleoil-sn-glisero-3-fosfokolin (DOPC) ve 1,2-dioleoil-sn-glisero-3-fosfoetanolamin-N-kapak biyotinil kloroform süspansiyon stok çözeltileri miktarını hesaplayın (Biotin-PE) istenen son konsantrasyonda seyreltilmiş stok yapmak için. 10 ml her biri 400 uM DOPC ve 80 uM Biyotin-PE fosfolipidler nihai konsantrasyonları sağlamak için, ayrı bir cam kromatografi tüplere 10 mg / ml DOPC 629 ul ve 88 ul 10 mg / ml biyotin-PE yerleştirilmesi ile başlar.
NOT: DOPC ve biotin-PE kloroform-süspansiyon stok solüsyonu aktarma sırasında, çözeltisi (120 ml su ihtiva eden 60 g potasyum hidroksit, KOH 1 L% 95 etanol) temizleyerek cam Hamilton şırınga ve bir cam kromatografi temiz tüplere önemlidir. - Kimyasal kaputu bir argon akıntısı ile kloroform kurutun. Parafilmle kromatografi tüpü kapatılmalıdır.
- Bir lyophiliz yüksek vakuma yeni kurutuldu lipozomlar Konuer O / N herhangi bir kalıntı kloroform kaldırmak için. 60-90 dakika boyunca kuru aynı gün tamamlanması için.
- Liyofilizerde çalışır iken, bazı seyreltme tamponu hazırlamak. Bu protokol için, 25 mM Tris, pH 8.0 oluşan 25 ml hazırlamak; 150 mM NaCI; ve (ağırlık olarak)% 2 n-oktil-β-D-glukopiranosid (KK), deterjan. Sonra kuru OG tozu eklemeden önce argon ile oksijenin yerini, birbirine Önce iki malzemeyi karıştırın. Hazırlandıktan sonra 4 ° C de RG 0.2 mikron selüloz asetat membran ile çözeltisi ve mağaza filtre edin.
- Buna ek olarak, ama RG olmadan aynı konsantrasyonlarda Tris-salin tamponu, 1 L, iki vidalı kapaklı şişe hazırlanır. Her bir alt damıtılmış suyla temizlenen manyetik karıştırma çubuğu yerleştirin. Tris-tuzlu tampon 6 ek litre hazırlayın. Argon ile tüm şişeler oksijen çıkarın ve hem de 4 ° C 'de koyun.
- Liyofilizasyondan sonra, her bir 4 mM çözeltinin yapılması Tris-salin RG tamponu içinde tutularak kurutulmuş lipitlerin çözülür. Örneğin ardındanmiktarlar, Biyotin-PE tüp DOPC tüpüne 2 ml ve 0,2 ml ilave ediniz.
- Birlikte DOPC lipidler ile biyotin-PE lipidleri karıştırın. Birleştiğinde biyotin fosfat baş grupları akışkanlığını bozabilir gibi bu, SLB hareketliliğini artırır. 80 uM Biyotin-PE bir son konsantrasyon sağlamak için, 0.2, 4 mM Biyotin-PE ml ve 4 mM DOPC 1 ml karıştırın. Daha sonra, Tris-salin RG tampon 8.8 ml ilave ediniz.
- 400 uM DOPC bir son konsantrasyon için, sadece Tris-salin RG 9 ml 4 mM DOPC 1ml karıştırın.
- Buzlu su ile sonikatör doldurun. Bir yardımcı kelepçe kullanarak sonikatörde merkezinde seyreltilmiş fosfolipid içeren cam tüp koyun. Çözelti berrak hale gelinceye kadar 10 dakika boyunca seyreltilmiş fosfolipid sonikasyon.
NOT: Sonication ısı üretir çünkü düşük sıcaklık tutmak için sonikatör su banyosu içine buz ekleyin. - Sıvının üzerindeki havanın oksijeni yerinden argon tüpler doldurun ve parafilm ile mühür.
Liposome'lara 2. Diyaliz
- Kuru diyaliz tüpünün iki bölüm kesin (Moleküler ağırlık cut-off: 12-14,000, çap: 6.4 mm) ve uygun uzunlukta (bu örnekte, 40 cm), her bir fosfolipid seyreltme için bir, rulosundan.
- Uygulanan 2 dakika boyunca bir cam kap içinde damıtılmış su, 200 ml ıslatmaya bırakarak boru bölümleri rehidrate.
- Yüksek ayarda 5 dakika bu mikrodalga, ya da en azından su kaynama noktasına gelene kadar.
- Her tüpün bir ucunda bir düğüm ve Tris-salin-OG tampon maddesinin bir kaç mililitre ile iç yıkayın. Bundan sonra, titizlikle içinde kalan tampon miktarını en aza indirmek için mümkün olduğunca bu yıkama tamponu kadar sıkmak.
- Havayı uzaklaştırmak için, bir laminar akış başlığı içinde, küçük bir diyaliz tüpü kapağın açık uçları, her bir tüp içinde seyreltilmiş fosfolipidleri ekleyebilir ve kelepçe. Komple hava dışlama ve altında sıkma numunenin küçük bir hacimde kurban gerektirir# 8220; su hattı ".
- OG olmadan Tris-tuzlu tampon önceden hazırlanmış şişelerde örnekleri daldırın. 4 ° C'de O / N karışmaya yeniden mühürleme ve yerleştirmeden önce argon ile şişe içinde oksijenin yerini.
- En az 3 kez OG olmadan Tris-salin tamponu yeni bir şişe içine, 12 saatte bir boru aktarın.
- Kısa bir süre diyaliz lipitlerin çıkarılmasının önce oksijenin yerini, argon her doldurarak lipidler kana içine küçük bir dizi tüpten hazırlar.
- 36 saat sonra, laminer akış kaputun içine diyaliz şişe almak ve şişelerden diyaliz tüpleri çıkarın. Islak ikinci tur toplamak için yandan bir tezgah bebek bezi veya beher var.
- Sonra klibini kaldırmak ve dikkatle buz üzerinde argon gazı ile doldurulmuş önceden hazırlanmış tüpler 1 ml kısma pipet aracılığıyla diyaliz lipit çözümü aktarmak, klibi üzerinde diyaliz tüp kesin.
- Sulu lipozom çözümü bölmeyin, i oksijen tekrar yerinden argon akışı kullanınn, her bir tüp.
- 4 ° lipozomlar saklayın. Donma yok.
Çift katlı lipid üzerindeki Antikor Yoğunluk 3. Belirlenmesi
- Aşağıdaki konsantrasyonlarda, biyotinile edilmiş, floresan etiketli antikorun bir seyreltme serisi, her bir seyreltme için hacim olarak 50 ul hazırlayın: (boş) 0 nM, 10 nM, 50 nM, 100 nM ve 500 nM. (Ahirette olarak "örnek serisi" olarak anılacaktır).
- 96 oyuklu V-tabanlı plakanın 6 kuyu içine silis boncuklar 1 ul ekle. Onlar çökmemesi için iyi pipetleme önce boncuk sallamak emin olun.
NOT: askıya yerine kuru boncuk sipariş sahip olursa, sulandırmak için üreticinin talimatlarını izleyin. - 1: 1 oranında bir Biyotinil fosfolipid: bu boncuklar için, 2 karma DOPC ul ekle. Her kuyu için bunu yapın.
- Boncuk ve fosfolipidler ile etkileşimi teşvik etmek 10 saniye, her orta güçte 3 kez vortexer üzerinde plaka Darbe.
- 5% cas 150 ul ekleyinHer bir oyuğa ein. Yukarı pipetleme ve üç kez aşağı iyice karıştırın.
- Plaka daha sonra 10 dakika boyunca kazein çözeltisi içinde inkübe yıkayın olsun. Yıkama, HEPES, 250 ul toplam hacmine her bir dolgu,% 1 insan serum albümini (HSA) ile tuzlu su (HBA) tamponlu. 2 dakika için 1000 xg'de santrifüj. Dışarı Pipet ve süpernatant iyi 200 ul atmak ve üç yıkama döngüsü toplam iki kez tekrarlayın.
- 333 ng / ml konsantrasyonda streptavidin 50 ul ekle. Tekrar 10 sn 3x plaka basınç ve 15 dakika boyunca bir karıştırıcıda bekletin. Yıkama 3x 6. adımda olduğu gibi bağlanmamış streptavidini kaldırmak için.
- Daha önce hazırlanan seyreltme serilerinden floresan etiketli biyotinile antikor, 50 ul ekle her oyuğa (adım 3.1), 20-30 dakika boyunca bir karıştırıcı üzerinde plaka değiştirin. Yıkama 3x aşama 6'da olduğu gibi bağlanmamış antikorların çıkarılması için.
- Son yıkamadan sonra, daha sonra bir FACS tüpü transfer HBS /% 1 HSA 100 ul boncuk yeniden süspanse edin. Iki kez bu işlemi tekrarlayın300 ul bir toplam kuyudan tüm tanelerin etkin şekilde çıkarılmasını sağlamak ve her bir oyuk için bunu.
- Akış sitometresinde elde edilen tüpler getirin. Onları okumak için zamanı.
- Florasan yoğunluğu kalibrasyon (FIC) kordon kiti "B" işaretli şişe 1 damla bir FACS tüpü için (bundan sonra "standart dizi" olarak anılacaktır) ve HBS /% 1 HSA 300 ul ile seyreltin.
- Bu tüp oku, ama henüz veri kaydı yok. Şimdilik, sadece boş boncuklar düzgün sıfırlanır emin olun. Zirve histogram kadar sol tarafında kadar uygun kanalda ölçülen boncuk floresan gösteren bir histogram yapın, sonra aşağı uyarma lazer gerilimi kayması.
- Tüp çıkarın ve aynı tüpe (4 üzerinden 1 etiketli) dizinin diğer 4 tüplerin her biri 1 damla ekleyin. Şimdi, tekrar makineye tüp yerleştirmek, ve 5 ayrı zirveleri olarak görünmelidir elde edilen verileri, kayıt.
- Örnek serisi her tüp okuyun.
- FACS analizi yazılımı kullanarak, yarı-maksimal noktada standart seri Histogramda her tepe tüm genişliğini kapsayan bir kapı çizin. Yani, her bir zirve için, bir kapı. Her numune için de yapın. MFI, her kapı için (ortalama floresan yoğunluğu) Not.
- Uygun bir yerde bir elektronik tablo programı girişi ölçülen MFI değerleri kullanarak. Ayrıca giriş MESF değerleri (Eşdeğer Çözünür Florokrom Moleküllerin) standart seride her şişe için (her bir boncuk kaplama floresan moleküller ortalama sayısı). Bu bilgiler plastik tüpler tarifi geldi kavanoz takip ederek ulaşabilirsiniz.
- Fluorophores sayısı ve ölçülen yoğunluğu arasında doğrusal bir ilişki oluştururken, MESF değerlerine karşı MFI arsa olacaktır e-tabloyu kullanın.
- Pro boyanın oranını belirlemek için mikro hacim spektrofotometrede ', proteinlerin ve etiket' modülünü kullanaraketiketli antikor proteindir.
- Giriş örnek protein etiketleme verimliliği, lipidler ile kaplı tanelerin ortalama çapı, ve her bir giriş için MFI değeri. Elektronik tablo otomatik olarak her bir protein seyreltme ve her konsantrasyonda örnek protein tohumlama yoğunluğu için MESF değerlerini hesaplamak için adım 3.16 oluşturulan çizgi grafikten formülü kullanacağız.
4. Yalıtımlı ve Kültürleme İnsan NK Hücreleri
- Kısım 15 ml 50 ml konik tüp içine periferik kan veya ince beyaz tabaka. PBS 1 oranında% 1 FBS içeren bu kan seyreltilir: 1 arasındadır.
- Yavaşça, 10 ml serolojik pipet ile tüpün dibine Ficoll 13 ml ilave edilir.
- Santrifüj 20 hızlandırıcı ile 1.200 xg'de dakika ve mola için kapalı veya düşük ayarlarda bu tüp.
- Santrifüj işleminden sonra, ağ, (PBMC'ler), periferal kan tek-çekirdekli hücrelerinin yüzen bulanık beyaz orta tabaka toplamak için serolojik bir pipet kullanınarada tutarak oturmak ve berrak sarı renkli bir üst tabaka ve kırmızı kan hücrelerinin (RBC) 'in bir alt katman üzerinde oturmak, her ikisi de, daha dumanlı ve uçuk renkli alt tabakası arasındaki kesişme gerekir. NOT PBMC'leri toplama herhangi eritrositlerde toplamak etmeyin.
- Yeni 50 ml konik tüp toplanan PBMC'leri yerleştirin ve PBS% 1 FBS içeren kapasitesine seyreltin. Tekrar santrifüj, 300 x g, 5 dakika boyunca en fazla üzerinde fren ile gaz pedalı, bu kez.
- Süpernatant atılır ve% 1 FBS içeren 10 ml PBS içinde tekrar süspansiyon hücreleri.
- Adım 4.6 olarak bir kez daha aynı ayarlarda santrifüj sırasında hücreleri saymak.
- Bir kez daha Süpernatant atılır ve 10000000 hücre / ml bir yoğunlukta R10 ortam içinde tekrar süspansiyon hücreleri.
- Üreticinin talimatları izleyerek, 5 ml polistiren tüp içinde 30 milyon hücre alın ve bir manyetik ayırma kiti kullanılarak NK hücreleri izole. İzolasyondan sonra, 500,0 bir yoğunlukta hücreler bir kez daha tekrar süspansiyon ve sayısıR10, tam bir ortamda 00 hücre / ml (% 88 RPMI,% 10 FBS,% 1 HEPES,% 1 sodyum piruvat), IL-2 (100 U / ml) ile takviye edilmiştir. CO 2 inkübatör 37 ° ve kültür 2-3 kez haftalık orta yerine.
5. Cam destekli Planar çift katlı lipid Montaj
- Bir çanak içinde 3: 1 oranında sülfürik asit ile% 30'luk hidrojen peroksit karıştırılarak 100 mi pirana çözelti hazırlayın.
NOT: Her zaman doğru belirlenmiş kimyasal davlumbaz sülfürik asit gibi zararlı maddeler ile çalışmalarını yürütmek. - Bu çözelti içine, 20-30 dakika boyunca pirana çözeltisi içinde 2 dikdörtgen # 1.5 lamelleri bırakın.
NOT: Bu piranha çözeltisi ile lamelleri temizlemek için gereklidir. - Lamelleri temizlenir edilirken, daha önce 400 mcM DOPC lipidler ve daha önce 80 mcM Biotin-PE lipidler hazırlanan 1 tüp hazırlanmış, 1 tüp almak. Argon tankına buz üzerinde taşırlar.
- Argon ile yeni bir mikrosantrifüj tüpü içinde oksijenin yerini,: 1 oranında daha sonra 1 de DOPC ve biotin-PE birbirine eklenir. Belirli hacmi deneysel ihtiyaçlarına göre değişir, ancak en az 2 ul her biri olmalıdır. Buzdolabı ikinci dönmeden önce, hem de bir kez daha argon gazı ve bireysel reaktif tüpleri ile karışım tüpü içinde oksijenin yerini.
- Onlar temizlik bittikten sonra, distile su ile iyice durulayın lamelleri. Bir kaç dakika için havayla kurumaya üzerinden lamelleri ayarlayın.
- Adım 5.4 hazırlanan lipozom karışımı 1.5 ul çekiniz ve oda slayt şeritli odalarından birine tek bir damla onu bölmeyin. Her şerit başına 2 damla kullanımı tipik, ancak gerekli değildir.
- Hızlı ve verimli bir şekilde damlacıklar üzerinde kuru lamel yerleştirin. Lamel yerleştirilir kez onlar birleştirme kalmamak damla yeteri kadar aralıklı emin olun. Ayrıca, damla odası duvarlarının kenarları dokunmadan, yuvarlak ve iyi tanımlanmış kalmasını emin olun. Sıkıca bastırınarasında her kulvarın etrafında lamel ve slayt arasındaki su geçirmez bir mühür sağlamak.
- Bir işaretleyici kalem kullanarak damla konumlarını işaretleyin
- Iki tabakalı engellemek için, odacık içinde, sulu% 5 kazein 100 ul geçirin. Akış odasında hiçbir kabarcıklar olmadığından emin olmak için deneyin.
- Her bir şerit halinde 333 ng / ml'lik bir konsantrasyonda streptavidin 100 ul enjekte edilir. Oda sıcaklığında 10-15 dakika kuluçkalayın. Bundan sonra, aşırı streptavidin kaldırmak için her kulvarın içinden HBS / 1% HSA 3 ml çalıştırarak yıkayın.
- , Daha önce 20-30 dakika süreyle karanlıkta inkübe bölüm 3'te en etkili olduğu tespit protein konsantrasyonunda Alexa Fluor 568 olarak biyotinile edilmiş floresan etiketli anti-CD16 100 ul ekle. Her kulvar üzerinden HBS / 1% HSA 3 ml çalıştırarak tekrar yıkayın.
- St spesifik olmayan bağlanma şansı fazlalık streptavidini bağlamak ve böylece ortadan kaldırmak için, odacık içinde bir konsantrasyonu, 25 nM D-biyotin 100 ul akışhücrelere reptavidin.
- HBS /% 1 HSA 500000 / ml'lik bir konsantrasyonda, NK hücreleri ve tekrar süspansiyon sayısı.
- Hücrelerin aşağı iplik birlikte, şerit başına HBS /% 1 HSA bir 3 ml bölmenin üzerinden D-biotin yıkayın.
- Önce NK hücrelerini ekleyerek bir toplam iç yansıma floresan (TIRF) veya konfokal mikroskobu üzerinde (sıkı bağlamak) photobleaching sonra floresan kurtarma ile SLB üzerinde ligandların hareketliliğini kontrol edin.
- Hücreler iplik bitirdim ve istenilen konsantrasyonda yeniden süspanse edildikten sonra, her kulvarın 100 ul ekleyin.
- 30-60 dakika boyunca 37 °,% 5 CO2 kuluçka makinesinde bölme yerleştirin.
- Bu inkübasyon süresinden sonra, 10-20 dakika boyunca oda sıcaklığında% 4 paraformaldehit ile hücrelerin tespit. Paraformaldehid kaldırmak için her sokağın içinden PBS 3 ml çalıştırarak yıkayın.
- Tamponu (% 5 normal eşek serumu ve% 0.2 PBS Tritron X-100) bloke 400 ul ekle. 30 dakika boyunca oda sıcaklığında inkübe edin.
- Leke F-aktin ve reklama göre perforinDing seyreltildi floresan işaretlenmiş falloidinle 200 ul (1 adet / ml işaretlenmiş falloidinle) ve floresan-etiketli anti-perforin mAb (500 ng / ml anti-perforin mAb). 1 saat süre ile oda sıcaklığında inkübe edin.
- PBS 3 ml çalıştırarak yıkayın. kamara görüntüleme için hazırdır.
STED'i kullanarak lipid iki-tabakalı NK Synapse 6. Görüntüleme
- Gerekli tüm donanım modüllerinde açın.
- Görüntü analiz yazılımı başlatın. Rezonans tarama ve STED'in modülleri hem etkinleştirin. Bu seçimleri yaptıktan sonra, yazılım başlatmak için yaklaşık 3-5 dakika bekleyin.
- Ekranın üst kısmındaki "Yapılandırma" sekmesine tıklayın.
- Seç "Lazer Yapılandırma" sonra beyaz ışık ve STED'in 592 nm lazerler açın.
- 100x hedefi seçin ve 592 nm tükenmesi lazer ile uyarma lazer ışını hizalamak.
- "Lazer Yapılandırma" modülünü seçin 592 tükenmesi kapatmakLazer ve 660 nm tükenmesi lazer dönüş.
- Lens üzerinde, sahnede üzerine slayt yerleştirin. Beyaz ışık lamba ve Okülerin kullanarak odağa demarcated iki katmanlı bölgeye bağlı hücreleri getir.
- Doğrudan "Yapılandırma" sekmesinin sağında, "Toplama" sekmesine dönün.
- "Anahtarı Whitelight için" sekmesine tıklayın, ardından bu modülü açmak ve uygun dalga boyu uyarma lazer çizgisini sürükleyin.
- Sonra dalga boylarında uygun kapsayacak şekilde algılama aralığı ayarlamak, mevcut olanların listesinden istediğiniz dedektör seçin.
NOT: Uyarma kirişin altında doğrudan algılama aralığı koymak ASLA. - Sol araç çubuğunun alt Sıralı Tarama diyalog getirmek için sol-el "Seqential" renkli "Edinme" araç çubuğunu tıklatın. Bu, kullanıcının birden dizileri eklemek için her veriyorFarklı renk için ayrı bir uyarım ışığı ile. "Çerçeveleri Arasında" tıklatın ve sonra adım 6.9 ve 6.10 gibi her ek renk için uyarma frekansı, dedektör ve algılama aralığı ayarlayın.
- Tüm ayarlar optimize sonra, satın alma işlemini başlatmak için "Başlat" çarptı.
- Daha önce açıklandığı gibi 13, STED deconvolution için tasarlanmış bir ayarı kullanarak ücretsiz Dekonvolüsyonun yazılımı (Huygens) uygulayın.
Sonuçlar
Şekil 1, bir lipid iki katmanının üzerinde antikor yoğunluğu sonucunu göstermektedir. ilke akış sitometrisi (A) üzerinden MFI karşı MESF standart eğri için standart boncuk kullanmaktır. Örnek serisi MFI standart eğri kullanılarak MESF dönüştürülmüştür. çift katlı lipid üzerinde antikor yoğunluğu doğrusal antikor konsantrasyonu (B) ile ilişkilidir. cam destek düzlemsel çift katlı lipid NK sinaps 2 gösteri üçlü renkli STED'in görüntü Şekil. Çift katlı lipid Anti-CD16 antikoru F-aktin oluşumunu ve kutuplaşmayı ve NK hücreleri immünolojik sinapsların odak panelinde F-aktin ağ üzerinden perforin penetrasyonunu tetikleyen, birikir. Bu kombine yaklaşım kullanarak, bir temiz doğrudan NK hücre üzerindeki CD16 kümelendirilmesini aynalar SLB içinde, anti-CD16 floresan etiketli microclusters gözlemleyebilirsiniz. Geleneksel konfokal görüntü, CD16 merkezindeki yapısı ile karşılaştırıldığındal küme daha kolay nedeniyle tükenmiş ortam floresan STED'in görüntüde ayırt edilir. Ayrıca, aktin hücre iskeletinin ultrastrüktür önemli ölçüde geliştirilmiş çözünürlük ile görülür. Önceki gözlemlerle 16,17 ile uyumlu olarak, perforin pozitif litik granüller STED'in imajı, çoğunlukla konfokal görüntüde kayıp önemli bir ayrıntı olarak düşük F-aktin yoğunluk bölgeleri üzerinde konumlandırılmış görülür.
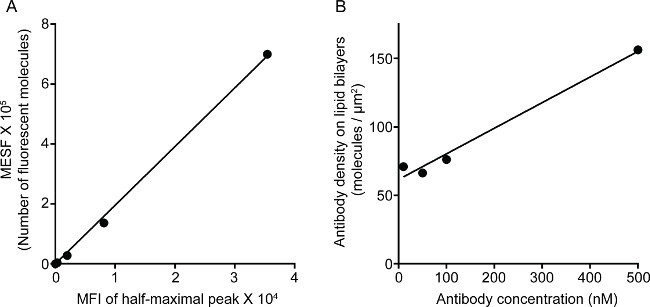
Çift katlı lipid üzerindeki 3G8 antikor Şekil 1. Yoğunluk. (A) standart serisi için MESF ve MFI arasında doğrusal korelasyon. (B) Protein yoğunluğu ve örnek protein seyreltme serileri için konsantrasyonu arasında doğrusal korelasyon, başına floresan-etiketli protein monomerlerin sayısını gösteren Lipid kaplı si artan konsantrasyonunun bir fonksiyonu olarak birim alanLica boncuk.
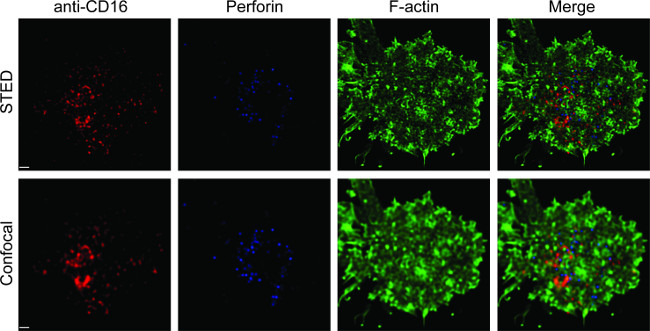
Düzlemsel bir lipid iki katmanının NK sinapsların Şekil 2. STED'in görüntüleme. Birincil NK hücreleri, SLB içeren biyotinile edilmiş floresan etiketli anti-CD16 (kırmızı) ile uyarılmış sabitlendi, geçirgenleştirildi ve sonra falloidinle (mavi) ve anti-F-aktine ile boyandı (yeşil). Tek bir hücre ilk normal konfokal ayarı altında görüntülü ve ardından STED'in ayarı yapıldı. Konfokal ve STED'in görüntüleri Huygens yazılımı kullanılarak deconvoluted edildi. Ölçek çubuğu, 1 mikron. Bu rakamın daha büyük bir versiyonu için burayı tıklayınız.
Tartışmalar
Bu çalışmanın yenilik NK hücre sinaps çalışma STED'in ile SLB tekniği birleştiren olmasıdır. Önceki çalışmalar plazma zarı 6 T hücre sinaps oluşumu 8 ve sinyalizasyon molekül kaçakçılığı çalışma TIRF ile iki tabakalı lipid görüntülü var. Diğer antikor kaplı cam slaytlar 13,14 kullanılarak NK hücre sinaps STED'in görüntüleme tarif edilmiştir. Burada daha fazla tarif hibrit yöntemi çift katlı lipid yüzeyinde süper çözünürlüklü görüntüleme sağladığı gelişmiş netlik ile NK hücre sinaps görüntüleme ile bu çabaların üzerine inşa olan bir APC daha iyi modelleri dinamik bir yüzey.
SLBS gerçek hedef hücreleri veya APC'lerdir sahip olduğu hücre iskeletinin, lipid sallar eksik yapay membranlar ve diğer ligandlar olmasına rağmen, bu tekniğin hareketlilik ve ligandların yönelim gibi önemli özellikleri özetlemek olabilir. Bu SLB sistemi diseksiyon t indirgemeci bir yaklaşım olarak hizmet veriyorIS oluşumu ve IS dinamiklerine bireysel reseptörleri ve ligandların o katkısı. SLBS en önemli özelliği araştırmacılar, konfokal ve TIRF mikroskopi gibi yüksek çözünürlüklü görüntüleme yaklaşımları, bu tekniği birleştirebilirsiniz olmasıdır. STED mikroskopi giriş bile daha fazla araştırma ve klinik uygulamaları IS içine görülmemiş anlayışlar sağlayarak, bu avantajı artırır.
Bu sistemin bir potansiyel eleştiri SLB yeterince bu şekilde elde edilen sinaps potansiyel olarak fizyolojik olmayan anatomik özelliklere yol açan, bir APC kompleks yüzeyi taklit olmasıdır. O SLB yüzey moleküllerinin sınırlı repertuarı tam bir APC heterojen nüfuslu yüzeyini özetlemek olmadığı doğru olsa da sinaps oluşumu bireysel reseptör ve ligand etkileşimleri etkisini belirlemek için müfettişler izin verir ki, bu sınır da avantajlı olabilir .
TBurada sürecinde birçok önemli adımlardır. En kritik arasında lipozomlar bu oksidasyon gibi adımlar 1.10, 2.6, 2.11 ve gibi sürekli tüp ve çözüm, oksijeni yerinden argon kullanarak üzerinden önlenebilir olduğunu. Lipidlerin oksitlenmesi, böylece serbestçe hareket ve sinaptik yapılanma katılma yüzey proteinleri engellemeden, azalmış lipit hareket neden olur. Aynı şekilde, bu liyofılizasyondan (adım 1.2) tarafından lipozom tüm kloroform kaldırmak için de önemlidir. Lipit protein yoğunluğunun belirlenmesi, ilk olarak, kümeler arınmış homojen bir süspansiyon haline silikon boncuk dağıtmak için önem taşımaktadır. Gerekirse, tanelerin sonikasyon uygulanabilir. Lamelleri temizlenir burada SLB monte edilirken, ilk adım (5,1-5,8) damla yerleştirilir ve kapak hayati önem yapıştırılmıştır. Bunlardan herhangi bir hata (bölüm 5 yılı başından itibaren) üzerinde deney başlamadan gerektirebilir. Bu nedenle, bununBir aksilik durumunda zaman kazanmak için gerekli olacak daha iyi bir uygulama daha lamelleri temizlemek için.
Bu sistem ile çalışırken olmayan kümeleme en sık konudur. Son adımda hücreleri görselleştirme zaman, biri herhangi bir floresan sinaps bulmak için başarısız olursa, alınabilir bir kaç adım vardır. Hücreler, sinaptik-katılan yüzey proteinleri gerekir, cam lamel veya iki tabakalı bir yüzeyine spesifik olmayan yapışma çıkarabilirler aynı kökenli hücre yüzeyi reseptörü için bir diğer boyama, hücre çift tabakalarına sahip bir sinaps meydana olmadığını doğrulamak için bölmeye eklenebilir tutturulmamış yüzey proteinleri pilin etrafında olarak yaygın boyama görünmelidir ise, hücreye iki katmanlı arayüzü düzleminde gibi farklı kümeleri görünür. Bu yöntem başarısız Should, belirli bir işaretleyici bir hücre yüzeyinde yeterli bolluk ifade edilir çalışma umuduyla emin olmak için flow sitometri aracılığıyla hücrelerini kontrol etmelisiniz. Bazı yüzey protein vivo kültür içinde uzun vadede aşağı regüle olduğu bilinmektedir.
Bu protokol bilgilerini özellikle nasıl NK hücre sinaps oluşumunu görselleştirmek için birlikte, SLB sistem yalnızca adım 5.11 birincil ligandın ikamesi ile akla gelebilecek herhangi bir immünosit sinaps oluşumunu çalışmak için de kullanılabilir. Çoklu ligand aynı anda ilave edilebilir. Bir de çift-katlı olan yüzey proteinlerini yapıştırılması için bir streptavidin-biyotin sistemi kullanmak gerekli değildir. Nikel-NTA: histidin etkileşimler de yaşayabilir. Ancak, streptavidinin yüksek mukavemet ve özgüllüğü: biotin etkileşim, bizim laboratuar bu sistemi tercih ediyor. Bir de adım 5.13 reçete edilen yoğunluktan çift-katlı eklenen hücre konsantrasyonu, aynı zamanda olgunlaşmasının farklı aşamalarında sinaps gözlemlemek için daha sonraki kuluçka periyodunun süresi değişebilir. Elbette bu hücre içi str görselleştirme olasılığını dışlar ancak bu bile, canlı yapılabiliructures (onlar zaten sigortalı floresan etiketi ile etiketlenmiş sürece, bizim laboratuar birkaç tür değişmiş hücre hatları kullanır). Bu nedenle protokolde olası özelleştirme yüksek derecede, tek bir temel lipit dinamikleri 15, sinaps oluşumu da dahil olmak üzere, immünoloji, hücre biyolojisi ve biyokimya soruları inanılmaz yelpazede ele almak, STED'in görüntüleme ile birlikte, temel SLB tekniği kullanabilirsiniz 16, hücre 17 sinyal ve tümör hücre metastazı 18.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
We thank Emily Mace and Malini Mukherjee for imaging and deconvolution analysis. Work in the Liu laboratory was supported in part by the Baylor-UTHouston Center for AIDS Research Core Support Grant number AI36211 from the National Institute of Allergy and Infectious Diseases, the Caroline Wiess Law Fund for Research in Molecular Medicine, Texas Children’s Hospital Pediatric Pilot Research Fund, and the Lymphoma SPORE Developmental Research Program from Baylor College of Medicine and the Methodist Research Institute.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 18:1 (Δ9-Cis) PC (DOPC) 1,2-dioleoyl-sn-glycero-3-phosphocholine | Avanti | 850375C | Liposome preparation |
| 18:1 Biotinyl Cap PE 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(cap biotinyl) (sodium salt) | Avanti | 870273C | Liposome preparation |
| Argon gas, compressed | Airgas | UN1006 | Liposome preparation |
| A lyophilizer | Labconco | Freezone 7740020 | Liposome preparation |
| Lyophilizer tubes | Labconco | 7540200 | Liposome preparation |
| Chromatography Columns | Santa Cruz | sc-205558 | Liposome preparation |
| 1 M Tris pH 8.0 | Ambion | AM9856 | Liposome preparation |
| 5 M NaCl | Ambion | AM9759 | Liposome preparation |
| Octyl-β-D-glucopyranoside | Sigma-Aldrich | O1008 | Liposome preparation |
| Dialysis tubing | Spectrum Labs | 132676 | Liposome preparation |
| 96-well V-bottom polystyrene plate (untreated) | Corning | 3896 | antibody density determination |
| Non-functionalized silica beads | Bangs Laboratories | SS06N | antibody density determination |
| FACS tubes | Fisher Scientific | 14-959-2A | antibody density determination |
| QuantumTM MESF beads | Bangs Laboratories | Variable | antibody density determination |
| Casein | Sigma-Aldrich | C0875 | Lipid bilayer preparation |
| HEPES buffered saline + 1% HSA | Homemade | Lipid bilayer preparation | |
| Streptavidin | Life technologies | 434301 | Lipid bilayer preparation |
| Fluorescently-labeled biotinylated protein | Homemade | Lipid bilayer preparation | |
| ibidi Sticky-Slide VI 0.4 | ibidi | 80608 | Lipid bilayer preparation |
| 25x75 mm glass coverslip | ibidi | 10812 | Lipid bilayer preparation |
| Hydrogen peroxide (30%) | Fisher Scientic | BP2633 | Lipid bilayer preparation |
| Sulfuric acid | Sigma-Aldrich | 258105 | Lipid bilayer preparation |
| D-Biotin | Invitrogen | B20656 | Lipid bilayer preparation |
| Lens paper | VWR | 54826-001 | For imaging |
| Type F Immersion Oil | Leica | 11 513 859 | For imaging |
| A Leica TCS STED microscope | Leica | For imaging |
Referanslar
- Dustin, M. L., Long, E. O. Cytotoxic immunological synapses. Immunol. Rev. 235 (1), 24-34 (2010).
- Monks, C. R., Freiberg, B. A. K. u. p. f. e. r. H., Sciaky, N., Kupfer, A. Three-dimensional segregation of supramolecular activation clusters in T cells. Nature. 395 (6697), 82-86 (1998).
- Grakoui, A., et al. The immunological synapse: a molecular machine controlling T cell activation. Science. 285 (5425), 221-227 (1999).
- Hafeman, D. G., von Tscharner, V., McConnell, H. M. Specific antibody-dependent interactions between macrophages and lipid haptens in planar lipid monolayers. Proc Natl Acad Sci USA. 78 (7), 4552-4556 (1981).
- Tscharner, V., McConnell, H. M. Physical properties of lipid monolayers on alkylated planar glass surfaces. Biophys J. 36 (2), 421-427 (1981).
- Crites, T. J., Chen, L., Varma, R. A TIRF microscopy technique for real-time, simultaneous imaging of the TCR and its associated signaling proteins. J. Vis. Exp. , (2012).
- Prins, K. C., Vasiliver-Shamis, G., Cammer, M., Depoil, D., Dustin, M. L., Hioe, C. E. Imaging of HIV-1 envelope-induced virological synapse and signaling on synthetic lipid bilayers. J. Vis. Exp. , (2012).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. J. Vis. Exp. , (2008).
- Michalet, X., Weiss, S. Using photon statistics to boost microscopy resolution. Proc. Natl. Acad. Sci. U. S. A. 103 (13), 4797-4798 (2006).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annu. Rev. Biochem. 78, 993-1016 (2009).
- Lippincott-Schwartz, J., Manley, S. Putting super-resolution fluorescence microscopy to work. Nat. Methods. 6 (1), 21-23 (2009).
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Mace, E. M., Orange, J. S. Visualization of the immunological synapse by dual color time-gated stimulated emission depletion (STED) nanoscopy. J. Vis. Exp. , (2014).
- Rak, G. D., Mace, E. M., Banerjee, P. P., Svitkina, T., Orange, J. S. Natural killer cell lytic granule secretion occurs through a pervasive actin network at the immune synapse. PLoS Biol. 9 (9), e1001151 (2011).
- Leutenegger, M., Ringemann, C., Lasser, T., Hell, S. W., Eggeling, C. Fluorescence correlation spectroscopy with a total internal reflection fluorescence STED microscope (TIRF-STED-FCS). Opt Express. 20 (5), 5243-5263 (2012).
- Liu, D., Bryceson, Y. T., Meckel, T., Vasiliver-Shamis, G., Dustin, M. L., Long, E. O. Integrin-dependent organization and bidirectional vesicular traffic at cytotoxic immune synapses. Immunity. 31 (1), 99-109 (2009).
- Liu, D., Peterson, M. E., Long, E. O. The adaptor protein Crk controls activation and inhibition of natural killer cells. Immunity. 36 (4), 600-611 (2012).
- Wu, J. C., et al. Antibody conjugated supported lipid bilayer for capturing and purification of viable tumor cells in blood for subsequent cell culture. Biomaterials. 34 (21), 5191-5199 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır