Method Article
In Vitro ve İn Vivo Modeli Gemi Duvar Altında Akış Koşulları Bakteriyel Yapışma Eğitim için
Bu Makalede
Özet
To study the interaction of bacteria with the blood vessels under shear stress, a flow chamber and an in vivo mesenteric intravital microscopy model are described that allow to dissect the bacterial and host factors contributing to vascular adhesion.
Özet
Endovasküler enfeksiyonları ve infektif endokardit neden olmak için, bakteriler, kan akışı kesme stresine maruz kalma sırasında damar duvarına yapışma mümkün olması gerekmektedir.
Mikroorganizmaların damar yapışmasına katkıda bakteriyel ve konakçı faktörleri belirlemek için, fizyolojik kayma koşulları altında bu etkileşimleri çalışmak uygun modeller ihtiyaç vardır. Burada, biz ekstraselüler matriksin farklı bileşenleri bakteriyel yapışma araştırmak ya da endotel hücrelerine sağlayan bir in vitro akış odası modeli tarif ve geliştirilmiş bir intravital mikroskopi modeli doğrudan in vivo splanknik dolaşıma bakterilerin ilk yapışma görselleştirmek için . Bu yöntemler akışı altında bakteri yapışma için gerekli bakteriyel ve ana faktörleri tanımlamak için kullanılabilir. Biz kayma gerilmesi alaka ve staphy yapışması için von Willebrand faktör rolünü göstermektedirlococcus aureus, hem in vitro hem de in vivo modelinde kullanılmıştır.
Giriş
To establish endovascular infections, pathogens require a mechanism to adhere to the endothelium, which lines the vessel wall and the inner surface of the heart, and to persist and establish an infection despite being exposed to the shear stress of rapidly flowing blood. The most frequent pathogen causing life-threatening endovascular infections and infective endocarditis is Staphylococcus aureus (S. aureus)1.
Various bacterial surface-bound adhesive molecules mediate adhesion to host tissue by interacting with extracellular matrix components. These MSCRAMMs (microbial surface components recognizing adhesive matrix molecules) recognize molecules such as fibronectin, fibrinogen, collagen and von Willebrand factor (VWF). MSCRAMMs are important virulence factors of S. aureus and are implicated in the colonization and invasion of the host2. Most studies on these virulence factors have been performed in static conditions, and thus may not be representative for human infections where initial adhesion of the bacteria occurs in flowing blood.
In the case of bloodstream infections, bacteria need to overcome the shearing forces of flowing blood in order to attach to the vessel wall. Models that investigate the interaction between bacteria and endothelium or subendothelium under flow conditions are therefore of particular interest.
A recent study showed that the adhesion of S. aureus to blood vessels under shear stress is mediated by VWF3. VWF, a shear stress-operational protein, is released from endothelial cells upon activation. Circulating VWF binds to collagen fibers of the exposed subendothelial matrix. Our group reported that the von Willebrand factor-binding protein (vWbp) of S. aureus is crucial for shear-mediated adhesion to VWF4.
In this article, we present an in vitro flow chamber model where bacterial adhesion to different components of the extracellular matrix or to endothelial cells can be evaluated. To validate the findings from in vitro data, we have developed an in vivo model that visualizes and quantifies the direct interaction of bacteria with the vessel wall and the formation of bacteria-platelet thrombi in the mesenteric circulation of mice, using real-time intravital vascular microscopy.
Protokol
Hayvan deneyleri KU Leuven Etik Komitesi tarafından kabul edildi.
İn Vitro perfüzyon ve in vivo deneylerde hazırlanması 1. Bakterilerin
- Biz S. kullanılan aureus Bu yazıda anlatılan tüm deneyler için suşu Newman. S. aureus Newman -80 ° C'de,% 10 gliserol ile Beyin Kalp İnfüzyon (BHI) 'de depolanmıştır.
- 37 ° C (OD> 3 600) havaalanındaki / N dondurulmuş bakteri kazıyın ve 5 ml Triptik Soy Broth (TSB) Ç aşılamak için steril bir döngü kullanın.
- Santrifüj (2,600 g, RT, 5 dakika) bakterilerin yıkanır ve 5 ml PBS (fosfat tamponlu tuzlu su) bakteriyel pelletini.
- Etanol, 5 (6) -karboksi-floresin N-hidroksisüksinimidil ester (karboksi-floresin) bir 1 mg / ml çözelti hazırlayın. Laboratuvar sınıfı su içinde, 150 ug / ml, 1 mg / ml karboksi-floresin çözeltisi (örneğin, MilliQ su) ile seyreltilir. Işık tüpleri korumak-20 ° C de, alüminyum folyo ve mağaza ile.
- (2.600 xg, RT, 5 dk) bakterileri santrifüj. 800 ul PBS içinde bakteriyel pelet yeniden süspanse edin ve 200 ul veya 150 ug / ml karboksi-floresin çözeltisi 400 ul (nihai konsantrasyon in vivo deneyler için 50 ug / ml) (perfüzyon deneyleri için 30 ug / ml nihai konsantrasyon) ilave edin. Alüminyum folyo ile ışıktan tüpleri korumak ve bir çalkalayıcı üzerinde oda sıcaklığında 30 dakika inkübe edilir.
- Etiketlemeden sonra, PBS içinde% 6 sığır serum albümini (BSA) çözeltisi ile bir blok.
- Optik dansitometrisi kullanılarak bakteri (OD), bir OD in vitro deneyler için 0.65, 600 seyreltin (ve bir OD in vivo deneyler için 1.8, 600 (yaklaşık 3 x 10 8 koloni oluşturan birim (CFU) S. aureus / ml'ye karşılık gelir) PBS içinde S. aureus için yaklaşık olarak 1 x 10 9 CFU / mL) karşılık gelir. Alüminyum folyo ile ışıktan koruyunuz tüpler buz üzerinde bırakın.
2. İn Vitro Perfüzyon Deneyleri
- Cam lameller kaplanması
- Laboratuvar sınıfı su içinde von Willebrand faktörü (vWF) (Haemate P stok konsantrasyonu 2400 ug / ml) ile seyreltilir, 50 ug / ml nihai konsantrasyona kadar (damıtılmış deiyonize).
- 160 ug / ml bir son konsantrasyona kadar (üretici tarafından sağlanan gibi, SKF çözeltisi, pH 2.7-2.9), izotonik glikoz çözeltisinde kollajen seyreltin.
- Parafilm üzerindeki kaplamanın 200 ul bırakarak ve damlacık üstüne lamel yerleştirin tarafından VWF'nin veya kollajen ile kaplayın cam lamelleri (24 × 50 mm). damlacık lamel yüzeyi boyunca yayılacak.
- Oda sıcaklığında 4 saat boyunca nemlendirilmiş bir kap içinde lamel inkübe edin. Dikkatle künt bir iğne ile parafilm gelen lamelleri kaldırın. Akış odasının alt kısmında lamel monte edin.
- Plastik Kaplama Endotel Hücreleri ile Fiş
- Coat plastik makbuzları(1-çukurlu PCA hücre kültür odası, Sarstedt, Almanya) PBS içinde% 1 jelatin çözeltisi, 1 ml ve 37 ° C'de 30 dakika inkübe edilir. Jelatin kaplı plastik makbuzları Tohum insan göbek damarı endotel hücreleri (HUVEC'ler), ve 70-80% konfluansa kadar bunları büyür. Akış odasının alt kısmında plastik kayma monte edin.
- Perfüzyon Deney
Not: In vitro perfüzyon modeli şematik bir genel görünüşü Şekil 1'de gösterilmiştir.- Farklı fizyolojik akış koşullarını simüle etmek için 2.5 din / cm2 ve 20 din / cm2 arasında bir laminer kesme stresinde mikro paralel plaka akış odasının in vitro bakteriyel yapışma çalışmaları gerçekleştirin.
- Akış odası (in-house tasarım) bir metal çerçeve ve pleksiglas yapılmış bir perfüzyon odasına (poli (metil) (PMMA)) oluşur. Yüksek doğruluk infüzyon pompası (PHD 2000 İnfüzyon, Harvard Aparatı, ABD) bağlayarak, biz akış ra üretebilir0.0001 ul / dk ve 220,82 ml / dk tes.
- Akış odasının üst kısmına boru bağlayın ve tüp orta enjekte. Yavaşça taban kısmının üst akış bölmesinin üst kısmı yerleştirin ve akış odası monte edin. Hava kabarcıklarını önlemek için dikkatli olun. Odacık sızıntı olmadığından emin olmak için ve fazla kaplama çözümü kaldırmak için haznesinden orta 1 ml enjekte edilir. Hava kabarcıkları kaçının.
- Bir mikroskop tepsiye 37 ° C'de bir termo-kontrollü ısıtma yastığı fare yerleştirin. Bu, bir terminal işlemi olduğu için, sıkı asceptic işlemleri için bir ihtiyaç vardır. Şahdamarından yakın bir kesi yapmak, nazikçe servikal kas sağ tarafını kaldırın ve çevre dokudan juguler ven izole.
- Infüzyon pompası ve floresan mikroskop ayarlayın. İnfüzyon pompası ayarları şırınga çapı ve istenilen debi (Bölüm 2.4 bakınız) bağlıdır. Şu andan itibaren, karanlık bir odada çalışıyoruz.
- VWF Kaplama:
- Flüoresan etiketli bakteriler ile bir şırınga doldurun ve giriş borusu bağlayın. Hava kabarcıkları kaçının. 10 dakika infüzyon Pompayı çalıştırın. İnfüzyon süresi kullanılan kesme hızı ve kaplamanın, bakteri ve ortama bağlıdır ve yapışma sürekli durumunu temsil etmelidir.
- 10 dakika sonra, giriş tüpü PBS ile bir şırınga bağlanması ve infüzyon pompası başlayarak bağlanmamış bakterileri uzak yıkayın.
- Yıkama işleminden sonra farklı yerlerde en az 15 fotoğraf veya film çekin. Bakteriler odaklanmak, küçük ve potansiyel güçtür. In vitro olarak akış Deneyden önce, uygun bir odak düzlemi, bir lamel flüoresan etiketli bakteriler bir damlasının yerleştirilmesiyle ve akış odası içinde lamel yerleştirerek elde edilebilir. Ardından, uygun odak düzlemi aramak ve ayarları kaydedin.
NOT: in vitro akış deney sırasında, yıkama aşamasında fotoğraf çekimi (başladıktan sonra ± 5 dakika) sağlayan sadeceyapışık bakteriler için sinyal yakalanır.
- Kollajen Kaplama:
- Sadece perfüzyon başlamadan önce floresan etiketli bakteri 60 ug / ml VWF ekleyin. 60 ug / ml ile takviye edilmiş VWF floresan etiketli bakteriler ya da flüoresan etiketli bakteriler ile bir şırınga doldurun ve giriş borusu bağlayın. Hava kabarcıkları kaçının. Tekrarlayın 2.3.5.2 2.3.5.3 adımları
- Endotel Hücreleri:
- Ca + 2 -ionophore A23187 bir 0.1 mM çözeltisi ile perfüzyon ile endotel hücrelerini aktive bir perfüzyon yoluyla, 10 dakika boyunca bakteriyel perfüzyon aynı kesme oranında DMEM (stok çözelti, dimetil sülfoksit (DMSO) içinde çözülmüştür, 10 mM) 0.1 mM. Tekrarlayın 2.3.5.3 Kalorifer kadar 2.3.5.2 adımları.
- Aşağıdaki gibi kayma hızı ve kayma gerilmesi hesaplayın.
Kayma hızı = 6Q / wh 2
Q: a ml / dak oranı, akış: cm genişlik, H: cm yükseklik
Kesme gerilmesi (τ) = kayma sıçanEski viskozite (μ)
Nerede μ: Ortam: 0.01 din x sn / cm2, tam kan: 0,04 din x sn / cm2 - Görüntü analizi
- Siyah beyaz kamera ile ters bir floresan mikroskop kullanılarak canlı görüntüleri elde etmek ve görüntüleme yazılımı kullanarak geliştirmek. 1.5 sn pozlama süresini kullanın. Rastgele akış odasının kaplanmış yüzeye yayılmış çoklu fotoğraf (en az 15) alın ve uygun dosya biçiminde kaydedebilirsiniz.
- ImageJ ile görüntü analizi yapın. Ve ilgi özelliklerine içine gri tonlu görüntüleri segmentlere, alt ve üst eşik değerlerini ayarlamak için eşiğini tanımlamak - Görüntünün (substract Arkaplan Süreci) pürüzsüz, sürekli arka kaldırmak için arka plan çıkarın. Eşik sınırlı alanı ölçün.
- Bakteriyel yapışma karşılaştırın, istatistiksel analiz yazılımı kullanılarak, örneğin flüoresan alanı olarak ifade edilir. Tek yönlü ANOVA veya t kullanan gruplar karşılaştırwo kuyruklu Student t testi. Ortalama (SEM) ortalama ± standart hata olarak tüm değerleri bildirin. Önemli <0.05 p değeri düşünün (* p <0.05; ** p <0.01; *** p <0.001).
Vivo Mezenterik Perfüzyon Modeli 3.
- Farenin Hazırlama / cerrahi
- Bağırsak hareketi sınırlamak amacıyla deney gece önce fare Hızlı.
- Buprenorfın bir deri altı enjeksiyon cerrahi öncesi (0.1 mg / kg vücut ağırlığı (BW)) 20-30 dk ile 6-8 haftalık fare (C57Bl / 6) ameliyat öncesi analjezi ver.
- Intra-peritoneal ketamin enjeksiyonu (125 mg / kg BW) ve xylazine (12.5 mg / kg BW) tarafından fare anestezisi. Pedal refleks edin. Kuruluğunu önlemek için veteriner merhem sürün.
- Bir mikroskop tepsiye 37 ° C'de bir termo-kontrollü ısıtma yastığı fare yerleştirin. Bu, bir terminal işlemi olduğu için, sıkı ascepti için bir ihtiyaç vardırc prosedürleri. Şahdamarından yakın bir kesi yapmak, nazikçe servikal kas sağ tarafını kaldırın ve çevre dokudan juguler ven izole.
- Floresan etiketli bakteriler ya da diğer çözeltiler infüzyonu için sağ boyun damarına bir 2 Fransız kateter yerleştirin. Orta hat insizyon aracılığıyla periton boşluğuna açın ve Mezenterium yaymak için pamuklu çubuklarla kullanabilir ve mezenterik arteryolar ve venüler dolaşımını görselleştirmek için.
- Şeffaf bir plaka üzerinde sağ tarafta fare yerleştirin ve bantla kanül sabitleyin. Hipotermi önlemek için sıcak bir takımı kullanınız. Doku kaybını önlemek için, bağırsakların 500 ul% 0.9 NaCl bırakın.
- Mezenterik dolaşıma bakteriyel yapışma floresan mikroskopi
- Karanlık bir odada çalışın. Damarları hareketsiz ve ters bir mikroskop altında görselleştirmek için pamuklu çubuklarla kullanın.
- Topikal bir 10 mM'lik bir çözeltisi, O 5 ul geçerlidirf Ca 2 + -ionophore A23187 DMSO içinde çözülmüştür. 10 saniye sonra, juguler kateter yoluyla bakteri etiketli 100 ul (adım 1) enjekte edilir. Time-lapse fotoğraf çekmek. Deney bittikten sonra, kurumsal onaylı kurallarına göre fare euthanize.
- Görüntü Analizi
- Siyah beyaz kamera kullanarak herhangi bir görüntüleme yazılımı kullanılarak geliştirilen yakalanan bir ters floresan mikroskop kullanarak canlı görüntüleri edinin. Otomatik pozlama süresini ve kullanılan ekipman özel kontrast optimizasyonu uygulayın.
- 1000 images / sn 40 döngü kullanarak - araç çubuğunda 'Toplama' aracını (Zaman çok boyutlu Devralmalar) kullanarak time-lapse görüntüleri edinin. Uygun bir görüntü dosyası formatında görüntü kaydetmek.
- Görüntü başına floresan sinyal alanı ölçmek için ImageJ analiz yazılımı kullanılarak işlem ve görüntüler. F içine gri tonlu görüntüleri segmentlere, alt ve üst eşik değerlerini ayarlamak için eşik tanımlayınilgi eatures. Faiz (kan damarı) bölgesini tespit ve eşik ve ilgi bölgeye sınırlı alanı ölçün. Bakteriyel yapışma karşılaştırın, herhangi bir istatistik veya grafik yazılımı kullanarak floresan alan olarak ifade edilmiştir.
Sonuçlar
VWF S. aureus yapışma, subendotelyal matriks ve endotel hücreleri bir kayma gerilmesi bağımlı bir olgudur
S. arasındaki etkileşimde kayma gerilmesi rolünü vurgulamak için aureus ve vWF, farklı kayma hızlarında ile kaplanmış kapak sliplerine (in vitro perfüzyon modeli şematik bir genel S. aureus 1. Yapışma 250 sn arasında artan kesme oranlarında arttığı vWF Şekil verilmiştir -1 2.000 VWF fazla perfüzyonunu gerçekleştirilen sn-1 (Şekil 2), yüksek kesme kuvvetleri önleyen fakat VWF bakterilerin yapışmasını güçlendirmek yok olduğuna işaret etmektedir.
Kollajen bakteriyel yapışma VWF katkısını araştırmak amacıyla, subendotelyal matrisinin başlıca bileşeni olan biz floresan etiketli S. perfüze VWF varlığında veya yokluğunda kolajen üzerindeki aureus. VWF, S. yapışma yokluğunda birkolajen ureus kesme oranları arttıkça azalmıştır. Bununla birlikte, VWF ortam içinde mevcut olduklarında olduğunu, S. yapışması aureus kayma oranları (Şekil 3) birlikte artmaktadır.
In vitro akış modeli aynı zamanda akış altında endotel hücrelerine bakterilerin yapışmasını incelemek için bize izin verir. Biz HUVECler ile floresan S. etiketli perfüze kayma hızlarında 500 ila 2,000 sn aureus -1. Burada, belirtilen HUVECler VWF salınmasına neden olmak için, bir Ca2 + -ionophore ile aktive edildi. Endotel hücre aktivasyonu ve ardından VWF salma, S. artan yapışması Tipik "dizge" gibi desenler oluşturulmuş aureus (Şekil 4A), floresan doğrusal gerilmiş VWF molekülü boyunca bakteri bağlanmasını gösteren kesme kuvveti (Şekil 4B) yönünde hizalanmış bakteriyel kümeler, etiketli.
Başlangıç in vivosplanknik damarlarındaki bakteriyel yapışma VWF aracılık eder
S. yana in vivo olarak aktif damar duvarına bakteriyel yapışmayı araştırılması - (- / vWF) aureus VWF bağlı mümkün olduğu için, (vWF + / +) ve vWF-eksikli farenin vahşi tipli fare kullanılır. Splanknik venlerin Gerçek zamanlı videomikroskopi floresan S. etiketli dolaşımdaki in vivo görselleştirme izin aureus (in vivo perfüzyon modeli şematik genel görünüşü Şekil 5'de temsil edilmiştir) hazırlandı.
Ca + 2 -ionophore tarafından endotelyumun farmakolojik aktivasyonu sonra WT farelerinde damar duvarına tek tek bakteri ve bakterinin agrega hızlı yerel birikimi gözlendi (ek video 1 ve 2). Bakteriler hemen hemen hiç bir yapışma vWF -deficie aktive damar duvarı izlendint fareleri (ek video 3) WT farelerde yapışma ile karşılaştırıldığında (Şekil 6). VWF yokluğu S. yeteneği azalır aureus aktif damar duvarına yapışma.
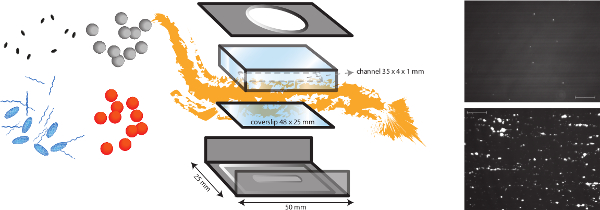
Şekil 1 in vitro olarak akış modelinin şematik bir temsili., In vitro akışı modeli, subendotelyal matrise bakteriyel yapışma gibi farklı kesme bağımlı mekanizmaların çalışmasını sağlayan bir çok fonksiyonlu bir model, ama aynı zamanda oluşumu trombus. Mikro paralel bir akış odasından proteinleri ve endotel hücrelerinin, farklı kaplamalar ile bir lamel (plastik veya cam) üzerine yerleştirilir. Farklı bakterilerin (turuncu ve siyah nokta) yapışması analiz edilebilir ve plazma proteinleri, trombositler ve tam kan varlığında etkisi değerlendirilebilir. Trombositlerin (mavi oval) ya da fibrinog için fluoresan işaretleyicilertr (mavi şeritler), bakteriyel ve ana faktörleri ayırt farklı önleyicileri (siyah ovaller) ile kombinasyon halinde de kullanılabilir. S. bakteriyel yapışma Temsilcisi görüntüleri VWF'nin varlığı (altta) kollajen kaplama ya da yokluğu (üst) aureus (ölçek çubuğu 100 mikron olan) gösterilmektedir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
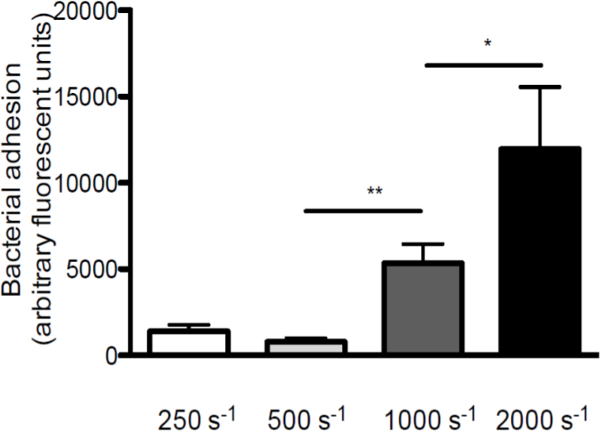
S. Şekil 2. Yapışma makaslama oranlarının artırılması ile VWF artar aureus. kaplanmış VWF üzerinde Mikro-paralel akış odası perfüzyon (/ ml 50 ug) ile floresan S. etiketli orta 250 sn -1 (sn -1) 2,000 makaslama oranları (n> 5) de aureus Newman. Tüm sonuçlar ortalama ± SEM olarak ifade edilmiştir. * P <0.05, ** p <0.01.
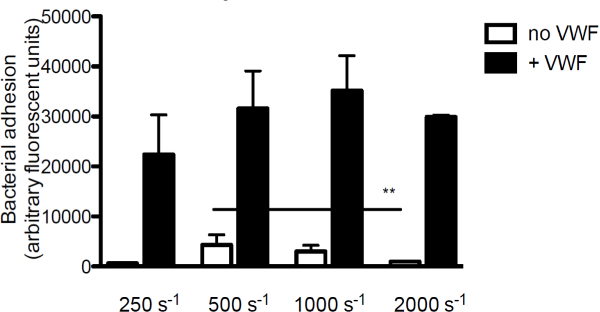
S. Şekil 3. Yapıştırma subendotelyuma aureus kayma ve VWF bağlıdır. ile floresan etiketli S. Kaplı kollajen (160 ug / ml) üzerindeki mikro-paralel bir akış odasından perfüzyon orta 250 sn 2,000 -1 makaslama oranları (n> 5) de aureus Newman. Aksi belirtilmediği VWF (60 ug / ml), ortam içinde mevcuttu. Tüm sonuçlar ortalama ± SEM olarak ifade edilmiştir. ** P <0.01.
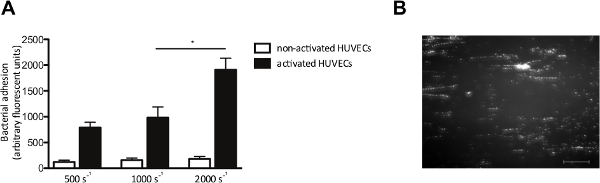
S. Şekil 4. yapışması aktive endotel hücrelerine aureus endotel hücreleri üzerinde kayma bağımlı. Mikro paralel akış odası perfüzyon olduğunu. (A) insan göbek damar endothelial hücreleri Ca + 2 -ionophore A ile aktive edildiFloresan etiketli S. 10 dakika perfüzyon takiben 23.187 (0.1 mM) orta 500 sn 2,000 -1 makaslama oranları (n> 5) de aureus Newman. Tüm sonuçlar ortalama ± SEM olarak ifade edilmiştir. * P <0.05. S ile aktive edilmiş HUVEC üzerinde mikro paralel bir akış odasından perfüzyon (B) Görüntü 1000 saniyelik bir kesme hızında -2. S. de aureus aureus VWF multimerleri yapışma (ölçek çubuğu 100 mikron olan) düşündüren, ± 200 mikron uzunluğunda dizeleri oluşturur. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 5. in vivo mezenterik perfüzyon modelinin şematik bir bakış. Sağ juguler ven kateteri (sarı hat) flor uygulaması için eklenirescently etiketli bakteriler (turuncu nokta) ilave anestetikler ya da farmasötik inhibitörleri ve antikorlar gibi diğer bileşenler. periton boşluğu açıldı ve Mezenterium flöresanlı bir mikroskop altında kan damarları (venöz ve arteriyel) görselleştirmek için yayılır. VWF salınmasını uyaran bir Ca2 + -ionophore tarafından endotelyumun farmakolojik hale getirilmesinden sonra, bakteriler jugular damar kateteri yoluyla enjekte edilebilir. Gerçek zamanlı intravasküler bir video mikroskobu floresan etiketli bakteri dolaşan in vivo görselleştirme ve bakteri-trombosit trombüs çıkan oluşum. Tanır , bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
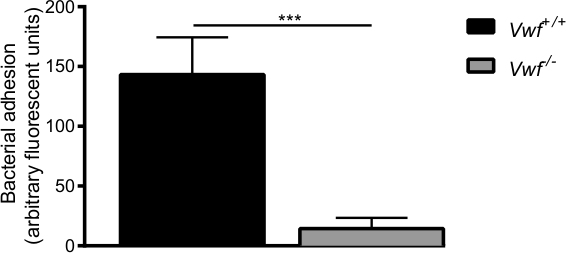
Şekil 6. S. ilk yapışma aureus- / - farelerin., in vivo ortamda aktive edilmiş endotele C57BL / 6, vWF + / + ve C57BL / 6-VWF VWF in vivo venöz mezenterik perfüzyon modeli tarafından aracılık etmek. Yapışma floresan etiketli S. / - - fareler yerel aktif damar duvarına aureus vWf anlamlı derecede düşük olduğunu. Tüm sonuçlar ortalama ± SEM olarak ifade edilmiştir. *** P <0.001, n> 7.
Video 1: S. Gerçek zamanlı yapışma aureus vWf + / + farelerde aktive damar duvarına. Bu videoyu görmek için lütfen buraya tıklayınız.

Video 2: Gerçek zamanlı toplu oluşumu ve S. embolizasyon aureus vWf + / + farelerde. Bu videoyu görmek için lütfen buraya tıklayınız.

Video 3: S. Gerçek zamanlı yapışma - / - farelerde - / -. vWF + / + ve VWF farelerde in vivo mezenterik perfüzyon modelinde aureus vWF aktif damar duvarına. Bir Ca2 + -ionophore (10 mM) Beş ul başvurunun oldugörüntülenmiştir vasküler yatağın bölgeye ed. Karboksi-floresin etiketli S. içindeki bir aureus, juguler kateter aracılığıyla enjekte edilmiştir. mezenterik dolaşım ters bir mikroskop altında görüntülendi. Bu videoyu görmek için lütfen buraya tıklayınız.
Tartışmalar
Kesme gerilmesi damar duvarına erken bakteriyel yapışma ve endovasküler veya endokardiyal vejetasyon ve metastatik enfeksiyonların 4,5 müteakip nesil için çok önemli bir faktördür. Fizyolojik makaslama gerilimi altında endovasküler enfeksiyonların hastalık oluşumunun incelenmesinde, in vitro ve in vivo modellerde tamamlayıcı tarif. Bu modeller bize büyük S. olarak von Willebrand faktör bağlayıcı protein (vWbp) tanımlamak için izin aureus protein VWF 4 açığa yaralı bir damar duvar ile akış altında etkileşim.
Endovasküler enfeksiyonları ve özellikle enfektif endokardit, aynı zamanda, çünkü yerel ve uzak ('metastatik'), komplikasyon, çünkü sadece sepsis kaynaklı organ yetmezliği ve ölüm endişe vardır. Enfektif endokardit ve metastatik enfeksiyonlara neden için, bakteri damar duvarına yapışır ve böylece kan akan kayma gerilmesi karşı zorunda. Çoğubakteriler üzerinde çalışmalar faktörleri statik koşullarda yapılmıştır virülansa. Ancak, bu kurulan etkileşimleri bakteri-konak etkileşimi yeni, daha önceden tanınmayan faktörleri ortaya çıkarabilir akış şartlarında kesme kuvvetlerini ve çalışmalar dayanacak olmayabilir.
Mikro paralel bir akış odasından kullanarak, ve diğerleri, vasküler yapışma VWF önem taşıdığını göstermiştir. Makaslama stres altında giderek Unfolds dinlenme küresel yapıdan VWF ve onun GPIb reseptörü 6 vasıtasıyla trombositler ile etkileşime A1 alanını ortaya çıkarır. Akış odaları yoğun trombosit fonksiyonu 7 incelemek için kullanılmıştır.
Dikkate değer, ayrıca S. akış altında aureus yapışma kesme sırasında maruz A1 etki VWF gerektirir, ve özellikle. Biz vWbp VWF bağlayıcı arabuluculuk belirledi. vWbp S. katkıda bulunan bir koagülaz olduğunu Ev sahibinin protrombini aktive ederek aureus patofizyoloji. Staphylothrombin, resbakteriyel Koagulaz ve protrombin kompleksi ulting, çözünmeyen fibrin 8,9 içine fibrinojen dönüştürür. Çalışmalarımız vWbp sadece protrombini aktive etmediğini göstermiştir, ancak akış 4,10,11 altında kan damarlarının yapışmasını geliştirmek bakteri fibrin-trombosit agrega, oluşumunu tetikler var.
in vitro akış odası modeli hücresel veya matris bileşenleri bakteriyel yapışma farklı oyuncuları çalışma sağlar. Bakteriyel virülans faktörleri spesifik yüzey proteinleri ifade mutantlar veya zararsız bakteriler kullanılarak incelenebilir. Seçenek olarak ise, farmakolojik inhibitörleri ya da bloke edici antikorlar, akış odasının ortama ilave edilebilir. gibi hücre dışı matrisin farklı bileşenler olarak ana faktörlerin rolü farklı kaplamalar ile lamelleri kullanılarak incelenebilir. lamelleri da aktivasyon durumu spesifik stimülatörlerinin eklenerek modüle edilebilir olan endotel hücreleri ile kaplı olabilir. Apavasküler duvar RT konakçı kan hücreleri ve plazma proteinlerinin katkısı akan ortam için bu faktörleri eklenerek incelenebilir. Böylece, artan karmaşıklık farklı koşullar bakteri in vivo damar duvarına yapışma sağlayan etkileşimleri çözülmeye laminer akış standart koşullar altında incelenebilir.
In vitro modelde tanımlanan etkileşimi, daha sonra, bir organizma içindeki önemini test etmek için bir hayvan modelinde incelenmiştir. Akış altında dinamik etkileşimler üzerinde çalışmak için in vivo modeller tür diğer hamsteri dorsal deri altı bölme 12 ve cremaster modeli 13 olarak tarif edilmiştir. Buna karşılık, burada açıklanan mezenterik perfüzyon modeli, olasılık farelerin genetik arka plan ev sahipliği değişir ve farmakolojik müdahalelerin değerlendirilmesi nedeniyle kullanım kolaylığı ve çeşitli avantajlar sunuyor.
Sonuç olarak, modeller tarifS. sadece yüzey proteinleri çalışma imkanı sunuyoruz aureus, ancak farklı konakçı geçmişleri diğer birçok mikroorganizma, daha iyi damar enfeksiyonlarının patogenezi anlamak için.
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
Bu eser Fonds voor Wetenschappelijk onderzoek (FWO) Vlaanderen G0466.10, 11I0113N tarafından desteklenmiştir; Pediatrik Kardiyoloji, UZ Leuven, Belçika "Eddy Merckx Araştırma Bursu" ve "Sporta araştırma Hibe" (JC); Moleküler Biyoloji ve Damar Merkezi Leuven Üniversitesi'nden "Geconcentreerde Onderzoeksacties" (GOA 2009/13) ve Boehringer-Ingelheim bir araştırma bursu ile, Programmafinanciering KU Leuven (PF / 10/014) tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Brain Heart Infusion (BHI) | BD Plastipak | 237500 | |
| Tryptic Soy Broth (TSB) | Oxoid | CM0129 | |
| Phosphate Buffered Saline (PBS) | Invitrogen | 14190-169 | D-PBS |
| 5(6)-carboxy-fluorescein N-hydroxysuccinimidyl ester | Sigma-Aldrich | 21878-25MG-F | fluorescent labeling |
| Bovine Serum Albumin Fraction V (BSA) | Roch | 10 735 086 001 | |
| Haemate-P | CSL Behring | PL 15036/0010 | VWF |
| Horm collagen | Takeda | 10500 | collagen |
| 1-well PCA cell culture chambers | Sarstedt | 94.6140.102 | plastic slips |
| Temgesic | Reckitt Benckiser | 283716 | bruprenorphine |
| Anesketin (Ketamin hydrochloride 115 mg/ml (100 mg/ml ketaminum)) | Eurovet | BE-V136516 | ketamin |
| XYL-M 2% (xylazine hydrochloride 23.32 mg/ml (20 mg/ml xylazine)) | VMD Arendonk | BE-V170581 | xylazine |
| 2 french intravenous catheter green | Portex | 200/300/010 | |
| 0,9% Sodium chloride (NaCl) | Baxter Healthcare | W7124 | |
| cotton swabs | International Medical Product | 300230 | |
| Ca2+-ionophore solution A23187 | Sigma-Aldrich | C7522-10 MG | |
| 26 gauge 1 ml syringe | BD Plastipak | 300013 | |
| 26 gauge 1 ml syringe with needle | BD Plastipak | 300015 | intra-peritoneal injection |
| Centrifuge 5810-R | Eppendorf | 5811 000.320 | |
| Glass cover slips (24x50) | VWR | BB02405A11 | Thickness No, 1 |
| PHD 2000 Infusion | Harvard Apparatus | 702100 | High-accuracy Harvard infusion pump |
| Axio-observer DI | Carl-Zeiss | Inverted fluorescence microscope | |
| ImageJ | National Institute of Health | Analysis software | |
| Graphpad Prism 5,0 | Graphpad Software | Analysis software | |
| AxioCam MRm | Carl-Zeiss | Black and white camera |
Referanslar
- Vanassche, T., Peetermans, W. E., Herregods, M. C., Herijgers, P., Verhamme, P. Anti-thrombotic therapy in infective endocarditis. Expert Rev Cardiovasc Ther. 9 (9), 1203-1219 (2011).
- Heying, R., van de Gevel, J., Que, Y. A., Moreillon, P., Beekhuizen, H. Fibronectin-binding proteins and clumping factor A in Staphylococcus aureus experimental endocarditis: FnBPA is sufficient to activate human endothelial cells. Thromb Haemost. 97 (4), 617-626 (2007).
- Pappelbaum, K. I., et al. Ultralarge von Willebrand factor fibers mediate luminal Staphylococcus aureus adhesion to an intact endothelial cell layer under shear stress. Circulation. 128 (1), 50-59 (2013).
- Claes, J., et al. Adhesion of Staphylococcus aureus to the vessel wall under flow is mediated by von Willebrand factor–binding protein. Blood. 124 (10), 1669-1976 (2014).
- Thiene, G., Basso, C. Pathology and pathogenesis of infective endocarditis in native heart valves. Cardiovasc Pathol. 15 (5), 256-263 (2006).
- Sixma, J. J., Schiphorst, M. E., Verweij, C. L., Pannekoek, H. Effect of deletion of the A1 domain of von Willebrand factor on its binding to heparin, collagen and platelets in the presence of ristocetin. Eur J Biochem/FEBS. 196 (2), 369-375 (1991).
- Theilmeier, G., Lenaerts, T., Remacle, C., Collen, D., Vermylen, J., Hoylaerts, M. F. Circulating activated platelets assist THP-1 monocytoid/endothelial cell interaction under shear stress. Blood. 94 (8), 2725-2734 (1999).
- Bjerketorp, J., Jacobsson, K., Frykberg, L. The von Willebrand factor-binding protein (vWbp) of Staphylococcus aureus is a coagulase. FEMS Microbiol Lett. 234 (2), 309-314 (2004).
- Friedrich, R., et al. Staphylocoagulase is a prototype for the mechanism of cofactor-induced zymogen activation. Nature. 425 (6957), 535-539 (2003).
- Vanassche, T., et al. Fibrin formation by staphylothrombin facilitates Staphylococcus aureus-induced platelet aggregation. Thromb Haemost. 107 (6), 1107-1121 (2012).
- Vanassche, T., et al. The role of staphylothrombin-mediated fibrin deposition in catheter-related Staphylococcus aureus infections. J Infect Dis. 208 (1), 92-100 (2013).
- Buerkle, M. A., Lehrer, S., Sohn, H. Y., Conzen, P., Pohl, U., Krötz, F. Selective inhibition of cyclooxygenase-2 enhances platelet adhesion in hamster arterioles in vivo. Circulation. 110 (14), 2053-2059 (2004).
- Kim, K. H., Barazia, A., Cho, J. Real-time imaging of heterotypic platelet-neutrophil interactions on the activated endothelium during vascular inflammation and thrombus formation in live mice. J Vis Exp. 2 (74), (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır