Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Planar Gradient Difüzyon Sistemi 3D Kollajen Matrix Kemotaksis Araştırma
Bu Makalede
Özet
Cell migration is an important part of human development and life. In order to understand the mechanisms that can alter cell migration, we present a planar gradient diffusion system to investigate chemotaxis in a 3D collagen matrix, which allows one to overcome modern diffusion chamber limitations of existing assays.
Özet
The importance of cell migration can be seen through the development of human life. When cells migrate, they generate forces and transfer these forces to their surrounding area, leading to cell movement and migration. In order to understand the mechanisms that can alter and/or affect cell migration, one can study these forces. In theory, understanding the fundamental mechanisms and forces underlying cell migration holds the promise of effective approaches for treating diseases and promoting cellular transplantation. Unfortunately, modern chemotaxis chambers that have been developed are usually restricted to two dimensions (2D) and have complex diffusion gradients that make the experiment difficult to interpret. To this end, we have developed, and describe in this paper, a direct-viewing chamber for chemotaxis studies, which allows one to overcome modern chemotaxis chamber obstacles able to measure cell forces and specific concentration within the chamber in a 3D environment to study cell 3D migration. More compelling, this approach allows one to successfully model diffusion through 3D collagen matrices and calculate the coefficient of diffusion of a chemoattractant through multiple different concentrations of collagen, while keeping the system simple and user friendly for traction force microscopy (TFM) and digital volume correlation (DVC) analysis.
Giriş
kemotaksisi olarak bilinen bir konsantrasyon gradyanı doğru hücrelerinin tercih edilen bir hareketi, vücut patolojik ve fizyolojik süreçlerde önemli bir rol oynar. Bu gibi örnekler, deri ve mukoza yara iyileşmesi, 1 morfogenez 2, iltihap 3 ve tümör büyümesi 4,5 bulunmaktadır. Aynı zamanda kanser hücreleri hem bireysel hem de kolektif hücre göç stratejilerinin 6 doğru göç edebildiğini ortaya konmuştur. Ayrıca, difüzyonel istikrarsızlık mekanizmaları besin kaynağına doğru göç ve dolayısıyla daha geniş alanları ve dokuları 7 istila edebilir sonra bir tümörlü beden / nesneden tek veya kümelenmiş hücrelerin ayrılmasını teşvik edebilirsiniz.
Ayrıca, çeşitli göç mekanizmaları nedeniyle adezyon moleküllerinin 8 farklı roller, 2D ve 3D aktif olabileceği gösterilmiştir. Bu nedenle, in vitro tayinlerde fizyolojik ilgili bir hareket, bir measureabl hücre hareketliliğini araştırmak içinE ve basit bir şekilde hücre hareketi fenomeni 9 anlamada önem taşımaktadır. Ne yazık ki, hücre göçü analiz zorluk, kapsamlı ölçülebilir kemotaksi deneyi genellikle tarafsız hücre hareketi ve ulaşım olayları modellerinin ölçümü üzerine kurulmuş uzun zahmetli bir yöntem gerektirir.
Hücre kemotaksisini araştırmak için Geçmiş deneysel yaklaşımlar Boyden haznesi 10 ve under agaroz tahlil 11 arasındadır. Bununla birlikte, bu ilk deneylerde, hücre göçü deneyleri zamana göre hareketi izlemek yoktu. Daha da önemlisi, deneyler için kullanılan konsantrasyon gradyanlar iyi tanımlanmış değil veya sadece birkaç saat fazla için sinyalizasyon sürdürülmesi sırasında tam olarak anlaşılamamıştır. Ayrıca, erken kemotaksis odasının girişimleri iki boyutlu hücre göçü kısıtlı ve bir göç 12 kinetiği izlemek için izin vermedi. Boyden odasının baktığımızda, bir uç nokta deneyiAraştırmacı görsel göç gözlemlemek için izin vermez ve doğrudan kemokinezinin (rastgele hareket) den kemotaksis (yönlü hareket) ayırt edemedi. Buna ek olarak, gözenek boyutu ve kalınlığı birkaç değişken-farklar kolayca üretmek için çok zor odasını membranların yapımı ve kemokinlere 13,14 hücrelerin göçmen tepkisini gizli.
Mikroakiskan yeni anlayışla, yeni odaları ve mikro cihazlar interstisyel akış koşulları altında hücre lokomosyon araştırmak için bir araç olarak incelenmiştir veya 15,16 kemotaksis oylandı. Bu yeni cihazlar altında, yeni hücre ölçümlerini tanıtıldı ve bir hücre 17,18 üzerinde kayma gerilmesi etkisi gibi, incelendi. Ne yazık ki, geçmiş ve şimdiki mikroakışkan kemotaksis odaları tümör hücre invazyonu ve metastaz, ve im de dahil olmak üzere birçok biyolojik süreçler, çünkü 2B yüzeyler-önemli bir gerileme hücre göçü çalışmalar sınırlıbağışıklık hücre göçü, göç 3D içerir.
Doğrudan gözlem odaları-burada bir kemoatraktanttır çözeltisi hücreleri ihtiva eden bir 3 boyutlu jel ile temas halinde olan, aynı zamanda, aynı zamanda 19,20 bildirilmiştir. Bu odalar yatay birbirlerine 21 yanında veya konsantrik halkalar 22 olarak birleştirilmiş, iki bölmeleri, bir kemoatraktan içeren bir ve hücreleri içeren bir tane var. Bu sistemler doğru yöne, ancak uzun bir süre için bir kemotaksis sistemi tutmuyorum.
Bundan başka, araştırmacılar da diyaliz hücreleri, hem de hidrostatik basınç 23-25 tabi kolajen örnekler aracılığıyla izleyici moleküllerinin difüzyonuna kolajen zarları aracılığıyla yayılma inceledik. Kollajen jel bazı difüzyon deneyleri manyetik alanlar ve kimyasal birleşme 26 kullanılarak jel fiziksel ve kimyasal değişiklikler dayanır. Colla içinde yayılma modellemek için popüler bir yöntemotojen dokular sürekli nokta photobleaching floresan görüntüleme dayanır. Bu yöntem odaklı kollajenoz dokularda makromoleküllerin difüzyon katsayılarında anizotropiye ortaya koymuştur. Oysa, photobleaching eklem kıkırdağı kullanılır ve matrisleri kollajen edilmiştir. Benzer birlikte, gerekli olan modelleme deneyleri özellikle kollajen jel difüzyon katsayısı anlama yoluyla yapılması gerekir. Daha da önemlisi, sistem, hücre gücü üretimi ölçmek için bir yöntem kullanmaktadır yoktur.
Ne yazık ki, çoğu sistem için ideal bir sistem için bir ya da iki temel unsuru eksik gibi görünüyor: Hücre izleme, matris tekrarlanabilirliği bir kolaylığı ile nispeten basit bir set up, en aza indirilmesi yoluyla kemotaktik faktörü ile difüzyon degrade anlayışının izin etkileşimler hücre-hücre ve boyutsal ölçümü için birimler (örneğin, hız, kuvvet, belirli konsantrasyon) ölçmek için yeteneği. Moghe ve diğ. 27 hücreleri başlangıçta jel boyunca dağınık ziyade filtre yüzeyinde konsantre edildiği, bu gereksinimleri en yerine bir sistem önerdi, ancak hücre üretir kuvvetleri ölçmek için zordu.
Bu amaçla, biz bir hücreyi ölçmek için görüntü analiz teknikleri ile birleştiğinde time-lapse mikroskopi dayalı mevcut deneyleri, modern yayılma odası sınırlamaları aşmak için izin veren bir 3D kollajen matriks içinde kemotaksis araştırmak için bir düzlemsel degrade difüzyon sistemi sunuyoruz 3 boyutlu bir ortamda kuvvetler. Bu protokol, farklı hücrelerde 3D kemotaksis araştırmak için kullanılabilecek basit bir 3D difüzyon odasını oluşturma basit ama yenilikçi bir yol sağlar.
Protokol
1. 3D Kalıp Tasarımı ve Parçaları
- Kalıp
- Çalışmaya başlamadan önce, bir silikon elastomer kiti, bir canlı hücre görüntüleme odası, 22 mm cam lamel ve boyutları 10.07 mm x 3.95 mm x 5.99 mm ile işlenmiş alüminyum metal küp edinin. Alt tutucu lamel yerleştirerek ve satıcı tarafından yönlendirildiği gibi odasının kalanını montaj döküm için canlı hücre görüntüleme odası hazırlayın.
- Sonra, forseps kullanarak, canlı hücre görüntüleme odası konut ortasında ve lamel üstüne işlenmiş alüminyum metal küp yerleştirin ve sonra bir kenara koyun.
- Elastomer 5 ml yapmak için, üreticinin protokolüne uygun olarak, silikon elastomer çözüm karıştırın.
- Tek kullanımlık laboratuar spatula kullanarak, canlı hücre görüntüleme odası kurulum içine silikon elastomer çözüm dökün ve yerleştirilen işlenmiş alüminyum metal küp taşımak için değil emin olun. Kür için güvenli bir yer O / N, laboratuar bankta sistemi yerleştirin.
- Ertesi sabah, deconstructCanlı hücre görüntüleme odası, üretici tarafından önerilen ve forseps kullanarak kalıp çekin. Forseps kullanarak, dikkatli bir kalıptan işlenmiş alüminyum metal küp ayıklayın. Lavaboya gidin ve deiyonize su ile kalıp durulayın. Kurutmak için kağıt havlu üzerine kalıp yerleştirin.
- Kuruduktan sonra, bir hobi maket bıçağı kullanılarak, kalıp yarıklar kesme silikon kalıbın içinde, her bir uzunlamasına ucundan 2.34 mm aralıklı. Eğer bir deney için sistem inşa hazır olana kadar güvenli ve kuru bir yerde kalıp kalır emin olun.
- Hidrofilik ve hidrofobik Cam Lameller Hazırlık
- Kolajen matrisi, bir yüzeye yapışır hidrofil lamelleri oluşturmak için izin vermek için:
- Tek kullanımlık bir pipet kullanarak, 3-aminopropil-trimetoksisilan, 150 ul ölçmek ve 50 ml'lik bir tüp içinde çözelti dökün. İkinci bir pipet ile 50 ml tüp% 100 etanol içinde 30 ml ilave edilir ve kapağı kapatın. Tüm karıştırma sağlanması, 2 dakika için çözelti vorteksleyin. PBizim cam Petri kabındaki solüsyonu ve bir kenara koyun.
- İkinci Petri kabındaki% 100 etil alkol 15 ml dökün ve kenara (yemekleri etiket emin olun).
- Yeni bir atılabilir pipet kullanılarak, deiyonize su içinde 30 ml ölçmek ve 50 ml'lik bir tüp içine dökün. Sonra, glutaraldehit 1.875 ul yeni atılabilir pipet ölçü dışarı kullanarak ve aynı 50 ml tüp içine çözüm dökün ve kapağını kapatın. Tüm karıştırma sağlanması, 2 dakika için çözelti vorteksleyin. Üçüncü Petri kabı içine karışımı dökün ve bir kenara koyun.
- Forseps kullanarak, tek 22 mm yuvarlak cam lamel çıkar ve tek kullanımlık pipet kullanarak% 100 etanol karışımı ile her iki tarafı durulayın.
- % 100 etanol çözeltisi çanağı 30 ml 3-aminopropil-trimetoksisilan içine durulanmış cam lamel yerleştirin ve 5 dakika boyunca çözelti içinde bekletin.
- Forseps ile cam lamel çıkarın ve tek kullanımlık pipet ile% 100 etanol çözeltisi ile tekrar yıkayın.
- 1875 içine durulanır cam lamel BırakGlutaraldehid ul 30 deiyonize su karışımı içinde çözdürülür ve 30 dakika için bir kenara.
- 30 dakika sonra, forseps ile cam lamel çıkarın ve iyonu giderilmiş su ile durulayın ve oda sıcaklığında kurumaya kuru ince dokulu O / N üzerine yerleştirin.
- Tekrarlayın lamel daldırma ve aynı oluşturulan çözümleri ile gerektiği kadar lamelleri için hareket.
- Verilen protokol hidrofobik lamelleri sağlayın.
- Tridekaflor-1,1,2,2-tetrahydrooctyl 500 ul asetik asit, 100 ul, 2 dakika boyunca 50 ml'lik bir tüp ve girdap içinde, heksan içinde 19.4 ml ekleyin. Cam Petri kabındaki solüsyonu dökün ve bir kenara koyun.
- Temiz forseps kullanarak, tek cam lamel almak ve 2 dakika için hazırlanan karma çözüm içine bırakın. 2 dakika geçtikten sonra, forseps ile cam lamel çıkarın ve oda sıcaklığında kurumaya kuru doku O / N üzerine atılan bir pipet ve yer lamel kullanılarak deiyonize su ile durulayın. Kullanılıncaya kadar plastik Petri kapları saklayın lamel.
- Tekrarlama lamel DIPPing ve aynı oluşturulan çözümleri ile gerektiği kadar lamelleri için hareket.
- Kolajen matrisi, bir yüzeye yapışır hidrofil lamelleri oluşturmak için izin vermek için:
2. Kalıp Montaj
- Tek kullanımlık pipet bir kimyasal atık konteyner üzerinde% 90 etil alkol ile kalıp durulayın kullanarak kalıplar kullanmadan önce. Daha sonra, iyondan arındırılmış su ile dolu bir Petri kabındaki kalıp yerleştirmek ve O / N bekletin.
- Kalıp aksamını başlamadan önce kuru hava bir havlu üzerine forseps ve yer kullanarak çözümün dışında kalıp atın.
- Kalıp hava kurutma iken, yüksek hassasiyetli elmas lıklar aracını kullanarak x 5.99 mm 3.95 mm'den biraz daha büyük iki dikdörtgen içine kare hidrofil lamelleri kesti. Silikon kalıp halinde kesilmiş yuvalarına her kesim dikdörtgen lamel kaydırın.
- Baş aşağı çevirin ve kalıp tek kullanımlık pipet kullanarak silikon kalıp alt kısmındaki vakum gres sürün. Sonra, arka sağ taraftaki yukarı kalıp çevirmek ve dairesel hidrofil cam kapaklar üzerine kalıbın alt basınBir mühür oluşturmak için dudak.
- Tek kullanımlık eldiven ile monte kalıp pick up ve tek kullanımlık Petri kabı içine ve daha sonra bir biyo-kaputun içine yerleştirin. Deneme oluşmadan önce kalıp sterilize etmek için 1 saat UV Bio-luk lamba açın.
3. Kolajen Karışımı ve 3D Matrix
- Kollajen karışımı, leke hazırlama ve standart protokoller 28 göre görüntülenmesi için hücreleri hazırlamak önce.
- Bir biyo-başlığı içinde, standart laboratuvar teknikleri ve protokolleri 29,30 kullanarak, istenen kimyasal çekici madde konsantrasyonu 15 ml'lik bir tüp içinde, hücre ortamı ve kemoatraktan karıştırın. Pipet 5, bir 15 ml tüp içine spesifik hücre ortam kemoatraktan konsantrasyonu solüsyonu ve ısıtılmış bir su banyosu içine solüsyon hareket ettirin.
- Bir pipet kullanarak, mikroskopi deneyleri için çözeltiyi ısıtmak için bir ısıtılmış su banyosu içinde, ikinci bir 15 ml tüp ve yerine, sadece hücre medya 5 ml ekstrakte edin.
- 10x fosfat tampon, bir biyo-kaput, pipet 30 ulmikro santrifüj tüpüne ed çözeltisi (PBS). 15 saniye için aynı mikro santrifüj tüpü ve girdap içine 1 N sodyum hidroksit (NaOH), 6 ul ekleyin.
- Buzdolabından kollajen I sıçan kuyruğu çözümü edinin ve standart laboratuar teknikleri ve protokolleri 29 kullanılarak biyo-kaput taşıyın. Kollajen hala soğuk olduğundan emin olun. Aynı mikro santrifüj tüpüne kollajen 168.3 ul pipetle.
- Daha sonra, aynı mikro santrifüj tüpüne bir pipet kullanılarak, sarı-yeşil floresan karboksilat ile modifiye edilmiş mikro-18 ul ekle. Vortex 30 sn tüm çözümleri ile mikro santrifüj tüpü.
- Mikro santrifüj tüpüne istenilen hücre medya-hücre karışımı (yaklaşık 2 x 10 6 hücre / ml konsantrasyonu) 77.7 ul ekleyin ve 20 saniye süreyle pipet kullanarak karıştırın. Gerektiğinde, flüoresan boncuklar ve hücre canlılığı tablo (Tablo 1) ilave için uyarlanmış özel kolajen karışım, aşağıdaki matris yoğunluğunu değiştirmek.
- Pipet 300 & #181; de merkezi haline kollajen hücre karışımı l hazırlanan kalıp düzeneğinin (iyi # 2). Tek kullanımlık bir Petri kabı üzerine kalıp yerleştirilir ve% 5 CO2 ile 37 ° C 'de 20 dakika boyunca standart bir inkübatör içine hareket eder.
- Inkübatör sistemi çıkarın ve biyo-kaputun içine geri koyun. Forseps kullanarak, her lamel tepesine sıkma ve uzak kalıp yukarı çekerek ve hem hidrofobik kapak fişleri çıkarın.
- Kollajen kalıp taraf düzlemsel difüzyon degrade sağlamak için düz hala emin olmak için istenen mikroskopi ve görüntü için tüm sistemin taşıyın.
- 100 ul tek kanallı pipet kullanarak mikroskop altında hala sistemi ile, iyi 1. içine hücre medya 100 ul ekleyin. Sonra, 100 ul tek kanallı pipet kullanarak iyi 3. içine istenilen kemoatraktan konsantrasyonuna sahip hücre medya 100 ul ekleyin.
- Hemen her iki kuyulara çözümler ekledikten sonra, görüntüleme başlar.
4. Görüntüleme ve DifüzyonModelleme
- Belirli bir konsantrasyon hesaplamak için belirli kollajen yoğunluğu için difüzyon katsayısı bulmak istiyorsa, aşağıdaki protokolü uygulayın:
- Yerine istenen kemoatraktan konsantrasyonuna sahip hücre ortamını oluşturma ", Kolajen Karışımı ve 3D Matrix" Yukarıdaki başlıktaki verilen protokol takip standart hesaplamalar ve protokolleri 30 ile 15 ml tüp içinde 5 mcM rodamin olun.
- Görüntü konfokal sistemi ile 3D kollajen matrisleri floresan yakalamak için argon lazer (488 nm) kullanılarak ters mikroskop üzerine monte edilmiş. Resim kadar 7 saat boyunca her 2 ya da 3 sn.
- Difüzyon Modelleme için: Aşağıda gösterilen matematiksel model kullanarak, bu genel adımlarla işleme ve analiz için bir hesaplama yazılım kodu yazmak.
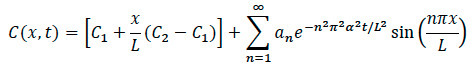
- Maksimum niyet etme yoluyla yeniden ölçekleme ve normalleştirme için hesaplamalı yazılımı içine İthalat görüntüversitesi. Kenar seçmek için görüntünün gri renk haritasına görüntüleri dönüştürün. Merkezin sağında ve merkezin solunda, görüntünün ortasında boyunca ekseni seçin.
- Hesaplamalı yazılım kodu kullanarak, gerçek yoğunluk ve ikisi arasındaki fark ile birlikte normalize yoğunluğunu arsa.
- Fitingin (yoğunluk, süre ve uzunluğu) için gerekli Sonra, parametreleri.
- Zamana karşı normalize konsantrasyon ve verilere polinom geçme ile x-ekseni boyunca konsantrasyon profili çizilir.
- Hesaplamalı yazılım kodu kullanarak difüzyon katsayısı hesaplayın.
5. Deneysel Ölçümler
- Lütfen difüzyon denklemi referansla, aşağıda gösterildiği gibi, sistem içinde herhangi bir noktada belirli bir konsantrasyonunu bulmak için denklemi yeniden.
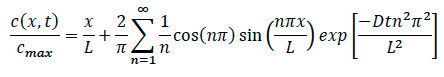
Nerede:
Th L = UzunlukE kolajen matrisi
soruşturma kapsamında, x = yeri
Difüzyon D = katsayısı
t = geçen süre - Kemotaksis deneyleri sırasında, moment kemokin sisteme eklendiğini belirli bir zaman kaydetmek için emin olun. Hücre göçü hareketi bulunduğunda, konfokal time-lapse kayıt kayıt ve görüntüleme meydana kenarından belirli bir zaman ve konumunu not sağlamak.
- Veri analizi sırasında, difüzyon ve hücre deneyleri hem kolajen içindeki herhangi bir noktada normalize spesifik konsantrasyon bulmak için denklemin içine belirli bir hücre için not geçen zaman, yer ve difüzyon katsayısı takın.
TFM kullanılması 6. Takip Cep Göç
- TFM / DVC teknikleri aşağıdaki protokolü takip kullanarak hücre göçü izlemek için:
- # 3 içine arzu edilen kemoatraktan konsantrasyonda ilave edildikten sonra, ters çevrilmiş bir MICR üzerine monte edilmiş bir konfokal sistemi ile 3D kolajen matrisleri görüntüleme başlamakOscope hücre araştırmak için bulmak için.
- Hareketli hücre bulunduğunda, görüş alanının ortasında hücreyi yerleştirin ve (z-ekseninde görüntüye) bir piezoelektrik motor, görüntü her 1 veya 2 dk kullanmaktadır.
- Hücre kuvvet oluşturma ve deformasyon hesaplamak için, TFM / DVC protokolleri 31 aşağıdaki floresan boncuk deplasmanları bulmak için bir hesaplama kodu üretmek.
Sonuçlar
doğru hücre migrasyonunu değerlendirmek için bu testin becerisi sistemin iyi bir kurulum dayanır. Bu nedenle, doğru difüzyon sistemi kalıp tasarım ve Şekil 1'de gösterildiği gibi, hidrofobik ve hidrofilik hem lamelleri yerleştirerek büyük özen emin yapmak için kritik öneme sahiptir. Sistem düzgün tasarlanmış ve çok bulmak sağlanması difüzyon modelleme aşamasında ise sistemin yayılmasını analiz etmek için, Şekil 2'de gösterildiği gibi, bir güze...
Tartışmalar
veya hücrelerin olmadan başarılı difüzyon deneyleri için en kritik adımlar şunlardır: doğru kalıp düzeneğini kurma; hidrofobik lamelleri çıkarılması sırasında zarar görmesini önlemek için gerekli el becerisi geliştirme; doğru difüzyon katsayısını hesaplamak için çok iyi bir doğrusal başlangıç çizgisine bulmak için sağlanması; kollajen ve kemoatraktan hem deneysel hesaplamalar düzeltmek; Doğru kurumaz matris sağlamak için canlı hücre görüntüleme sisteminin kullanımı;...
Açıklamalar
The authors declare that they have no competing financial interests.
Teşekkürler
The authors would like to acknowledge Drs. Jonathan Reichner and Angle Byrd for cell experiment insight. The National Science Foundation Graduate Research Fellowship Program (GRFP) supported this work.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Silicone elastomer kit | Dow Corning Corp | 182 SIL ELAST KIT .5KG | a two-part misture with a 10:1 mix |
| Live cell imaging chamber | Live Cell Instrument | CM-B18-1 | CMB for 18 mm round coverslips |
| 22 mm Glass Coverslip | Fisher Scientific | NC0180281 | Neuvitro Corp. cover slip 22 mm 1.5 |
| Machined aluminum metal cube | |||
| Hobby utility knife | X-Acto | X3201 | |
| 3-(aminopropyl) trimethoxysilane | Sigma-Aldrich | 281778-5ML | |
| Glutaraldehyde | Polysciences, Inc | 00216A-10 | Glutaraldehyde, EM Grade, 8% |
| 50 ml tube | Fisher Scientific | 14-432-22 | Standard floor model and tabletop centrifuges |
| Glass Petri dish | Fisher Scientific | 08-747A | Reusable Petri Dishes: Complete (60 x 15 mm) |
| Forceps | Fisher Scientific | 22-327-379 | Fine Point Forceps |
| Cover glasses | Fisher Scientific | 12-518-105A | Rectangle; 30 x 22 mm; Thickness No. 1 |
| Tridecafluoro-1,1,2,2-tetrahydrooctyl | Gelest | SIT8174.0 | |
| Acetic acid | Sigma-Aldrich | 320099 | Acetic acid ACS reagent, ≥99.7% |
| Hexane | Sigma-Aldrich | 296090 | anhydrous, 95% |
| Ethyl alcohol | Sigma-Aldrich | E7023 | 200 proof, for molecular biology |
| High-precision diamond scribing tool | Lunzer | PV-081-3 | Straight extended tip scribe, .020" (.50 mm) diameter by .200" (5.0 mm) tip length |
| Vacuum grease | Dow Corning | 14-635-5C | High-Vacuum Grease |
| 15 ml tube | Fisher Scientific | 14-959-49D | 15 ml conical centrifuge tubes with hydrophobic, biologically inert surface |
| 10x phosphate buffered solution | Fisher Scientific | BP399-500 | 1.37 M Sodium Chloride, 0.027 M Potassium Chloride, and 0.119 M Phosphate Buffer |
| 1 N sodium hydroxide | Sigma-Aldrich | 38215 | Sodium hydroxide concentrate |
| Collagen I, rat tail | BD Biosciences | 354236 | Rat tail |
| Micro centrifuge tube | Fisher Scientific | 02-681-332 | Volume: 2.0 ml; O.D. x L: 13 x 40 mm; sterile; single-wrapped |
| [header] | |||
| Carboxylate-modified microspheres | Invitrogen | F-8813 | Carboxylate-modified microspheres, 0.5 µm, yellow-green fluorescent (505/515), 2% solids |
| Rhodamine | Sigma-Aldrich | 83689 | Rhodamine B for fluorescence |
Referanslar
- Adzick, N. S. The Molecular and Cellular Biology of Wound Repair. Ann Surg. 225 (2), 236 (1997).
- Reddi, A. H. Bone morphogenetic proteins: an unconventional approach to isolation of first mammalian morphogens. Cytokine Growth F. R. 8 (1), 11-20 (1997).
- Coussens, , Werb, Z, L. M., Werb, Z. Inflammation and cancer. Nature. 420 (6917), 860-867 (2002).
- Vital-Lopez, F. G., Armaou, A., Hutnik, M., Maranas, C. D. Modeling the effect of chemotaxis on glioblastoma tumor progression. AIChE J. 57 (3), 778-792 (2011).
- Hughes-Alford, S. K., Lauffenburger, D. A. Quantitative analysis of gradient sensing: towards building predictive models of chemotaxis in cancer. Curr. Opin. Cell Biol. 24 (2), 284-291 (2012).
- Friedl, P., Gilmour, D. Collective cell migration in morphogenesis, regeneration and cancer. Nat. Rev. Mol Cell Bio. 10 (7), 445-457 (2009).
- Cristini, V. Morphologic Instability and Cancer Invasion. Clin. Cancer Res. 11 (19), 6772-6779 (2005).
- Lammermann, T., et al. Rapid leukocyte migration by integrin-independent flowing and squeezing. Nature. 453 (7191), 51-55 (2008).
- Parent, C. A., Devreotes, P. N. A cell's sense of direction. Science. 284 (5415), 765-770 (1999).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. J. Exp. Med. 115, 453-466 (1962).
- Nelson, R. D., Quie, P. G., Simmons, R. L. Chemotaxis under agarose: a new and simple method for measuring chemotaxis and spontaneous migration of human polymorphonuclear leukocytes and monocytes. J. Immunol. 115 (6), 1650-1656 (1975).
- Rosoff, W. J., McAllister, R., Esrick, M. A., Goodhill, G. J., Urbach, J. S. Generating controlled molecular gradients in 3D gels. Biotechnol. Bioeng. 91 (6), 754-759 (2005).
- Wells, A., Kassis, J., Solava, J., Turner, T., Lauffenburger, D. A. Growth factor-induced cell motility in tumor invasion. Acta Oncol. 41 (2), 124-130 (2002).
- Wilkinson, P. C. Assays of leukocyte locomotion and chemotaxis. J. Immunol. Methods. 216 (1-2), 139-153 (1998).
- Bonvin, C., Overney, J., Shieh, A. C., Dixon, J. B., Swartz, M. A. A multichamber fluidic device for 3D cultures under interstitial flow with live imaging: development, characterization, and applications. Biotechnol. Bioeng. 105 (5), 982-991 (2010).
- Noo, L. J., et al. Neutrophil chemotaxis in linear and complex gradients of interleukin-8 formed in a microfabricated device. Nat. Biotechnol. 20 (8), 826-830 (2002).
- Shao, J., et al. Integrated microfluidic chip for endothelial cells culture and analysis exposed to a pulsatile and oscillatory shear stress. Lab Chip. 9 (21), 3118-3125 (2009).
- Haessler, U., Kalinin, Y., Swartz, M. A., Wu, M. An agarose-based microfluidic platform with a gradient buffer for 3D chemotaxis studies. Biomed. Microdevices. 11 (4), 827-835 (2009).
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nat. Rev. Cancer. 3 (5), 362-374 (2003).
- Sixt, M., Lammermann, T. In vitro analysis of chemotactic leukocyte migration in 3D environments. Methods Mol. Biol. 769, 149-165 (2011).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. J. Cell Biol. 75 (2 Pt 1), 606-616 (1977).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. J. Cell. Sci. 99 (Pt 4), 769-775 (1991).
- Gilbert, D. L. Macromolecular diffusion through collagen membranes. Int. J. Pharm. 47 (1-3), 79-88 (1988).
- Ramanujan, S., et al. Diffusion and convection in collagen gels: implications for transport in the tumor interstitium. Biophys. J. 83 (3), 1650-1660 (2002).
- Weadock, K., Silver, F. H., Wolff, D. Diffusivity of 125I-calmodulin through collagen membranes: effect of source concentration and membrane swelling ratio. Biomaterials. 7 (4), 263-267 (1986).
- Erikson, A., Andersen, H. N., Naess, S. N., Sikorski, P., Davies, C. d. L. Physical and chemical modifications of collagen gels: impact on diffusion. Biopolymers. 89 (2), 135-143 (2008).
- Moghe, P. V., Nelson, R. D., Tranquillo, R. T. Cytokine-stimulated chemotaxis of human neutrophils in a 3-D conjoined fibrin gel assay. J. Immunol. Methods. 180 (2), 193-211 (1995).
- Sundd, P., et al. Live cell imaging of paxillin in rolling neutrophils by dual-color quantitative dynamic footprinting. Microcirculation. 18 (5), 361-372 (2011).
- Sanders, E. R. Aseptic Laboratory Techniques: Volume Transfers with Serological Pipettes and Micropipettors. J. Vis. Exp. (63), 2754 (2012).
- Stephenson, F. H. . Calculations for Molecular Biology and Biotechnology: A Guide to Mathematics in the Laboratory 2e. , (2010).
- Bar-Kochba, E., Toyjanova, J., Andrews, E., Kim, K., Franck, C. A Fast Iterative Digital Volume Correlation Algorithm for Large Deformations. Exp. Mech. In press, (2014).
- Shenoy, V., Rosenblatt, J. Diffusion of Macromolecules in Collagen and Hyaluronic Acid, Rigid-Rod-Flexible Polymer Composite Matrixes. Macromolecules. 28 (26), 8751-8758 (1995).
- Leddy, H., Guilak, F. Site-Specific Molecular Diffusion in Articular Cartilage Measured using Fluorescence Recovery after Photobleaching. Ann. Biomed. Eng. 31 (7), 753-760 (2003).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır