Method Article
için içi boş fiber Biyoreaktörler
Bu Makalede
Özet
Kültürdeki hücrelerin işlevsel davranışı, 3 boyutlu bir kültür ortamında 16-21 benzeri in vivo olarak daha fazla kültür iyileştirilebilir. Bu el yazması, in vivo benzeri memeli doku kültürü için bir içi boş fiber biyoreaktör sisteminin kurulum ve çalışması açıklanmaktadır.
Özet
Tissue culture has been used for over 100 years to study cells and responses ex vivo. The convention of this technique is the growth of anchorage dependent cells on the 2-dimensional surface of tissue culture plastic. More recently, there is a growing body of data demonstrating more in vivo-like behaviors of cells grown in 3-dimensional culture systems. This manuscript describes in detail the set-up and operation of a hollow fiber bioreactor system for the in vivo-like culture of mammalian cells. The hollow fiber bioreactor system delivers media to the cells in a manner akin to the delivery of blood through the capillary networks in vivo. The system is designed to fit onto the shelf of a standard CO2 incubator and is simple enough to be set-up by any competent cell biologist with a good understanding of aseptic technique. The systems utility is demonstrated by culturing the hepatocarcinoma cell line HepG2/C3A for 7 days. Further to this and in line with other published reports on the functionality of cells grown in 3-dimensional culture systems the cells are shown to possess increased albumin production (an important hepatic function) when compared to standard 2-dimensional tissue culture.
Giriş
Doku kültürü, 100 yıldan 1,2 kullanılmıştır hücrelerinin büyümesi ve / veya bakımı için kurulmuş bir tekniktir. Okuyan hücreler ve yanıtların ex vivo kolaylık kadar aksi imkansız değilse son derece zorlu olur deneyler izin avantajları ulaşan olan, örneğin, genetik olarak işlenmiş hücre çizgileri üretimi ve yüksek verimli tarama deneylerinde 3 raportör hücrelerinin kullanımı. Daha yakın bir zamanda, doku kültürü, in vitro modellerin üretimi için ve rejeneratif tıpta için doku mühendisliği alanı ile yol açmıştır. Bu uygulamalar sayesinde, dinamik 3 boyutlu (3D) kültür sistemlerinde ilgi önemli ölçüde büyüdü.
(3B, kültür alt-tabaka ve / veya yön dinamik akış giriş olarak tanımlanmıştır) 3B kültür yöntemleri daha iyi elde edilmesi için önemli bir in vivo hücre ortamında mimarisini, özetlemekdaha fizyolojik gibi işlev. hastalıklı ve hasarlı dokuyu tamir amacıyla nakli hücreleri, özü büyümek, farklılaştırmak ve yeteneği hasta yararına ve ticari bir fırsat için büyük bir potansiyele sahip bir çalışma alanıdır. Örneğin, otolog yanıkların tedavisi için keratinositler (4) ve inme tedavisi için hücre bazlı terapiler için kullanım kullanımı (5). Aynı şekilde, in vitro modeller için pazar tabakalı ilaç uygulamaları, ilaç keşfi kapsar. doku kültüründe Kongre bir doku kültür şişesine 2 boyutlu (2D) yüzeyinde yapışık veya ankoraj-bağımlı hücre tiplerinin büyümesi. Şu anda bir araştırma ortamında altın standart olarak kabul ederken, doku mühendisliği uygulamaları son faiz mevcut 2B doku kültürü ortamında hücresi üretimi 6 gerekli ölçek kadar yetersiz olduğu gerçeğini vurgulamıştır.
yapışık hücre tipleri, bir scaffol içinD, kimyasal bileşimi ve mekanik özellikleri açısından daha, son kullanıma bağlı olarak farklılık gösterecek gereklidir. Bazı sistemler olarak, yüksek iç fazlı emülsiyon çiftleşmiş oluşan oldukça gözenekli bir matris içeren, iyi levha eklemeler (7) ya da bilinen 2D kültürü teknikleri minimum uyum gerektiren electrospun elyaf (8) iskeleleri kullanır. Hücreler değişen kompozisyonlar mikrotaşıyıcıları üzerine ekilmiş ve besin ve sinyal molekülleri teslim karıştırılan tanklarda yetiştirilen ve dinamik de karma bir ortamda 9 ile atık ürünleri (toplu taşıma) uzağa taşımak olabilir. Bununla birlikte, bu sistemler, in vivo benzeri çevre sınırlıdır ve daha fazla iyileştirmeler ölçek büyütme maliyetleri açısından yapılabilir. Içi boş fiber biyoreaktörler (HFBs), genellikle lif lümen yoluyla teslim gözenekli elyaf ve medyanın dışında seribaşı hücreleri ile bir modül içerisine sabit liflerden oluşan bir 3D kültür sistemi olan (1 gözden0) (Şekil 1). HFBs liflerin istenirse tanımlanan kesme yan bağlantı noktaları üzerinden sıvı akışı yoluyla hücrelere uygulanacak izin verirken, kan damarları taklit ve dinamik medya teslimat ile ilgili kayma stresleri hücreleri koruyucu bir in vivo benzeri ortam sunuyoruz. Bu yüksek hücre yoğunlukları 11 ulaşılabilen üstün kitle taşıma ile çok yönlü bir kültür sistemi oluşturur. HFB sistemi ankoraj-bağımlı hücre tiplerinin bakımı için uygundur ve kültür Langerhans 12, fare β-TC-3 insülinom hücre çizgisi 12, primer insan hepatositleri 13, insan kemik sıçan pankreatik adacıkların dahil olmak üzere hücrelerin çeşitli kullanılmıştır kemik iliği tek çekirdekli hücreleri 14, Madin Darby köpek böbrek hücreleri (MDCK), 15 ve Caco-2 hücreleri 16 birkaç isim.
Kütle transferi ve ölçek-up sistem avantajlarının yanı sıra, hücreler 3D tis yetiştirilensue kültür sistemleri deneysel ipuçlarına morfolojisi ve in vivo benzeri daha daha duyarlı olma eğilimindedir. Örneğin 2B kültür 17 yetiştirilen hücreler ile karşılaştırıldığında ticari olarak temin edilebilir polistiren iskele yetiştirilen birincil hepatositler parasetamol toksisiteye daha kübik morfoloji, artan canlılığı, sitokrom P450 enzim aktivitesinin daha fazla indüksiyon ve artan bir hassasiyet göstermektedir sıçan. Hepatokarsinoma hücre çizgisi HepG2 serum albumin üretimi 18 artırmak ve 2D kültürlenmiş hücrelerde 19 ile karşılaştırıldığında metotreksat tepki benzeri in vivo olarak daha göstermek için gösterilmiştir, aynı iskele kullanılması. Primer insan hepatositler gecikmiş dediferansiyonunu yüksek sitokrom P450 aktivitesini gösterdi ve bir perfüzyon kültür sistemi 20 test 4/5 bileşiklerin açıklık arttı. İnsan sinir kök hücre, bir ticari olarak temin edilebilir polistiren iskele kültürlenmiş türetilen nöron ve glial yüksek (aksiyon potansiyeli) ve düşük frekanslı hem sergilediNCY (yerel alan potansiyeli) hiçbir nöronal aktivitenin ise spontan aktivite 2D kültürlü hücrelerde 21 tespit edildi. Caco-2 hücreleri, artan alkalin fosfataz, γ-glutamiltransferaz ve p-glikoprotein aktivitesinin ve protein 16 F-aktin ve zona-1 okludinler daha yüksek ifadesi ile ölçülen 2B kültür kıyasla HFB olarak geliştirilmiş farklılaşma gösterdi. 3D hücre kültürü gerekçe yayın sayısı son 10 yıl içinde (8 kat artış büyüyor olmasına rağmen avantajlara rağmen, 2B doku kültürü şişesi yüzeyinden dışındaki sistemlerde hücrelerin rutin kültür hala birçok laboratuvarda uygulanan değildir. Kaynak : '3D kültür') ile probed aracı Pubmed 'Yılın tarafından Sonuçlar'.
Bu el yazması memeli hücre kültürü için bir HFB sisteminin kurulum ve çalışma koşullarını açıklar ve hepatokarsinom hücre çizgisi HepG2 / C3A kültüre onun faydasını ortaya koyar. Bu yöntemin amacı, kültür içinde hücreleriYeterince basitlik koruyan bir daha in vivo benzeri kültür sistemi 3D kültür sistemlerine yeni olanlar için uygun hale getirilmesi. Uygulamada HFBs kullanılarak arkasındaki mantık, karaciğer modelini tahmin edilebilirliği HFB ortamında 22 içinde bir hepatik sinüzoid taklit etmek için teorik olarak mümkün olmasıdır geliştirmek amacına sahip olan, burada tarif eder. Bu, diğer kültür sistemleri ile, şu anda mümkün değildir.
Protokol
1. Lifler
- döküm faz inversiyon dönüş ile lifleri (iplik) imalatı. Bu yöntem ayrıntıları 23,24 bulunabilir.
NOT: Bu çalışma için liflerin bir biyolojik olarak çözülemez özel polimer kullanılarak in-house üretilen NMP çözücü ve çözücü olmayan madde olarak H2O olarak. Diğer uygun polimerler ayrıntıları tartışma bulunabilir. Burada anlatılan sistem içinde kullanılan lifler, bir 600-700 um lümen çapı 1.05mm dış çapı vardır. lifler (ortalama ± standart sapma) gözenek çapları mikron ± 1.5 mikron 2.28 ölçme gözenekli. Bu, diğer dokuların, karaciğer sinüzoit veya damar replike elyaf lümeninde ortam besleme hücreleri ayırmak için tasarlanmıştır. Lifler aynı zamanda, Pall membran tedarikçilerden satın alınabilir.
2. Modül İmalatı
NOT: Bu çalışmada kullanılan modüller 2 yan bağlantı noktaları ile 1 mm kalınlığında borosilikat camdan yapılmış(Şekil 2A). Burada tarif edilen modüle lifler 6 oyuklu plaka iyi kabaca yarısı eşdeğerdir 4.95 cm 2 lik bir dış yüzey alanına sahiptir.
- Sigmacote (Tablo 1) iç yüzeyini kaplayan ve bir çeker ocak içinde kurumasına izin ilk kullanımdan önce Siliconize modülleri. Otoklav (121 ° C, 1 atm, 20 dakika) muamele ömrünü artırmak için.
- 75 mm uzunluğundaki lifler bir neşter kesmek kullanarak ve her bir ucu (Şekil 3A) de ~ 7 mm aşırı uzunluğu bırakarak her modül içine üç lifleri yerleştirin.
- Talep ~ bir tartım kabı içerisine silikon yapıştırıcı (Tablo 1), 0.5 mi. Fiberler, bir 3-5 mm fiş (Şekil 3B) oluşturmak için çevresinde bir silikon az miktarda almak ve modülün uçlarına doğru tutkal çalışmak için bir P200 pipet kullanın. > 3 saat boyunca kurumaya bırakın.
- Bir neşter kullanılarak cam modülü uçları (Şekil 3C) ile silikon floş kesti.
- Wrap birpolitetrafloroetilen (PTFE) az miktarda (~ 4 kat) bir tarafı liman çevresinde bant.
3. Sistem Kurulum ve Sterilizasyon
NOT: liflerle Pompa hortumu ve modüller otoklava olmayan ve% 70 etanol kullanılarak sterilize edilir. Yazarlar pompa ile pompa hortumu kullanılmak üzere kalibre öneriyoruz. Aşağıdaki prosedür, bir laminar akış başlığı içinde yapılır.
- Otoklav (bölüm 2.1 gibi) otoklav bileşenler önce set-up.
- Kurmak
- Q serisi kapağı, besleme tüpü, pompa ve pompa hortumu (Tablo 1), Şekil 4'te olduğu gibi hazne şişe ve ayar haznesi şişeye 10 mi% 70 etanol yerleştirin.
- Gevşek PTFE bantlanmış yan bağlantı noktası üzerinden bir uç kapağı yerleştirin. Modül uçları ve ücretsiz yan portu üzerinden L / S16 modülü konnektörleri uçlarını kaydırın. Şekil 2B'de olduğu gibi başlıklı bir yan bağlantı noktası yakınında modülü konektörünün L / S13 boru (Tablo 1) 'in bir 40 mm kesit iletişime Rong.
- şapkalı yan liman pompa yakın yani modülü yönlendirmek için sağlanması, pompa tüp modülü bağlayın.
- Modül konnektörleri ve L / rezervuar şişe Y-bağlacının S14 (Tablo 1) nüfuz hattı ve tutulan hattını bağlayın. Set-up Şekil 4'te şemaları benzer olduğundan emin olun.
- Sterilizasyon
- > 30 dakika boyunca unautoclaved bileşenlerini ıslah etmek üzere yeterli bir süre için 800 ul / saat (lif başına 267 ul / saat) modülü ile etanol pompa (diğer bir sterilizasyon yöntemleri kullanıldığında kez ayarlamak; 25).
- Yıkama
- İlk, sistemin dışına etanol yıkama pompasını kapatmak ve boru boşaltmak için. İlk olarak, modül adaptörü tüp pompa hortumunu ayırın. geri rezervuar şişeye, elyaf ve alıkonan çizgi dışına etanol boşaltmak için havada modülünü tutun. th boşaltmak için modülün yan liman uç kapağını çıkarınmodülünün kendisi ve süzüntü hattı e etanol. Yan liman uç kapağını tekrar takın. Pompa hortumunu ve etanol besleme hattını boşaltmak için pompa medya akışını tersine çevirir. Pompayı kapatın ve modül adaptörü pompa hortumunu takın.
- kapak etanol bir şişe sökün ve serumsuz (örneğin, EMEM, GMEM, DMEM veya RPMI gibi) hücre büyüme ortamı 10 ml ihtiva eden bir şişe ile değiştirin. 800 ul sistemi ile orta Pompa / saat alıkonan çizgisine kadar medyanın doludur. modülü yıkamak için liflerin yoluyla medyanın nüfuz zorlamak için alıkonan hattını Kelepçe. ~ 2 saat boyunca yıkanır.
4. Tohumculuk
NOT: Medya ve istenilen hücre tipi için kurulmuş olanlar olmalıdır Bu protokolde kullanılan takviyeleri. Literatürde bakın, daha fazla bilgi için Avrupa Hücre Kültürleri Koleksiyonu (ECACC) ve Amerikan Tip Kültür Koleksiyonu (ATCC). Önceki bu yöntem hücre olmalıdır için maintained istenen hücre tipi için standart prosedürlere göre yöntem. Bu iş için hepatokarsinom hücre hattı HepG2 / C3A alt klon distribütörleri önerileri (ATCC) göre muhafaza edilmiştir.
Not: aşağıda sunulan tohumlama protokolü hücresi büyümesi öncesinde hücre kültürü ortamı ile modül kültür öncesi vermektedir. daha kapsamlı bir ön kültür daha sonra gerekli ise, bu, sistemin, yıkama ortamı boşaltma büyüme ortamı ile değiştirerek ve birkaç saat modülü ile bu nüfuz ettiğinde modülü tohumlanmasından önce yapılmalıdır. sistemdeki medyayı değiştirilmesi ile ilgili ayrıntılar için bölüm 7.5.2.1 bakın.
- İstenen bir hücre tipi için standart prosedürlere uygun olarak tripsinizasyon ile tek bir hücre süspansiyonu hazırlanır. aşağıdaki gibi T75 kültür için genel bir protokol şöyledir:
Not: hücre sayısı, istenen hücre tipi için ampirik olarak tespit edilmelidir tohumlama adımda kullanmak için. Burada açıklanan biyoreaktörler 35 kat daha yüksek cel numaralı seribaşı7 günlük bir kültür 2B doku kültürü plastik kullanılan daha LS yoğunluğunun (hücre / cm2).- 10 ml fosfat tamponlu tuz (PBS), aspirat ekleyerek hücreleri yıkanır, daha sonra 3 mi% 0.05 tripsin etilendiamintetraasetik asit (EDTA) ekleyin (yeterli hücreleri kapsayacak şekilde) ve 5 dakika için 37 ° C,% 5 CO2 inkübe edilir.
- 7 mi büyüme ortamı hasat Hücreler, tripsin nötralize etmek için% 10 cenin sığır serumu (FBS) ile takviye edilmiştir. İyice karıştırın, bir hemasitometre odasına 10 ul eklemek ve hücreleri saymak.
- pelet hücreleri 5 dakika 200 x g'de santrifüjleyin.
- İstenen bir hücre tipi için gereken şekilde desteklenmiş büyüme ortamı içinde 4x10 6 / ml'de süpernatan ve tekrar süspansiyon hücreleri aspire.
- Pompayı kapatın ve 3.4.1 gibi besleme borusunu ve modül boşaltın.
- Ücretsiz bir tarafı limandan ayrılmadan, modül konnektörleri modülü çıkarın ve% 70 etanol içinde önceden sterilize edilmiş modül uç kapakları (Tablo 1) takın.
- Lifleri zarar kabarcık oluşumunu önlemek için özen ve bir 18 G iğne ile 1 ml şırınga kullanarak modüle hücre süspansiyonu (2x10 6 hücre) (4.1.4) ve ~ 500 ul aktarın.
- Bir uç kapağı kullanarak yan bağlantı noktasını Cap. 180 ° her 5 dakika ile modülün elle döndürülmesi 2-4 saat boyunca 37 ° C'de,% 5 CO2 hücreleri inkübe edin. Alternatif olarak modüller kesintili karıştırma ayarı (Tablo 1) sahip bir boru döndürücüye bağlanabilir.
- Tohumlamadan sonra,% 70 etanol içinde önceden sterilize edilmiş bir enjeksiyon ağzı (Tablo 1) üzerinde bir uç kapağı takın ve PTFE-bantlı bir yan bağlantı bu ekleyin. Diğer tarafta liman uç kapağını çıkarın ve yavaşça bir 27 G iğne ile 1 ml şırınga kullanılarak ekli enjeksiyon portu içine hava enjekte ederek hücreleri boşaltın.
- Bir uç kapağı enjeksiyon portu değiştirin. Yavaş yavaş serbest yan port ve 1 ml şırınga ile 18 G iğne kullanılarak medya ile modülü doldurun. RemoModül uç kapakları ettik ve modül konnektörlerini kullanan tüp modülü takın.
- 7.5.2.1'e detaylı prosedür izlenerek 50 ml büyüme ortamı ve takviyeleri içeren biriyle yıkama medya şişesini değiştirin. 800 ul / saatte sistemi ile büyüme ortamı Pompa.
5. Çoğalma
Not: Burada anlatılan araştırma sistemi kullanılan lifler, bir 800 ul / saat besleme hızı ile, 80 ul / saat • en nüfuz ayarlanır.
- 37 ° C'de,% 5 CO2 ayarlanmış bir nemlendirilmiş kuluçka makinesi içinde 7 güne kadar bir süre için hücrelerin büyümesini elyafların kullanımı.
NOT: Büyüme aşamasında besin ve metabolitleri İzleme çoğalması hakkında yararlı bilgiler, metabolik alımı ve medya hücre ve besin ve metabolit düzeylerinin çıkışını sağlayabilir. Örneğin, kullanımı ve laktat üretimi glikoz. Kitleri medyadan bu faktörleri ölçmek için çeşitli tedarikçilerden temin edilebilir (bkz Tablo bu çalışmada kullanılan 1). Enjeksiyon çıkışlarından süzüntü ve tutulan boru ve 27 G iğne ve şırınga ile örneklenmiş ortama ilave edilebilir ve ortam ortam haznesi şişe örnek olabilir. Bu giriş ve hem de çıkış akışları için besin ve metabolizma bilgi verir. Numune, bir laminar akış başlığı içinde yapılmalıdır. > 30 saniye süreyle limanda karşı bir etanol batırılmış mavi rulo tutarak örnekleme önce enjeksiyon portları sterilize edin.
6. Eksizyon
Not: fiberler analiz için deneyin sonunda modülü eksize edilebilir.
- Çıkarın ve HFB boşaltın.
- Cam ve silikon arasında bir neşter / mikro bıçak (Tablo 1) bıçak yerleştirin. cam silikonu kesip şekilde modülü çevirin. modülün her iki ucunda bu prosedürü yineleyin.
- bir ucundan silikon fişini kanca ve yavaşça çekin bıçak kullanarak. lifler onunla birlikte gelen emin olun.
7. Hücre Analizi
- Hücre sayıları
Not: büyüme oranları büyük ölçüde, bu süre içinde elde edilen hücre yoğunlukları üzerinden değişmez şekilde 7 günlük büyüme süresi içinde bir zaman noktası Bu hesaplamada kullanmak için uygun olan, bu çalışmada kullanılan C3A hücreleri için.- eksizyon (Bölüm 6) sonra yıkama ve 0.5 ml Tris EDTA (TE) tampon çözeltisi içeren 1.5 ml'lik bir tüp içine kesmek için PBS lifleri daldırın. Bir iki donma-çözülme döngüleri bu konu -80 ° C derin dondurucuda. PicoGreen kullanılarak DNA içeriğini ölçmek ve istenen hücre Tip 26 ile yapılan standart bir eğriye bu değer karşılaştırarak hücre sayısını belirler.
- Hücre çoğalma hızları
- İki farklı zaman noktalarında hesaplamak hesaplanan hücre numaralarını kullanarak spesifik büyüme oranı μ (Denklem 1) Ln (X1) ilk kez noktasında ve Ln (X2) hücre sayının logaritmik olduğu hücrenin doğal günlüğü saniye zaman noktasında sayısı.
μ = (Ln (X2) -ln (X1)) / zaman (saat) (1)
Bundan μ spesifik büyüme oranı nüfus iki katına kez (dT) (Denklem 2) hesaplayın.
dT = LN2 / μ (2)
- İki farklı zaman noktalarında hesaplamak hesaplanan hücre numaralarını kullanarak spesifik büyüme oranı μ (Denklem 1) Ln (X1) ilk kez noktasında ve Ln (X2) hücre sayının logaritmik olduğu hücrenin doğal günlüğü saniye zaman noktasında sayısı.
- Hücre canlılığı
- eksizyon (Bölüm 6) sonra yıkama ve 500 ul% 0.05 tripsin etilendiamintetraasetik asit (EDTA) ihtiva eden 1.5 ml bir tüp içine kesmek için PBS lifleri daldırın. 10 dakika boyunca 37 ° C'de inkübe edin.
- Karıştırın ve 10 ul tripan mavi hücre süspansiyonu 10 ul ekle. Yük 10 ul haemocytometer üzerine ve ölü (mavi) ve canlı hücrelerin sayısını.
- Görüntüleme
- eksizyon sonrası yıkama ve 24 plaka içine daha küçük boylarda içine kesmek için makas kullanmak için PBS içine lifleri batırın. (PBS içinde) 400 ul% 4 paraformaldehid ilave edin ve 20 dakika boyunca oda sıcaklığında inkübe edilir.
- ul ve kapalı 400 pipetleme PBS ile yıkayın. Tekrarlama thiTaze PBS ile s bir adım.
- yaklaşık olarak PBS içinde seyreltilmiş 400 ul 4 ', 6-diamidino-2-fenilindol (DAPI) ekleyin. 100 ng / ml ve 20 dakika boyunca oda sıcaklığında inkübe edilir. Işıktan koruyunuz.
- (7.3.2 gibi) PBS ile iki kez yıkayın ve bir kez H2O ile kuru numuneler önce veri toplamak için hemen lif ve görüntüyü kapsayacak şekilde bir floresan montaj orta ekleyin (DAPI ex / em; 359/461 nm).
- Farklı odak düzlemleri görüntüleri almak ve 'istifleme odak' yazılımı kullanmak (örneğin, aşağıda ImageJ için yığın odaklayıcı eklentisi) bir alan büyük ölçüde genişletilmiş derinliği gösteren bir kompozit görüntü yapmak. lifler düz değil gibi bu gereklidir.
- İndir ImageJ (http://imageJ.nih.gov/ij/) ve 'yığını-odaklayıcı' eklentisi (http://rsb.info.nih.gov/ij/plugins/stack-focuser.html).
- ImageJ görüntüleri yığılmış açık. Ardından 'resmi' menüsünden 'Stacks' gidin - 'Görüntüler Stack'. 'Eklentiler' menüsünden Yığın odaklayıcı 'gidin'. nxn çekirdek için bir n belirtin. 'N' ile deneme yanılma biraz 'gürültü' bir görüntü oluşturmak için gerekli olabilir. 11 ve 77 arasındaki değerler iyi çalışması için eğilimindedir.
- albümin salgı
Not: Bu bir hepatosit hücre fonksiyon testi ve hücre fonksiyonunun genel bir testtir.- Tohum hücreleri 10.667 / cm2'de 2B doku kültürü plastik üzerine (HepG2 / C3A) ve 6 gün için büyütülmüştür. Bölüm 4'te tarif ve 6 gün için büyüdükçe Tohum HFBs.
- Bu proliferasyon süresi kültür ortamı (EMEM +% 10 FBS, 1 x glutamin ve 1x penisilin / streptomisin), 24 saat için 1 x glutamin ve 1 x penisilin / streptomisin ile takviye edilmiş serumsuz bir Williams E doku kültürü ortamı plastik ve HFB için değiştirin:
- 3.4.1 belirlenen adımları izleyerek boru ve HFB modülünü boşaltın. rezervuar şişe sökün ve Williams E ortamı içeren bir şişe ile bu değiştirin. 8'de HFB ile bu pompa00 ul / saat.
- 24 saat sonra, medya numune almak. Üreticinin talimatlarına (Tablo 1) 'e göre ELISA ile salgılanmış albümin ölçmek. Standart eğri aralığında albümin konsantrasyonları getirmek için kullanılmadan önce 10 40 1 ila ortam numuneleri 1 seyreltin.
Sonuçlar
Hücre tohumlama kritik bir adımdır. 3D düzeninde lif yapışma hücrelerinin yeteneği 2B doku kültürü plastik görülenden önemli ölçüde daha azdır. Bu durum, hücre ve alt-tabaka arasındaki düşük temas süresi muhtemeldir. HFB hücreler tohumlama statik aşamalarında modülü ile düşer. Bunlar 2B kullanılan bir sürekli statik fazına oranla, zaman içinde oldukça kısadır. Hücreler bu süre içinde alt tabakaya bağlantıları yapmak zorunda. Buna ek olarak, bağlı elyafların kavisli doğasına hücreler dinlenme ve 2D kültüründe var gibi bağlantıları yapmak için herhangi düz bir yüzey yoktur. Bu lif kimyası ile bileşik olabilir iken bu çalışmada kullanılan polimer için durum böyle bilmezler kullanılabilir (veriler gösterilmemiştir). tohumlama zamanı ve hücre ekim yoğunluğunun artması daha hızlı bir r statik aşamalarında modülü ile sonbahar hücre agrega oluşumuna yol açarTek hücrelerden daha yedik ve daha fazla hücre ve alt tabaka arasındaki temas süresini azaltır. hücrelerin yüksek yoğunluğu ve bu aşama sırasında herhangi bir ortam değişimi olduğu gibi, zaman artırmak da ortam sararmasına yol açar. % 15 ~ Bölüm 4 Hücre Ekme oranlarında tarif edilen koşullar kullanılarak sürekli olarak HepG2 / C3A hücreleri (Şekil 5A) ile elde edilir. , Bu düşük fraksiyon kabul edilebilir gün iken (Şekil 5b ve 6) bir konuda iyi nüfuslu lifleri oluşturmak için yeterli hücre vardır yedi günlük çoğalma dönemini HFB varılan hücre yoğunluğu 3x10 5 / cm 2 yaklaşırken aşağıda yer almaktadır. Bu, pek çok deneyler hepatositleri kullanılarak ve kaynaşmaya eriştikten olarak kabul edilebilir uygun bir yoğunluğudur.
2B hücre kültürü (Şekil 5C) elde edilene kıyasla HFB elde çoğalma hızları daha yavaştır. Bu unve bu: Medyada hücre sayımları (3674 toplam hücrelerin% 4 izdiham 24 saat başına hücreleri, ± 20.343 hücreleri ± SEM ortalama) düşük olduğu nedeniyle sistemin dinamik akışının hücrelerin kaybı olması muhtemeldir geçirgenlik oranı 400 ml / saat kadar açıldığında artmaz (veriler gösterilmemiştir). Nedeniyle canlılığında azalma ve hücrelerin sonraki kaybı (aşağıdaki Şekil 5D ve bakınız) de olması pek mümkün değildir. Aslında, bu hücre çizgisi klonal HepG2 türetilir ve hücre çoğalmasının inhibisyonunu göstermek için yeteneğine seçilen en azından kısmen, açıklanabilir. HFB hücreler 6x daha yavaş çoğalma oranları yol açabilir 2B hücrelerinin yoğunluğu numaralı seribaşı.
Canlılık>% 90 sergileyen hücrelerle HFB boyunca yüksek kalır. giriş göre çıkış ucunda canlılığı hafif bir azalma olduğu iken, bu önemli bir (t-testi p, bulunmamıştır = 0.22).
glikoz tüketimi ve laktik asit üretimi İzleme ayarlamak için sistemde ortam besleme hızı ve medya hacmi kullanılmıştır. 800 ul / saat ve glikoz ve laktik asit düzeyleri aşağıda (sırasıyla) yukarıda tutulur ve ml'lik 50 toplam medya hacmi standart doku kültürü plastik kültüründe görülen bu kullanma.
Albümin sekresyon hepatositler tarafından gerçekleştirilen bir tuş karaciğer fonksiyonudur. Bu nakliye ve homeostasis çeşitli roller oynamaktadır serum içine salgılanır. HFB yetiştirilen hücreler tarafından albümini sekresyonu 2D yetiştirilen hücreler (Şekil 7) daha yüksektir 15 kat fazladır. Bu hücreler, HFB fonksiyonel en azından albümin salgılama durumunda bu fonksiyon HFB yükselir olarak gösterir.
jpg "/>
Şekil 1. Bir HFB in vivo benzeri ortamı. Hücreler gözenekli liflerin dış üzerine ekilir. Medya kan kılcal taklit, lif lümen yoluyla teslim edilir. (A), bir lifin uzunlamasına bölümü (ölçekli değildir). (B) Çapraz 3 lif reaktörün bölümü. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 2. HFB modülü (A). Bu çalışmada kullanılan modülün boyutları. boyutlar mevcut araştırma projesinin ihtiyaçlarına 3 lifleri uygun ve yerine getirmek için seçildi. Farklı boyutlarda üretilen ve bireysel sistemler ve lifler için uygun olabilir. (B) m bir fotoğrafEkli uç kapağı ve modül konnektörleri ile ödüle. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
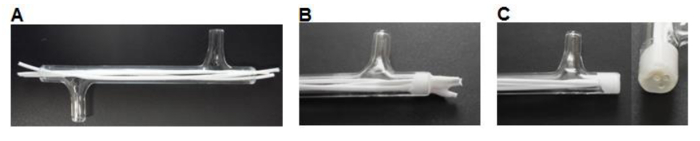
Şekil 3. modül fabrikasyon (A). Elyaf boyutta kesilir ve modül yerleştirilir. (B) Elyaf kurumasına izin modül içine yapıştırılır. (C) uçları cam ile aynı hizada kesilir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
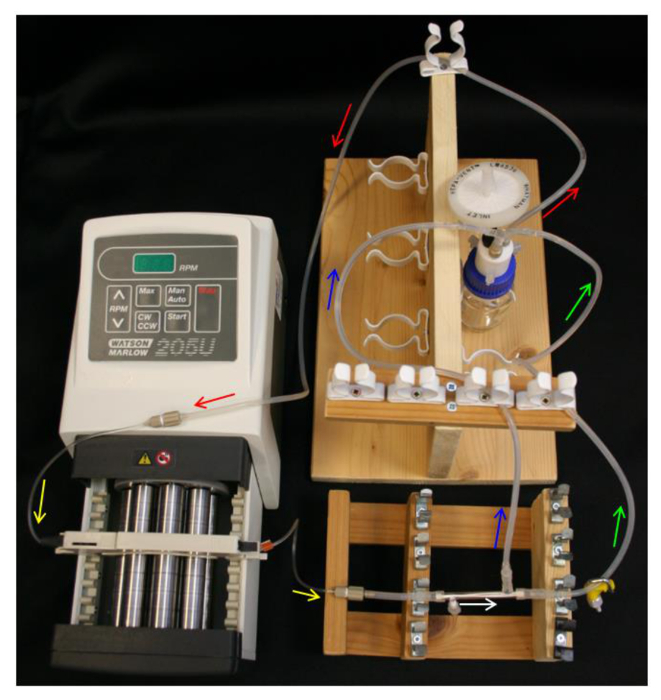
Şekil 4. HFB sistemi set-up. Oklar medya akış yönünü gösterir. Kırmızı = besleme tüpü. Sarı = pompa tuolacak. Beyaz = HFB modülü. kelepçe ile Yeşil = retentat tüp. Mavi = tüp nüfuz. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
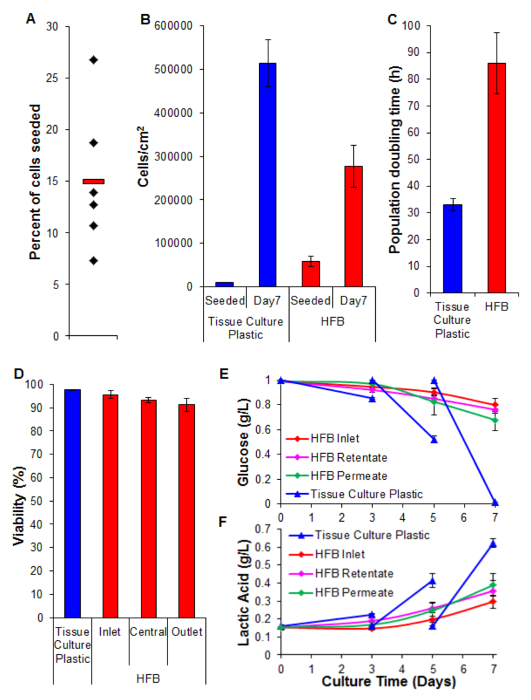
Şekil 5. Tohumculuk, çoğalması, canlılığı ve biyokimyasal analizler. Seribaşı hücrelerin (A) Yüzde. Siyah elmas bireysel HFBs temsil etmektedir. Kırmızı çubuk ortalamasıdır. (B) Hücreler tohumlama de ve 7 gün çoğalması süre sonra yoğunluklarından. 2B hücre sayıları tripsinizasyon ile bir hemositometre kullanılarak sayma belirlenmiştir. HFB hücre sayıları PicoGreen deneyi ve C3A hücreleri 26 üretilen bir standart eğri kullanılarak belirlenmiştir. n = 5-6. Barlar = SEM. (C) Nüfus kez iki katına. n = 5-7. Barlar = SEM. (D) Canlılık tryp tarafından belirlenen7 günlük çoğalma sonunda mavi dışlama. Giriş, orta ve çıkış HFB içindeki bölgeleri temsil etmektedir. n = 3-5. Barlar = SEM. (E & F) Glikoz tüketimi ve laktik asit üretimi. Seviyeleri rezervuar şişe (giriş) yanı sıra retentatında izlenir ve çıkışları nüfuz ve doku kültürü plastik rutin kültür compered edildi (medya günde 3 5 değiştirildi). n = 3-5. Barlar = SEM. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
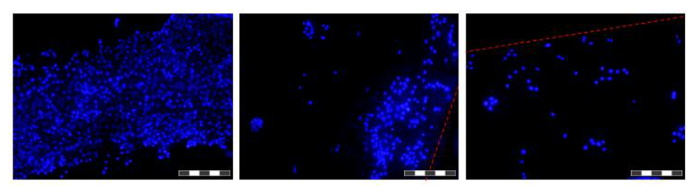
Şekil 6. Bir HFB elyaflar üzerinde yetiştirilen hücreler görüntüleri. Hücreler PBS ve DAPI ile boyanmış çekirdeklerde yıkandı,% 4 paraformaldehid içinde sabitlendi, PBS içinde yıkandı, tohumlanır ve lifler kesilmiş önce 48 saat için büyütülmüştür. Her resim 12 kompozit ima 'yığılmış odak' olduğusırayla ges resmin alan derinliğini artırmak için. daha yüksek ve daha düşük hücre yoğunluğuna sahip alanlar, bu zaman noktasında elyaf üzerinde konumlanır ve gösterilir. Nerede mevcut fiber sınırları kırmızı bir kesik çizgi ile gösterilir. Fotoğraflar bir ters flüoresan mikroskop alınmıştır. Görüntü = 10X objektif. Bar = 200 mikron. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
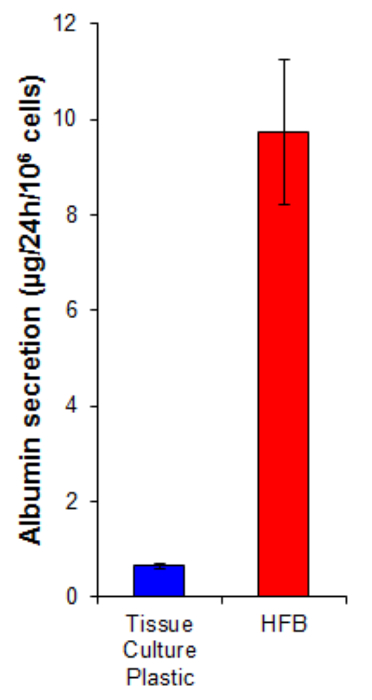
4. Hücreler, 6 gün proliferasyona uğradığını bölümünde tarif edilen şekilde Şekil 7. albümin salgılama. Hücreler 10.667 / cm2'de ve HFB doku kültürü plastik üzerine ekilmiştir. Bu çoğalma dönemini takiben doku kültürü plastik ve HFB kültür ortamı glutamin ve penisilin / streptomyci ile desteklenmiş bir serum serbest Williams E medya için değiştirildi24 saat boyunca n. Medya örnekleri alındı ve bir albümin talimatları (Tablo 1) üretmektedir göre ELISA yöntemi ile belirlendi. n = 5-6. Barlar = SEM. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
| Bölüm | Ekipman adı | şirket | Kedi. Yok hayır. | notlar | Görüntüler |
| 2 | Cam HFB Modülü | Soham Bilimsel | --- | Özel Öğe. | |
| 2.1 | Sigmacote® | Sigma-Aldrich | SL2 | ||
| 2.3 | Silicoset 151 | Intertronics | ACCSS151 | Silicbir Tutkal. | |
| 2.5 | PTFE bant | Sigma-Aldrich | Z104388 | ||
| 3.2.1 | rezervuar şişe | balıkçı | 11972619 | ||
| Q serisi kapağı | Kinesis | 00932Q-3V | PTFE adaptörleri ve uydurma somun vida dişleri. Q serisi başlığına takın. 1 mm adaptör kapsamında tedarik PTFE tüp bir 8.5 cm bölümü ve 3 mm adaptör altında 4 cm bölümü takın. |  | |
| Adaptör, Erkek, 1.0 mm ID | Kinesis | 008NB10-KD5L | |||
| Adaptör, Erkek, 3.0 mm ID | Kinesis | 008NB30-KD5L | |||
| Montaj Somun | Kinesis | U-350 | |||
| neopren boru | balıkçı | 10366344 | neopren boru 6 cm Hepa filtre takın ve 'uydurma somun' Bu ekleyin. Y konektörüdür iki diken alt ve L / S16 boru 3 cm bölümüne L / S14 boru 2x 30 mm birleştiriniz. 3 mm ID adaptörünün diken bu takın. (Bölüm 3.2.1) |  | |
| HEPA-vent | balıkçı | 11374634 | |||
| Y-konnektör, dikenli | Cole Parmer | OU-06295-10 | |||
| L / S16 Silikon tüp | Cole Parmer | OU-96410-16 | |||
| L / S14 Silikon tüp | Cole Parmer | WZ-96410-14 | |||
| L / S13 Silikon tüp | Cole Parmer | OU-96410-13 | 80 cm pompa küvet Q serisi kapağı üzerindeki 1,0 mm dikenli adaptörü bağlamak için ing = Besleme borusu. | ||
| WM 205U / CA pompa | balıkçı | 1248-6300 | |||
| WM pompa hortumu, PVC, mavi-turuncu, 0,25 mm delik | balıkçı | 12416310 | PTFE vida erkek adaptör iplik ve dişi adaptörünü bağlayın. dikenler birinin üzerine pompa hortumunu çalışın. borunun diğer ucunda bu düzenekte tekrarlayın. (Bölüm 3.2.1) |  | |
| Adaptör, Erkek, 1.0 mm ID | Kinesis | 008NB10-KD5L | |||
| Adaptör, Kadın, 1.0 mm ID | Kinesis | 008NB10-KD2L | |||
| 3.2.2 | Kadın Luer kapağı | Cole Parmer | WZ-45508-64 | Yan liman uç kapakları. | blefig4.jpg "/>  |
| L / S13 Silikon tüp | Cole Parmer | OU-96410-13 | 40 mm bölümü modülü konnektörünün pompa hortumunu bağlamak için. | ||
| L / S16 Silikon tüp | Cole Parmer | OU-96410-16 | 3x L 30 mm / S16 düşürücüler = modül konnektörlerini 3x takıldı. (Bölüm 3.2.2) | ||
| Dikenli redüktör 1/8 "x 1/16" | Cole Parmer | 30.616-43 | |||
| 3.2.4 | L / S13 Silikon tüp | Cole Parmer | OU-96410-13 | 55 cm uzunluğunda L Q serisi kapağı üzerindeki Y-bağlacının / S14 için bakiyenin bağlamak için. |  |
| L / S13 Silikon tüp | Cole Parmer | OU-96410-13 | 45 cm uzunluğunda L Q serisi kapağı üzerindeki Y-bağlacının / S14 için tatlı su bağlamak için. | ||
| Düz dikenli birlik | Cole Parmer | WZ-30612-43 | Y-konnektör L / S14 ile bağlanacak L / S13 sonuna kadar takın. | ||
| 3.4.2 | Kelepçe | VWR | 229-0609 | ||
| 4.3 | 4 mm Silikon tüp | balıkçı | FB68858 | Hortumun 40 mm bölümü üzerinde katlayın ve bir kablo bağı = Modül uç kapağı ile sabitleyin. (Bölüm 4.3) |  |
| Kablo bağı | balıkçı | 12326377 | |||
| 4.4 | MACSmix tüp rotator | Miltenyi Biotech | 130-090-753 | Bir adaptasyon ATTAC'a gerekebilirh modülleri. | |
| 4,5 | Leur enjeksiyon ağzından | dikeni Bilimsel | IB-10820 | enjeksiyon noktasına uç kapağı takın. (Bölüm 4.5) | |
| Kadın Luer kapağı | Cole Parmer | WZ-45508-64 | |||
| 5 | L-laktik asit kiti | MEGAZYME | K-GEÇ | ||
| 5 | D-glikoz kiti | MEGAZYME | K-glukozit | ||
| 6.2 | Neşter / mikro bıçak | InterFocus | 10.315-12 | ||
| 7.4.3 | albümin ELISA | Bethyl Labs | E80-129 |
Tablo HFB set-up 1. Bileşenleri. her bir bileşenin ilgili metin parçalarıyla 1 'de verilmiştir.
Tartışmalar
Bu el yazması memeli hücre kültürü için bir delikli fiber biyoreaktör (HFB) sistem set-up ve çalışmasını açıklar ve onun yarar hepatosit hücre hattı HepG2 / C3A çoğalan gösterilmiştir. Sistem standart inkübatör ve set-up rafa sığacak şekilde tasarlanmıştır aseptik teknik aşina herhangi bir yetkili hücre biyolog tarafından yürütülecek kadar kolaydır.
Burada anlatılan araştırma sistemi kullanılan lifler, bir biyo-dejenere olmayan özel polimer kullanılarak (dönme) döküm faz geçiş Spin evde üretilmektedir. Örneğin, hücre kültürü için müsait, hem biyolojik olarak parçalanabilen ve biyolojik olarak ayrışabilir olmayan malzemelerin çeşitli iplik lifleri yapmak mümkündür; polikaprolakton (PCL) 27, poli-L-laktit asit (PLLA) 28, poli (laktik-ko-glikolik asit) (PLGA) 29, polisülfon (PSU) 12 ve polietereterketon (PEEK) 13. Her biri farklı özelliklere sahip birnd sistemin ihtiyaçlarına göre seçilmelidir. sterilizasyon aşamasında kullanılan etanol ile çalışan fiber uyumluluğunu kontrol edin. PLGA etanol, antibiyotik / antimikotik solüsyon 25 gibi alternatif bir tedavi gerektiren ile plastikleştirmek bilinmektedir.
Burada kullanılan cam modüllerinin boyutları güncel araştırma ihtiyaçlarına göre seçildi. Farklı boyutlarda herhangi bir saygın bir cam üfleme şirket tarafından yapılabilir. Modül boyutunda bir göz modülünde elyaf ve olası akış hızı sayısına bağlı hücre sayısını ifade eder. daha fazla hücre yüksek akış oranları biyoreaktör çıkış ucunda olumlu kültür koşullarını korumak için olması gerekir modülünde bulunmaktadır. Bu modül permeate medya koşulların izlenmesi gerekebilir noktada ve bazı deneme yanılma olarak bir sınırı ulaşacaktır. Matematiksel modelleme gerekli modül DIMEN içine bazı anlayışlar sağlayabilirtiplerde ve akış oranları 22.
Burada kullanılan düzeneğin boyutu bir inkübatör raf üzerine uyacak şekilde tasarlanmıştır. boru uzunluğu da kurulum ve kullanım için izin vermek için parçaların kadar hareket etmeye olanak sağlar konektörler arasındaki ulaşmak için gerekli uzunluğu ile belirlenir. zamana bağlı örnekleme gerekirse, modülünde ortam koşullarının izlenmesi, örneğin daha sonra enjeksiyon noktaları retentatına eklenebilir geçirir ve bu kolaylaştırmak için hatları nüfuz.
bir hücre kültür sistemi için bir ön koşul canlı ve büyüyen bir çok durumda hücreler tutmaktır. 3D kültür sistemlerinde yetiştirilen hücrelerde fenotip benzeri vivo bir daha gösteren çalışmalar ışığında da yakından hücreler tarafından karşılaşılan in vivo ortamda taklit eden bir ortam sağlamak için önemli görünmektedir. Bu son nokta genellikle bu kültür sistemi sunan kolaylık lehine 2B hücre kültüründe ihmal edilmektedir. TO elyaf lümeni boyunca hücrelerine besin sağlayarak in vivo kılcal ağ şebekeleri olarak taklit HFB. atık ürünler, dinamik akış sistemi kaldırılır. Bu durum, bu hücrelerin kültürlenmesi için 2B doku kültürü plastik göre bu sistem, daha iyi bir seçim yapmak, hücre kültürü yakından hepatositler tarafından görülen in vivo ortamda taklit biri için bir in vivo benzeri sistemi oluşturur. Bu hücreler salgıladıkları gerçeği ile pekiştirilmiştir 15 kat 2B doku kültürü plastik yetiştirilen kıyasla HFB kültür sistemi içinde albumin miktarını önemli karaciğer fonksiyon.
HFB sistemi tümü olmasa bile çoğu ankoraj-bağımlı hücre tipleri için uygun olmakla birlikte, ilaç endüstrisi işlevsel kültür, daha fazla in vivo benzeri ilaç geliştirilmesinde kullanım için hepatositler edebilmek için gerçek bir ihtiyaç vardır, çünkü, örneğin, burada hepatositler için ve vücut dışı destek biyoyapay karaciğer cihazlardaKaraciğer yetmezliği hastalarının. daha işlevsel hücreler için ihtiyaç rejeneratif tıp alanında öteleme çalışma safhasına girer özellikle de bu örneklerden ötesine uzanır. Daha in vivo benzeri kültür ortamının avantajları göz ardı edilmemelidir.
Açıklamalar
MJE is a founder and director of Cellesce Ltd which aims to provide bioprocessing solutions for tissue engineering-based research and industry.
Teşekkürler
This work was funded by the National Centre for the Replacement, Refinement and Reduction of Animals in Research (NC3Rs) CRACK IT funding.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Glass HFB Module | Soham Scientific | --- | Custom Item. (Section 2) |
| Sigmacote | Sigma-Aldrich | SL2 | (Section 2.1) |
| Silicoset 151 | Intertronics | ACCSS151 | Silicone Glue. (Section 2.3) |
| PTFE tape | Sigma-Aldrich | Z104388 | (Section 2.5) |
| Reservoir bottle | Fisher | 11972619 | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Q-series cap | Kinesis | 00932Q-3V | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Adapter, Male, 1.0 mm ID | Kinesis | 008NB10-KD5L | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Adapter, Male, 3.0 mm ID | Kinesis | 008NB30-KD5L | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Fitting Nut | Kinesis | U-350 | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Neoprene tubing | Fisher | 10366344 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| HEPA-vent | Fisher | 11374634 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| Y-connector, barbed | Cole Parmer | OU-06295-10 | Attach the Hepa filter to 6 cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S16 Silicone tubing | Cole Parmer | OU-96410-16 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S14 Silicone tubing | Cole Parmer | WZ-96410-14 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 80 cm to connect the 1.0 mm barbed adapter on the Q-series cap to the pump tubing = Feed tube. (Section 3.2.1) |
| WM 205U/CA pump | Fisher | 1248-6300 | (Section 3.2.1) |
| WM pump tubing, PVC, blue-orange, 0.25 mm bore | Fisher | 12416310 | PTFE the screw thred of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Adapter, Male, 1.0 mm ID | Kinesis | 008NB10-KD5L | PTFE the screw thread of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Adapter, Female, 1.0 mm ID | Kinesis | 008NB10-KD2L | PTFE the screw thred of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Female Luer cap | Cole Parmer | WZ-45508-64 | Side port end caps. (Section 3.2.2) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 40 mm section to connect the pump tubing to a module connector. (Section 3.2.2) |
| L/S16 Silicone tubing | Cole Parmer | OU-96410-16 | 3x 30 mm of L/S16 fitted to 3x reducers = module connectors. (Section 3.2.2) |
| Barbed reducer 1/8"x1/16" | Cole Parmer | 30616-43 | 3x 30 mm of L/S16 fitted to 3x reducers = module connectors. (Section 3.2.2) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 55 cm section to connect the retentate to the L/S14 of the Y-connector on the Q-series cap. (Section 3.2.4) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 45 cm section to connect the permeate to the L/S14 of the Y-connector on the Q-series cap. (Section 3.2.4) |
| Straight barbed union | Cole Parmer | WZ-30612-43 | Attach to the end of the L/S13 that will connect with the L/S14 of the Y-connector. (Section 3.2.4) |
| Clamp | VWR | 229-0609 | (Section 3.4.2) |
| 4 mm Silicone tubing | Fisher | FB68858 | Fold over a 40 mm section of tubing and secure with a cable tie = Module end cap. (Section 4.3) |
| Cable tie | Fisher | 12326377 | Fold over a 40 mm section of tubing and secure with a cable tie = Module end cap. (Section 4.3) |
| MACSmix tube rotator | Miltenyi Biotech | 130-090-753 | An adaptation may be required to attach the modules. (Section 4.4) |
| Leur Injection port | Thistle Scientific | IB-10820 | Attach the end cap to the injection port. (Section 4.5) |
| Female Luer cap | Cole Parmer | WZ-45508-64 | Attach the end cap to the injection port. (Section 4.5) |
| L-lactic acid kit | Megazyme | K-LATE | (Section 5) |
| D-glucose kit | Megazyme | K-GLUC | (Section 5) |
| Scalpel / micro knife | InterFocus | 10315-12 | (Section 6.2) |
| Albumin ELISA | Bethyl Labs | E80-129 | (Section 7.4.3) |
Referanslar
- Lewis, W. H. Experimental evidence in support of the theory of outgrowth of the axis cylinder. American J Anat. 6 (1), 461-471 (1906).
- Harrison, R. G. The development of peripheral nerve fibers in altered surroundings. Wilhelm Roux Arch Entwickl Mech Org. 30 (2), 15-33 (1910).
- Ding, L., et al. A genome-scale RNAi screen for Oct4 modulators defines a role of the Paf1 complex for Embryonic Stem Cell identity. Cell Stem Cell. 4 (5), 403-415 (2009).
- Groeber, F., Holeiter, M., Hampel, M., Hinderer, S., Schenke-Layland, K. Skin tissue engineering -In vivo and in vitro applications. Adv Drug Deliv Rev. 63 (4), 352-366 (2011).
- Sinden, J. D., Vishnubhatla, I., Muir, K. W. Prospects for stem cell-derived therapy in stroke. Prog Brain Res. 201, 119-167 (2012).
- Ouyang, A., Yang, S. -. T. A two-stage perfusion fibrous bed bioreactor system for mass production of embryonic stem cells. Expert Opin Biol Ther. 8 (7), 895-909 (2008).
- Carnachan, R. J., Bokhari, M., Przyborski, S. A., Cameron, N. R. Taloring the morphology of emulsion-templated porous polymers. Soft Matter. 2 (7), 608-616 (2006).
- Deshpande, P., et al. Simplifying corneal surface regeneration using a biodegradable synthetic membrane and limbal tissue explants. Biomaterials. 34 (21), 5088-5106 (2013).
- Storm, M. P., Orchard, C. B., Bone, H. K., Chaudhuri, J. B., Welham, M. J. Three-dimensional culture systems for the expansion of pluripotent embryonic stem cells. Biotechnol Bioeng. 107 (4), 683-695 (2010).
- Wung, N., Acott, S. M., Tosh, D., Ellis, M. J. Hollow fibre membrane bioreactors for tissue engineering applications. Biotechnol Lett. 36 (12), 2357-2366 (2014).
- Ellis, M., Jarman-Smith, M., Chaudhuri, J. B., Chaudhuri, J., Al-Rubeai, Bioreactor systems for tissue engineering: A four-dimensional challenge. Bioreactors for tissue engineering; principles, design and operation. , 1-18 (2005).
- Silva, A. I., Mateus, M. Development of a polysulfone hollow fibre vascular bio-artificial pancreas device for in vitro studies. J Biotechnol. 139 (3), 236-249 (2009).
- De Bartolo, L., et al. Human hepatocyte functions in a crossed hollow fiber membrane bioreactor. Biomaterials. 30 (13), 2531-2543 (2009).
- Schmelzer, E., Finoli, A., Nettleship, I., Gerlach, J. C. Long-term three-dimensional perfusion culture of human adult bone marrow mononuclear cells in bioreactors. Biotechnol Bioeng. 112 (4), 801-810 (2015).
- Tapia, F., et al. Production of high-titer human influenza A virus with adherent and suspension MDKC cells cultured in a single-use hollow fiber bioreactor. Vaccine. 32 (8), 1003-1011 (2014).
- Deng, X., Zhang, G., Shen, C., Yin, J., Meng, Q. Hollow fiber culture accelerates differentiation of Caco-2 cells. Appl Microbiol Biotechnol. 97 (15), 6943-6955 (2013).
- Schutte, M., et al. Rat primary hepatocytes show enhanced performance and sensitivity to acetaminophen during three-dimensional culture on a polystyrene scaffold designed for routine use. Assay Drug Dev Technol. 9 (5), 475-486 (2011).
- Bokhari, M., Carnachan, R. J., Cameron, N. R., Przyborski, S. A. Novel cell culture device enabling three-dimensional cell growth and improved cell function. Biochem Biophys Res Commun. 354 (4), 1095-1100 (2007).
- Bokhari, M., Carnachan, R. J., Cameron, N. R., Przyborski, S. A. Culture of HepG2 liver cells on three dimensional polystyrene scaffolds enhances cell structure and function during toxicological challenge. J Anat. 211 (4), 567-576 (2007).
- Vivares, A., et al. Morphological behaviour and metabolic capacity of cryopreserved human primary hepatocytes cultivated in a perfused multiwell device. Xenobiotica. 45 (1), 29-44 (2015).
- Smith, I., et al. Human neural stem cell-derived cultures in three-dimensional substrates form spontaneously functional neuronal networks. J Tissue Eng Regen Med. , (2015).
- Davidson, A. J., Ellis, M. J., Chaudhuri, J. B. A theoretical approach to Zonation in a bioartificial liver. Biotechnol Bioeng. 109 (1), 234-243 (2012).
- Mulder, M. . The basic principles of membrane technology. 2nd ed. , (1996).
- Ellis, M. J., Chaudhuri, J. B. Poly(lactic-co-glycolic acid) hollow fibre membranes for use as a tissue engineering scaffold. Biotechnol Bioeng. 96 (1), 177-187 (2007).
- Shearer, H., Ellis, M. J., Perera, S. P., Chaudhuri, J. B. Effects of common sterilization methods on the structure and properties of poly(D,L lactic-co-glycolic acid) scaffolds. Tissue Eng. 12 (10), 2717-2727 (2006).
- Forsey, R. W., Chaudhuri, J. B. Validity of DNA analysis to determine cell numbers in tissue engineering scaffolds. Biotechnol Lett. 31 (6), 819-823 (2009).
- Williamson, M. R., Coombes, A. G. A. Gravity spinning of polycaprolactone fibres for applications in tissue engineering. Biomaterials. 25 (3), 459-465 (2004).
- El-Salmawy, A., et al. Preparation and properties of pronectin F-coated biodegradable hollow fibres. J Artif Organs. 8 (4), 245-251 (2005).
- Meneghello, G., et al. Fabrication and characterization of poly(lactic-co-glycolic acid)/polyvinyl alcohol blended hollow fibre membranes for tissue engineering applications. J Memb Sci. 344 (1-2), 55-61 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır