Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Diş Biyofilmler ekstraselüler pH rasyometrik Görüntüleme
Bu Makalede
Özet
Bir pH-duyarlı rasyometrik boya gerçek zamanlı olarak diş biyofilmlere ekstrasellüler pH izleme konfokal lazer tarama mikroskobu ve dijital görüntü analizi ile kombinasyon halinde kullanılır.
Özet
dişler üzerinde bakteri Biyofilmlererde pH diş çürüğü, yüksek dünya çapında yaygınlık bir hastalık için merkezi öneme sahiptir. Besinler ve metabolitleri diş Biyofilmlererde eşit olarak dağıtılır değildir. biyofilm organik madde ile karşı emilim ve reaksiyon karmaşık bir etkileşim çözünenlerin difüzyon yolları azaltır ve biyofilm karşısında, organik asitler içeren reaktif moleküllerin dik rampaları oluşturur. Bu floresans ömrü görüntüleme ya da pH ratiometry olarak kantitatif flüoresan mikroskopi yöntemler, diş biyofilm farklı mikroçevrelerde pH görselleştirmek için kullanılabilmektedir. pH ratiometry pH'a duyarlı boyalar, floresan emisyonunda bir pH değerine bağımlı bir değişim patlatır. iki farklı dalga boylarında emisyon oranı hesaplaması olmaksızın boya konsantrasyonu, mikroskobik görüntüleri lokal pH belirlenmesi sağlar. ile gerçek zamanlı olarak hem dikey hem de yatay pH geçişlerini takip veriyor tekniği Mikroelektronlar aksinedışarı mekanik biyofilm rahatsız. Ancak, bakım biyofilm ekstra ve hücre içi bölmeleri arasında doğru ayrım alınmalıdır. Burada, rasyometrik boya seminaphthorhodafluor-4F 5- (and-6) karboksilik asit (Cı-SNARF-4) bilinmiyor türleri, bileşimin in vivo büyümüş diş biyofilmlere ekstrasellüler pH izlemek için kullanılır. boya glukoz maruz kaldığında kadar konsantre Biyofilmlererde tüm bakteri hücrelerinin içinde olduğunu; Böylece, bir genel bakteriyel leke gibi ekstrasellüler pH bir göstergesi olarak kullanılır edilir. odaklı mikroskopik görüntü kazanılmasından sonra, bakteriyel biyokütle sadece ekstrasellüler pH değerini hesaplamak için izin dijital görüntü analiz yazılımı kullanarak tüm resimlerin kaldırılır. rasyometrik boya ile pH ratiometry 75'e um kalınlıkta ince biyofilmler hücre dışı pH çalışması için çok uygundur, ama 4.5 ila 7.0 arasında bir pH aralığı ile sınırlıdır.
Giriş
Burada açıklanan yöntem rasyometrik boya (ve-6) karboksilik asit (Cı-SNARF-4) konfokal lazer tarama mikroskobu ile kombinasyon halinde kullanım ve seminaphthorhodafluor-4F 5-, 4.5 ve 7 arasında aralık diş biyofilm hücre dışı pH değerine sağlar dijital görüntü analizi. Kullanılan floresan boya pH-duyarlı ve protonasyon durumuna bağlı olarak floresan emisyonunda bir kayma gösterir. 580 nm'de protonlanmış molekül zirveleri floresan emisyon ve 640 nm 1'de deprotone molekülün emisyonu. iki emisyon değerlerinde soğurum pikleri içeren, iki algılama pencere floresan emisyonu yoğunluklarının oranı (576-608 nm ve 629-661 nm) bu şekilde bağımsız olarak, boya konsantrasyonu, sıvı fazda pH yansıtır. ~ 6.4 bir pKa ile boya orta asidik ortamlarda pH görselleştirmek için uygundur.
Bakteriyel Biyofilmlererde PH tüm metabolik işlemler için merkezi öneme sahiptir.Diş biyofilm durumunda, hücre dışı matris içinde pH diş çürüğünün gelişimi için önemli bir virülans faktörü olduğu. Biyofilm-diş arayüzü kurşun düşük pH süreleri uzatıldı altta yatan emaye 2 deminerlizasyonunu yavaş. Nedeniyle organik asitler de dahil olmak üzere biyofilm, metabolitler, karmaşık üç boyutlu mimari, eşit biyofilm dağılmış değil. Son derece az acidogenic microenvironments yakın uzamsal yakınlık 3 bulunabilir.
On yıllardır, biyofilm dikey pH geçişlerini Mikroelektronlar 4-6 yardımıyla kaydedildi. onlar nedeniyle küçük uç boyutu iyi uzaysal çözünürlüğü sunarken, yatay geçişlerini izlemek için çok uygun değildir. Ayrıca, elektrodun ekleme mekanik biyofilm rahatsız ediyor. Nicel floresan mikroskobik teknikler, mekanik müdahale olmaksızın bir biyofilm farklı alanlarda pH değişiklikleri görselleştirme avantajı sunuyoruznce. Farklı bakış mikroskobik alanları serbestçe seçilmiş ve uzun süre 1,7-9 üzerinde tekrar tekrar görüntülenebilir. mikroskopik biyofilm görüntüleri yorumlanırken Ancak, hücre dışı alana kaynaklanan Mikrobiyal biyokütle ve floresan kaynaklanan floresan ayırt etmek önemlidir. Bakteriler aktif adenosin trifosfat 10 pahasına hücre membranından proton taşınması gibi asidik koşullar altında, bakteri hücreleri içinde, pH, hücre dışı matris içinde pH farklıdır. Düşük dışı pH demineralizasyon neden ise diş çürüğü bağlamında, hücre içi bakteri pH altında yatan mine üzerinde doğrudan bir etkisi yoktur. bakteri serbest alanlar ve bakteriler hem ihtiva mikroskobik görüntüleri pH Ortalaması hatalı sonuçlara yol açar. bakteriyel biyokütle görselleştirmek ve ekstra ve hücre içi alanlar arasında ayrım yapmak amacıyla pH duyarlı boya ile birlikte diğer lekeleri kullanımı ab getiriyorekstraselüler alan floresan kirlenme ve yanlış ölçümlere 11 riski dışında.
bu yazıda, bu nedenle, bir çift işlev rasyometrik boya kullanımını tarif eder; pH belirteci olarak ve evrensel bir bakteri leke olarak hem. boya bakteri hücrelerinde konsantre kadar olduğu gibi, konfokal mikroskopik görüntüleme kombinasyonu ve doğru bir dijital görüntü analizi prosedürü ince diş Biyofilmlererde 4.5 ila 7.0 aralığında dışı pH tayininde sağlar.
Protokol
Deney protokolü gözden geçirilmeli ve Aarhus County Etik Komitesi (M-20100032) tarafından onaylanmıştır.
Oranlı metrik Dye 1. Konfokal mikroskopik Kalibrasyon
- görüntü elde etmek için, bir kuluçka ile donatılmış bir ters konfokal mikroskop, bir 63X / 1.2 sayısal diyafram suya daldırma hedefi, bir 543 nm lazer hattı ve bir META dedektör kullanın.
- HEPES stok çözeltileri (0.1 pH birimi adımlarla pH 4,5-8,5 ayarlanmış 50 mM) tamponu hazırlayın. Floresan mikroskopi için berrak tabanlı 96 oyuklu bir plaka gözlerine, her çözeltinin 100 ul pipet.
- oranlı metrik boya C-SNARF-4 işlerken nitril eldiven giyin. dimetil sülfoksit içinde bir boya, 1 mM stok çözelti hazırlayın. de HEPES tamponu her stok çözeltisi 5 ul ekle. Mikroskop 96 oyuklu plaka koyun.
- mikroskop açın. mikroskop yazılımını açın. Aşağıdaki paneller tıklayın: Lazer → Edinme; → M EdinmeICRO; → Config'i Edinme; → Tarama Edinme; → Stage kazanır. 37 ° C inkübatör kadar ısıtın.
- "Lazer Kontrol" penceresinde 543 nm lazer ve "Açık" düğmesini tıklayarak 543 nm lazer çizgisi açın. "Mikroskop Kontrolü" penceresinde 63X / 1.2 sayısal diyafram suya daldırma hedefi seçin.
- Aynı anda 576- 608-nm (yeşil) ve 629- nm 661 (kırmızı) aralıklarla ( "Yapılandırma Kontrolü" → "ChS") içinde floresan izlemek için META dedektörü ayarlayın. lazer gücü ( "Yapılandırma Kontrolü" → "Uyarma") ayarlayın. ( "İğne Deliği" → "Tarama Kontrolü") 1,6 mikron optik dilim kalınlığı elde etmek için iğne deliği ayarlayın.
- 5 um 96-çukurlu plaka cam alt yukarıdaki her HEPES tampon çözeltisi, bir imgesi alınır. Not: odak düzlemi cam alt aşağıda yer almaktadır en kısa sürede, hiçbir floresan ışık görülebilirekranda. her üçüncü görüntüde sonra, sıfır ve arka plan çıkarma için bir görüntü almak için lazer gücünü ayarlayın.
- üç nüsha olarak kalibrasyon deneyi (1,2-1,7) gerçekleştirin.
- Tüm kırmızı ve yeşil görüntülerde ortalama floresan yoğunluğu ve standart sapması belirleyin.
- Denklemlere göre her resim için oran R ve ortalamanın standart hatası, S R hesaplayın (1) ve (2)
(1)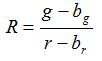
(2)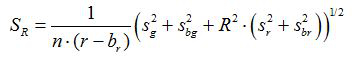
g, r, s g ve s r ilgili yeşil ve kırmızı görüntülerde ortalamaları ve standart sapmaları b. g, b, r bg ve s br arka plan görüntüleri için karşılık gelen değerler n. edilmektedir s vardır 2 görüntülü piksel sayısıdır. - (Yazılım SigmaPlot 13 kullanarak yani) bir şemada üç çoğaltmak kalibrasyon deneyleri her pH değeri için hesaplanan oranları arsa ve veri noktalarının bu dizi ile donatılmış bir eğri oluşturmak. PH değerleri 10 içine oranları dönüştürebilirsiniz donatılmış eğriden matematiksel bir fonksiyon yapın.
- Denklemlere göre her resim için oran R ve ortalamanın standart hatası, S R hesaplayın (1) ve (2)
In Situ Grown Diş Biyofilm Örneklerinin 2. Koleksiyonu
- Çalışmanın hakkında içerme ve dışlama kriterleri yerine getiren gönüllüler seçin. üst ve alt diş arkın aljinat izlenimlerini olun. Bu gösterimlerinde döküm modelleri yapmak ve alt çenedeki akrilik ateli imalatı. Gönüllü, normal oklüzyon 12 ısırık sağlayan bir lingual ortodontik tel ile bağlı bukkal akrilik flanşlı atel tasarlayın.
- Akrilik splint yanak flanş içinde Matkap çekilmeleri (Şekil 1 ) Diş akrilik frez yardımıyla biyofilm toplama için cam levhalar sokulmasını sağlamak için. durgunluk genişliği ve uzunluğu eklenir cam plaka sayısına bağlı olarak değişebilir; durgunluk derinliği, en az 1.5 mm olmalıdır.
- Biyofilm toplama, doğal emaye 11 kolonizasyon desen taklit etmek için grit 1.200 bir yüzey sertliği ile ısmarlama floresan olmayan cam plaka (4 x 4 x 1 mm 3) kullanın.
- Montaj öncesinde otoklav cam döşeme sterilize edin. Yanaklar 11 hareketi tarafından uygulanan kesme kuvvetlerinin biyofilm korumak için biraz akrilik yüzeyinin yüzeyine girintili her iki tarafında bukal flanş girintiler yapışkan balmumu cam plaka monte edin.
Not: Bir durgunluk yerleştirilen cam plaka sayısı çalışmanın amacı bağlı olarak 3 ile 14 arasında değişebilir. - Gönüllünün ağzına cihazı takın. gönüllülü- talimatteer deney süresi boyunca intra-oral cihazı korumak için. ıslak kağıt doku parçası ile ortodontik tutucu kapta Cihazı saklamak için gönüllü talimat diş fırçalama ve yiyecek ve su dışında içecek alımı sırasında, oda sıcaklığında (nemli tutmak için). yerleştirme ve cihaz sökerken cam levhalarla bukkal akrilik flanşlar dokunmayın gönüllüyü söyleyin.
Not: Deney süresi çalışma (birkaç hafta, bir gün) amaca bağlı olarak değişebilir. - Dikkatle deney süresi sonunda cihazdan cam döşeme kaldırın. Bir bıçakla plakalar etrafında yapışkan mum çıkarın ve mikroskopik analiz kadar, kapalı bir kap, yukarı bakacak biyofilm bir cımbız ile aktarabilirsiniz. ıslak kağıt dokusu ile nemli tutunuz. biyofilm toplandıktan sonra birkaç saat içinde pH görüntüleme gerçekleştirin.
3. Biyofilm pH Görüntüleme
- hazırlamakde Jong ve ark., 13 yöntemine göre toplanan tükürük ditiotreitol ekleyerek tükürük çözeltisi. pH 7.0 tükürük titre ve% 0.4 (ağırlık / hacim) bir konsantrasyonda glikoz ekleyin. biyofilm başına Pipet 100 ul mikroskopi için bir cam alt 96 oyuklu bir plakaya analiz edilmesi. oyuk başına rasyometrik boya 5 ul ekle.
- mikroskop sahnede 96 oyuklu plaka koyun. mikroskop ve 543 nm lazer çizgisi açın. 37 ° C inkübatör kadar ısıtın. boya kalibrasyonu için aynı mikroskop ayarları kullanmak (adımları 1,5-1,6 bakınız). 96 oyuklu bir plaka çalışma sıcaklığına gelene kadar, 30 dakika boyunca bekleyin.
- aşağıya bakacak biyofilmlerde ile, kuyu başına bir kütüğün cımbız ince seti ile bir veya daha fazla cam döşeme Pick up ve tükürük dolu kuyulara koyun.
- Tek görüntüleri ( "Tarama Kontrolü" → "Tek") ya da z-yığınları kazanmak ( "Tarama Kontrolü" → "Başlat") spanniFarklı alanlarda biyofilm derinliği ng. z-yığınları dilim sayısı ( "Tarama Kontrolü" → "Z Ayarlar" → "Num Dilimleri") yansıması tercih kazanmak ve ( "Tarama Kontrol birinci ve mikroskop yazılımı son dilim z-pozisyon işaretlemek için "→" Z Ayarlar "→" Mark Önce ";" Mark Son ").
Not: Z-yığınları kadar 75 mikron hücre içi ve hücre alanlar arasında iyi kontrast elde edilebilir bir derinliğe sahip. - ( "Scan Control" → "mikroskop yazılımı (" Sahne ve Odak Kontrol "→" Mark Pos ") olarak xy-pozisyonunu işaretleyin, zamanla bir görüş mikroskobik alanda pH değişimleri takip ve ardışık zaman noktalarında tekrarlanan görüntüleri çekmek için Tek"). Düzenli arka plan çıkarma için sıfıra ayarlanmış lazer gücü ile görüntü alabilir.
4. Dijital Görüntü Analizi
- export TIF dosyaları olarak mikroskobik görüntüleri, mikroskop yazılımı ( "Makro" → "Dosya Toplu İhracat") dosya toplu ihracat kullanın. ( "Başlat Toplu İhracat") dosyaları ihraç edilecek işaretleyin ve TIF dosyaları gibi ayrı klasörlerde kırmızı ve yeşil kanal görüntüleri kaydetmek. Onlara ardışık sayılar vererek, her iki klasörlerdeki dosyaları yeniden adlandırın.
- Böyle Daime (mikrobiyal ekoloji dijital görüntü analizi) 14 olarak yazılım içine kırmızı ve yeşil görüntü serilerini alın. Segment tek tek seçilen parlaklık eşikleri (Segment → Otomatik segmentasyon → Özel eşiği) ile yeşil kanal görüntüler. tüm bakteriler (ekstraselüler matriks daha parlak), ancak matris segmentasyonu sırasında nesneler olarak kabul edilecek, böylece bakım (tipik olarak 20 ile 80 arasında) ile parlaklık eşik seçin. nesneler olarak tanınan alanlar bakteriyel biyokütle iyi uygun görsel doğrulayın.
- Parçalara g nesne katmanını aktarınİlgili kırmızı kanal görüntüleri reen kanal görüntüleri (Segment → Transferi nesne katmanı). kırmızı ve yeşil kanal görüntüleri tüm nesneleri reddetmek ve silmek için nesne editörü işlevini kullanın. Artık sadece hücre dışı matriks biyofilm görüntüleri bırakılır. TIF dosyalarını olarak işlenen görüntü serisi ihracat.
- (; V.1.47 http://rsb.info.nih.gov/ij) ImageJ içine resim serisi alın. (Histogram → Analiz) lazer ile çekilen arka plan görüntüleri ortalama floresan yoğunluğu kapalı belirleyin. (Matematik → Çıkart → Süreci) uygun kırmızı ve yeşil görüntüleri arka plan çıkarın.
- Yine ImageJ, kendisi (Süreç → Görüntü hesap) tarafından yeşil görüntü serisi (G1) bölün. Sonra yeşil görüntü serisi (G1) elde edilen görüntü serisi (G2) çarpın. Bu NaN Daime nesne olarak kabul edildi alanlara ait tüm pikseller atanan bir görüntü serisi (G3), verecektir. t DevamO kırmızı görüntü serisi ile aynı şekilde (R1 / R1 = R2 R2 x R1 = R3).
Not: bakteriyel biyokütlenin adım 4.3 görüntülerden çıkarılır gibi floresan yoğunluğu bu alanlarda 0'dır. Adım 4.5 adımda 4.6 oranı hesaplamasına olanak sağlar NaN, değeri 0 dönüştürmek için gereklidir. - Dedektör gürültü telafi etmek için:; 'Mean' filtre (1 piksel yarıçapı Mean → Süreci → Filtreler) uygulayın. Kırmızı resim serisi (Süreç → Görüntü hesap) tarafından yeşil görüntü serisi bölün. Bu görüntülerin hücre dışı boşlukta kalan her piksel için kırmızı / yeşil oranı ile sonuçlanır. Görüntülerde oranları grafik gösterimi (Görüntü → Arama Tabloları) için sahte renklendirme kullanın. Her resim için ortalama oranını hesaplayın (Histogram → Analiz).
- 1.9.2 altında takılan işleve) göre pH değerlerine yeşil / kırmızı oranları dönüştürün. Not: Kalibrasyon verileri ve Oturtulan eğrinin bir örnek Schlafer et görülebilirdiğerleri, 2015 11.
Sonuçlar
Bu çözümler izleme ekstrasellüler pH gerçek zamanlı olarak 4.5 ile 7 pH aralığı diş biyofilm farklı mikroçevrelerde damla sağlar. Yukarıda açıklandığı gibi deneysel koşullar seçilirse, pH kısa bir süre glukoza maruz kaldıktan sonra biyofilm tüm alanlarında düşmeye başlar.
Bir biyofilm pH düştüğünde rasyometrik boya hücreleri (Şekil 2A) 'de upconcentrated olarak, bakteri ...
Tartışmalar
Elektrod veya mikroelektrot ölçümler 4-6 ile karşılaştırıldığında biyofilm pH mikroskopik gözlem, birçok avantaj sağlar. Mikroskopik teknikler yüksek uzaysal çözünürlüğü ile pH'ı belirlemek ve mekanik biyofilm bozmadan Biyofilmlererde yatay hem de dikey pH gradyanları yakalama izin izin verir. Mikroskobik pH monitorizasyonu Önceki girişimler, ancak, biyofilm 1,7,9 hücre dışı ve hücre içi pH ayırt başarısız oldu. Bakteriyel homeostaza, hücre içi pH dışı p...
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
Yazarlar verimli tartışmalar için Javier E. Garcia ve teknik yardım için Lene Grönkjaer ve Merete K. Raarup teşekkür etmek istiyorum. Bu çalışma Aarhus Üniversitesi Araştırma Vakfı tarafından finanse edildi ve Simon Vakfı Spies.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Zeiss LSM 510 META | Zeiss | N/A | |
| C-Apochromat 63X water immersion objective | Zeiss | N/A | |
| XL Incubator | PeCON | N/A | |
| SNARF-4F 5-(and-6)-Carboxylic Acid | Life Technologies | S23920 | |
| Dimethyl sulfoxide | Life Technologies | D12345 | |
| HEPES | Life Technologies | 11344-041 | |
| Costar 96-well black clear-bottom plate | Fisher Scientific | 07-200-567 | |
| Custom-made glass slabs (4 x 4 x 1 mm3; 1,200 grit) | Menzel | N/A | |
| Alginate impression material | GC Corporation | N/A | |
| Acrylic Adjusting Logic Sets/set of acrylic dental burs | Axis Dental | LS-906 | |
| Orthodontic retainer containers | Spark Medical Equipment Co., Ltd | SK-WDTC01 | |
| Sticky wax | Dentsply | N/A | |
| Chewing paraffin wax | Ivoclar Vivadent AG | N/A | |
| Dithiothreitol | Sigma Aldrich | D0632 | Used during preparation of salivary solution |
| 0.45 µm and 0.2 µm syringe filters | Sigma Aldrich | CLS431220; CLS431219 | |
| daime | University of Vienna, Austria | http://dome.csb.univie.ac.at/daime | |
| ImageJ | NIH, Bethesda, Maryland, USA | http://imagej.nih.gov/ij/ |
Referanslar
- Hunter, R. C., Beveridge, T. J. Application of a pH-sensitive fluoroprobe (C-SNARF-4) for pH microenvironment analysis in Pseudomonas aeruginosa biofilms. Appl. Environ. Microbiol. 71 (5), 2501-2510 (2005).
- Takahashi, N., Nyvad, B. Caries ecology revisited: microbial dynamics and the caries process. Caries Res. 42 (6), 409-418 (2008).
- Schlafer, S., et al. pH landscapes in a novel five-species model of early dental biofilm. PLoS. One. 6 (9), e25299 (2011).
- von Ohle, O. C., et al. Real-time microsensor measurement of local metabolic activities in ex vivo dental biofilms exposed to sucrose and treated with chlorhexidine. Appl. Environ. Microbiol. 76 (7), 2326-2334 (2010).
- Revsbech, N. P. Analysis of microbial communities with electrochemical microsensors and microscale biosensors. Methods Enzymol. 397, 147-166 (2005).
- Vanhoudt, P., Lewandowski, Z., Little, B. Iridium oxide pH microelectrode. Biotechnol. Bioeng. 40 (5), 601-608 (1992).
- Franks, A. E., et al. Novel strategy for three-dimensional real-time imaging of microbial fuel cell communities: monitoring the inhibitory effects of proton accumulation within the anode biofilm. Energy & Environmental Science. 2 (1), 113-119 (2009).
- Hidalgo, G., et al. Functional tomographic fluorescence imaging of pH microenvironments in microbial biofilms by use of silica nanoparticle sensors. Appl. Environ. Microbiol. 75 (23), 7426-7435 (2009).
- Vroom, J. M., et al. Depth penetration and detection of pH gradients in biofilms by two-photon excitation microscopy. Appl. Environ. Microbiol. 65 (8), 3502-3511 (1999).
- Bender, G. R., Sutton, S. V., Marquis, R. E. Acid tolerance, proton permeabilities, and membrane ATPases of oral streptococci. Infect. Immun. 53 (2), 331-338 (1986).
- Schlafer, S., et al. Ratiometric imaging of extracellular pH in bacterial biofilms using C-SNARF-4. Appl. Environ. Microbiol. 81 (4), 1267-1273 (2015).
- Dige, I., Nilsson, H., Kilian, M., Nyvad, B. In situ identification of streptococci and other bacteria in initial dental biofilm by confocal laser scanning microscopy and fluorescence in situ hybridization. Eur. J Oral Sci. 115 (6), 459-467 (2007).
- de Jong, M. H., van der Hoeven, J. S., van OS, J. H., Olijve, J. H. Growth of oral Streptococcus species and Actinomyces viscosus in human saliva. Appl. Environ. Microbiol. 47 (5), 901-904 (1984).
- Daims, H., Lucker, S., Wagner, M. daime, a novel image analysis program for microbial ecology and biofilm research. Environ. Microbiol. 8 (2), 200-213 (2006).
- Liu, Y. L., Nascimento, M., Burne, R. A. Progress toward understanding the contribution of alkali generation in dental biofilms to inhibition of dental caries. Int. J Oral Sci. 4 (3), 135-140 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır