Method Article
Solunum Sıvılarda equid Herpes-2 Teşhis için bir Nicel PCR Yöntemi Geliştirilmesi ve Validasyonu
Bu Makalede
Özet
Here, we present a protocol for the development and validation of a quantitative PCR method used for the detection and quantification of EHV-2 DNA in equine respiratory fluids. The EHV-2 qRT-PCR validation protocol involves a three-part procedure: development, characterization of qRT-PCR assay alone, and characterization of the whole analytical method.
Özet
The protocol describes a quantitative RT-PCR method for the detection and quantification of EHV-2 in equine respiratory fluids according to the NF U47-600 norm. After the development and first validation step, two distinct characterization steps were performed according to the AFNOR norm: (a) characterization of the qRT-PCR assay alone and (b) characterization of the whole analytical method. The validation of the whole analytical method included the portrayal of all steps between the extraction of nucleic acids and the final PCR analysis.
Validation of the whole method is very important for virus detection by qRT-PCR in order to get an accurate determination of the viral genome load. Since the extraction step is the primary source of loss of biological material, it may be considered the main source of error of quantification between one protocol and another. For this reason, the AFNOR norm NF-U-47-600 recommends including the range of plasmid dilution before the extraction step. In addition, the limits of quantification depend on the source from which the virus is extracted. Viral genome load results, which are expressed in international units (IU), are easier to use in order to compare results between different laboratories.
This new method of characterization of qRT-PCR should facilitate the harmonization of data presentation and interpretation between laboratories.
Giriş
Equid herpes virüsü 2 (EHV-2) gibi burun akıntısı, farenjit ve lenf düğümleri 1-3 potansiyel klinik olarak, solunum sendromu yer almaktadır. Bu virüs aynı zamanda at endüstrisi 2 için önemli ve olumsuz ekonomik etkileri neden olabilir atların kötü performans ile ilişkili olduğu şüphesi.
Şimdiye kadar, gama-ÇYG için altın standart (γ-ÇYG) algılama hücre kültürü yöntemi oldu. Bu prosedürün ilk rahatsızlık EHV-2 ve diğer arasında ayrım yokluğuydu y-EHV'lerin (örneğin, EHV-5). İkinci rahatsızlık 4,5 tezahür 12 28 gün arasında sürer sitopatik sürecin yavaş gelişme oldu.
valide ve normalize kantitatif gerçek zamanlı polimeraz zincir reaksiyonu Gelişimi (QRT-PCR) yöntemi hızla ÇYG-2 ve EHV- ayırt etmek, virüs tespit yardımcı olacaktır5 ve viral genomun yükü ve miktar yönüyle hastalık sayesinde arasındaki ilişkiyi incelemek için.
Polimeraz zincir reaksiyonu (PCR) Mullis 6 tarafından 1986 yılında ilk kez tarif ve biyolojik tanı (insan, çevre ve veteriner) alanlarının çoğunda yeni altın standart haline hakkındadır. özgüllük, duyarlılık ve hızı: patojenlerin genomunun bir bölümünün yükseltilmesi dayanan bu yöntem, bir çok avantaj sunar. Ayrıca, amplikon kontaminasyon riski Mah-PCR gelişiyle ve kalite güvencesi 7 beri gerilemiştir. Yine de, yeni bir altın standart yöntem olarak PCR tanınması sadece gelişmiş performans verileri değil, aynı zamanda zamanla performans bozulma olmadan tüm yöntem geliştirme ve validasyon adımları kontrol gösteri daha gerektirmiştir.
saptanması için kullanılan ilk moleküler araçlar ÇYG-2 kez c vardıİç içe PCR ile onsuming ve ilgili spesifik olmayan amplifikasyon sıralama 8 izledi. Herpes virüsleri için hedeflenen genlerin deoksiribonükleik asit (DNA) polimeraz ve DNA ambalaj 9 idi. Ancak, iç içe PCR amplikonlarının tarafından kontaminasyon riski yüksek sunuyor. O zamandan beri, geleneksel PCR testleri Daha yakın zamanlarda, gerçek zamanlı PCR özellikleri EHV-2 10 ölçümü için tarif edilmiştir. 2, 2009 gözden interlökin 10 gibi geni ya da glikoprotein B geni, amplifiye etmek için tasarlanmıştır, ancak herhangi bir veri mevcut olan ayıklama işlemi de dahil olmak üzere tüm yöntemin doğrulama ile ilgili.
Bu protokolde, geliştirme ve doğrulama işlemleri, Association Française de normalleşme göre at solunum sıvılarda EHV- 2 DNA tespiti ve ölçülmesi için bir kantitatif PCR yöntemi için (AFNOR) norm NF U47-600 3,11,12 tarif edilmiştir Fransız temsilcisi olarak hangiuluslararası normalizasyon komitesi. Bu norm NF EN ISO / CEI 17025, 2005 13 ve OIE (Dünya Hayvan Sağlığı Örgütü) 'e göre, 11,12 "hayvan sağlığı analizi yöntemiyle veteriner PCR uygulanması, geliştirilmesi ve onaylanması için Gereksinimleri ve öneriler" ayrıntıları . QRT-PCR testinin (a) geliştirme, (b) tek başına QRT-PCR testinin karakterizasyonu ve bütünün (c) karakterizasyonu: önerileri 2010 14 EHV- 2 QRT-PCR doğrulama protokolü üç bölümlü bir prosedür içerir (PCR analizine biyolojik numuneden nükleik asitlerin ekstre gelen) analitik yöntem.
Algılama (LOD) limitini ve tayin sınırı (LOQ): QRT-PCR testinin ve tüm analitik yöntem karakterizasyonu iki sınır tanımını içerir. LOD% 95 PCR Tüm cas% 95 tespit edilebilir birim hacim başına nükleik asit kopya düşük sayıyı temsil ederes. LOQ% 95 PCR dikkate belirsizlikler alınarak tespit edilebilir nükleik asit kopya düşük miktarını temsil eder.
Bu Mah-PCR yöntemi kesin algılama ve solunum sıvılarda ÇYG-2 hızlı ölçümü sağlar. Bundan başka, yöntem, diğer yeni QRT-PCR deneyleri geliştirilmesi için standart bir prosedür ve genel bir şablon temin etmek için başka laboratuarlarda uygulanabilir.
Protokol
Not: Şekil 1 'de gösterilmiştir, tüm farklı aşamalara bakınız.
Nükleik Asitlerin 1. Ekstraksiyon
Not: nükleik asitler ile hava yolu kontaminasyonu sınırlamak için bir davlumbaz altında çıkarma gerçekleştirin. reaktifler yok istenmeyen DNA ile kontamine olmasını sağlamak için, DEPC ile muamele edilmiş su ile bir ekstraksiyon negatif kontrol içerir.
- Daha önce tarif edilen bir protokol 15 ve üreticinin protokolüne uygun olarak biyolojik numuneden nükleik asitlerin ekstre.
- lizis çözeltisi (AVL tamponu) 560 ul biyolojik numunenin 140 ul ilave edin ve oda sıcaklığında 10 dakika inkübe edilir. etanol içinde 560 ul ekle. Bir silis kolonu ve santrifüj Bu çözeltiye (örnek + lizis çözeltisi + etanol) ilk 630 ul uygulanır.
- Aynı silis kolonu ve santrifüj Bu çözeltinin geri kalan 630 ul uygulanır. Daha sonra, 500 ul kolon yıkaması2 farklı yıkama tamponlar (AW1 ve AW2) evi.
- elüsyon tamponu (AVE tamponu), 50 ul nükleik asidin elüte ve oda sıcaklığına dengelenmeye. Kapağı kapatın ve 1 dakika için oda sıcaklığında inkübe edin. 1 dakika boyunca 6000 g'de santrifüjleyin.
2. Büyütme İşlemi
- Her reaksiyon için, reaksiyon karışımı 22.5 ul hazırlayın. PCR Master Mix, X | il 20 uM ileri primeri, X ul 20 uM ters primeri, 22.5 ul ulaşmak için gerektiği gibi, aşırı saf su ul 10 uM probu ve Z'nin Y'nin ul 12.5 ul ekle (x, y ve z, miktarlar elde edilir titrasyon sonra, Bölüm 3.2.3 ve 3.2.6) bkz.
- Kısım, bir 96-çukurlu plaka içindeki her bir reaksiyon için uygun olan bir reaksiyon karışımı 22.5 ul.
Not: çıkarılması için negatif kontroller dahil ve PCR için reaktif hiçbirinin istenmeyen DNA ile kontamine sağlamak. - örnek 2.5 ul ekstraksiyon negativ 2.5 ul eklee kontrolü, PCR negatif kontrolün 2.5 ul ve iyi gelen reaksiyon pozitif numune (referans suş veya plazmid) 2.5 ul. dağıtıldıktan sonra yapışkan bir levha conta ile plaka kapsamaktadır. 6000 g'de 10 saniye boyunca plaka santrifüjleyin.
- bir Real-Time PCR sisteminin plaka koyun. Tahlil düzeni için şablonu seçin ve çalışma başlatmak. 95 ° C'de 15 saniye 45 döngü, ardından 95 ° C'de 10 dakika ve 60 ° C (Tablo 1) 1 dk: PCR programı ayarını kullanın.
- Bir e-tabloya Real-Time PCR sisteminden ham veri aktarın. taban çizgisinin üstünde amplifikasyon araziler eşiğini ayarlamak ve üstel büyüme bölge içinde her bir örnek için eşik döngüsünü elde etmek. doğrusallık elde etmek için bir standart eğri olarak ayarlanmış her bir nokta standardı çizilir. Standart eğri esas Farklı numuneler için kopya sayısını hesaplayın.
Kantitatif RT-PCR 3. Gelişme
Not: Bir Mah-PCR testinin geliştirilmesi referans suşları, belirli bir titre plazmid ve farklı kontroller gerektirir ve primer ve prob titrasyon gerektirir.
- ön Testi
- Önceki önerileri 16 göre özel yazılım ile astar tasarımı ve sondalar.
- 1. bölümde anlatıldığı gibi referans suşlar ayıklayın.
- primerler nihai konsantrasyonu 900 nm ve prob nihai konsantrasyon 250 nM bölüm 2'de tarif edildiği gibi yükseltin. bölüm 2.5 de açıklandığı gibi sinyal analiz edin.
- problar olmayan (bölüm 3.1.3 tarif edildiği gibi), aynı zamanda, bir referans suşları DNA'nın amplifikasyonunu yapmak. Sanger yönteminde 17,18 ile elde edilen amplikonlar sekansı. Bir nükleotid BLAST 19 çalıştırarak dizileri analiz.
- Topraklar ve Probe Titrasyon
- Probun 250 nM son konsantrasyon ile ve farklı nihai concentr 3 farklı karışımları hazırlamakileri bir ations ve pozitif numune ve bir negatif kontrol için 3 kopya için geri primerler (50 nM / 50 nM, 300 nM / 300 nM, 900 nM / 900 nm). Her bir karışımı için, (900 nM nihai konsantrasyon elde etmek için 300 nM nihai konsantrasyon ya da 4.5 ul elde etmek için 50 nM nihai konsantrasyon elde etmek üzere 0.25 ul 1.5 ul), 20 uM ileri primer aynı uygun hacimde ve 20 uM ters primeri ekleme PCR Master mix 50 ul, gereken şekilde 10 uM probu ve ultra saf su 2.5 ul 90 ul ulaşmak için.
- 2. bölümde açıklandığı gibi büyütme işlemini gerçekleştirin.
- amplifikasyon en üst düzeyde elde etmek için en iyi koşul seçin, erken devir eşiği (Ct) ve 3 koşullar arasında en iyi tekrarlanabilirlik. En iyi konsantrasyon ve ileri ul gelen hacim x belirleyin ve ters primerleri.
- 4 numuneler için 5 farklı karışımları (pozitif numunenin 3 çoğaltır ve bir negatif kontrol) hazırlanmasıprob 5 farklı son konsantrasyonları (50 nM, 100 nM, 150 nM, 200 nM, 250 nM). Her bir karışımı için, elde etmek için 0.5 mL, (bölüm 3.2.3, daha önce belirlenen) 20 uM ileri primer ve x ul 20 uM ters primerin ul PCR ana karışımı 50 ul, 10 uM prob uygun hacmi (x ekleme 90 ul ulaşmak için gereken şekilde, 50 nM konsantrasyonu, 1 ul 250 nM konsantrasyon) ve ultra saf su elde etmek için, 150 nM bir konsantrasyon elde etmek için, 200 nM bir konsantrasyon elde etmek için 2 ul ve 2.5 ul 1.5 ul 100 nM konsantrasyon elde etmek.
- 2. bölümde açıklandığı gibi büyütme işlemini gerçekleştirin.
- amplifikasyon en üst düzeyde elde etmek için en iyi koşul seçin, erken devir eşiği (Ct) ve 5 koşullar arasında en iyi tekrarlanabilirlik. En iyi konsantrasyon ve prob için ilgili birim y ul belirleyin.
Kantitatif Rea 4. KarakterizasyonuL-zamanlı PCR (qRT-PCR)
Not: En iyi koşullar geliştirme adım ve kararlılık kullanmak sonra, PCR karakterizasyonu adımı özgüllüğünü, algılama sınırı, doğrusallık aralığı ve QRT-PCR miktarının sınırını kapsamaktadır.
- Hazırlama ve plazmitin titrasyonu
- PCR için seçilen DNA hedef genin ilgili fragmanını ihtiva eden ticari bir plazmid sipariş (Bu protokol, nükleotid EHV-2 glikoprotein B geninin 2081-2381, bakınız Tablo 1).
Sentetik DNA ile havayolu kirlenme riskini sınırlamak için geliştirme ve doğrulama prosedürünün her aşamasında ayrı bir odada davlumbaz altında plazmid seri dilüsyonları gerçekleştirmek ve seyreltilmiş DNA ile çalışmak Not:. - Yeniden askıya 50 ng / ml bir stok çözeltisi hazırlamak için ultra-saf su ile plazmid. kısaca girdap ve santrifüj plazmid stok solüsyonu.
Not: Plazmid sto gerçek konsantrasyonunu belirleyinplazmidin kopya sayısını hesaplamak için re-süspansiyon ardından ck çözeltisi. - spektrofotometre ile plazmid 1 ul ekleyin. 230 nm, 260 nm ve 280 nm'de optik yoğunluk (OD) okuyun. spektrofotometre yazılımı (OD, 260 nm) DNA konsantrasyonu okunur.
- Avogadro numarası (NA) ve aşağıdaki formül kullanılarak plazmit kopya sayısını hesaplayın:
Kopya sayısı / ul = (N A [ng plazmid / ul]) / (plazmid uzunluğu baz çiftinin x 10 9 x ortalama ağırlığı) = (6022 x 10 23 x [plazmid]) / (plazmid uzunluk x 10 9 x 660)
- PCR için seçilen DNA hedef genin ilgili fragmanını ihtiva eden ticari bir plazmid sipariş (Bu protokol, nükleotid EHV-2 glikoprotein B geninin 2081-2381, bakınız Tablo 1).
- Mah-PCR özgünlüğünün (Kapsayıcılık ve münhasırlık) Test
- PCR sisteminin dahil olma test edin. Seç ÇYG-2 pozitif DNA örnekleri, daha önce dizileme ile karakterize (pozitif statü kuruldu).
- 2. bölümde açıklandığı gibi büyütme işlemini gerçekleştirin.
- analiz etmekHer numune için, PCR verileri olarak 2.5 bölümünde tarif edilen. bölüm 4.2.1 seçilen tüm örnekler için üstel eğrinin varlığını kontrol edin ve PCR dahil olma onaylayın.
- Bu durumda hedef genetik benzerlikler patojenlerden DNA özleri kullanılarak PCR sisteminin münhasırlık (test, bu tür ÇYG-1, EHV- 4, EHV- 3, ÇYG-5 ve eşekçe herpesvirüs-5 gibi diğer equid herpes açıklandığı gibi Tablo 2), bu durumda ana bilgisayar, solunum hastalıkları ile ilgili diğer patojenlerin (in, at arterit virüsü, at influenza virüsü, Coxiella burnetii, Rhodococcus equi, Streptococcus equi equi, Streptococcus equi zooepidemicus Chlamydophila abortus ve Klebsiella pneumoniae, ) Tablo 2'ye bakınız.
- 2. bölümde açıklandığı gibi büyütme işlemini gerçekleştirin.
- Bölüm 2.5 de tarif edildiği gibi her bir örnek için, PCR verileri analiz edin. Bütün numuneler, seçilen bir üstel eğrisinin olmadığını kontrolbölüm 4.2.4 PCR münhasırlık onaylayın.
- Mah-PCR Algılama sınırı
- 6 tüp içine, aşırı saf su 90 ul koyun.
- azaltım bölgesini (Cı algılama kaybı) hedef plazmitin 6 on kat seri dilüsyonları gerçekleştirin. Aktarım ultra saf su 90 ul tüp seyreltmenin çalışma plazması 10 ul. Vortex ve santrifüj kısaca tüp. Seri seyreltme son tüp kadar adımı yineleyin 4.3.2 plazmid aldı.
- bölüm 2'de tarif edildiği gibi plazmid 6 on kat seri dilüsyonları amplifikasyon gerçekleştirin.
- Azaltma bölgesini belirleyin: a olumlu bir sinyal ve algılama olmadan ilk seyreltme sunan plazmid son seyreltme arasındaki bölgeyi (bakınız Şekil 2).
- 6 iki kat seri dilüsyonları başlatmak için, pozitif bir sinyal (bölüm 4.3.4 bakınız) verir plazmid son seyreltme seçin.
Not: 3 bağımsız tri gerçekleştirinals QRT-PCR (LOD% 95 PCR) tespit limitini belirlemek için - 6 tüp içine, aşırı saf su 25 ul koyun.
- plazmid 6, iki kat seri dilüsyonları gerçekleştirin. Aktarım ultra saf su 25 ul tüp, bölüm 4.3.5 belirlenen plazmid çalışma seyreltisi 25 ul. Vortex ve santrifüj kısaca tüp. Seri seyreltme son tüp kadar adımı yineleyin 4.3.7 plazmid aldı.
- bölümünde açıklandığı gibi 2. Tekrar 6 on misli her 8 tekrardan (24 kopya) ile 3 deneme elde edilmesi için, iki kez 4.3.8 etmek 4.3.7 adımları plazmid 6, iki kat seri seyreltiler amplifikasyonunu yapmak plazmidin seri seyreltileri.
Not: QRT-PCR tespiti (LOD% 95 PCR) sınır vakaların% 95'inde tespit edildiği hacim biriminde düşük DNA kopyası sayısı olarak tanımlanır. - plazmid konsantrasyonları her düzeyi için 24 çoğaltır dışında olumlu çoğaltır sayısını hesaplayınyon.
- LOD% 95 PCR belirleyin. LOD% 95 PCR 24 çoğaltır arasından 23 olumlu çoğaltır tespiti sonuçlanır seviyesidir.
- Doğrusallık aralığı ve QRT-PCR Nicelik sınırı
Not: aralığında kullanılan en düşük konsantrasyon, PCR 4.3.10 önceden belirlenmiş LOD% 95 aynı olup olmadığını kontrol plazmidi 6 on kat seri seyreltmeleri ile 4 bağımsız denemeler gerçekleştirin.- 6 tüplerde ultra saf su 45 ul koyun.
- 10 7 LOD% 95 PCR'ye gelen plazmid çalışma seyreltisi konsantrasyonu 6 on kat seri dilüsyonları başlatın.
- plazmid 6 on kat seri dilüsyonları gerçekleştirin. Aktarım ultra saf su 45 ul tüp plazmid çalışma seyreltisi (bölüm 4.4.2 belirlenen) 5 ul. Vortex ve santrifüj kısaca tüp. Seri seyreltme son tüp kadar adımı yineleyin 4.4.3 p aldılasmid.
- bölüm 2'de tarif edildiği gibi plazmid 6 on kat seri dilüsyonları yükseltin.
- Kesişim (Şekil 3) için eğimi ve b için doğrusal regresyon y = ax + b Trace.
- Standart eğrinin eğimi a gelen amplifikasyon verimliliğini (E) hesaplayın denklem kullanılarak (4.4.5 bakınız):
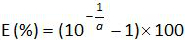 .
.
Tekrarlayın 4.4.1 üç kez 4.4.6 için yineleyin.
Not: Amplifikasyon etkinliği her döngü sonrası PCR ürünü artış miktarını temsil eder. İdeal reaksiyon% 100'e yakın verimlilik ulaşır. Uygulamada, e (%)% 75 ve% 125 arasında değişir. Yüksek E spesifik olmayan ürünler veya seri seyreltme bir pipetleme hatası amplifikasyonu gösterebilir. aynı zamanda seri seyreltme, kötü primer tasarımı ya da olmayan uygun reaksiyon koşullarında bir pipetleme hata tespit etmektedir Alt e. - (Tablo önyargı hesaplayın3). Mutlak önyargı değer kritik önyargı değeri (0.25 log 10) daha az her plazmid düzeyi için doğrulayın. Ortalama önyargı ve her plazmid düzeyinde (Tablo 3) EHV- 2 qPCR için lineer regresyon performansını değerlendirmek için (Şekil 4) için doğrusallığı belirsizlikleri (U Lini) belirleyin. U Lini hesaplanan i seviyesini plazmid her için belirlenen doğrusallık belirsizlik standart sapma (SD'i) ve gelen önyargı anlamına gelir. Formül ile verilen birleşik doğrusallığı belirsizliği (U LIN) EHV- 2 qPCR belirlenmesi:

(Genel mutlak önyargı 0.25 log 10) önyargı Kabul laboratuvar tarafından belirtilen ve en düşük değer ve (log 10 kopya sayısı ölçülen miktar) 0,5 log 10 en yüksek değeri arasındaki fark karşılık Not:. U LIN değeri farklı laboratuvarlarda qPCR performansını karşılaştırmak için yardımcı olabilir. - Mah-PCR (LOQ PCR) miktarının limitini belirleme: LOQ PCR doğrusallık aralığı (Tablo 3) için kullanılan bir önyargı 0.25 log 10 ile en düşük konsantrasyon olduğunu.
Tüm Analitik Yöntem 5. Karakterizasyonu (DNA Ekstraksiyon gelen QRT-PCR Sonucu)
Not: Bütün yöntemin karakterizasyonu solunum örnekten DNA çıkartılmasından, yani Mah-PCR verilerini (elde etmek için gerekli tüm adımların doğrulama olan (hedefin amplifikasyonu ve miktarının bölümüne 1) bakınız (bakınız bölüm 2 )).
- PCR reaksiyonunda kopya sayısı ve formülü ile biyolojik numunede kopya sayısı mevcut arasındaki ilişkiyi kurmak:
 .
.
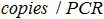 PCR reaksiyonunda plazmid kopya sayısıdır,
PCR reaksiyonunda plazmid kopya sayısıdır, 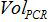 PCR'ye ilave örneğin hacmi amplifikasyonu için karışımı olan
PCR'ye ilave örneğin hacmi amplifikasyonu için karışımı olan 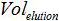 Tampon AVE hacmi nükleik asitleri elüt edilmesi için kullanılmış ve
Tampon AVE hacmi nükleik asitleri elüt edilmesi için kullanılmış ve 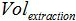 ekstre numunenin hacmidir.
ekstre numunenin hacmidir. - Tüm Analitik Yöntem duyarlılık ve özgüllük test
Not: Yalnızca bilinen EHV- 2 pozitif (veya negatif) örnekleri bu bölümde kullanılmaktadır.- hedef (ÇYG-2) için pozitif numunelerin analiz ederek QRT-PCR yönteminin "hassasiyetini" test edin.
- Seç ÇYG-2 pozitif DNA örnekleri, daha önce karakterize (pozitif statü).
- bölüm 2'de tarif edildiği gibi bir amplifikasyon prosedürü uygulayın Bölüm 1'de tarif edildiği gibi bir nükleik asit özütü.
- Gerçek pozitiflerin sayısını (pozitif örnekler belirleyinBu RT-PCR) ve yanlış negatif sayısının (bilinen bu RT-PCR ile negatif pozitif örnekler) ile pozitif olan.
- negatif örnekleri analiz ederek QRT-PCR yönteminin "özgüllük" test
- Seç ÇYG-2 negatif DNA örnekleri (negatif statü).
- bölüm 2'de tarif edildiği gibi bir amplifikasyon prosedürü uygulayın Bölüm 1'de tarif edildiği gibi bir nükleik asit özütü.
- Gerçek negatifleri (bu RT-PCR ile negatif olduğu bilinen olumsuz örnekler) ve yanlış pozitif (bu RT-PCR ile pozitif bilinen olumsuz örnekleri) sayısının sayısını belirler.
- Aşağıdaki gibi "tanısal duyarlılığı" (Se) ve "teşhis özgüllük" Bütün yöntemi (Sp) (Tablo 4) hesaplayın: Se = ve gerçek Sp = sayısının gerçek pozitiflerin sayısı / (gerçek pozitifler + yanlış negatifler sayısı) gerçek negatif negatifleri / (sayıs + yanlış pozitifler) () Tablo 4 bakın.
- Greiner ve Gardner ilişkisi 12,20 formülü ile tüm yöntemin duyarlılığı ve özgünlüğü için% 95 güven aralığı hesaplayın:
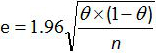
E tahmini hata olduğu, θ Se (veya Sp) ve n analiz örneklerinin sayısıdır.
Not: numunelerin az sayıda için, bütün yöntemin duyarlılığı ve özgünlüğü için% 95 güven aralığı hesaplamak için AFNOR normuna 12'ye göre Schwartz tabloyu kullanın.
- hedef (ÇYG-2) için pozitif numunelerin analiz ederek QRT-PCR yönteminin "hassasiyetini" test edin.
- Tüm Analitik Yöntem Karakterizasyonu için negatif Kaynak Malzemenin Hazırlanması
DİKKAT: Bütün yöntemle (LOD Yöntemi ve LOQ Yöntemi) saptanması ve miktarının sınırlarını belirlemek ari olduğu bilinen biyolojik örneklere plazmid bilinen konsantrasyonlarını eklemek içinhedef (EHV-2 bu durumda) arasında. Bu örnekler, sayısal plazmid ile birlikte, LOD Yöntemi ve LOQ Yöntem belirlemek için pozitif standartlar oluşturmaktadır.- Pozitif standartları oluşturmak için kullanılan biyolojik numunelerde hedefin olmadığını (EHV- 2) onaylayın.
- Farklı bilinen olumsuz biyolojik örnekler seçin.
- 2. bölümde açıklandığı gibi amplifikasyon prosedürü uygulayın bölüm 1'de açıklandığı gibi biyolojik örnekler ayıklayın.
- Bu örneklerde PCR sinyalinin olmaması ile hedef yokluğunu onaylamak.
Not: 5.4 ve 5.5 arasındaki tüm adımlar için aynı negatif kaynak materyali kullanın.
- Negatif kaynak materyal (komple doğrulama için gerekli olan hacim) 15 ml elde etmek için, farklı numuneler negatif havuz. 100 tüp içine bu olumsuz kaynak malzemesinin 135 ul koyun. + 4 ° C'de tüpler tutmak ya da uzun depolama için -80 ° C 'de.
- Pozitif standartları oluşturmak için kullanılan biyolojik numunelerde hedefin olmadığını (EHV- 2) onaylayın.
- LimiTüm Analitik Yöntem Tespit t
- Bütün yöntemin azaltma bölgesini belirleyin.
- 6 tüplerde ultra saf su 45 ul koyun.
- plazmid 6 on kat seri dilüsyonları gerçekleştirin. Aktarım (bölüm 4.3.10 belirlenen), aşırı saf su 45 ul tüp 10 7 LOD% 95 PCR'ye gelen plazmid çalışma seyreltisi 5 ul. Vortex ve santrifüj kısaca tüp. Seri seyreltme son tüp kadar adımı yineleyin 5.4.1.2 plazmid aldı.
- 2 elde etmek için negatif kaynak malzemesinin 135 ul 2 tüplerine plazmid her seyreltme transfer 5 ul 6 olumlu standartları çoğaltır. Vortex ve kısaca santrifüj.
- bölüm 2'de tarif edildiği gibi amplifikasyon prosedürü uygulayın Bölüm 1'de tarif edildiği gibi 6 pozitif standartlar 2 replicate çıkarma gerçekleştirin.
- azaltma bölgesini belirlemek: Geçen kons arasındaki bölgeolumlu bir sinyal ve hiçbir sinyal gösterir ilk konsantrasyon veren plazmid entration.
- Yöntem Algılama (LOD Yöntemi) sınırı 2 Bağımsız Denemeler tarafından belirlenir
Not: Bütün yöntemi (LOD Yöntemi) tespit limiti belirlemek için 2 bağımsız denemeler yapın.- 4 kat daha fazla konsantre edilir pozitif bir sinyal verdi plazmid son konsantrasyonu (bölüm 5.4.1.5 bakınız) olan plazmid çalışma seyreltisi 6, iki kat seri dilüsyonları başlatın.
- 6 tüplerde ultra saf su 25 ul koyun.
- plazmid 5, iki kat seri dilüsyonları gerçekleştirin. Aktarım ultra saf su 25 ul tüpe (bölüm 5.4.2.1 belirlenen) plazmid çalışma seyreltisi 25 ul. Vortex ve santrifüj kısaca tüp. Seri seyreltme son tüp kadar adımı yineleyin 5.4.2.3 plazmid aldı.
- plasmi her seyreltme transfer 5 ulNegatif kaynak malzemesi 135 ul 4 tüpler d 5 olumlu standartları 4 çoğaltır elde etmek. kısaca girdap ve tüpler santrifüj.
- bölüm 2'de tarif edildiği gibi amplifikasyon prosedürü uygulayın Bölüm 1'de tarif edildiği gibi 5 Pozitif standartlar, 4 kopyanın çıkarma gerçekleştirin.
- Tekrarlayın plazmid konsantrasyon her seviye için 8 çoğaltır elde etmek için bir kez 5.4.2.5 için 5.4.2.1 adımları.
- plazmid konsantrasyon her seviye için 8 tekrardan dışarı olumlu çoğaltır sayısını.
- LOD Yöntemi belirleyin. LOD Yöntemi (bölüm 5.4.2.7 de açıklandığı gibi) 8 8 çoğaltır olumlu dışında çoğaltır hangi son seviyesidir.
- Bütün yöntemin azaltma bölgesini belirleyin.
- Tüm Analitik Yöntem Niceleme doğrusallığı Aralığı ve Sınır
Tüm yöntemle (LOQ Yöntemi) miktarının sınırını belirlemek için biyolojik için plazmid bilinen konsantrasyonları ekleyin: Notbilinen örnekler hedef (EHV- 2 bu durumda) ücretsiz olarak. Bu örnekler LOQ Yöntemi belirlemek için olumlu standartları oluşturmaktadır.- 6 tüplerde ultra saf su 45 ul koyun.
- plazmid 6 on kat seri dilüsyonları gerçekleştirin. Aktarım ultra saf su 45 ul tüpe (bölüm 5.4.2.8 belirlenen) 10 7 LOD yöntemine karşılık gelen plazmid çalışma seyreltisi 5 ul. Vortex ve santrifüj kısaca tüp. Seri seyreltme son tüp kadar adımı yineleyin 5.5.2 plazmid aldı.
- Negatif biyolojik kaynak malzemesi 135 ul 2 tüplerine plazmid her seyreltme transfer 5 ul 6 pozitif standartların 2 çoğaltır elde etmek. Vortex ve kısaca santrifüj.
- bölümünde anlatıldığı gibi yükseltme prosedürü uygulayın Bölüm 1'de tarif edildiği gibi 6 pozitif standartlar 2 replicate çıkarma işlemlerini 2. Tekrar 5.5.1 adımları5.5.4 üç kez için.
- Değerlendirmek ve Yöntem Kantitatif Performans doğrulamak için bir Doğruluk Profili tanımlayın.
- laboratuvar için tüm yöntemin kabul edilebilirlik sınırlarını belirler. Bu protokolde, kabul edilebilirlik sınırları Labeo tarafından 0,75 ± olarak Log 10 tanımlanır Frank Duncombe.
- Bir çalışma, çok az bir birinci lineer regresyon kullanılarak y = ax + b (eğim ve b mesafesidir) Ct değerleri bir kopya, standart eğrinin her bir tahmini değerine karşılık gelen. bu ilk lineer regresyon, bu ilk standart eğri için kullanılan Ct değerleri çoğaltır için kopya sayısının deneysel değerini hesaplamak. Ct değerleri ikinci tekrarlı adımı yineleyin 5.5.5.2 ikinci lineer regresyon elde ve ikinci standart eğri için kullanılan Ct değerleri ikinci çoğaltır için kopya sayısının deneysel değerini hesaplamak.
- İkinci ve üçüncü denemeler ile adımı yineleyin 5.5.5.2.
- NF U47-600-2 12 göre her plazmid düzeyi için hassasiyet, doğruluk ve doğruluk sınırları hesaplayın.
- Tüm standart puan (5.5.5.4) için bilgi derlemek ve 5.5.5.1 önceden tanımlanmış kabul edilebilirlik limitleri ile bir doğruluk profili ve birlikte veri gerçekliğini oluşturmak için bir e-tablo oluşturun 5.5 hesaplanan alt ve üst sınırları doğruluk .5.4 (Şekil 5).
- LOQ Yöntem belirlenmesi: 5.5.5.5 hesaplanan doğrusallık aralığı için kullanılan bu doğruluk 0.75 log 10 standart bir eğrinin en düşük konsantrasyon karşılık gelir.
- Tekrarlanabilirlik ve uyarlık değerlendirilmesi
Not: standart sapma arasındaki oranı ve tekrarlanan ölçümlerin (varyasyon katsayısı, ya da CV = standart sapma ortalamasını kullanarak tekrarlanabilirlik ve yeniden kontrol edin /ortalama).- 1 Analisti Tüm Yöntem Tekrarlayabilme değerlendirin:
- (Daha önce, örneğin, PCR ile test) 3 farklı viral genomun yükleri 3 Biyolojik numune yapın.
- bölüm 2'de tarif edildiği gibi amplifikasyon prosedürü uygulayın Bölüm 1'de tarif edildiği gibi 3 numune 8 tekrardan ekstrakte edin.
- Ortalama ve her bir örnek için toplanan Ct değeri standart sapmasını hesaplayın.
- Formül CV = standart sapma kullanılarak test içi CV hesaplayın / anlamına gelir.
- 3 Analistler tarafından Tüm Yöntemi Tekrarlanabilirlik değerlendirin:
- (Daha önce örneğin PCR test) 3 ayrı viral genomun yükleri ile 3 biyolojik örneklerin seçin
- (Bölüm 1 'de tarif edildiği gibi) Madde 5.6.2.1'de seçilen 3 örneğin 2 tekrarı ekstrakte edin. 2 bağımsız analistler tarafından bölüm 2. tekrarlayın içinde 5.6.2.2 adımları anlatıldığı gibi amplifikasyon prosedürü uygulayın.
- ortalama ve standart sapma hesaplamakHer numune için elde Ct değeri.
- Formül CV = standart sapma kullanılarak inter-analiz CV hesaplayın / anlamına gelir.
- 1 Analisti Tüm Yöntem Tekrarlayabilme değerlendirin:
Sonuçlar
Yukarıda tarif edildiği gibi kantitatif RT-PCR yöntemi, tespit ve solunum sıvılarda equid herpesvirüs-2 ölçmek için uygulanmıştır. Şekil 1 AFNOR NF normuna göre olan bir nicel RT-PCR yöntemi geliştirilmesi ve doğrulama için bir şematik iş akışları görüntülemektedir U47-600. Öncüllerin ve problann Özelliği PCR adım adım gelişimi sırasında doğrulanmıştır. Sadece EHV-2 suş bu sistemde amplifiye edilmiştir. Daha sonra, qRT-PCR performansı, özelliği gerekiyordu.
İlk olarak, bir 6 on kat seri seyreltme azaltma bölgesi (Şekil 2) için yapıldı LOD PCR tahmin etmek. Bu örnekte, 6, on kat seri seyreltmeler LOD PCR tahmin etmek için (26.000 0.26 kopya / 2.5 ul numune arasında) 10 -5 10 -10 arasında yapıldı. azaltım bölgesi l(2.6 ve 0.26 kopya / 2.5 ul numune arasında) 10 -9 ve 10 -10 seyreltmeleri arasındaki ler. Bu durumda, LOD PCR değeri belirlemek için, plazmid 6, iki kat seri seyreltiler, bu azaltım bölgesinde 5.2 ve 0.16 kopya / 2.5 ul numune arasında yapılmıştır. LOD PCR değeri 2.6 kopya / 2.5 ul örnek oldu.
Doğrusallık aralığı ve LOQ PCR belirlemek için, LOD PCR değeri 2.6 (LOD PCR) ile 260,000 kopya / 2.5 ul numune arasında 6 on kat seri dilüsyonları aralığı başlatmak için kullanılmıştır. 3 EHV2 için doğrusal regresyon göstermektedir Şekil bir deneme Mah-PCR. Lineer regresyon (Şekil 4) performansları Tablo 3'te anlatılan hesaplamalar kullanılarak dört nüsha olarak doğrulanır. Hesaplamalar kriterlerine göre doğrusallık aralığı tanımlamak için yapılır mutlak Eğilim i value plazmid yükü ne düzeyde i, 10 günlük ≤0.25. Bu durumda, doğrusallık 2.6 ila 260.000 kopya / 2.5 ul örnek yatıyordu aralığı. LOQ PCR doğrusallık aralığında en düşük konsantrasyon (yani, 2.6 kopya / bu durumda 2.5 ul örnek). U LIN aralığında 2.6-260,000 kopya / DNA 2.5 ul 0.12 log 10 olduğu tespit edildi.
Mah-PCR (Şekil 1, sarı) gelişimi (Şekil 1, mavi) ve karakterizasyonu sonra, AFNOR NF U47-600 norm Mah-PCR (Şekil 1, turuncu) DNA ekstraksiyon gelen tüm analitik metodun karakterizasyonu önerir. (Doğruluk profili ile Tablo 4'te açıklandığı gibi tanısal duyarlılık ve özgüllük. Hesaplandı QRT-PCR bütün analitik yöntemin kantitatif performansları değerlendirilmiş ve onaylanmıştır Şekil 5).
state-of-the-art moleküler teknolojisini kullanan Bu protokol, bize algılamak ve solunum bozuklukları ve / veya enfeksiyon klinik şüphesi olan atları elde edilen 172 nazal sürüntü örneklerinde EHV- 2 viral genomun yükü ölçmek için izin verdi. EHV-2 alanı (biyolojik) örneklerden insidansı bu popülasyonda% 50 (86/172) idi. Kantitatif analizleri ÇYG-2 viral genom yükleri genç atlar anlamlı derecede yüksek bulundu ve viral genomun yüklerinin bölümlerini yeniden yaşı (Şekil 6) ile azaldığını gösterdi. Bu çalışmada, yüksek EHV-2 viral genomun yük (1.9 x 10 11 kopya / ml) taylar (Şekil 6) tespit edildi.
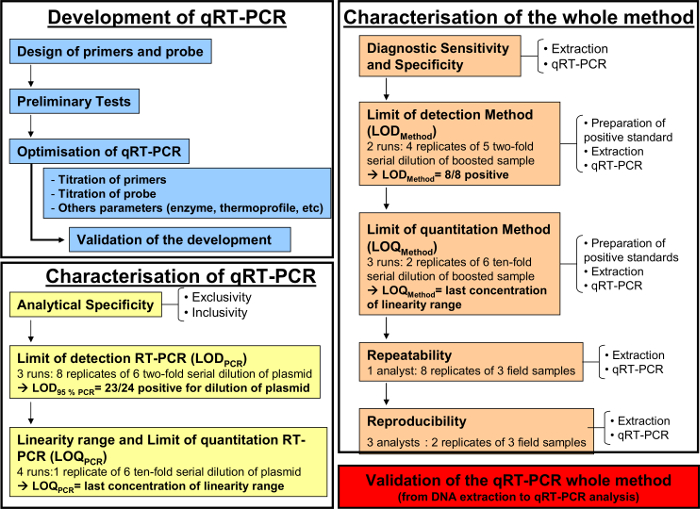
Şekil 1: geliştirme (mavi) için iş akışı şeması, nicel RT-PCR karakterizasyonuAFNOR norm NF U47-600-2 göre (sarı) ve QRT-PCR (turuncu) DNA ekstraksiyon gelen tüm analitik yöntemin karakterizasyonu. akışı grafik gelişimi için farklı adımlar devam eder, kantitatif RT karakterizasyonu -PCR ve QRT-PCR ile DNA ekstraksiyonu gelen tüm analitik yöntemin karakterizasyonu. Her adım için, iş akışı tablosu gerekli çalışan sayısını gösterir, seyreltiler gerçekleştirmek ve gerekli analistlerin sayısı edilmesi. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
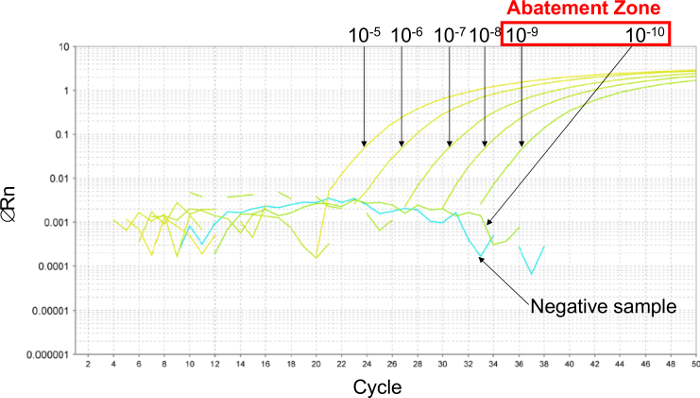
Şekil 2: Plazmid 6 on kat seri seyreltmeleri ile elde edilen gerçek-zamanlı PCR eğrilerden Örnek sonuçlar azaltma bölgesinin belirlenmesi. azaltım bölge tahmin etmek için, 6, on kat seriseyreltmeler 10 -5 arası (26.000 kopya / 2.5 ul numune) ve 10 -10 (0.26 kopya / 2.5 ul numune) yapılır. Azaltım bölgesi 10 -9 seyreltilmiş arasında (2.6 kopya / 2.5 ul numune) ve 10 -10 (0.26 kopya / 2.5 ul numune) yatıyor. Bu durumda, plazmid 6 iki kat seri seyreltme 5.2 ve 0.16 kopya / 2.5 ul örnek arasında, LOD% 95 PCR belirlemek için bu azaltma bölgesinde yapılmıştır. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
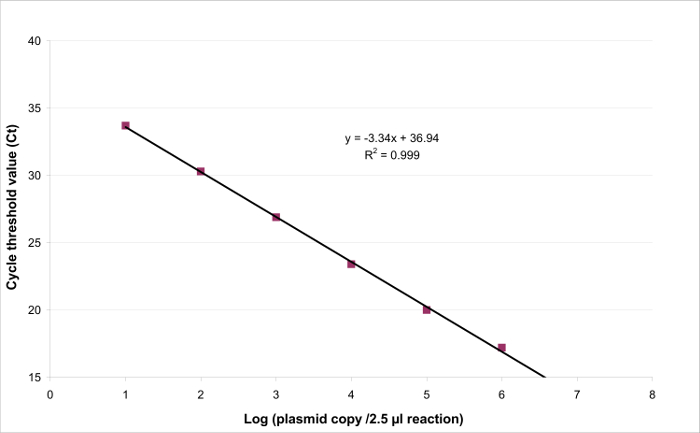
Şekil 3:. EHV2 QRT-PCR için lineer regresyon kantitatif tayini doğrusallığı belirli bir aralıkta bulunan hedef konsantrasyonu ile orantılı sonuçlar üretme yeteneğidir. Bu tarafından örnek alınabilirlineer regresyon enstrümantal yanıt (Döngü eşiği veya Ct) ve hedefin miktarının logaritma arasındaki (y = ax + b) (hedef kopya / 2.5 ul numune sayısı). tıklayınız Bu rakamın büyük bir versiyonunu görmek için .
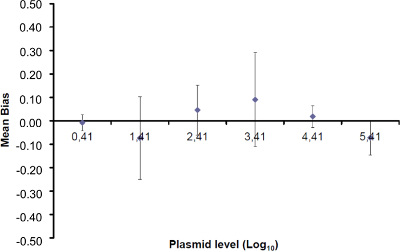
Şekil 4:. EHV- 2 qPCR doğrusal regresyon Performans ortalama sapma (ölçülen plazmid miktarı arasındaki ortalama farkı temsil 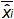 ) Ve her bir plazmid seviyesinde teorik plazmid miktarı (X 'I)' in. Dikey çubuklar formülle verilen doğrusallığı belirsizliği (U Lini) temsil
) Ve her bir plazmid seviyesinde teorik plazmid miktarı (X 'I)' in. Dikey çubuklar formülle verilen doğrusallığı belirsizliği (U Lini) temsil 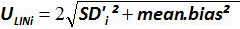
SD'i standart sapma O olduğu f ölçülen plazmid miktarı. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
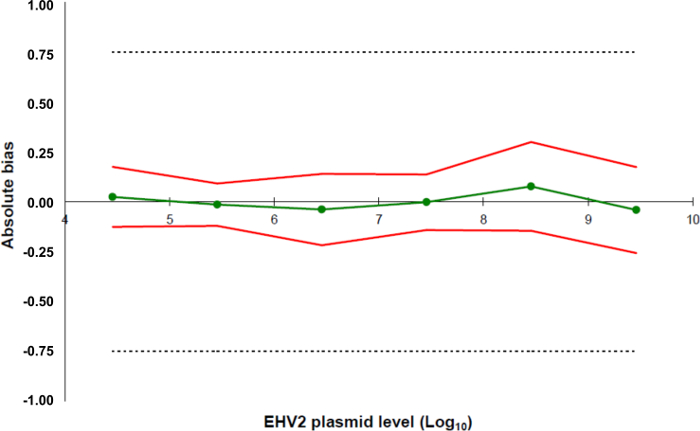
Şekil 5:. EHV- 2 Mah-PCR yöntemiyle doğrulama sonuçlarına göre Doğruluk profilleri yeşil hat (daireler) veri gerçekliğini (sistematik hata, ya da önyargı) temsil eder. Kabul edilebilirlik sınırları laboratuvar (kesik çizgiler) tarafından ± 0.75 Log 10 tanımlanır. Alt ve üst doğruluk sınırları güvenilirlik verileri (kırmızı çizgiler) iki kez ortalama ± standart sapma önyargı her plazmid yük seviyesi için belirlenmiştir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
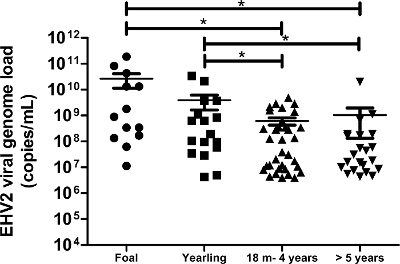
Şekil 6:. ÇYG-2 yaşına göre viral genom yük miktarının belirlenmesi ÇYG-2 nazal sürüntü örneklerinde tespit viral genom yük dağılımı farklı yaş grupları için temsil edilir. yatay çizgiler standart sapma (m = ay) içindeki ortalama değerleri temsil etmektedir. * Newman-Keuls post-hoc testi (p <0.05) ile ANOVA ile önemli ölçüde farklı. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
| Hedef gen, | Primerler, prob ve plasmid dizileri (5'-3 '), | nükleotid pozisyonu | Ürün boyutu (nükleotidler) | Termal döngü koşulları | Kaynaklar | |||
| EHV2 gB (HQ247755.1) | İleri: GTGGCCAGCGGGGTGTTC | 2113-2130 | 78 | 95 ° C 5 dakika | 11 | |||
| Ters: CCCCCAAAGGGATTYTTGAA | 2189-2170 | 95 ° C 15 sn | 45 devir | |||||
| Sonda: FAM-CCCTCTTTGGGAGCATAGTCTCGGGG-MGB | 2132-2157 | 60 ° C 1 dakika | ||||||
| Plazmid: ACCTGGGCACCATAGGCAAGGTGGTGGTCA ATGTGGCCAGCGGGGTGTTCTCCCTCTTTG GGAGCATAGTCTCGGGGGTGATAAGCTTTTT CAAAAATCCCTTTGGGGGCATGCTGCTCATA GTCCTCATCATAGCCGGGGTAGTGGTGGTG TACCTGTTTATGACCAGGTCCAGGAGCATAT ACTCTGCCCCCATTAGAATGCTCTACCCCGG GGTGGAGAGGGCGGCCCAGGAGCCGGGCG CGCACCCGGTGTCAGAAGACCAAATCAGGA ACATCCTGATGGGAATGCACCAATTTCAG | 2081-2381 | |||||||
Tablo 1:. Bu protokolde kullanılan primerler, problar ve pozitif sentetik DNA kontrol sekansları plazmidinin dizisi (pozitif sentetik DNA) konumlarını EHV2gB dizisi (HQ247755.1) arasında 2081-2381 nükleotidine karşılık gelir. Bu protokolde kullanılan primerler ve problar tasarımı özel bir yazılım kullanılarak elde edilmiştir.
| PATOJENLERDEN | Referans (orijin) | Suşların sayısı | SONUÇLAR |
| EHV-2 | |||
| EHV-2 | VR701 (ATCC) | 20 | pozitif |
| 20 numune (FDL toplama) | |||
| EHV-5 | KD05 (GERC) | 20 | Negatif |
| 20 numune (FDL toplama) | |||
| EHV-3 | VR352 (ATCC) | 2 | Negatif |
| T934 WSV (GERC) | |||
| EHV-1 | Kentucky suşu Ky A (ATCC) | 3 | Negatif |
| 2 numune (FDL toplama) | |||
| EHV-4 | VR2230 (ATCC) | 1 | Negatif |
| Eşek herpesvirüs AHV5 | FDL Koleksiyonu | 1 | Negatif |
| AtGrip Virüsü | A / at / Jouars / / 2006 4 (H3N8) | 1 | Negatif |
| (Erişim Numarası JX091752) | |||
| Atçılık Arterit Virüs | VR796 (ATCC) | 2 | Negatif |
| Rhodococcus equi | FDL Koleksiyonu | 1 | Negatif |
| Streptococcus equi subsp. Zooepidemicus | FDL Koleksiyonu | 1 | Negatif |
| Streptococcus equi subsp. equi | FDL Koleksiyonu | 1 | Negatif |
| Coxiella burnetii | ADI-142-100 (ADIAGENE) | 1 | Negatif |
| Chlamydophila abortus | ADI-211-50 (ADIAGENE) | 1 | Negatif |
| Klebsiella pneumoniae | FDL Koleksiyonu | 1 | Negatif |
Tablo 2: EHV-2 qRT-PCR analitik özgüllük.
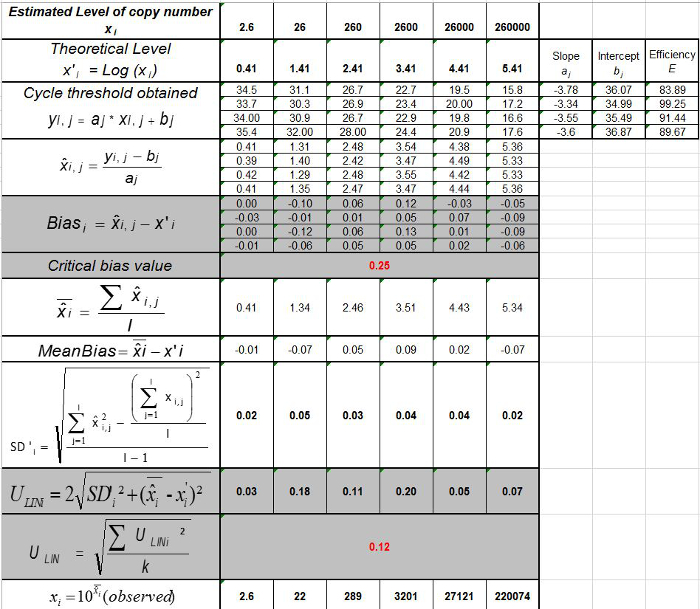
Tablo 3: (NF U47-600-2 12 uyarlanmıştır) önyargı ve doğrusallık belirsizlik hesaplanması. Her deneme için, lineer regresyon performansları (y = ax + b) y elde edilen çevrim eşik tablo kullanılarak doğrulanır; bir yamaç elde edilmektedir;. X plazmid seviyesi ve b kesmek i plazmid olduğunu düzeyi (i K seviyeleri, 1 arasında değişir) t k kullanılan plazmid seviyeleri sayısıdır (örneğin, k = 6onun tablo) j (j i denemelere 1 arasında değişir) deneme, bu tabloda, örneğin I = 4) (3 ve 6 denemeler arasında bulunan, deneme sayısı X Her için tahmin edilen plazmid miktarıdır. ben seviyesini plazmid. x i seviyesini plazmid her i = 10 log (x i) 'i denklemi x elde edilen teorik plazmid miktar'. Her j duruşma sırasında, devir eşiği her i için elde edilen plazmid seviyesi lineer regresyon ile hesaplanır y i, j j x i, j + B j =. 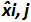 Deneme j sırasında ölçülen plazmid miktarıdır. Bias i sub> ölçülen plazmid miktarı ve her deneme için teorik plazmid miktarı ve her plazmid seviyesinde arasında gözlenen farktır.
Deneme j sırasında ölçülen plazmid miktarıdır. Bias i sub> ölçülen plazmid miktarı ve her deneme için teorik plazmid miktarı ve her plazmid seviyesinde arasında gözlenen farktır. 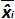 ortalama değeri
ortalama değeri 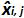 Her tarafından i düzeyini plazmid; SD 'i ölçülen miktarın standart sapma olduğunu
Her tarafından i düzeyini plazmid; SD 'i ölçülen miktarın standart sapma olduğunu 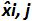 Her i için plazmid seviyesi önyargı ortalama Bias i ortalamasıdır; U Lini i SD'i hesaplanan seviyesini plazmid ve önyargı ortalama her biri için belirlenen doğrusallık belirsizliktir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Her i için plazmid seviyesi önyargı ortalama Bias i ortalamasıdır; U Lini i SD'i hesaplanan seviyesini plazmid ve önyargı ortalama her biri için belirlenen doğrusallık belirsizliktir. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Tablo 4:. Bütün yöntemin tanı duyarlılığı hesaplanması (Se), özgüllüğü (SP), Schwartz Tablo confid hesaplanması için kullanılmıştırNF U47-600-2 açıklandığı gibi tüm yöntemin duyarlılık ve özgüllük% 95 ence aralığı.
Tartışmalar
2000'li yıllardan itibaren, gerçek zamanlı PCR laboratuarlarının artan sayıda altın standart teknikler (hücre kültürü ve bakteri kültürü yöntemleri) yerine edilmiştir. tekniğin uygulanması kolaydır. Ancak laboratuvar yöntemlerinin doğrulama doğru, tekrarlanabilir ve güvenilir veri sağlamak için moleküler algılama ve patojenlerin ölçümü için esastır.
özütleme aşaması biyolojik maddenin başlıca nedenidir olduğu için, bir protokol ve diğeri arasındaki miktar hatası ana kaynağı olarak kabul edilebilir. Bu şekilde, esas olarak literatürde QRT-PCR esnasında DNA plazmidinin standart bir eğri, yaratılması, viral genomun yükünü gösteren, ancak, ekstre etme aşaması dikkate almaz.
AFNOR norm NF U47-600-2 bir bütün yöntem doğrulama işlemi için de novo strateji açıklaması bu alanda önemli bir ilerlemeyi temsil ediyor. gösterildiği gibiÇYG-2 atların için bu kağıt ya da arı 21 başkaları tarafından, bu gelişme aşamasında ve tüm yöntem PCR karakterizasyonu ve karakterizasyonu ile doğrulama adımı arasında açık bir farklılaşma gerektirir. Bu ilginç yaklaşımda bir sınırlama protokolünde herhangi bir değişiklik çok pahalıya mal olabilir tam süreci revalidate zorunluluğu neden olacaktır. Bu sınırlama, aynı zamanda ölçümü sakıncaları virüs (örneğin, solunum sıvıları, organlar, kan veya idrar) ile ekstre edildiği kaynağa bağlı olduğu gerçeği ile vurgulanmış. Aslında, her matris fiziko-kimyasal özellikleri farklı spesifisitelere sunulur ve bağımsız bir şekilde QRT-PCR ile virüs tespit ve miktar tayini için kullanılan her bir farklı matris tanımlamak önemlidir. Bu durumda, her bir biyolojik numunenin viral genomun yükü daha kesin çıkartılmasından belirlenebilir. karakterizasyonu de dikkate termo mod içine alırEl ve önceden iyi karakterize yöntemin kullanımı (örneğin, bu yazıda anlatılan EHV- 2 qPCR yöntemi) ana laboratuvar veya başka bir laboratuarda makinenin yeni bir tür zorunlu olduğunda, bir o aracın performansını onaylamanız gerekir. Tüm testler laboratuvar haline getirmek için qPCR testinin performans onayı şarttır. Bu, normal olarak bilinen özelliklere sahip olan bir referans örneği analiz edilmesi ile elde edilir. Böyle bir çek bir ön ve qPCR (LOD, LOQ verimlilik) performansını ve bütün yöntemle (LOD, LOQ) sağlamlığını doğrulamak için NF 47-600-1 AFNOR norm tarafından talep edildiği gibi zorunlu kabul edilir. Sadece geliştirme ve karakterizasyon adımları sırasında ancak araştırma veya teşhis amaçlı kullanılan, aynı zamanda zaman, risk faktörleri tespit ve iyi protokol standardizasyonu sağlamak için kontrol edilebilir. Özellikle kaygı verici yeterli personel eğitimi, kalifiye personel, sarf malzemeleri kalite kontrolKullanılmış ve depolama, deneyde yer alan bilimsel aletlerin performansını etkileyebilir acil çevre koşulları ve metrolojik koşulları farkındalık kontrolü. laboratuvarlar arası karşılaştırmalar için referans örneklerinin kullanılması da belirsizlikler kontrol etmenize yardımcı olabilir. Bu şekilde, laboratuarlar arasında veri karşılaştırması kolaylaştırılabilir. Nitekim, laboratuvarlar arası yeterlilik testleri değerlendirmek ve yöntemin tekrarlanabilirliği onaylamak için gereklidir.
analiz biyolojik matris uluslararası birim (IU) olarak ifade edilmiştir viral genom yük sonuçları (IU: sıvıları veya kopya için kopya / ml dokular için / g) Farklı laboratuarlar arasında sonuçları karşılaştırmak için kullanımı daha kolaydır. LOQ üzerindeki tüm sonuç olmayan bir ölçülebilir pozitif sonuç olarak alınır kopya / ml LOD ve LOQ arasında bir sonucu olarak ifade edilmiştir. Bu şekilde genomun niceleme verileri sunmak proces daha doğrusu uygundurAnaliz S (genom amplifikasyonu). Aslında, hücre kültürü deneylerinde, TCID50 viral yük ekspresyonu (ortalama doku kültürü enfektif dozu) hücre ve virüs türlerinin özelliklerine bağlıdır. Her suş hattı ilk sitopatojenik etkisi belirgindir önce eşsiz enfeksiyon kinetik ve ÇYG-2 gibi bazı virüsler birkaç gün sürebilir sahiptir.
Sonuç olarak, Mah-PCR karakterizasyonu bu yeni yöntem laboratuarlar arasında veri sunumu ve yorumlama uyumu kolaylaştıracaktır. Bu hastalık durumunun beyanı yerine sadece patojenin varlığı ya da yokluğu için cut-off değerinin kurulması gibi gelecekte Mah-PCR potansiyel yeni uygulamalar için çok yararlı olacaktır.
Açıklamalar
Yazarlar hiçbir rakip mali çıkarları olduğunu beyan ederim.
Teşekkürler
The authors would like to thank Sophie Castagnet and Nadia Doubli-Bounoua for their technical support. This work received financial support from the General Council of Calvados and the agreement of Region Basse-Normandie and French Government (CPER 2007-2013; project R25 p3). The authors would like to thank the experts of the AFNOR group and particularly Jean-Philippe Buffereau and Eric Dubois.
Malzemeler
| Name | Company | Catalog Number | Comments |
| AB-1900 natural color ABgene 96 well plate | Dutsher | 16924 | |
| Adhesive film qPCR Absolute | Dutsher | 16629 | Adhesive film used for sealing the plate prior to the qRT-PCR run |
| 0.5 ml microtubes, skirted, caps | Dutsher | 039258 | |
| Ethanol 98% | Sodipro | SAF322941000 | |
| Primers | Eurofins | Custom order | |
| Probe | Life Technologies | Custom order | |
| Plasmid | Eurofins | Custom order | |
| QIAamp RNA viral Mini Kit (containing: QIAamp Mini column, AVL buffer, AW1 buffer, AW2 buffer, AVE buffer, collection tubes) | Qiagen | 52906 | AVL buffer: pre-warm 5 min at 72 °C |
| Sequencing by Sanger method | Eurofins | Custom order | |
| Taqman Universal PCR Master Mix | Life Technologies | 4364340 | |
| Tris-EDTA buffer solution | Santa Cruz | sc-296653A | |
| NanoDrop 2000c Spectrophotometer | Thermoscientific | ND-2000C | |
| StepOnePlus Real-Time PCR systems | Life Technologies | 4376600 | pre-warm 15 min |
Referanslar
- Brault, S. A., et al. The immune response of foals to natural infection with equid herpesvirus-2 and its association with febrile illness. Vet.Immunol.Immunopathol. 137 (1-2), 136-141 (2010).
- Fortier, G., Van Erck, E., Pronost, S., Lekeux, P., Thiry, E. Equine gammaherpesviruses: pathogenesis, epidemiology and diagnosis. Vet.J. 186 (2), 148-156 (2010).
- Hue, E. S., et al. Detection and quantitation of equid gammaherpesviruses (EHV-2, EHV-5) in nasal swabs using an accredited standardised quantitative PCR method. J Virol.Methods. 198 (1), 18-25 (2014).
- Diallo, I. S., et al. Multiplex real-time PCR for the detection and differentiation of equid herpesvirus 1 (EHV-1) and equid herpesvirus 4 (EHV-4). Vet.Microbiol. 4 (1-3), 93-103 (2007).
- Williams, K. J., et al. Equine multinodular pulmonary fibrosis: a newly recognized herpesvirus-associated fibrotic lung disease. Vet.Pathol. 44 (6), 849-862 (2007).
- Mullis, K., et al. Specific enzymatic amplification of DNA in vitro: the polymerase chain reaction. Cold Spring Harb.Symp.Quant.Biol. 51 (1), 263-273 (1986).
- EPA Office of Water (4607). . EPA-815-B-04-001. Quality Assurance/Quality Control Guidance for Laboratories Performing PCR Analyses on Environmental Samples. , (2004).
- Telford, E. A., et al. Equine herpesviruses 2 and 5 are gamma-herpesviruses. Virology. 195 (2), 492-499 (1993).
- Fortier, G., et al. Identification of equid herpesvirus-5 in respiratory liquids: A retrospective study of 785 samples taken in 2006-2007. Vet.J. 182 (2), 346-348 (2009).
- Brault, S. A., Bird, B. H., Balasuriya, U. B., MacLachlan, N. J. Genetic heterogeneity and variation in viral load during equid herpesvirus-2 infection of foals. Vet.Microbiol. 147 (3-4), 253-261 (2011).
- Association Francaise de Normalisation. . NFU 47-600-1. Animal health analysis methods-PCR-Part 1: Requirements and recommandations for the implementation of veterinary PCR. , (2015).
- Association Francaise de Normalisation. . NFU 47-600-2. Animal health analysis methods-PCR-Part 2: Requirements and recommendations for the development and the validation of veterinary PCR. , (2015).
- ISO. . EN ISO-CEI 17025. General requirements for the competence of testing and calibration laboratories. , (2005).
- . . Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2010. Chapter1.1.1.4/ 5. Principles and Methods of Validation of Diagnostic Assay for Infectious Diseases. , (2009).
- Apaza, S., et al. Detection and genogrouping of noroviruses from children's stools by Taqman One-step RT-PCR. J Vis.Exp. (65), e3232 (2012).
- Lorenz, T. C. Polymerase chain reaction: basic protocol plus troubleshooting and optimization strategies. J Vis.Exp. (63), e3998 (2012).
- Sanger, F., Coulson, A. R. A rapid method for determining sequences in DNA by primed synthesis with DNA polymerase. J Mol.Biol. 94 (3), 441-448 (1975).
- Sanger, F., Nicklen, S., Coulson, A. R. DNA sequencing with chain-terminating inhibitors. Proc.Natl.Acad.Sci.U.S.A. 74 (12), 5463-5467 (1977).
- NCBI. . BLAST Homepage and Selected Search Pages. Introducing the BLAST homepage and form elements/functions of selected search pages. , (2015).
- Greiner, M., Gardner, I. A. Application of diagnostic tests in veterinary epidemiologic studies. Prev.Vet Med. 45 (1-2), 43-59 (2000).
- Blanchard, P., Regnault, J., Schurr, F., Dubois, E., Ribiere, M. Intra-laboratory validation of chronic bee paralysis virus quantitation using an accredited standardised real-time quantitative RT-PCR method. J Virol.Methods. 180 (1-2), 26-31 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır