Method Article
Otoimmün demiyelinizasyonun Farmakolojik Müdahaleler için CNS Koruma karşı Belirlenmesi Bağışıklık Sistemi Bastırma
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
This protocol describes how to determine whether pharmacological treatments for experimental autoimmune encephalomyelitis show CNS protection as a consequence of suppressing immune cell infiltration or are neuroprotective during the onslaught of immune cell infiltration.
Özet
A major hallmark of the autoimmune demyelinating disease multiple sclerosis (MS) is immune cell infiltration into the brain and spinal cord resulting in myelin destruction, which not only slows conduction of nerve impulses, but causes axonal injury resulting in motor and cognitive decline. Current treatments for MS focus on attenuating immune cell infiltration into the central nervous system (CNS). These treatments decrease the number of relapses, improving quality of life, but do not completely eliminate relapses so long-term disability is not improved. Therefore, therapeutic agents that protect the CNS are warranted. In both animal models as well as human patients with MS, T cell entry into the CNS is generally considered the initiating inflammatory event. In order to assess if a drug protects the CNS, any potential effects on immune cell infiltration or proliferation in the periphery must be ruled out. This protocol describes how to determine whether CNS protection observed after drug intervention is a consequence of attenuating CNS-infiltrating immune cells or blocking death of CNS cells during inflammatory insults. The ability to examine MS treatments that are protective to the CNS during inflammatory insults is highly critical for the advancement of therapeutic strategies since current treatments reduce, but do not completely eliminate, relapses (i.e., immune cell infiltration), leaving the CNS vulnerable to degeneration.
Giriş
Multipl skleroz (MS), ağırlıklı olarak, hastalığın erken döneminde beyin ak madde bölgelerinde enflamatuar lezyonlar ile karakterize edilir. Uzun vadeli ilerlemesi sonra, gri cevher atrofi MR görüntüleme ile saptanan ve hastalığın nörodejeneratif fazını işaretleri. Reaktif gliozis, demiyelinizasyon ve beyaz cevherde aksonal hasar MSS-infiltre Bağışıklık hücreleri atfedilir. Şu anda CNS'de nörodejenerasyonu önlemek, direkt olarak ters veya MS kullanılan tedavilerin hiç biri - bunun yerine, merkezi sinir sistemi, T hücresi aktivasyonunu ve / veya sızmasını hafifletecek iltihabı azaltır. Orada MS tedavisi yok ve güncel tedaviler kullanan hastalar hastalığın ilerlemesini yaşamaya devam çünkü, demiyelinizasyon ve nöronal kaybını önlemek ilaçların keşifler önem taşımaktadır. Yani, CNS azaltılmış hasar - - s görünüyor Ancak, bağışıklık hücreleri üzerindeki etkileri ve MSS üzerinde olanlar arasında ayrım sonuç olarak, deneysel zor olabilirne olursa olsun meydana geldiği mekanizmaları ame. Bu nedenle, merkezi sinir sistemi koruma değerlendirilmesi hastalık mekanizmalarını nasıl etkilediğini farmakolojik ajanlar belirlemek için çevre bağışıklık hücreleri ve immün hücrelerin proliferasyonunu MSS-süzücü değerlendirmeleri ile ortak olmalıdır.
, Deneysel otoimmün ensafalomiyelitis (EAE), şu anda MS 1-4 tedavisinde kullanılan ilaçların keşfi için doğrudan sorumlu olan oto-bağışıklık iltihap hastalıklarının köklü bir hayvan modelidir. Fareler genellikle C57BL / 6 fareleri genetik varyantları müsaitlik durumuna göre bir popüler suşu olmak, EAE için kullanılır. EAE ile uyarılan C57BL / 6 fareler gün 10 sonrası indüksiyon etrafında başlayan kronik hastalık progresyonunu sergilerler. Omurilik parankimi ve beyincik infiltrasyonu kortikal parankiminde 5 infiltrasyon yokluğu ile, bu hayvanların histopatolojik karakteristiktir. b Buna ek olarak, kortikal lezyonları ve demiyelinasyonYağmur C57BL / 6 farelerinde, nispeten mevcut olmayan hastalık 6-9 diğerlerinden ayıran vardır. Tekrarlayan-düzelen hastalık ve MS 10 yılında benzer görünen beyin ve omurilikte hem de bulundu lezyonu SJL fareler, kullanmak mümkün olduğunda nedenle, tercih edilebilir.
bağışıklık hücreleri MSS ulaşmak asla eğer tedavi nöroprotektif olarak sınıflandırılmış olamaz. Bu nedenle, bu protokol daha önce 11 gösterildiği gibi beyin, omurilik ve EAE farelerden dalak akış sitometrik analizi kullanımı immün hücre merkezi sinir sistemi içine sızma ve çevre immün hücrelerin proliferasyonu üzerinde tedavinin etkisini belirlemek için yapar. kapsamını ve Nöro-doğasını belirlemek için CNS dokusunun immünohistokimyasal analizleri de tarif edilir. Bu yöntemlerin birleştirilmesi MSS olup olmadığını PR bağışıklık hücreleri aktive immun hücre MSS girdi olup, periferde çoğaldı tespiti, izin verir veenflamasyon veya hasar otected. nöroprotektif etkileri bağışıklık sistemi üzerine etkilerine rağmen şüphesi varsa, deneyci MSS oluştu içine tedavisi bağışıklık hücre infiltrasyonu sonra kez start değiştirebilir.
Burada, aktif EAE, MS T hücre-aracılı hayvan modelinde iki farklı modellerini kullanarak bir protokol mevcut ve farklı yönleri üzerinde deneysel tedavilerin etkinliğini belirlemek için hastalık sırasında çeşitli zaman noktalarında immünohistokimya ile birlikte akış sitometri analizine MS patogenezi. Bu yöntem, immün hücre çoğalması ve MSS koruması karşı sızması üzerindeki etkileri arasında ayrım ilaçlar hastalığın patogenezi ile ilgili nasıl hareket daha kolay daraltmak için yapım araştırmacılar yardımcı olacaktır.
Protokol
fareler içeren deneysel prosedürler, ilgili kurumsal ve hükümet yönetmeliklere uygun olmalıdır. Bu çalışmada, fareler yerleştirildiler ve Birmingham Kurumsal Hayvan Bakım ve Kullanım Kurulu kurallarına Sağlık ve Alabama Üniversitesi National Institutes göre tedavi.
1. EAE indüksiyon ve Puanlama
- C57BL / 6 farelerinde 11-13 veya 10,11 SJL farelerinde EAE Teşvik Eder, daha önce 13 tarif.
NOT: Deneyciler araştırma sorusu (daha fazla detay için tartışmaya bakınız) için bir model ideali seçmelisiniz. - Tutanak puanları günlük olarak daha önce gün 7 sonrası indüksiyon başlayarak her bir fare için 11 nitelendirdi. Tedavi grupları arasında zamanla günlük ortalama puanları karşılaştırın.
2. Tedavi
- Tedavi bağışıklık hücresi infiltrasyonu veya çoğalmasını etkiler olmadığını belirlemek için hastalığın başlangıcından önce EAE fareler davranın.
- Bana bir tedavi seçinTeslimat metod ile, ve tedavinin sıklığı ilacın kan-beyin bariyeri geçirgenliğinin, yarılanma ömrü ve dozaj göz önüne alarak.
NOT: EAE kan-beyin bariyeri geçirgenliğini arttırır ve uyuşturucu aksi takdirde sağlıklı hayvanlarda mümkün olmaz MSS ulaşmak için izin verebilir. EAE klinik skorlar bakarak doz-yanıt eğrileri için deneylerini ilacın uygun bir doz seçiminde yardımcı olabilir. Araç kontrol ilaç tedavisine paralel yapılmalıdır. Alternatif olarak, koşullu knockout farelerde kontrol olarak littermates kullanılabilir. - Bu deney için SJL veya C57BL / 6 fareleri kullanın. Teslimat seçilen yöntem kullanılarak semptomlarının başlamasından önce, erken EAE indüksiyonu (gün 7) sonra, fareler tedavi edin.
- Kurban ve adım 3.1 ve zamanla en yüksek klinik skor ortalamasına dayanarak alt adımlar, olduğu gibi, hastalığın pik (yaklaşık gün 15) fareler teşrih.
- Davranış bağışıklık hücresi infiltrati belirlemek için (adım 3.2 gibi) fare omurilik üzerinde akım sitometriVe dalak (aşama 3.3'te olduğu gibi), CNS ilgili çevre immün hücre çoğalmasını belirlemek. Ayrı fareler üzerinde, (4. adımda olduğu gibi) davranış immünohistokimyasal astrositler ve mikroglia ve miyelin korunması ölçmek için.
- Bana bir tedavi seçinTeslimat metod ile, ve tedavinin sıklığı ilacın kan-beyin bariyeri geçirgenliğinin, yarılanma ömrü ve dozaj göz önüne alarak.
- bağışıklık hücre infiltrasyonu oluştuktan sonra tedavi CNS korur olmadığını belirlemek için hastalığın başlangıcından sonra EAE fareler davranın.
- Adımı tekrarlayın 2.1.1.
- Bu fareler ölçülebilir hastalık remisyon olduğu gibi, bu deney için SJL fareler kullanın. ortalama klinik skorlar ile ölçülen (bir sonraki dönemde yineleme zirvesinde, istenirse, ya da) hastalığında ilk zirve sırasında fareler davranın.
- istenen zaman sonrası EAE indüksiyon fareler Kurban. sızma oluştuysa, bunun nedeni FACS analizi ile infiltrasyonu ölçmek için yararlı olmayabilir. Ancak, bağışıklık hücresi infiltrasyonu rağmen MSS koruma olup olmadığını belirlemek için reaktif gliozis ve miyelin ölçmek için omurilik alır.
3. Akım Sitometri Analizi
- teşrih
- Hayvanın kimliği ve dokusunun türü ile hayvan başına Label üç 15 ml konik tüpler (beyin için bir, omurilik için bir ve dalak için) içeriyordu. buz üzerinde tüm prosedür için ayrı tüplerde tüm dokuların tutun.
- 3 dakika - dalak FACS analizi için, 2 dakikada yaklaşık% 15 nispetinde bir boş hacim bir akış oranı ile, karbon dioksit ile hastalığı (~ gün 15 sonrası EAE indüksiyonu) zirvesindeki fareler kurban. solunum yetersizliği ötenazi onaylayın. Her bir farenin kurban sonra, bir birey içinde dalak 14 temizleyin ve buz gibi soğuk RPMI% 2 FCS, 100 IU penisilin ve 100 ug / ml streptomisin ile takviye edilmiş ihtiva eden (aşama 3.1.1 arasında) 15 ml konik tüp (etiketli protokol boyunca "medya" olarak bahsedilecektir).
- Beyin ve omurilik FACS analizi için, circulatin serbest bırakmak için cerrahi makas ile farenin sağ atrium keserek kardiyak perfüzyon gerçekleştirmekg, kan ve buz soğukluğunda 10 ml PBS ile doldurulmuş bir şırınga bağlı bir iğne ile, sol ventrikül delici. Yavaş yavaş 10 ml PBS enjekte edilir.
- Farenin kafasını kesti ve cerrahi makas ile kafa derisi orta hat kesilmiş olun. Peel geri elle veya forseps ile ve cilt bir başlangıç nokta olarak omuriliğin giriş noktası kullanarak, cerrahi makas ile kafatası orta hat kesilmiş olun.
- Mikro forseps ile kafatasını uzak soyma ve beyin boşaltmak için bir kepçe kullanın. (Adım 3.1.1 itibaren) etiketli 15 ml konik tüpler içeren ortama beyinleri yerleştirin.
- forseps ve cerrahi makas ile farenin deri kaldırmak ve cerrahi makas kullanarak fare eviscerate. uzuvlar, kuyruk, kaburga kesti ve cerrahi makas ile herhangi çevreleyen kas vertebra sütun ücretsiz.
- cerrahi makas ile yaklaşık 5 kabaca eşit parçaya omur sütunu kesin ve hemostatla tek parça bir ucunu sıkmak ve daha sonra başka bir hemostat t kullanmako omurilik üst dışarı sıkar kadar parça boyunca hareket, sıkma devam edin. Vertebral kolonun her parça için bu işlemi yineleyin ve bireyin içine kablolarını yerleştirin ortamı içeren 15 ml (adım 3.1.1 itibaren) konik tüpler etiketli.
- beyin ve omurilikte bağışıklık hücre infiltrasyonu değerlendirilmesi
- Steril makas kullanarak küçük parçalar halinde beyinleri ve omurilik kesti. medya ile süzgeci durulama sırasında yeni bir 50 ml tüp içine 70 mikron hücre süzgecinden üzerinde 3 ml şırınga pistonu ile Crush. ortam ile 50 ml hacme her tüp getirin. Pelet hücreleri 5 dakika boyunca 453 x g'de santrifüjleyin.
- Süpernatant aspire ve% 40 yoğunluk gradyan ortamının 4 ml içinde süspanse pelet. Dikkatle gradyanı uygun katmanlarını sağlamak için konik tüp duvarı üzerine yavaş yavaş yeni bir 15 ml'lik konik bir tüp pipet% 70 yoğunluk gradyanı 2 ml üzerine hücreleri ihtiva eden% 40 yoğunluk gradient kaplar. Oda sıcaklığında 20 dakika ile 796 xg'de SpinBir fren dışarı.
- Dikkatle, 1 ml transfer pipet ile degrade üst miyelin tabakası kaldırmak sonra yeni bir 15 ml konik tüp 1 ml transfer pipet ve transfer arayüzünde canlı hücreleri çıkarmak. 10 dakika boyunca 448 xg'de medya ve santrifüj ile 15 ml tüp getirin.
- Süspanse 200 ul ortam pelet ve (kendi kuyuya gidecek her hayvandan her numune), 96 oyuklu yuvarlak dipli levhanın bir kuyunun içine yerleştirin. 5 dakika boyunca 410 x g'de plaka santrifüjleyin.
- yeniden uyarma ortamı 200 ul süpernatan ve tekrar süspansiyon pelet geri çek (RPMI,% 10 FCS ile takviye edilmiş, 100 lU / ml penisilin, 100 ug / ml streptomisin, 2 mM L-glutamin, 1 x esansiyel olmayan amino asitler, 1mM sodyum piruvat ve β-mersaptoetanol 55 uM, artı 50 ng / ml forbol miristat asetat (PMA), 750 ng / ml iyonomisin ve protein taşınma inhibitörünün Brefeldin A). 4 saat boyunca 37 o C'de bir inkübatör plaka koyun.
Not: PMA ve ionomamacıyla, tüm T lenfositlerinin-bağımsız antijen spesifikliği aktivasyonuna gentamisin yeniden uyarma sonuçları belirli bir dokuda, her T hücresi alt kümesi sayısı değerlendirmek. Ancak, antijene özgü efektör T hücresi tepkileri Brefeldin A 15,16 mevcudiyetinde MOG peptidi ile hücrelerin tekrar uyarılmasından dahil olmak üzere çeşitli yollarla değerlendirilebilir. - Merkezi sinir sistemi, CD4 + T hücre fenotiplerinin değerlendirilmesi
- İnkübasyondan sonra, 5 dakika boyunca 410 x g'de santrifüj (aşama 3.2.5 den), 96-gözlü yuvarlak dipli levha ve süpernatant hafifçe vurun. Aşağıdaki lekeleme adımların hepsi plakada gerçekleştirilir.
- 5 dakika boyunca 410 x g'de% 2 FCS ve santrifüj ile 200 ul PBS içinde hücreleri yıkayın. Süpernatantı Flick ve 200 ul PBS 10 Fc Block (klon 2.4G2)% 2 FCS içeren hücrelerin inkübe - buz üzerinde 15 dakika.
- 50 yılında, 5 dakika boyunca 410 xg'de süpernatant kapalı fiske ve tekrar süspansiyon pelet dışı leke, santrifüj hücreleri başlamak için &956., yüzey leke kokteyli l (1: 200, 1 ug / ml) CD4 karşı fluorofor etiketli antikorlar ihtiva TCRβ 15 PBS içinde seyreltilmiş (1: 200, 1 ug / ml) ve canlılığı boya (500 1) buz üzerinde dak. süpernatant kapalı 5 dakika ve fiske 410 xg'de Santrifüj hücreleri. Yıkama Hücreler daha sonra 5 dakika boyunca 410 x g'de santrifüj 200 ul PBS içinde 2 x.
- Hücre dışı leke çıkardıktan sonra, hücre içi boyama ve ardından sabitleme / permeabilization tarafından hücre içi boyama prosedürünü başlatabilir.
- Gece boyunca 4 O ° C'de 30 dakika için (bakınız Materyaller listesi, üreticinin talimatlarına göre) Foxp3 transkripsiyon faktörü boyama reaktifler 17 / Permeabilize hücreleri yüzer kapalı fiske başlar ve düzeltmek için
- 5 dakika boyunca 410 xg'de kiti ve santrifüj plaka 150 ul permeabilization tampon hücreleri yıkayın. (1, IL-17A karşı fluorofor etiketli-antikorlar ile 50 ul permeabilization tampon supernatant ve leke hücrelerini itin: 200, 1 ug / ml), IFN-γ (1: 200, 1 ug / ml) ve Foxp3 (1: 200, buz üzerinde 30 dakika süreyle PBS içinde seyreltilmiş 2.5 ug / ml).
- süpernatant kapalı 5 dakika ve fiske 410 xg'de Santrifüj hücreleri. Aşırı antikorlar daha sonra 5 dakika boyunca 410 xg'de santrifüj 200 ul permeabilization tamponu içinde 3x yıkayın kaldırın. 200 ul PBS içinde supernatant ve tekrar süspansiyon geri çek.
- Daha önce, her molekülü sentezleyen hücrelerin yüzdesini değerlendirmek için 11 tarif + TCRβ + hücreleri gibi canlı CD4 üzerinde kapılama, akış sitometrisi ile analiz hücreleri. CD4 + T hücre fenotiplerinin her biri ile fare başına hücre sayısını belirlemek için bir hemasitometre 18 ya da başka geçerli yöntem kullanarak hücreleri sayın.
- Elde edilen verileri kullanarak, EAE patogenezinde ve koruma kritik rol oynayan bu popülasyonları üzerinde özel bir odaklanma ile, yüzde ve her fareden beyin ve omurilik infiltrasyon CD4 + T hücrelerinin sayısını hesaplamak19: IL-17A + IFN-γ -, IL-17A + IFN-γ + IL-17A - IFN-γ + Foxp3 +.
- Periferal T hücresi çoğalması ve aktivasyonunun değerlendirilmesi
- 60 x 15 mm kültür kaplarına buzlu cam slaytlar ile dalak Crush. Hücreleri askıya medyayı kullanarak 15 ml konik bir tüp içinde hücre süspansiyonu yerleştirin. 5 dakika boyunca 448 xg'de medya ve santrifüj hücreleri ile 15 ml tüp doldurun.
- 2 ml aspire medya ve tekrar süspansiyon pelet ACK yaklaşık 3 dakika süreyle kırmızı kan hücreleri parçalama oda sıcaklığında tampon parçalama.
- Yeni bir tüp içine 70 mikron hücre süzgecinden üzerinde 15 ml medya ile hacim ve zorlanma tüp getirin. Santrifüj hücreler 5 dakika için 448 x g hızında, 2 mi ortam supernatant, ve tekrar süspansiyon aspire.
- Ki-67 renklendirme ile periferal CD4 + T hücresi çoğalmasının değerlendirilmesi
- eşi küçük bir kısım (tipik olarak 200 ul) koyunBir 96-gözenekli yuvarlak tabanlı plaka içinde, tek tek oyuklara (örnek başına bir tane) 3.3.3 gelen splenositlerin eşdeğerlikte sayıları.
- süpernatant kapalı 5 dakika ve fiske 410 xg'de santrifüj. % 2 FCS ve tekrar santrifüj içeren 200 ul PBS içinde süspanse. PBS Fc Block (klon 2.4G2)% 2 FCS içeren süpernatan ve tekrar süspansiyon hücrelerini Flick ve 10 boyunca inkübe - buz üzerinde 15 dakika. Hücre dışı leke adımı yineleyin 3.2.6.3 için.
- Hücre dışı leke çıkardıktan sonra, hücre içi boyama ve ardından sabitleme / permeabilization tarafından hücre içi boyama prosedürünü başlatabilir.
- Adımı tekrarlayın 3.2.6.4.1.
- süpernatant kapalı 5 dakika ve fiske 410 xg'de Santrifüj hücreleri. Yıkama hücreleri 5 dakika boyunca 410 xg'de kit ve santrifüj 200 ul permeabilization tamponunda 1x. 30 dakika: Anti-Ki-67 antikoru (200, 1 ug / ml, 1) 50 ul permeabilizasyon tampon maddesi içinde yüzer ve leke hücrelerini Flick.
- 410 xg fo Santrifüj hücrelersüpernatant kapalı r 5 dakika ve fiske. Yıkama hücreleri 5 dakika boyunca 410 xg'de kit ve santrifüj 200 ul permeabilization tamponunda 2x.
- Süpernatantı Flick ve yıkama hücreler 200 ul PBS içinde 1 x ve 5 dakika boyunca 410 x g'de santrifüjleyin. Daha sonra yüzde Ki-67 + hücreler değerlendirmek, daha önce 11 açıklanan + TCRβ + hücreler canlı CD4 üzerinde yolluk, flow sitometri ile hücrelerin analiz edin.
- Periferal CD4 + T hücre fenotiplerinin değerlendirilmesi
- 5 dakika boyunca 410 x g'de 96 oyuklu yuvarlak dipli levha (örnek başına bir oyuk) ve santrifüj (adım 3.3.3 gelen) hücreler, 200 ul koyun ve 3.2.5 olarak yeniden uyarır.
- 4 saat boyunca 37 o C'de bir inkübatör plaka koyun. Adım 3.2.6 ve alt adımlar aynı boyama işlemini gerçekleştirin. 3.2.6.4.4-3.2.6.5.5 gibi flow sitometri hücreleri analiz edin.
4. İmmunohistokimya bird Ölçümü
- Doku hazırlanması
- C57BL / 6 fareleri ya da ortalama klinik skorlardaki zirve sırasında hastalığın kronik fazında, EAE indüksiyonu (genellikle ~ 30. günden sonra herhangi bir noktada adım 3 ve alt adımlar kullanılanlardan ayrı deneyde EAE fareler kurban aşağıdaki adımları izleyerek SJL fareler) reaktif gliozis ve demiyelinizasyon boyutunu belirlemek için.
- yanıtın eksikliği arıyorum, forseps kullanarak çimdik% 2.5 izofluran ve% 97.5 oksijen ile fareler anestezi ve hafif bir ayak ile anestezi uygun derinliği onaylayın. Aşama 3.1.3 tarif edildiği gibi transkardiyak perfüzyon gerçekleştirin. Gözlerde ciddi hasara neden olabilir, Paraformaldehyde bir cilt ve akciğer tahriş edicidir ve kansere neden olduğu düşünülmektedir. Sol ventrikül içine PBS enjekte sonra, PBS DİKKAT% 4 paraformaldehit 10 ml enjekte etmek için yeni bir şırınga kullanın. solumaktan, gitmesini engellemek ve cilde ve göze temas. Perfüzyon davlumbaz yapılmalıdır.
- 3.1.6 - adımlarda 3.1.4 açıklandığı gibi beyin ve omurga sütunları kaldırmak. Omuriliğin düz uyum sağlamak için dize ile sopa vertebral sütunları kravat.
- PBS içinde yaklaşık olarak 50 ml% 4 paraformaldehit ile hayvanın numarası ile etiketlenmiş konik tüpler gece boyunca yayınlamak-düzeltmek için 50 ml sintilasyon PBS içinde% 4 paraformaldehid, yaklaşık 20 ml, hayvan numarası ile işaretlenmiş şişelere ve omurilikte beyinleri koyun.
- , Beyinleri cryoprotect 1x PBS içinde% 30 sakaroz 4 o C'de 3 1x PBS süreleri ve mağaza durulayın. beyinleri onların kapları (yaklaşık 3 gün) dibine izin verin.
- ~ 7.8 pH için, ~ 1 x PBS içinde 3 kez yıkama ve 1 x PBS içinde 0.5 M EDTA (fare omurilik yaklaşık 50 mi) (pH olacak başlayan büyük hacimde yerleştirerek 10 belkemiğinin kalsiyumu kaldırma 2 6 N HCI) ile - 3 hafta kemik artık sert olana kadar. adım 4.1.5 takip ederek omurga sütunu cryoprotect.
- Embed beyinler veen kısa sürede onların kapların dibine aşağıdaki alt adımları izleyerek OCT vertebra sütunlar.
- 1x PBS içinde 1 kısım% 30 sükroz ve 2 kısım OCT karışımı yapmak (örneğin, 1 x PBS içinde 15 ml% 30 sukroz ekleme 30 mi OCT).
- tam ½ kadar gömme kalıp (22 x 22 x 20 mm beyin ve omurilik 22 x 30 x 20 mm) OCT / sükroz karışımı ekleyin.
- Bir jilet kullanarak 6 eşit büyüklükte parçalar halinde omur sütunları kesin ve koronal omurilik bölümleri için ileriye dönük bir 22 x 30 x 20 mm gömme kalıp içine yerleştirin. ileriye dönük 22 x 22 x 20 mm kalıplar içine bütün beyinleri yerleştirin.
- doku kapağı ve 1 saat bekletin için Ekim / sakaroz karışımı ekleyin. böylece kabarcıklar kaçabilir. Bu saat süresince, flaş dondurma için gömme kalıpları tutabilecek bir çanak 2-bromür ekleyin. kuru buz üzerinde çanak yerleştirin ve serin öncesi kapsamaktadır.
- Ac içinde -80 o C'de kuru buz ve mağaza 2-metilbütana kalıp Flash dondurmakOntainer su kaybını önlemek için.
- Hazır olduğunda, bölüm kriyostat ile 16 mikron doku ve elektrostatik olarak yüklenmiş slaytlar monte. Her beyin ve omurilik için bir slayt üzerinde her 10 inci bölümü koymak (örneğin, böylece 1 bölümleri 1, 11 olacak kaydırın ve 21 ve bölümleri 2, 12 olacak slayt 2 ve 22, ve benzeri). Mağaza -80 o C'de slaytlar ya da hemen boyanması için kullanılacak.
- reaktif gliyoz ve miyelin için boyama
- Ne zaman hazır boyama, aynı (ya da mümkün olduğunca benzer) bölgedeki her hayvan için leke başına beyin ve omurilik için bir slayt her seçin. beyin için, korpus kallosum ve cingulum kümesini gösteren slaytları seçin.
- Yeri 7 dakika süreyle 70 o C'de bir ısı bloğu üzerinde doku ile slaytlar. 7 dakika sonra ısı bloğu kapatın ve slaytlar başka bir 10 için ısı bloğu üzerinde soğumasını bekleyin - 15 dakika. Bu boyama işlemi sırasında slaytlar düşmesini doku bölümleri önleyecektir.
- Yıkama 5 dakika boyunca (yüzey antijenleri hedef antikorları) (hücre içi antijenlere)% 0.1 noniyonik deterjan veya 1 x PBS ile 1 x PBS içinde 3 kez her kayar.
NOT: Bu protokolde kullanılan antikorlar, hücre içi olduğu için, non-iyonik deterjanlar, bir sonraki adımda kullanılır. slaytlar, bu aşamadan sonra tamamen kurumasını bekleyin asla. - Bir kap içinde slaytlar yerleştirin ve sitrat tamponu pH 3.0 ile kaplayın. , Sitrat tamponu hale su içinde 100 ml'lik bir son hacme 0.192 g susuz sitrik asit ekleyin. Aşağıda ise pH 3.0 üstünde veya NaOH ise asetik asit ile pH ayarlayın.
- 30 dakika boyunca 37 C 'de slaytlar inkübe ve 5 dakika için% 0.1 noniyonik deterjan ile 1x PBS içinde 3 kez yıkanır.
- Yuvarlak hidrofobik bir bariyer kalemle doku etrafında bir alan ve nemlendirilmiş bir odada slaytlar yer (örneğin, ıslak kağıt havlu içeren bir slayt kutusu). dokuya bloklama tamponu ilave edin. Oda sıcaklığında 30 dakika süreyle inkübe edilir.
Not: Bloke edici tamponun 1x PBS oluşmaktadır% 0.3 noniyonik deterjan ve ikincil antikor, örneğin, Iba1 için miyelin bazik proteini (MBP) ve glial fibriller asidik protein (GFAP) ve keçi serumu için at serumu ana göre uygun serumu (% 5) bir artı. - slaytlar rahatsız tampon ve primer antikor ilave bloke döndürme (1: 1000 ya da oligodendrositler 0.2 ug / ml keçi anti-miyelin bazik protein, 1: astrositler için 1.000 veya 1 ug / ml ile 3 mg / ml fare anti-GFAP veya 1 : 750 veya uygun engelleme tamponu içinde seyreltilmiş 0.67 ug / ml tavşan mikroglia anti-Iba1) (daire içine alan adım 4.2.6) bkz. Nemlendirilmiş odasında 4 o C gece boyunca bekletin.
- slaytlar rahatsız tamponu ve 5 dakika için% 0.1 noniyonik deterjan ile 1x PBS içinde kayan 3 kez yıkama bloke Flick antikoru.
- İkincil antikor ekleyin (1: 200 ya da MBP ve GFAP veya biyotinile edilmiş keçi Iba1 anti-tavşan 7.5 ug / ml biyotinile at anti-fare) uygun bir bloke edici tampon içinde seyreltildi (bakınız Stedaire içine alınmış alanın p 4.2.6) ve oda sıcaklığında 1 saat boyunca nemlendirilmiş bir odada kuluçkaya slaytlar bırakın.
- slaytlar rahatsız tamponu ve 5 dakika için% 0.1 noniyonik deterjan ile 1x PBS içinde kayan 3 kez yıkama bloke Flick antikoru.
- Kullanmadan önce immunoperoksidaz avidin-biyotin-peroksidaz kompleksi (ABC) (malzeme listesine bakınız) 30 dakika hazırlanması ve 4.2.12 ihtiyaç duyulana kadar bir çalkalayıcı üzerinde çalkalayın. Endojen peroksidaz aktivitesi sönmesi için 10 dakika süre ile daire içine alınmış alanın için metanol içinde% 0.3 H2O 2 ekleyin.
- Slaytlar geri çek çözeltisi ve 1 x PBS içinde, daha sonra 5 dakika için% 0.1 noniyonik deterjan ile 1x PBS veya 1 x PBS içinde 2 kez 1 kez yıkayın. 30 dakika süre ile daire içine alınmış alanın ABC reaktifı ilave edin.
- 5 dakika boyunca su içinde Flick slaytlar rahatsız çözeltisi ve 5 dakika için 1 x PBS içinde 3 kez yıkanır, daha sonra 2 kez. 3,3'-diaminobenzidin (DAB) çözümünü yapmak (Malzeme Listesi) ve bölümleri kapsayacak şekilde ekleyin.
Not: Bu adım algılamak optimum gözlemlemek için bir mikroskop gerektiririyon boyama zamanı ve slaytlar için zaman aynı miktarda için yapılmalıdır karşılaştırılmak üzere. - Yıkama her biri 5 dakika su içinde 3 defa açılır. su içinde,% 70 etanol, su içinde% 95 etanol, su içinde% 100 etanol,% 50 ksilen ve% 50 etanol,% 100 ksilenler: 2 dakika her biri için, aşağıdaki çözeltiler içine koyarak doku kurutmak. reçineli montaj ortamı ile slayt bir lamel mühür.
- Daha önce IBA-1 ve GFAP karşı antikorlar kullanılarak, reaktif gliozis değerlendirmek için 11 tarif edildiği gibi alternatif olarak, immünofloresan boyama yapar.
- Bir 4X, 0.13 NA amacı ile (DAB kullanarak ilgili antikor ile boyandı) Her omurilik bölümünün görüntüleri çekmek ve tiff olarak görüntüleri kaydetmek. Alternatif olarak, 20x, 0.50 NA objektif kullanılarak, sol ya da sağ beyin yarımkürede korpus kallosum ve cingulum demetinin görüntüleri almak ve tiff olarak görüntüleri kaydetmek. beyindeki lezyon yükü daha kapsamlı bir tayin için, her iki hemisferde dahil etmek yararlıanalizlerde es.
- reaktif gliyoz ortalama fraksiyon Ölçüm alanı (Iba1 ve GFAP boyama)
- İndir NIH ImageJ (http://imagej.nih.gov/ij/) ve bilgisayarda açık. ImageJ yazılım, Aç menü dize Dosya> kullanmak ve adım 4.2.16 bir görüntü seçin. Menü çubuğundaki "Poligon seçimleri" aracını kullanarak bir alan çizin. omurilik için, tüm bölüm iz; beyinleri, korpus kallosum ve cingulum paket için. Görüntü> Tip gidip tıklayarak 16-bit görüntü dönüştürmek "16-bit."
- De-gürültü> Proses Arka Plan çıkarma ve arka planda (http ImageJ kullanım kılavuzuna bakın parçası değildir büyük nesnenin en az boyutu "Rolling top yarıçapı" set giderek görüntüyü: //rsbweb.nih gov / ij / docs / rehber / 146-29.html).
NOT: Iba-1 boyanma 4X görüntü için biz 4.0 kullanın ve GFAP biz 50.0 kullanabilirsiniz, ancak bu sayılar görüntü büyütme ve boyama int bağlı olarak değişebilirensity. - "Sürme parabloid" Kontrol ve "Tamam" a tıklayın. > Eşik Ayarla> Görüntü gitmek ... ve sürgülü çubuklarını kullanarak alt eşik seviyesini (üst bar) olarak ayarlayın. Dahil sadece hücresel bir boyama ve resim arasında tutarlı olun. koyu arka plan (sadece floresan boyama için geçerlidir) görüntüler için, "Karanlık arka plan" kutusunun işaretli olduğundan emin olun.
- > Set Ölçümleri Analiz ... ve "Alan fraksiyonu" seçeneğini gidin (ilgi bölgedeki eşiklenir alanın yüzde verir). "Eşik sınırı" denetlenmeyen ve "Ekran etiketi" işaretli olduğundan emin olun. tam zaman "Tamam" a tıklayın.
- ölçümler elde etmek için,> Ölçü analiz gidin. Bir "Sonuçlar" pop-up kutusu görünür ve bu verilerin başka bir programa olduğu gibi kaydedilir veya kopyalanabilir. Analiz için, tedavi grupları arasında "Alan kesir" değerleri karşılaştırın.
- opt MBP boyama kantifikasyonuical yoğunluğu
- Adım 4.3.1 de açıklandığı gibi aç görüntü ilgi alanı çizin ve. > Set Ölçümleri Analiz gidin ... ve seçin (piksel sayısına bölünmesiyle seçim içinde gri değerlerin toplamını) "gri Ortalama değer". "Eşik sınırı" denetlenmeyen ve "Ekran etiketi" işaretli olduğundan emin olun. tam zaman "Tamam" a tıklayın.
- ölçümler elde etmek için,> Ölçü analiz gidin. Bir "Sonuçlar" pop-up kutusu görünür gözlemleyin. Bu veri kopyalama ve ya başka bir programa kopyalamak olarak kaydedin.
- Analiz için, başka bir programa kopyalama ve yapıştırma değerleri. OD = 10 log (255 gri / ortalama değer) aşağıdaki formül kullanılarak optik yoğunluğun (OD) içine ortalama gri değer dönüştürün.
Sonuçlar
Burada, bir farmakolojik ajan tarafından MSS koruma sağlar anlamak için EAE iki model kullanılan ya MSS-süzücü T hücrelerini zayıflatan veya enflamatuar, bağışıklık hücre infiltrasyonu saldırı sırasında miyelin ve akson hasarı önler. Immün hücre infiltrasyonu ve patolojisi çoğunlukla, omurilik (Şekil 1A) 'de bulunduğu bir terapötik madde omuriliğe bağışık hücre içi filtratı önler olmadığını belirlemek için, kronik EAE, C57BL / 6 fare modeli kullanılır. Terapötik ilaç MSS, beyin ve omurilik (Şekil 1B) hem de hastalık patolojisi gösteriyor kullanılan tekrarlayan-düzelen EAE SJL hayvan modeli, içine bağışıklık hücrelerinin saldırı sırasında MSS koruma sağlar olmadığını belirlemek için.
klinik Değerlendirmeleri
İlgili Klinik değerlendirmeler, tipik aşağıdaki başlığı (Şekil 1 'e göre yapılırC) ya da atipik (Şekil 1D) EAE. Tipik klinik hastalık için 0 puan anormal bir davranıştır. kuyruk tabanı tarafından yakalandı zaman kuyruk (çok bir helikopter, rotor gibi) hızla dönebilir ve arka bacaklar ayrı yayılacaktır. 1 olan bir klinik skor kuyruk tabanından ile fare kaldırarak belirlenebilir kısmen gevşek kuyruk vardır. Normal helikopter gibi dönen zayıflamış ya da yok, ve kuyruk kısmı tamamen gevşek olabilir olabilir. kuyruk paralizi kapsamını belirlemek için bir yardımcı yolu kısmen felçli kuyruk bunu yapamaz olacak ise bir unparalyzed kuyruk genellikle parmak etrafında kıvırmak gibi, kuyruk uzunluğu kişinin parmağını yukarı çalıştırmaktır. 2 olan bir klinik skor tamamen felç kuyruk temsil eder. kuyruk dibinde fare yukarı seçerken kuyruk hiçbir hareket tüm oluşur. 3 klinik skor kısmi arka bacak felç eder. Bu skorun belirlenmesi fare fla üzerinde hareket etmek üzere serbest olmasını gerektirirt yüzeyi. bir arka bacak sürükleyerek ise fare ilerledikçe, bir veya her iki arka bacaklarda kısmen felçli olarak görünüyorsa, 3 skoru verilebilir. 4 klinik skor tam arka bacak paralizi temsil eder. Bu skor ile, bir fare, arka bacaklarda hareket edemiyoruz olacak ve ön uzuvların kullanarak kendini öne sürükler. 5 Klinik skor can çekişen fare temsil veya güçlükle fare kafes veya solunum genelinde kendisini hareketli. Bir fare kafesinin alt kısmındaki veya nefes zahmetli ise kendisini sürükleyerek yapamıyorsanız, fare insanca ötenazi edilmelidir. 6 klinik skor kafesine ölü bulundu fare temsil eder. 6 puan sıradışı ve EAE dışındaki ölüm nedenleri araştırılmalıdır.
Atipik klinik hastalık olabilir veya felç eşlik olmayabilir. Bir fare atipik hastalık artı tipik belirtileri ile sunuyor eğer iki ayrı skorlama sistemleri dahil gerekli olabilir. 0 puan, anormal davranışları, a,Tipik puanlama sistemi ile s. Fare yürürken 1 olan bir klinik skor hafif bir baş dönüş ya da tilt temsil eder. Bu fare öne yürümeye izin vermek ve hareketi için sürekli bir sağ veya sol yönünü gözlenmesiyle belirlenebilir. 2 olan bir klinik skor daha belirgin baş dönüş ve kötü düzeltilmesi yeteneği temsil eder. 1 atipik puan ile olduğu gibi, fare kendi hareketi yönü vardır ve denge ile hafif zorluk çekebilir. 3 klinik skor düz bir çizgide yürümek için bir yetersizlik temsil eder. Fare zorluk dengeleme olacak ve yürür gibi doğru kendini yardım etmek kafesin yan kullanabilirsiniz. 4 klinik skor nedeniyle dengeleme sorunları yürümekte zorluk yan döşeme fare, temsil eder. Fare kafesinin alt kısmındaki kendini sürüklemek mümkün olabilir ancak hareketin yönünü olabilir. Desteklenen sürece 5 olan bir klinik skor sürekli haddeleme temsil eder. Bu skor ulaşan bir fare insanca ötenazi edilmelidir. bir klinik6 al puanı kendi kafesine ölü bulundu fare temsil eder. 6 puan sıradışı ve EAE dışındaki ölüm nedenleri araştırılmalıdır.
Bir farenin durum değişiklikleri hafifçe veya eğer iki puanları arasındaki seçimi zor ise bir puana 0.5 ekleyerek, örneğin skorları, "aradaki-" için izin vermek için gerekli olabilir. Örneğin, başlayan bir fare normal muadillerine göre daha yavaş hareket ama hiçbir felç veya 0,5 puan verilebilir kuyruk tarafından yakalandı zaman onun bacaklarını dışarı eğimlendirme yerine kendi ön, arka ayakları tokalar fare görüntüler için . Sadece kafesinin alt kısmındaki kendini sürüklemek ve sadece 3.5 bir puan verilebilir periyodik veya dokundu onun arka bacaklarda seğirme mümkün olabilir bir fare.
Bağışıklık Hücre İnfiltrasyonunun bir Azaltma değerlendirilmesi
C57BL / 6 fare modelinde EAE (Şekil 1A, gün 0) antijen presentati indüksiyonundan sonradalakta T hücrelerinin ve çoğalması üzerinde günlerde meydana 1 - yaklaşık 3 ile 5 gün, klinik skorları ile mevcut başlangıç bağışık hücre içi filtratı fareler gün sonra 7. yaklaşık CNS bağışık hücre infiltrasyonu ve ardından 5. terapötik ajan omuriliğe bağışıklık hücre infiltrasyonu engelleme olup olmadığını değerlendirmek için, ilaç veya araç dalak antijen sunumu ve çoğalması gün sonra 7 tanıtıldı ama bağışıklık hücreleri omuriliğe içine sızmak başlamadan önce edilir. Bağışıklık hücre infiltrasyonu zayıflatılmış olması durumunda, klinik seyri gün hastalığın yükselen faz 10 ila 15 (Şekil 2) esnasında geliştirilmiş klinik skorları yansıtmalıdır.
bağışık hücre içi filtrasyonundan bir azalma azalması nöro neden olur. Reaktif astrositleri ve mikrogliyozu nöro başlıca işaretlerinden olarak kabul edilir. Iba-1 ile GFAP ve mikroglia ile astrositler için boyama sonra chang değerlendirmek için kullanılabilirOrtalama alan kesir boyama es Nöroenflamasyon (Şekil 3) ölçmek için.
Bağışık hücre içi filtratı azaltılmış olup olmadığını belirlemek için, omurilik uzaklaştırılmış ve hastalık tepe (Şekil 1A, yaklaşık günde 18) de akış sitometri analizi için işlemden geçirilir. Bu bağışıklık hücrelerinin en fazla sayıda omurilik girmiştir sağlar. CNS'ye T hücrelerinin giriş başlatılması enflamatuar etkinliği olarak kabul edilir ve her iki Th1 ve Th17 hücreleri EAE hayvan modellerinde hem de MS hastalarında bulunur. Birlikte ele alındığında, akış sitometrik analizi, patojenik T hücrelerinin her iki tip değerlendirme içermelidir. Ayrıca, Treg'ler hastalığı nemlendirin iyi karakterize baskılayıcı T hücreleridir. Bu nedenle, toplam CD4 + popülasyonundan Tregs yüzdesi efektör T hücre popülasyonlarının yüzdesi ile karşılaştırıldığında değerlendirilmelidir. Bu ise ther T hücre infiltrasyonu genel bir azalma meydana gelmişse ortaya ya da olacake MSS T hücre fenotipleri bir eğriltmeyi olduğunu. Örnek nokta diyagramları (Şekil 4A), araç ile tedavi edilmiş farelerde (sağ üst kadranda numaraları), omurilik ile karşılaştırıldığında ilaçla işleme tabi tutulan farelerden alınan omurilik T hücrelerinin infiltre CD4 + genel sayısında bir azalma göstermektedir. Sırasıyla IFN-y + IL-17 + ve Foxp3 + ve (Şekil 4A) azaltılmalıdır: Th1, Th17 ve Treg hücreleri aşağıdaki imza proteinleri değerlendirilir değerlendirmek. İstatistiksel analiz önemli bir düşüş (Şekil 4B) göstermek için CD4 +, IFN-y + IL-17 + ve Foxp3 + hücre sayıları üzerinde yapılmalıdır. (Ve Foxp3 + hücreler yapılır - IL-17 + IFN-γ - T hücre alt bir eğrilme, IFN-y + IL-17 + IFN-y + IL-17 oranının istatistiksel değerlendirme ekarte etmek için Fişekil 4C).
T hücrelerinin MSS nüfuz eden bir azalma periferinde çoğalmasını, aktivasyonunu ve farklılaşmasını inhibe etmek için bir sonucudur olasılığını ortadan kaldırmak için, aktif T hücre alt tipi oranına ek olarak T hücrelerinin proliferasyon sayısı değerlendirilmesi gerekir. Aktivasyonu ve farklılaşması etkilenmemiş (Şekil 5A) ise hiçbir CD4 +, IFN-y + yüzdesi değişiklik, IL-17 + veya Foxp3 + bulunmalıdır. Proliferasyon (Şekil 5B) etkilenmez Dahası, Ki67 + CD4 + hücrelerinin bir değişiklik bulunmalıdır. İlaç tedavisi 7. günde tanıtılmaktadır veya daha çevre ilk antijen sunumu ve T hücre aktivasyonunu değiştirilmesini engellemek. Ancak genetik modeller proteinler genellikle embriyogenez sırasında yapısal silinir veya splenosit asse yapma EAE indüksiyon öncesi uyarılanbüyük önem ssment.
CNS Koruma Değerlendirilmesi
Belirli bir terapötik madde, bağışıklık hücresi infiltrasyonu sonra merkezi sinir sistemi hastalık patolojisi modüle etmesi halinde göstermek için, iki ilaç klinik hastalık puanlama ilk zirve sırasında tatbik edilmelidir. Bu fareler, bir nüks-remisyon fenotip sergileyen yana EAE SJL modeli Bu deneyler için avantajlıdır. Bir uyuşturucu tedavi miyelin-akson dejenerasyonu engeller varsa, klinik skorlarında düzelme (Şekil 6) görülecektir. miyelin Patolojik değerlendirme geliştirilmiş klinik skorları ile tutarlı miyelin hasarının bir azalma teyit edilmelidir. Kantitatif miyelin bütünlüğü, miyelin bazik protein DAB boyama değerlendirmek (MBP), bu lekeleme için optik yoğunluk istatistiksel analizi (Şekil 7), ardından gerçekleştirilir. bundan başka nöro-inflamasyonu kanıtlamak için sürekli veya therape azaltılırUTIC girişimler, reaktif gliyoz (Şekil 3), yukarıda tarif edildiği gibi reaktif gliyoz ortalama fraksiyon alanı ölçülerek değerlendirilebilir. bir tedavi yöntemidir doğrudan immünomodülatör etkileri olmadan MSS koruyucu olduğunu doğrulamak için, dalak immün hücre CNS içine sızması ve çoğalma zayıflama indirimli edilmelidir. Bu sorunu çözmek için, beyin ve immün hücre infiltrasyonu ve periferik T hücresi çoğalması ve aktivasyonunun değerlendirilmesi omurilik değerlendirilmesi için yöntemler yukarıda tarif edildiği gibi gerçekleştirilmelidir (Şekiller 4 ve 5). Birlikte ele alındığında, T hücreleri ya da çevre T hücrelerinin proliferasyonunu MSS nüfuz eden bir azalma ile hiçbir kanıt CNS'de hücre hasarı bloke terapötik maddeler merkezi sinir koruyucu tedavilerdir.
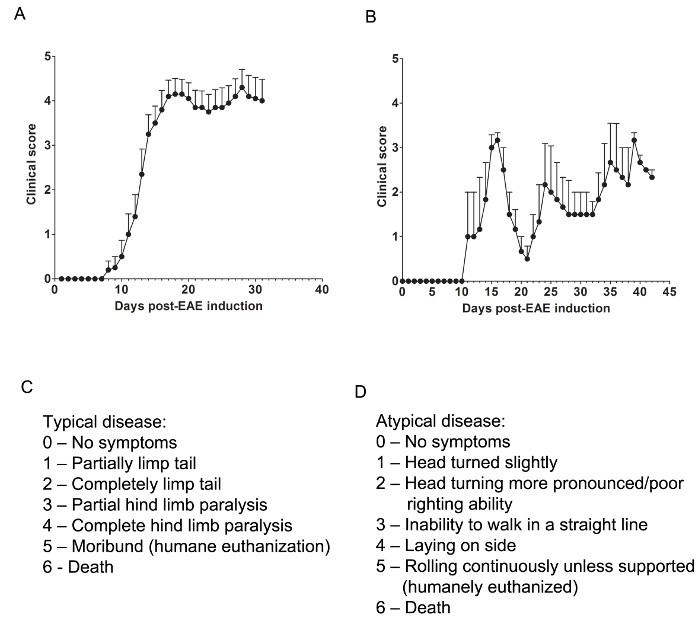
Şekil 1. Temsilcisi ResuC57BL / 6 ve SJL Farelerde EAE Klinik Puanlarının lt. (A) Klinik skorlar kronik hastalığı olan EAE üretmek için MOG 35-55 ile uyarılan (n = 10) / 6 fareleri C57BL (ortalama ± SEM). (B) Klinik puanlar, tekrarlayan-düzelen hastalığa sahip EAE üretmek PLP 139-151 indüklenen SJL farelerinin (n = 3) ve (ortalama ± SEM). (C) EAE farelerde tipik hastalık ilerlemesini izlemek için kullanılan klinik skorlama tablosu. (D) EAE farelerde atipik hastalığın ilerlemesini izlemek için kullanılan klinik skorlama tablosu. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
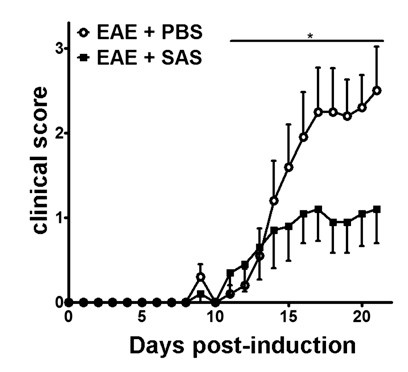
EAE ile C57BL / 6 farelerde Şekil 2. Farmakolojik Tedavi öncesinde Bağışıklık Hücre Sızma. C57BL / 6 fareleri MOG 35-55 güne 7 İmmünizasyondan PBS ile muamele edilmiş (n = 20) ya da SAS (n = 19) kliniksel skorlar (ortalama ± SEM). Veriler, üç bağımsız deneyin Havuzlanmış vardır. İstatistiksel fark * p <0.05, parametrik olmayan bir, iki kuyruklu, Mann-Whitney U-testi kullanılarak tespit edilmiştir. (11) izni ile yeniden yazdırın.
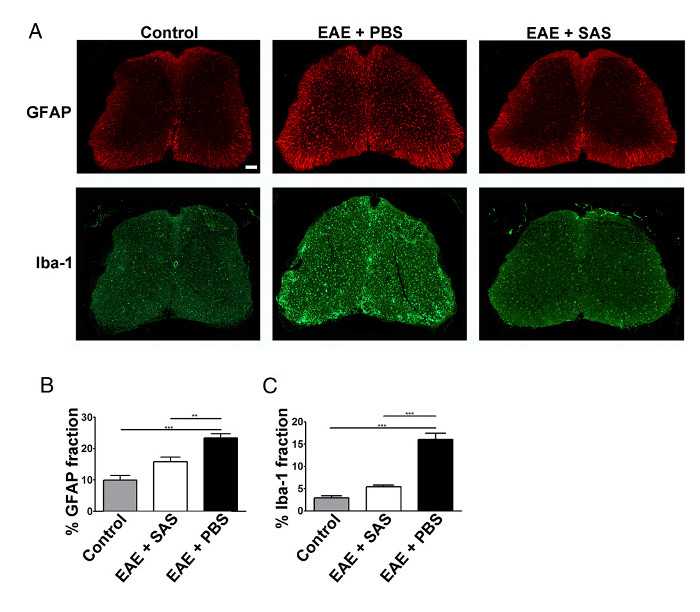
Şekil 3. Immunofluorescent Boyama ve Kontrol, EAE Spinal Kabloları reaktif gliozis miktarının belirlenmesi ve Tedavi C57BL / 6 fareler. (A) kontrol omurilik GFAP (astrositler) ve İba-1 (mikroglia) için Floresan etiketleme (aşılanmamış PBS (orta paneller) veya SAS (sağ paneller) ile tedavi) fareler (sol panel) ve EAE fareler. Ölçek çubuğu = 100 mikron. boyama miktarının yüzde immunop ölçmek için Konum fraksiyon tekniği kullanılarak saptanmıştırGFAP (B) ve IBA-1 (C) kablo bağlantısının artı yeri alanı. , Ortalama ± SEM, n = 3, kontrol, n = 3 SAS ile muamele edilmiş ya da N = 4, PBS ile tedavi edilmiş fareler, fare başına 6 bölümleri. İstatistiksel farklılıklar, bir tek-yönlü ANOVA kullanılarak belirlendi * p <0.05, ** p <0.01, *** P <0.001. Yeniden baskı (11) izni ile. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
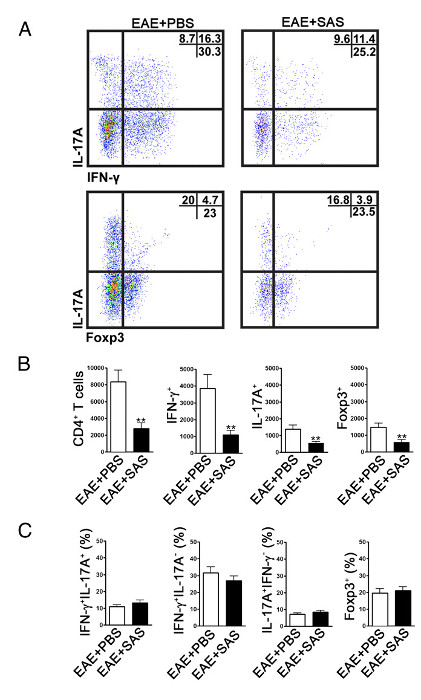
EAE, C57BL / 6 fare omurilik Şekil 4. FACS analizi. Muameleye tabi tutulmuş fare T hücresi infiltrasyonu Azaltılmış gösteren C57BL / 6 fareleri EAE 7 gün postinduction başlayarak SAS veya PBS ile muamele edilmiştir. Omurilik Th1 (IFN-γ + / IL-17 -) göstermektedir 15. gün (A), Örnek nokta diyagramları elde edilmiş ve Th17 (IFN-γ- / IL-17 +) CD4 + kapısı (üst panel) ve T düzenleyici hücreler (FoxP3 +) (alt paneller) hücreler. Nokta araziler sağ üst kadranda yüzdeleri gösterir. (B) mutlak CD4 + hücrelerinin sayısı olarak, IFN-γ + IL-17A + ve Foxp3 + hücreleri istatistiksel olarak analiz edilmiştir. (C) Sas- ve PBS ile tedavi edilmiş EAE fareleri arasındaki T hücre popülasyonlarının yüzde değişim de incelenmiştir. iki bağımsız deneyden elde işlenmiş SAS ve n = 9, ortalama ± SEM, n = PBS tedavi için 10. Iki kuyruklu t-testi, tüm çubuk grafikler kullanılmıştır. ** P <0.01. Yeniden baskı (11) izni ile. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
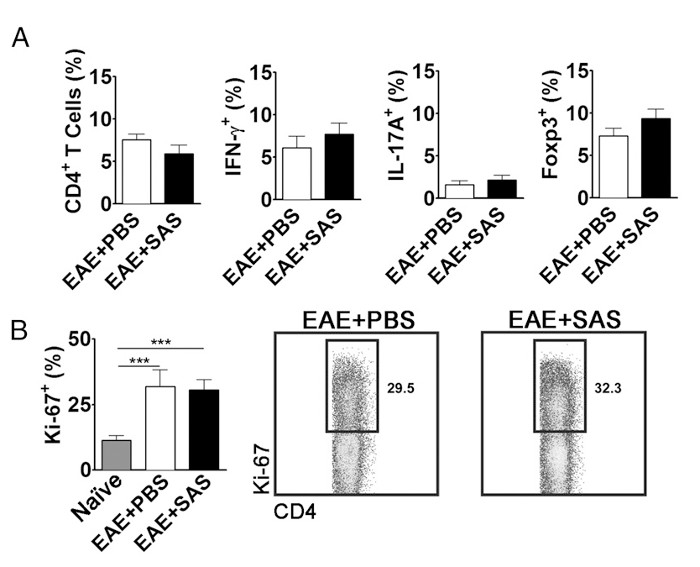
Şekil 5. FACEAE, C57BL / 6 fare dalak S Analizi Arıtılmış ve tedavi görmemiş farelere denk T hücre ekspresyon profilleri ve çoğalmasını gösterilmesi. PBS ve SAS ile tedavi edilen farelerden alınan dalak EAE 15 D postinduction analiz edilmiştir. (A) CD4 + T hücrelerinin yüzdesi, Th1 (IFN-γ + / IL-17 -), Th17 (IFN-γ - / IL-17 +) PBS gelen dalaklarda ve regülatör T hücreleri (FoxP3 +) ile muamele edilmiş (n = 10) ve iki bağımsız deneyden (n = 9) fareler SAS-işlemden geçirildi. (B, sol panel) naif dalaklarından CD4 + popülasyonunda Ki-67 + hücrelerinin oranı (n = 4) diğer yandan da PBS- (n = 5) ve SAS-ile tedavi edilmiş farelerde (n = 5) ile teşvik EAE. Bir tek yönlü ANOVA testi PBS veya SAS-tedavi EAE dalak ya kıyasla naif dalak Ki-67 + hücrelerinin oranı arasında istatistiksel önemini gösterdi. Hiçbir önemi PBS ve SAS-tedavi EAE dalak arasında gözlenmiştir. (B, sağ panel) Temsilcisi nokta araziler; numaraları çoğalma oranını gösterir. Nokta araziler yüzdeleri gösterir. Çubuk grafikler iki kuyruklu t testi temsil *** p <0.001. Yeniden baskı (11) izni ile. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
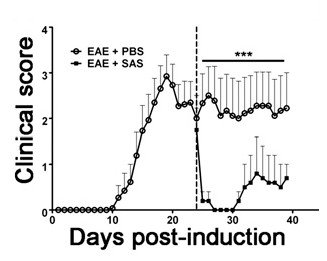
Şekil 6. Farmakolojik muameleden sonra EAE ile SJL farelerinde bağışık hücre içi filtratı. Klinik puanlar (ortalama ± SEM) PBS ile muamele SJL farelerinin (n = 8) ya da SAS (n = 8) PLP ile immünizasyon sonrası 24. günde (kesikli çizgi) ile ilgili 139-151. Veriler klinik skorları ± SEM. İstatistiksel fark *** p <0.001, parametrik olmayan bir, iki kuyruklu, Mann-Whitney U-testi kullanılarak tespit edilmiştir. Üst satır istatistiksel için kullanılan değerleri temsilAnaliz. (11) izni ile yeniden yazdırın.
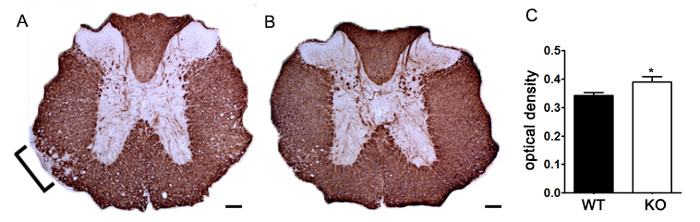
Optik Yoğunluk kullanarak MBP Boyama Şekil 7. belirlenmesi. (A) EAE ile uyarılan yavru kontrol C57BL / 6 fare ile karşılaştırıldığında belirtilmeyen bir genetik nakavt fare torakal omurilikteki MBP Temsilcisi boyama. Parantez azaltılmış MBP boyama belirten demiyelinizasyon temsilcisi alanını belirtir. Belirsiz bir genetik nakavt C57BL / 6 fare gelen torakal omurilik (B) MBP boyama. (C) EAE ile indüklenen Tanımlanmamış genetik knockout farelerde (KO n = 6 fare, 2-4 bel ve hayvan başına göğüs bölümleri) vahşi tipli (ağırlık itibarı ile omurilik MBP boyama daha yüksek bir optik yoğunluk (OD) sergiler; n = 3 fareler, 2-4 lomber ve EAE ile uyarılan göğüs hayvan başına bölümler) fareler. Istatistiksel olarak analiz USI* P <0.05, bir iki kuyruklu t testi ng. Hata çubukları SEM'i temsil etmektedir. Ölçek çubuğu 100 mikron.
Tartışmalar
MS'li hastalar, CNS içine T hücre aktivasyonu ve / veya infiltrasyonu zayıflatan ilaçlar doğrudan MSS korumak tedavi seçeneklerinin gelişmesini warranting ise hastalık dönemleri devam. EAE klasik MS belirtileri modellemek için kullanılır olmuştur ve in vivo immün sistem ve MSS arasındaki etkileşimlerin doğasını okuyan zaman güçlü bir araç olabilir. Çevre immün hücre CNS'de infiltrasyonu ve çoğalmasını ve aktivasyonunu inceleyerek ile bağlantılı olarak daha önce veya hastalığın başlangıcından sonra işleme EAE de hususlar, örneğin, zamanlamasını kullanarak, bağışıklık sistemi ve hem de tedavi etkilerini belirlemek mümkün olduğu CNS.
C57BL / 6 fare EAE daha yaygın olarak kullanılan iken bu fareler parankiminde bir nüks-remisyon fenotip ve bağışıklık hücrelerinin infiltrasyonu olduğu gibi, SJL fare EAE, MS vakaların çoğunda daha iyi temsil olabilirBeynin 10. SJL fareler hastalığı sunmuştur sonra mümkün tedaviye başlamak için yapım ancak azaltılmış inflamasyon dönemlerinde, hem de remisyon sırasında açık bir iyileşme var. SJL fareler her zaman nüks ve sonuçları toplanmış zaman potansiyel olarak büyük değişkenlik sonuçlanan senkronize havale olmadığını dikkate almak önemlidir. Bu nedenle, bazı araştırmacılar hastalığın ilerlemesinde bireyselleştirilmiş noktalarda FACS analizi ve histoloji için fareler çekerken bir hayvandan klinik puanlar için temsili sonuçları göstermek için tercih edebilir.
manipülasyonlar bir tedavisi bağışıklık sistemini ya da merkezi sinir sistemini nasıl etkilediği belirlenmesinde yardımcı olabilir EAE fareler yapıldığında göz önüne alındığında. Tedavi başladığında için birçok seçenek kendi bağışıklık hücreleri CNS girmiş olup olmadığını için çağrışım ve nasıl her MSS ile etkileşim olabilir, vardır. Semptomların başlangıcından önce tedavisi bağışıklık hücreleri henüz girilen veya MSS hasara neden değil anlamına gelir.Semptomların başlangıcından sonra tedavisi bağışıklık hücreleri MSS girdiniz ve bazı hasara neden olduğunu ima eder. SJL fareler kullanılarak, tedavi de bağışıklık hücreleri aktif olarak sızmakta ve inflamasyona yol açar, ya da bağışıklık hücreleri daha az inflamasyon ile MSS az yaygın olabilir remisyon sırasında olan bir tekrarlama sırasında başlayabilir. bağışıklık hücreleri tedavi sırasında patolojik sürecin neresinde göz önüne alındığında, tedavi CNS ve bağışıklık sistemini nasıl etkilediğini ilgili ilk hipotezler yapılabilir.
tedaviler bağışıklık hücreleri ve MSS, EAE belirtilerin şiddetini azaltma sonuçta her etkileyebilir yolları bir dizi vardır. Nedenle, bağışıklık hücreleri MSS girmiş olup olmadığını, çevre ve MSS nasıl etkilendiğini bağışıklık hücreleri bakmak için akış sitometrik analizi ve immunohistokimyasal kullanmak gereklidir ve MSS tedavisi nasıl tepki vereceğini. omurilik akım sitometri analizi kaç hücre ha belirlemek mümkün olmakla birliktebelirli bir zamanda MSS girdikten bir bağışıklık hücrelerinin çoğalması dalak etkilenmez sürece bu etkisi azalır bağışıklık hücre kaçakçılığı nedeniyle olduğunu belirleyemiyor. Hem çevresel ve merkezi sinir sistemi dokusu analiz ve her iki dokular karşılaştırıldığında mekanistik anlama sonuçlarına belirlemek için gereklidir. bağışıklık hücre aktivitesi profilleri düzenleyici T hücresi yoğun profilinin patojenik yardımcı T hücre ağır profilinde bir anahtara sahip, örneğin, muamele ile değiştirilebilir için de mümkündür. Farklı hücre tipleri için belirteçler bakarak ve işlenmiş ve işlenmemiş hayvanlardan arasındaki yüzde ifadesini karşılaştırmak, bu nedenle, aynı zamanda önemli bir husustur. MS araştırmalarında ortaya çıkan bir kavram B hücreleri otoimmün demiyelinizasyon önemli bir rol oynadığını düşündürmektedir. Bu B hücreleri, T hücreleri 20 yeniden aktivasyonu için gerekli olduğunu gösteren çalışmalara dayanmaktadır. Bu kavram gibi rituksimab, CD20 eski karşı bir antikor olarak tedavi başarısı tarafından desteklenmektedirB hücrelerinin 21,22 yüzeyinde bastırdı. Klinik çalışmalarda monoklonal antikor ocrelizumab başarısı gösterildiği gibi, CD20 farklı epitopları hedefleyen ilaçlar, B hücresi hedefli terapötik 23 etkinliğini iyileştirebilir.
Burada sunulan tekniklerden biri sınırlama bağışıklık hücreleri MSS girmek ama parankiminde yolculuk mümkün olabilmesi için bunun mümkün olmasıdır. İmmünohistokimya muamele edilmiş ve muamele edilmemiş hayvanlar arasında parankimi mesafeyi bağışıklık hücrelerinin perivasküler cuffing tespit etmek ve değerlendirmek için de kullanılabilir. Bir diğer potansiyel sınırlama EAE patogenezinde mikrobiyomları etkilerini içermektedir. Ortakçı bağırsak Mikrobiyota ağır hastalık patogenezi 24 etkileyebilir; Bu nedenle, fareler, farklı koloniler içinde yer alır ve hatta farklı kafeslere hastalık şiddetinde büyük farklılıklar olabilir. aynı kafeste kaldırdı yavru denetimlerini kullanmak için mümkün olduğunca Buna göre, her zaman tercih edilirEAE ilgili deneyler. Son bir not da çevre immün hücre proliferatif değişikliklerin etkilerini ortadan kaldırmak için deneysel arzu edilir ise, pasif transferi indüksiyon yerine bu protokolü açıklanan aktif indüksiyon kullanarak bunu yapmak mümkün olabilir olmasıdır.
Nöro için daha fazla onay hücre ölümünün ya da seçici bir hücre tipi proteinlerin silinmesi sağlar koşullu nakavt fareler kullanılarak özel mekanizmalar test etmek için bir ko-kültür sistemi 11 kullanılarak gerçekleştirilebilir. Ayrıca, nöro-koruyucu farmakolojik ajanların araştırılmasını uzatmak için, aksonal transection ve nöron ölümüne belirteçleri dahil edilmelidir. önemi bir başka alan remiyelinizasyon olduğunu. Yaralı aksonlar nöroprotektif tedaviler remiyelinizasyon tedavilerin önemli bir parçası olmalıdır ileri destek veriyor remyelinate edemiyoruz. Ayrıca, miyelinsiz aksonlar myelina daha yaralanmaya daha savunmasızted aksonlar. Bu bir akson aksonal hasarı önlemek olacaktır zamanında yeniden miyelin oluşumunu teşvik demiyelinize terapötik girişimlerin olduğunda ortaya koymaktadır. Bu yollar araştırmak için, demiyelinasyon ve remiyelinasyon diğer in vivo modelleri (örn cuprizone ve lisolesitin) kullanılabilir. yöntem Burada miyelin kaybı miktarının tarafından nöro değerlendirilmesi üzerinde duruldu tarif. remiyelinizasyon değerlendirilmesi progenitör hücrelerin sayısı yanı sıra çoğalmaya ve de araştırmak önemli olacağını olgun yetenekleri için. Bu alternatif modellerin söz ile, bir de viral aracılık ensefalit farklı modeller göz önüne almalıyız. Miyelin kaybı üreten iki iyi karakterize edilmiş RNA viral modeli vardır: Bir Theiler ensefalomiyelit sıçan, zarfsız Picornaviridae virüsüdür ve diğer fare hepatit virüsü, Coronaviridae virüs ailesinden 25,26 bir üyesidir.
EAE st için değerli bir araçtırmanipülasyonlar veya tedaviler bağışıklık sistemi ve in vivo merkezi sinir sistemini nasıl etkilediğini udies. tedavi, hastalık sürecini etkileyen burada bu, kan-beyin bariyeri de ya da merkezi sinir sisteminde, periferde olsun, tespit yardımcı olabilir Burada açıklanan protokol. MS için hiçbir mevcut tedaviler hastalığı ve hastaları zamanla sık sık tecrübe düşüş tedavi. Benzer şekilde, akut dissemine ensefalomyelit, transvers miyelit ve nöromiyelitis optika, bağışıklık hücreleri infiltre tarafından saldırı altında doğrudan olarak CNS korumak eksikliği tedavisi dahil bağışıklık hücresi CNS içine sızmasını ve miyelin bozulması ile ilgili diğer hastalıklardan. dikkate tedavinin zamanlaması alınması ve tedavileri konusunda yapılacak mekanik belirlemeleri için izin verecektir inflamasyon ve hasarı değerlendirmek için CNS immünhistokimya ile birlikte akım sitometri dalak analizi ve omurilik kullanarak.
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
Genel Endowment Fonu, Ulusal - Bu çalışma, Ulusal Multipl Skleroz SocietyRG 4587-A-1, Civitan Uluslararası Araştırma Vakfı, Mike L. Jezdimir Enine Myelit Vakfı, Alabama Sağlık Hizmetleri Vakfı Üniversitesi NINDS P30-NS069324 tarafından finanse edildi Ulusal Alerji ve Bulaşıcı Hastalıklar Enstitüsü, Ulusal Sağlık Enstitüleri Bilim Vakfı 1355183, ve T32 AI007051.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 22 x 22 x 20 mm embedding mold | Fisher Scientific | NC9719245 | |
| 22 x 30 x 20 mm embedding mold | Fisher Scientific | NC9531194 | |
| 2-Mercaptoethanol (55 mM) | Thermo Fisher Scientific | 21985-023 | |
| 2-Methylbutane | Fisher Scientific | O3551-4 | |
| 30 x 22 x 20 mm embedding mold | Fisher Scientific | 18-30 | |
| ACK Lysing Buffer | Quality Biological | 118-156-101 | |
| anti-CD4 PE-Cy7 | BD Biosciences | 552775 | 0.2 mg/ml stock concentration |
| anti-Foxp3-FITC | eBioscience | 11-5773-82 | 0.5 mg/ml stock concentration |
| anti-GFAP (Cocktail) | Biolegend | 835301 | 1 - 3 mg/ml stock concentration |
| anti-Iba-1 Polyclonal Antibody (50 µg) | Wako | 019-19741 | 0.5 mg/ml stock concentration |
| anti-IFN-γ APC | eBioscience | 17-7311-82 | 0.2 mg/ml stock concentration |
| anti-IL-17A PerCP-Cy5.5 | eBioscience | 45-7177-82 | 0.2 mg/ml stock concentration |
| anti-Ki-67 PE | eBioscience | 12-5698-82 | 0.2 mg/ml stock concentration |
| anti-MBP (D-18) | Santa Cruz Biotechnology | sc-13912 | 0.2 mg/ml stock concentration |
| anti-TCRβ FITC | eBioscience | 11-5961-85 | 0.5 mg/ml stock concentration |
| anti-TCRβ PE | eBioscience | 12-5961-83 | 0.2 mg/ml stock concentration |
| Biotinylated Goat Anti-Rabbit IgG | Vector Labs | BA-1000 | 1.5 mg/ml stock concentration |
| Biotinylated Horse Anti-Mouse IgG | Vector Labs | BA-2000 | 1.5 mg/ml stock concentration |
| Citric Acid, Anhydrous, 99.5% | Fisher Scientific | AC42356-5000 | |
| Ethylenediaminetetraacetic acid (EDTA), tetrasodium salt dihydrate, 99% | Fisher Scientific | AC446085000 | |
| Fetal Bovine Serum | HyClone | SH30071.03 | |
| Fisherbrand Superfrost Plus Microscope Slides, case of 10 | Fisher Scientific | 12-550-15 | |
| Golgi Plug | BD Biosciences | 555029 | protein transport inhibitor |
| Immedge Hydrophobic Barrier Pen | Fisher Scientific | NC9545623 | |
| Ionomycin | EMD Millipore | 407952-5mg | |
| L-Glutamine, 100x | Corning | 25-005-Cl | |
| MEM Nonessential Amino Acids | Corning | 25-025-Cl | |
| Near IR Live/Dead Staining Kit | Life Technologies | L10119 | viability dye |
| Normal goat serum | Vector Labs | S-1000 | |
| Normal horse serum | Vector Labs | S-2000 | |
| Paraformaldehyde, 96% | Fisher Scientific | AC416785000 | |
| Penicillin-Streptomycin Solution, 100x | Corning | 30-002-Cl | |
| Percoll | GE Healthcare | 17-0891-01 | density gradient |
| Permount | Fisher Scientific | SP15-500 | resinous mounting medium |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma | P1585-1mg | |
| Purified anti-Myelin Basic Protein Antibody | BioLegend | 808401 | |
| RPMI 1640 | Corning | 10-040-CM | |
| Sodium Pyruvate | Corning | 25-000-Cl | |
| Tissue-Tek CRYO-OCT Compound | Fisher Scientific | 14-373-65 | |
| Triton X-100 | Sigma-Aldrich | T9284 | nonionic detergent |
| Vectastain Elite ABC Kit (Standard) | Fisher Scientific | NC9206402 | avidin-biotin-peroxidase complex (ABC) in immunoperoxidase |
| Vector Laboratories Peroxidase Substrate Kit (DAB) | Fisher Scientific | NC9276270 | DAB solution |
Referanslar
- Teitelbaum, D., Meshorer, A., Hirshfeld, T., Arnon, R., Sela, M. Suppression of experimental allergic encephalomyelitis by a synthetic polypeptide. Eur J Immunol. 1, 242-248 (1971).
- Yednock, T. A., et al. Prevention of experimental autoimmune encephalomyelitis by antibodies against alpha 4 beta 1 integrin. Nature. 356, 63-66 (1992).
- Ridge, S. C., et al. Suppression of experimental allergic encephalomyelitis by mitoxantrone. Clinical immunology and immunopathology. 35, 35-42 (1985).
- Steinman, L., Zamvil, S. S. How to successfully apply animal studies in experimental allergic encephalomyelitis to research on multiple sclerosis. Annals of Neurology. 60, 12-21 (2006).
- Kuerten, S., et al. MP4- and MOG:35-55-induced EAE in C57BL/6 mice differentially targets brain, spinal cord and cerebellum. J Neuroimmunol. 189, 31-40 (2007).
- Brownell, B., Hughes, J. T. The distribution of plaques in the cerebrum in multiple sclerosis. J Neurol Neurosurg Psychiatry. 25, 315-320 (1962).
- Kidd, D., et al. Cortical lesions in multiple sclerosis. Brain. 122 (Pt 1), 17-26 (1999).
- Kutzelnigg, A., Lassmann, H. Cortical lesions and brain atrophy in MS. Journal of the neurological sciences. 233, 55-59 (2005).
- Geurts, J. J., et al. Cortical lesions in multiple sclerosis: combined postmortem MR imaging and histopathology. AJNR Am J Neuroradiol. 26, 572-577 (2005).
- Rasmussen, S., et al. Persistent activation of microglia is associated with neuronal dysfunction of callosal projecting pathways and multiple sclerosis-like lesions in relapsing--remitting experimental autoimmune encephalomyelitis. Brain. 130, 2816-2829 (2007).
- Evonuk, K. S., et al. Inhibition of System Xc(-) Transporter Attenuates Autoimmune Inflammatory Demyelination. J Immunol. 195, 450-463 (2015).
- Rowse, A. L., et al. Lithium controls central nervous system autoimmunity through modulation of IFN-gamma signaling. PloS one. 7, e52658(2012).
- Bittner, S., Afzali, A. M., Wiendl, H., Meuth, S. G. Myelin oligodendrocyte glycoprotein (MOG35-55) induced experimental autoimmune encephalomyelitis (EAE) in C57BL/6 mice. J Vis Exp. , (2014).
- Flaherty, S., Reynolds, J. M. Mouse Naive CD4+ T Cell Isolation and In vitro Differentiation into T Cell Subsets. J Vis Exp. , (2015).
- McWilliams, I. L., Rajbhandari, R., Nozell, S., Benveniste, E., Harrington, L. E. STAT4 controls GM-CSF production by both Th1 and Th17 cells during EAE. J Neuroinflammation. 12, 128(2015).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. J. Vis. Exp. , (2012).
- Law, J. P., et al. The importance of Foxp3 antibody and fixation/permeabilization buffer combinations in identifying CD4+CD25+Foxp3+ regulatory T cells. Cytometry Part A : the journal of the International Society for Analytical Cytology. 75, 1040-1050 (2009).
- Strober, W., et al. Monitoring cell growth. Current protocols in immunology. Appendix 3, Appendix 3A(2001).
- Korn, T., et al. Myelin-specific regulatory T cells accumulate in the CNS but fail to control autoimmune inflammation. Nature medicine. 13, 423-431 (2007).
- Pierson, E. R., Stromnes, I. M., Goverman, J. M. B cells promote induction of experimental autoimmune encephalomyelitis by facilitating reactivation of T cells in the central nervous system. Journal of immunology. 192, 929-939 (2014).
- Hauser, S. L., et al. B-cell depletion with rituximab in relapsing-remitting multiple sclerosis. The New England journal of medicine. 358, 676-688 (2008).
- Bar-Or, A., et al. Rituximab in relapsing-remitting multiple sclerosis: a 72-week, open-label, phase I trial. Ann Neurol. 63, 395-400 (2008).
- Kappos, L., et al. Ocrelizumab in relapsing-remitting multiple sclerosis: a phase 2, randomised, placebo-controlled, multicentre trial. Lancet. 378, 1779-1787 (2011).
- Berer, K., et al. Commensal microbiota and myelin autoantigen cooperate to trigger autoimmune demyelination. Nature. 479, 538-541 (2011).
- Bergmann, C. C., Lane, T. E., Stohlman, S. A. Coronavirus infection of the central nervous system: host-virus stand-off. Nat Rev Microbiol. 4, 121-132 (2006).
- Anghelina, D., Pewe, L., Perlman, S. Pathogenic role for virus-specific CD4 T cells in mice with coronavirus-induced acute encephalitis. The American Journal of Pathology. 169, 209-222 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır