Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kapiler Elektroforez Real Time Kitosan Films üzerine Peptit Aşılama Monitör
Bu Makalede
Özet
Free solution capillary electrophoresis is a fast, cheap and robust analytical method that enables the quantitative monitoring of chemical reactions in real time. Its utility for rapid, convenient and precise analysis is demonstrated here through analysis of covalent peptide grafting onto chitosan films for improved cell adhesion.
Özet
Özgür-çözelti kılcal elektroforezi (CE), bir elektrik alanının uygulanmasıyla çözeltisi analitlerin genellikle şarj bileşikleri ayırır. kromatografi gibi diğer analitik ayırma teknikleri ile karşılaştırıldığında, CE, sağlam, ucuz ve etkili bir şekilde (karmaşık, doğal matrisler ya da polimerik bir numune sayısı için) herhangi bir numune hazırlamasını gerektirir. CE hızlı ve ayrılan bileşikler için gözlenen sinyal çözeltisi içindeki miktarı ile doğru orantılı olarak, gerçek zamanlı olarak (örneğin, kimyasal reaksiyon kinetiği) karışımların evrimi takip etmek için kullanılabilir.
Burada, CE verimliliği sonraki biyomedikal uygulamalar için kitosan filmlerin üzerine peptidlerin kovalent aşılama izlemek için gösterilmiştir. Kitosan antimikrobiyel ve biyouyumlu özellikleri böyle hücresi büyüme yüzeylerde gibi biyomedikal uygulamalarda çekici bir malzeme yapmak. Kovalent peptid RGDS (arjinin aşılama - glisin -aspartik asit - serin) kitosan filmlerin yüzeyine hücre eki geliştirmeyi amaçlamaktadır. Tarihsel olarak, kromatografi ve amino asit analizi aşılanmış peptidin miktarı doğrudan ölçümünü sağlamak için kullanılmaktadır. Ancak, CE tarafından sağlanan örnek hazırlama hızlı ayrılması ve yokluğu peptid aşılama sürecinin eşit doğru ama gerçek zamanlı izlenmesini sağlar. CE ayrılması ve reaksiyon karışımının farklı bileşenlerinin ölçülmesi mümkün: (non-aşılı) peptid ve kimyasal ilave maddeleri içerebilir. Bu şekilde, CE kullanımı alt uygulamaları için geliştirilmiş filmler ile sonuçlanır.
kitosan filmler katı hal NMR (Nükleer Manyetik Rezonans) Spektroskopisi vasıtasıyla karakterize edildi. Bu teknik daha zaman alıcı ve gerçek zamanlı olarak uygulanabilir, ancak peptit direkt ölçümü verir ve bu nedenle CE tekniğini doğrular.
Giriş
Ücretsiz çözüm kılcal elektroforezi (CE) kendi yük-sürtünme oranı 1,2 dayalı çözümler bileşikleri ayıran bir tekniktir. Şarj-boyutlu oranı genellikle literatürde açıklanan, ancak bu sadeleştirme bu çalışmada polipeptitleri dahil olmak üzere, polielektrolitler için geçerli değildir, ve aynı zamanda küçük organik moleküller 3 için uygun değildir gördü. CE bir durağan fazı, bir arka plan elektrolit (genellikle bir tampon) yok diğer ayırma teknikleri farklıdır. Bu teknik, 5, fermantasyon Brews 6 sentetik polimerler 7, gıda numuneleri 8 ve sıkıcı numune hazırlık yapmadan pek çözünür peptidler 9 ve üzerine aşılama bitki lifleri gibi karmaşık matrisler 4 örneklerin geniş bir ürün yelpazesi analiz kabiliyeti güçlü olmasını sağlar saflaştırılması. Bu çözünme sorunları var kompleks polielektrolitler (ler için özellikle önemlidirUCH nedenle kitosan 10 ve gellan sakızı 11) olarak birleştirilmiş ya da çözelti içinde çökeltilmiş ana kadar başarıyla örnek, süzme olmadan, analiz edilmiştir. Dahası, kahvaltılık tahıllar şekerlerin analizi suda 8 çöktürülmüş kahvaltı gevreği örneklerinin parçacıkları ile örnekleri enjekte çıkıyor. Bu aynı zamanda da dallı polielektrolitler veya kopolimerler 12,13 analizi için de geçerlidir. Kapsamlı çalışmalar da, özellikle proteomik 14, doğal ya da sentetik peptidler, 15 ve protein ve peptid 16 mikroçip ayırmaların şiral ayrımı için proteinlerin analizi CE tekniklerinin geliştirilmesi tamamlanmıştır. Ayırma ve analiz kılcal gerçekleşecek bu yana, sadece küçük örnek hacimleri ve çözücüler kromatografi 5,6,17 dahil olmak üzere diğer ayırma tekniklerinden daha düşük çalışma maliyeti için CE sağlayan kullanılmaktadır. CE tarafından ayırma hızlı olduğundan, monito veriyorReaksiyon kinetiğinin halka. Bu iyileştirilmiş hücre yapışması için 18 kitosan filmleri üzerine peptidlerin aşılama durumunda gösterilmiştir.
Kitosan kitin N -deacetylation türetilmiş bir polisakkarittir. Nedeniyle çitosan en biyouyumluluk 21, 18,20 19 biyo yapışkanlar ve hücre büyümesi substratlar Chitosan filmler gibi çeşitli biyomedikal uygulamalar için kullanılabilir. Fibronektin, kolajenler ve laminin gibi özel hücre dışı matris proteinlerine Hücre bağlanması, doğrudan hücre 22 hayatta kalma ile bağlantılıdır. Özellikle, farklı hücre tipleri çoğu zaman hayatta kalma ve uygun işlev için, farklı hücre dışı matris proteinlerine eki gerektirir. Kitosan filmlerin Hücre eki fibronektin 23 aşılama yoluyla geliştirilmiş olduğu gösterilmiştir; Bununla birlikte, terkip, saflaştırma ve bu büyük proteinlerin aşılama ekonomik açıdan uygun değildir. Alternatif olarak, küçük peptidlerin bir serisi havE, büyük hücre dışı matris proteinlerinin özelliklerini taklit etmek mümkün olduğu gösterilmiştir. Örneğin, bu gibi fibronektin mimetikleri RGD peptitler (arjinin - glisin - aspartik asit) ve RGDS (arjinin - glisin - aspartik asit - serin) kolaylaştırmak ve hücre eki 24 geliştirmek için kullanılmıştır. Kitosan filmlerin üzerine RGDS kovalent aşılama vivo 18 fibronektin takmak için bilinen hücreler için gelişmiş hücre eki sonuçlandı. Daha büyük protein ikamesi aynı işlevselliği önemli bir maliyet düşüşü sağlamaktadır sahip küçük peptitler ile fibronektin seviyor.
Daha önce 18 yayınlanan Burada, kitosan için aşılama peptid yapıldı. Daha önce gösterildiği gibi, bu yaklaşım için RGDS karboksilik asit işlevselleştirilmesi bağlama maddeleri EDC-HCL (1-etil-3- (3-dimetilaminopropil) karbodiimid) ve NHS (N-hidroksisukinimid) kullanarak, basit ve etkili bir aşılama sağlar üzerine aşılanmışkitosan filmi. Bu aşılama yöntemi önemli avantajı, çitosan veya peptit herhangi bir değişiklik gerektirmez, ve gelecekteki hücre kültür uygulamaları 18,20 ile uyumluluğu arttırmak için, sulu bir ortam içinde yürütülmektedir. bağlama maddeleri ve peptit şarj edilebilir CE reaksiyon kinetiği analizi için uygun bir yöntemdir. Önemlisi, CE aracılığıyla reaksiyon kinetiği analizi aşılama reaksiyonu gerçek zamanlı izlenmesini sağlar ve böylece hem optimize ve aşılama derecesinin miktarını sağlar.
Rutin gerekli olmasa da, CE analizi sonuçları kovalent aşılama göstermek için katı hal NMR (Nükleer Manyetik Rezonans) Spektroskopisi 25,26 kullanılarak kitosan filmler üzerine aşılama peptidin doğrudan ölçülmesi ile off-line doğrulanabilir filmin 18 üzerine peptid. Bununla birlikte, katı hal NMR spektroskopisi ile karşılaştırıldığında, gerçek zamanlı analizi ile teminCE gerçek zamanlı olarak peptit tüketimi ve reaksiyonun kinetiği değerlendirmek, böylece yeteneğinin ölçümü sağlar.
Yukarıda belirtilen yöntem basit ve aşılama ölçüde dolaylı ölçümü ile kitosan filmlerin üzerine aşılama peptid gerçek zamanlı analiz sağlar. gösterilen yöntem, farklı kimyasal reaksiyonlar sürece reaktanlar ya da şarj edilebilir analiz edilecek ürünlerin gerçek zamanlı kantitatif değerlendirmesi uzatılabilir.
Protokol
Kitosan Filmlerin hazırlanması 1.
- ultra saf su ile, 100 ml tam buzlu asetik asit 2 g tartılır.
- % 2 a / a, asetik asit sulu çözeltisi, 100 ml ekleyin, kitosan tozu üzerinden 1.7 g tartılır. ya da alüminyum folyo ile ya da karanlıkta kaplı oda sıcaklığında karıştırma çubuğu ve manyetik bir karıştırma levhası ile 5 gün için karıştırın.
- 1 saat süre ile, 23 ° C'de 1.076 x g'de çitosan dispersiyon santrifüjleyin. bir şırınga ile süpernatant toplayın ve çökelti atın.
- Her bir film, kısım, oda sıcaklığında, 9 cm plastik Petri kabı içine çitosan süspansiyonu 10 ml. en az 7 gün süreyle kurumaya örtülü filmleri bırakın.
- Kullanarak makas 1 x 1 cm kare şeklinde kuru filmler kesti. Not: Deney bu aşamada durdurulmuş olabilir.
Fosfat tamponlu tuz 2. Hazırlık (PBS)
- 8 gr sodyum klorür tartılır, 0.2 g potasyum klorür, 1.44 g disodyum hidrojen fosphate ve 0.24 g potasyum dihidrojen fosfat.
- ultra saf su 800 ml bu tartıldı kimyasal çözülür ve pH 7.4 olacak şekilde derişik hidroklorik asitle titre.
Not: Deney bu aşamada durdurulmuş olabilir.
pH 9.2 75 mM sodyum borat tampon maddesi 3. hazırlanması
- borik asit 3,0915 g tartılır. ultra saf su 75 ml içinde çözülür.
- 10 M veya daha yüksek bir konsantrasyonda bir sodyum hidroksit solüsyonu ile 9.2 arasında bir pH değerine, borik asit çözeltisi titre edilir.
Dikkat: Konsantre sodyum hidroksit çözeltileri aşındırıcı ve eldiven ele alınmalıdır. - ultra-saf su ile komple çözelti 100 ml elde edildi. Bu pH 9.2 bir 500 mM sodyum borat tampon verir.
- 75 mM sodyum borat tampon, aşırı saf su ile 500 mM sodyum borat tampon ile seyreltilir. Not: Deney bu aşamada durdurulmuş olabilir.
Kitosan Fi 4. hazırlanmasıAşılama Reaksiyon için LMS
- Oda sıcaklığında bir Petri kabındaki 2 saat 5 ml PBS, 10 kare kitosan film (1 x 1 cm) yıkayın.
- Bu süre zarfında, hazırlamak ve kapiller elektroforez cihazı (adım 5) doğrulamak.
Kapiler Elektroforez Enstrüman 5. Hazırlanması ve Doğrulama
- 50 mikron iç çapa sahip bir 43.5 cm çıplak erimiş silis kılcal hazırlayın ile ayarlanan uzunluğunda kılcal polimer dış kaplama zayıflatarak (toplam uzunluk, algılama penceresine etkili uzunluğu 43.5 cm tipik 35 cm olduğunu) künt kap sonra kılcal yakalamaya.
- girişten 8.5 cm polimer kaplama yakmak için bir çakmak kullanarak kılcal bir pencere oluşturmak ve soğuduktan sonra etanol ile silerek temizleyin. bir çakmak ile birkaç milimetre için her iki ucunda kılcal kaplama yakmak ve soğur sonra etanol ile silerek temizleyin.
- Yeri kılcal inside algılama penceresi giriş ve çıkış bölgeleri eşit boylarda yerleştirerek ve kaset iğ etrafında sararak kılcal kaset takın ve. Sonra kapiller elektroforez cihazında kaseti yükleyin.
- Her ayırma için yöntemin parametrelerini ayarlamak. Yazılım menüsünde "Tüm yöntemini düzenlemek" sonra "yöntemi" seçeneğini seçin. (Örneğin 25 ° C, 10 dakika, 30 kV) ayrılması için kullanılan sıcaklık, süre, voltaj ve küçük şişeler ayarlayın.
- (Su içinde) 1 M sodyum hidroksit (su içinde), 0.1 M sodyum hidroksit, aşırı saf su ile 5 dakika 75 mM sodyum borat tampon maddesi ile 5 dakika ile 5 dakika ile 10 dakika: Ön şartlandırma bölümünde, arka arkaya basmaları ayarlamak bir dizi analiz ilk yöntem için, pH 9.2 de.
- (Su içinde) 1 M sodyum hidroksit, pH 9 75 mM sodyum borat tampon maddesi ile 5 dakika ile 1 dakika: takip eden yöntemler için, önceden ayarlanmış şartlandırma bölümünde üst üste basması ayarlayın.2.
- Enjeksiyon bölümünde, tüm yöntemler için 10 saniye boyunca 30 mbar basınç hidrodinamik enjeksiyon için parametrelerini ayarlamak. Ayırma bölümünde, tüm yöntemler için 9 dakika boyunca, 25 ° C'de 30 kV'a ayırma koşullarını ayarlamak.
NOT: üreticileri arasında değişebilir CE cihazı çalıştırmak için prosedür olarak özel CE cihazının kullanım kılavuzuna başvurun. günde 1 M sodyum hidroksit solüsyonu hazırlayın.
- Enjekte edilir ve (75 mM sodyum borat tampon maddesi 450 ul seyreltilmiş, su içinde% 10 h / h dimetilsülfoksit 10 ul (DMSO)), nötr bir iç standart ayırın. Sonra enjekte ve aynı şekilde bir oligoacrylate standardı ayrı, kılcal geçerliliğini kontrol etmek (10 g ∙ L -1 de ultra saf suda çözünmüş Malzeme listesi bakınız). aşılama reaksiyonu başlatmak için hazır olana kadar burada dizisi Pause.
Kitosan Film üzerine RGDS 6. Tırnak
- peptid tarttın (1 mg RGDS)ve bağlama maddeleri (3 mg EDC-HCl ve 2 mg NHS).
- 2 saat PBS içinde çitosan filmi ıslatma başlamasından sonra peptit ve PBS 5 ml bağlama maddeleri çözülür.
- Bu çözeltinin 50 ul tablet alın. kısım için bir iç standart olarak nötral su içinde% 10 h / h DMSO 2 ul ekle. CE kısım analiz (adım 7).
- 5 ml PBS Petri kabı kitosan filmler durulanması için kullanılmıştır çıkarın. çitosan filmler içeren Petri kabı peptidi ve birleştirme ajanlarının 5 mi solüsyonu ilave.
- parafın film Petri kabı kapak ve oda sıcaklığında bir orbital çalkalayıcı üzerine yerleştirin. set zamanlarda reaksiyon ortamı 50 ul alikotları alın.
Not: CE toplam analiz süresi 15 dakika olan ve böylece bir alikosu her 15 dakikada bir (veya iki reaksiyonları paralel olarak izlenmektedir halinde her 30 dakika, vs.) alınabilir.- Her al bir iç standart olarak nötral su içinde% 10 h / h DMSO 2 ul ekleiquot.
NOT: Alikot en kısa sürede de alınır gibi CE analiz edilmelidir (adım 7).
- Her al bir iç standart olarak nötral su içinde% 10 h / h DMSO 2 ul ekleiquot.
- çalkalama ve bir alikot alımından 4 saat sonra, karıştırıcı Petri çanağı çıkarın. Petri kabı reaksiyon ortamı çıkarın. kitosan filmlerin durulama PBS 5 ml ekleyin.
- , Petri kabı PBS çıkarın ultra saf su ile kitosan filmi durulayın ve onları gece boyunca kurumaya bırakın. ultra saf su çıkarın ve bir plastik Petri kabındaki -20 ° C'de filmleri saklayın.
Tırnak Reaksiyon 7. İzleme CE kullanma
- Enjekte edilir ve derhal bölüm 5.2 olarak analiz koşullar kullanılarak Petri kabı çıkarıldıktan sonra reaksiyon ortamının ayrı alikotları.
- ayrılmaların tamamlandıktan sonra 10 dakika süre ile, aşırı saf su ile kılcal yıkayın. 10 dakika boyunca boş bir şişede (hava) ile bir flaş boyunca kurutun.
NOT: Deney bu aşamada durdurulmuş olabilir.
8. Veri Trea CE tment
- ayrılması sırasında akım ve (bu durumda DMSO) elektroozmotik hareketlilik marker göç zamanı hem oligoacrylate standart ayrılması için gözlenen benzeyen olduğunu kontrol ederek, her ayrılık geçerliliğini kontrol edin.
NOT: varyasyon yaklaşık 50 uA ve 1.3 dakika göç zaman değerinin beklenen cari değeri kabul edilebilir% 10-15 kadar (daha yüksek bir tekrarlanabilirlik gerekiyorsa elektroforetik mobilite değerleri yerine göç kez kullanılmalıdır). - Her başarılı ayrılması için, sağ ihracat tıklayıp uygun bir sinyali seçmek, belirli bir veri kümesi seçerek kapiller elektroforez yazılımından ham veri ihracat.
- CE tarafından kaydedilen ham veri dönüştürme (göç, zamanın bir fonksiyonu olarak, UV absorbans ile gösterilmiştir). Denklem 1 Aşağıdaki bir elektroforetik mobilite u içine X ekseni (göç zamanı t m) dönüştürmek:
n 1 "src =" / files / ftp_upload / 54549 / 54549eq1.jpg "/> (1)
L D detektöre uzunluğudur, L T kılcal toplam uzunluğu, V gerilim olduğu ve T EO nötr tür olan (bu durumda DMSO iç standart) 27 göç zamandır.
28: Denklem 2 Aşağıdaki elektroforetik hareketlilik W (μ) bir dağılımına ham veri (au absorbans) Y-ekseni dönüştürmek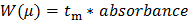 (2)
(2)
Peptid-aşılı Film 18 9. Ek Karakterizasyonu
- 4 mm solid-state NMR rotor kendi etrafında haddelenmiş peptid-aşılı kitosan filmlerin, yerleştirin. filmler şişer ve rotor kapatmak için, fosfat-tamponlu tuzlu su ile rotor doldurun. Birkaç saat bekleyin.
- 13 filmi analiz </ sup> C NMR spektroskopisi 18.
Sonuçlar
CE kitosan filmleri üzerine peptidler (ör RGDS) aşılanmasını takip için uygundur. Müsait bağlama maddeleri kitosan üzerine aşılanabilir (Şekil 1) peptidi aktive EDC-HCl ve NHS bulunmaktadır. CE reaksiyon ortamından farklı ilgi molekülleri ayırabilmektedir. elektroferogramdaki üzerinde doruklarına atamak için, saf RGDS, EDC-HCl ve NHS, çözünmüş enjekte ve ayrı ayrı ayrıldı. Pik belirlemesinden sonra, reaksiyon ortamı enjekte edilmi?...
Tartışmalar
Burada açıklanan protokol sadeliği bu ideal yaygın uygulamaya uygun hale getirir. Ancak, özellikle dikkat aşağıdaki kilit adımların ödenecek gerekmektedir.
Uygun CE enstrüman hazırlama
Gün kılcal ve aletin geçerliliğini kontrol etmek için bilinmeyen numunelerin ayrılması hemen önce bilinen bir standart (aynı zamanda da ayrılmaların dizisinin sonu) ayırmak önemlidir. Bu standart, bir oligoacrylate 27 veya göç...
Açıklamalar
Yazarlar hiçbir rakip mali çıkarları olduğunu beyan ederim.
Teşekkürler
MG, MO'C and PC thank the Molecular Medicine Research Group at WSU for Research Seed Funding, as well as Michele Mason (WSU), Richard Wuhrer (Advanced Materials Characterisation Facility, AMCF, WSU) and Hervé Cottet (Montpellier) for discussions.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Water | Millipore | All water used in the experiment has to be of Milli-Q quality | |
| Chitosan powder (medium molecular weight) | Sigma-Aldrich | 448877 | lot MKBH1108V was used. Significant batch-to-batch variations occur with natural products such as polysaccharides |
| Acetic acid - Unilab | Ajax Finechem | 2-2.5L GL | laboratory reagent |
| Dimethylsulfoxide | Sigma-Aldrich | D4540 | laboratory reagent, slightly hazardous to skin, hazardous if ingested |
| Sodium hydroxide | Sigma-Aldrich | 221465 | laboratory reagent, corrosive |
| 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide | Sigma-Aldrich | D80002 | Irritant to skin |
| N-hydroxysuccinimide | Sigma-Aldrich | 130672 | Irritant to skin |
| Sodium chloride | Ajax Finechem | 466-500G | laboratory reagent |
| Potassium chloride - Univar | Ajax Finechem | 384-500G | analytical reagent, slight skin irritant |
| Disodium hydrogen phosphate - Unilab | Ajax Finechem | 1234-500G | laboratory reagent, slight skin irritant |
| Potassium dihydrogen phosphate - Univar | Ajax Finechem | 4745-500G | analytical reagent, slight skin irritant |
| Oligoacrylate standard | custom made | See reference for synthetic protocol: Castignolles, P.; Gaborieau, M.; Hilder, E. F.; Sprong, E.; Ferguson, C. J.; Gilbert, R. G. Macromol. Rapid Commun. 2006, 27, 42-46 | |
| Boric acid | BDH AnalR, Merck Pty Ltd | 10058 | Corrosive |
| Hydrochloric acid - Unilab | Ajax Finechem | A1367-2.5L | laboratory reagent, corrosivie |
| Fused silica tubing | Polymicro (Molex) | TSP050375 | Flexible fused silica capillary tubing with standard polyimide coating, 50 µm internal diameter, 363 µm outer diameter |
| Agilent 7100 CE | Agilent Technologies | G7100CE | Capillary electrophoresis instrument |
| Orbital shaker | IKA | KS260 | |
| Electronic balance | Mettler Toledo | MS204S | |
| Milli-Q Synthesis | Millipore | ZMQS5VF01 | Ultrapure water filtration system |
| Parafilm | Labtek | PM966 | Parrafin wax |
Referanslar
- Muthukumar, M. Theory of electrophoretic mobility of a polyelectrolyte in semidilute solutions of neutral polymers. Electrophoresis. 17, 1167-1172 (1996).
- Barrat, J. L., Joanny, J. F. . in Advances in Chemical Physics, Vol Xciv Vol. 94 Advances in Chemical Physics. , 1-66 (1996).
- Fu, S. L., Lucy, C. A. Prediction of electrophoretic mobilities. 1. Monoamines. Anal. Chem. 70, 173-181 (1998).
- Harvey, D. . Modern Analytical Chemistry. , (2000).
- Oliver, J. D., Gaborieau, M., Hilder, E. F., Castignolles, P. Simple and robust determination of monosaccharides in plant fibers in complex mixtures by capillary electrophoresis and high performance liquid chromatography. J. Chromatogr. A. 1291, 179-186 (2013).
- Oliver, J. D., Sutton, A. T., Karu, N., Phillips, M., Markham, J., Peiris, P., Hilder, E. F., Castignolles, P. Simple and robust monitoring of ethanol fermentations by capillary electrophoresis. Biotechnology and Applied Biochemistry. 62, 329-342 (2015).
- Thevarajah, J. J., Sutton, A. T., Maniego, A. R., Whitty, E. G., Harrisson, S., Cottet, H., Castignolles, P., Gaborieau, M. Quantifying the Heterogeneity of Chemical Structures in Complex Charged Polymers through the Dispersity of Their Distributions of Electrophoretic Mobilities or of Compositions. Anal. Chem. 88, 1674-1681 (2016).
- Toutounji, M. R., Van Leeuwen, M. P., Oliver, J. D., Shrestha, A. K., Castignolles, P., Gaborieau, M. Quantification of sugars in breakfast cereals using capillary electrophoresis. Carbohydr. Res. 408, 134-141 (2015).
- Miramon, H., Cavelier, F., Martinez, J., Cottet, H. Highly Resolutive Separations of Hardly Soluble Synthetic Polypeptides by Capillary Electrophoresis. Anal. Chem. 82, 394-399 (2010).
- Mnatsakanyan, M., Thevarajah, J. J., Roi, R. S., Lauto, A., Gaborieau, M., Castignolles, P. Separation of chitosan by degree of acetylation using simple free solution capillary electrophoresis. Anal. Bioanal. Chem. 405, 6873-6877 (2013).
- Taylor, D. L., Ferris, C. J., Maniego, A. R., Castignolles, P., in het Panhuis, M., Gaborieau, M. Characterization of Gellan Gum by Capillary Electrophoresis. Australian Journal of Chemistry. 65, 1156-1164 (2012).
- Thevarajah, J. J., Gaborieau, M., Castignolles, P. Separation and characterization of synthetic polyelectrolytes and polysaccharides with capillary electrophoresis. Adv. Chem. 2014, 798503 (2014).
- Sutton, A. T., Read, E., Maniego, A. R., Thevarajah, J., Marty, J. -. D., Destarac, M., Gaborieau, M., Castignolles, P. Purity of double hydrophilic block copolymers revealed by capillary electrophoresis in the critical conditions. J. Chromatogr. A. 1372, 187-195 (2014).
- Righetti, P. G., Sebastiano, R., Citterio, A. Capillary electrophoresis and isoelectric focusing in peptide and protein analysis. Proteomics. 13, 325-340 (2013).
- Ali, I., Al-Othman, Z. A., Al-Warthan, A., Asnin, L., Chudinov, A. Advances in chiral separations of small peptides by capillary electrophoresis and chromatography. J. Sep. Sci. 37, 2447-2466 (2014).
- Kasicka, V. Recent developments in capillary and microchip electroseparations of peptides (2011-2013). Electrophoresis. 35, 69-95 (2014).
- Taylor, D. L., Thevarajah, J. J., Narayan, D. K., Murphy, P., Mangala, M. M., Lim, S., Wuhrer, R., Lefay, C., O'Connor, M. D., Gaborieau, M., Castignolles, P. Real-time monitoring of peptide grafting onto chitosan films using capillary electrophoresis. Anal. Bioanal. Chem. 407, 2543-2555 (2015).
- Rinaudo, M. Chitin and chitosan: Properties and applications. Prog. Polym. Sci. 31, 603-632 (2006).
- Li, Z., Leung, M., Hopper, R., Ellenbogen, R., Zhang, M. Feeder-free self-renewal of human embryonic stem cells in 3D porous natural polymer scaffolds. Biomaterials. 31, 404-412 (2010).
- Domard, A. A perspective on 30 years research on chitin and chitosan. Carbohydr. Polym. 84, 696-703 (2011).
- Shekaran, A., Garcia, A. J. Nanoscale engineering of extracellular matrix-mimetic bioadhesive surfaces and implants for tissue engineering. Biochim. Biophys. Acta Gen. Subj. 1810, 350-360 (2011).
- Custodio, C. A., Alves, C. M., Reis, R. L., Mano, J. F. Immobilization of fibronectin in chitosan substrates improves cell adhesion and proliferation. J. Tissue Eng. Regen. Med. 4, 316-323 (2010).
- Boateng, S. Y., Lateef, S. S., Mosley, W., Hartman, T. J., Hanley, L., Russell, B. RGD and YIGSR synthetic peptides facilitate cellular adhesion identical to that of laminin and fibronectin but alter the physiology of neonatal cardiac myocytes. Am. J. Physiol. Cell Physiol. 288, C30-C38 (2005).
- Lefay, C., Guillaneuf, Y., Moreira, G., Thevarajah, J. J., Castignolles, P., Ziarelli, F., Bloch, E., Major, M., Charles, L., Gaborieau, M., Bertin, D., Gigmes, D. Heterogeneous modification of chitosan via nitroxide-mediated polymerization. Polym. Chem. 4, 322-328 (2013).
- Gartner, C., Lopez, B. L., Sierra, L., Graf, R., Spiess, H. W., Gaborieau, M. Interplay between Structure and Dynamics in Chitosan Films Investigated with Solid-State NMR, Dynamic Mechanical Analysis, and X-ray Diffraction. Biomacromolecules. 12, 1380-1386 (2011).
- Castignolles, P., Gaborieau, M., Hilder, E. F., Sprong, E., Ferguson, C. J., Gilbert, R. G. High resolution separation of oligo(acrylic acid) by capillary zone electrophoresis. Macromol. Rapid Commun. 27, 42-46 (2006).
- Chamieh, J., Martin, M., Cottet, H. Quantitative Analysis in Capillary Electrophoresis: Transformation of Raw Electropherograms into Continuous Distributions. Anal. Chem. 87, 1050-1057 (2015).
- Maniego, A. R., Ang, D., Guillaneuf, Y., Lefay, C., Gigmes, D., Aldrich-Wright, J. R., Gaborieau, M., Castignolles, P. Separation of poly(acrylic acid) salts according to topology using capillary electrophoresis in the critical conditions. Anal. Bioanal. Chem. 405, 9009-9020 (2013).
- Chung, T. W., Lu, Y. F., Wang, S. S., Lin, Y. S., Chu, S. H. Growth of human endothelial cells on photochemically grafted Gly-Arg-Gly-Asp (GRGD) chitosans. Biomaterials. 23, 4803-4809 (2002).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır