Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Sıralı Fumigasyon Kuluçka Prosedürleri kullanma Toprakta Dayanıksız Organik Karbon Değerlendirilmesi
Bu Makalede
Özet
Labile organic carbon (LOC) and the potential carbon turnover rate are sensitive indicators of changes in soil nutrient cycling processes. Details are provided for a method based on fumigating and incubating soil in a series of cycles and using the CO2 accumulated during the incubation periods to estimate these parameters.
Özet
Yönetim uygulamaları ve çevresel değişiklikler, toprak besin ve karbon bisiklet değiştirebilir. Toprak kararsız organik karbon, bir kolaylıkla ayrışabilir C havuzu, rahatsızlık oldukça duyarlıdır. Aynı zamanda besin döngüsü için temel bir toprak mikroorganizmaları için birincil substrat vardır. Nedeniyle bu özelliklerine, kararsız organik karbon (KO) toprak sağlığı için bir gösterge parametre olarak tespit edilmiştir. LOC devir hızı miktarının da toprak besin döngüsü süreçlerinde değişiklikleri anlamakta yardımcı olur. Sıralı fümigasyon inkübasyon yöntemi toprak LOC ve potansiyel C devir hızı tahmin etmek geliştirilmiştir. Yöntem toprak örnekleri fumigating ve tütsüleme-inkübasyon döngüsü bir dizi üzerinde 10 günlük kuluçka döneminde CO 2-C solunuma ölçülmesi gerektirir. Kararsız organik C ve potansiyel C devir hızı daha sonra bir negatif üstel modeli ile birikmiş CO 2 hesaplanmıştır. Bu yöntemi yürütmek için prosedürler tarif vardırd.
Giriş
Nedeniyle karbon (C) ve besin döngüsü ve toprak değişimine duyarlılığı içinde hayati rollere, toprak LOC toprak organik madde kalitesinin bir göstergesi olarak ölçmek için önemli bir parametredir. büyük ölçüde ormanlar ve Ekosistemler besin kaynağı olarak toprak organik madde besinlerin mineralizasyon bağlıdır. Yönetimi faaliyetleri besin kaynağı 1 değişiklikler sonucu, toprak organik C havuzu boyutunu ve devir hızı değiştirebilir. Toprak organik C birkaç yıl 2,3,4 birkaç hafta ciro oranlarına sahip inatçı birkaç bin yıl ciro oranlarına sahip C ve LOC, iki temel kesirler oluşur. Toprak kararsız Cı, bitki çöp 1,4,5 mikrobiyal biyokütle C, düşük molekül ağırlıklı bileşikler (amino asitler, basit karbonhidrat) tesis rhizodeposition arasında, ve ayrıştırma yan ve sızıntı suları gibi kolayca ayrıştırılabilen yüzeyler oluşur. Toprak kararsız C kolayca ayrışabilir olduğundan, orahatsız veya toprağa 6 değiştirmek yönetim uygulamaları ve doğal olayların son derece duyarlı. Toprak kararsız C organik maddenin 7 ayrışma toprak mikroorganizmaları için birincil enerji kaynağı olarak hizmet vermektedir. Toprağın organik C 8 kararlı formları yaptığından daha büyük ölçüde böyle, LOC etkiler besin döngüsü olarak. Toprak mikroorganizmalar da LOC 9,10,11 ve prime etkisi ile kolaylaştırdı inatçı toprak organik madde ayrışması sırasında meydana heterotrofik solunum çoğunluğu sorumludur. Toprak organik C yaklaşık iki katı atmosferik C 11 olduğundan, bu solunum küresel C döngüleri önemli bir rol oynar.
Karasal ekosistemlerde önemi bir sonucu olarak, çeşitli yöntemler, toprak LOC tahmin etmek için geliştirilmiştir. fiziksel, kimyasal ve biyokimyasal: Bu yöntemler üç genel sınıfa tarif edilebilir. Densitometrik ayırma yöntemleri, fiziksel met vardırağır veya hafif fraksiyonlar halinde veya kaba ve ince tanecikli organik C 12,13,14,15 içine toprak organik C ayıran oluşur ods. Ayırma yöntemleri gerçekleştirmek için nispeten kolay, ama onlar çoğu zaman yapmak için şu fraksiyonları toprak tipi mineral kompozisyonu, bitki materyali boyut ve yoğunluk ve toprak agrega tutarlılık 13,15 ile değişir çünkü tutarlı sonuçlar üretir. Ayırma yöntemleri de LOC 15 hakkında sadece niceliksel bilgi üretmek.
Çeşitli kimyasal yöntemler LOC tahmini için kullanılabilir. organik karbon sulu ekstraksiyon gerçekleştirmek için nispeten kolaydır, ve yöntemler genellikle kolayca tekrarlanabilir sonuçlar sağlamaktadır. Bununla birlikte, bu ekstraksiyon mikroorganizmalar 15 için uygun alt-tabakaların bütün spektrumunu içermez. Toprağın organik C kimyasal fraksiyon için çeşitli oksidasyon yöntemleri geliştirilmiştir. Oksidasyon yöntemleri miktarı ve kararsız organik C kalitesini karakterize avantajına sahiptirBazı yöntemler tehlikeli kimyasallarla çalışma gerektirir ve sonuçların 15 tekrarlanabilirlik yöntemler arasında değişkenlik olmasına rağmen. Asit hidroliz ekstraksiyon yöntemi miktarı ve LOC kalitesini ölçmek kimyasal fraksiyonasyon prosedürünün başka bir türüdür, ancak bu yöntemin sonuçları biyolojik özelliklerinin 13,15 yorumunu kolaylaştırmak yoktur.
Toprak LOC yorumlanması için biyokimyasal yöntemler geliştirilmiştir. CO2 solunum deneylerinde mikroorganizmalar tarafından açıklanan olarak kararsız organik Cı ölçülebilir. Bu testler gerçek madeni organik madde tahminleri sağlamak, ancak tipik olarak sadece en kararsız bileşikler deneyleri 15 sırasında mineralize bulunmaktadır. Tütsüleme-inkübasyon 16 ve tütsüleme-çıkarma 17 ile ölçülen toprak mikrobiyal biyokütle C LOC ilgili çıkarımlarda geliştirmek için kullanılır olmuştur. Ancak, bu işlemler mikrobiyal biyokütle ziyade LO C tahminleri sağlamakC. Her iki fumigasyon işlemleri Mikrobiyalbiyokütle C belirlemek olmayan fumigated topraktan değerler çıkarılmak içerir, ancak değerler olmayan fumigated toprak çıkarma olmaksızın elde ileri mikrobiyal biyokütle 18 ilave olarak C olarak kararsız organik fraksiyonlar bir ölçüsünü temin edilmiştir .
LOC ölçmek için sıralı tütsüleme-inkübasyon (SFI) prosedürü 13 toprak mikrobiyal biyokütle C ölçümü için tütsüleme kuluçka prosedürü 16 uyarlanan bir biyokimyasal bir yöntemdir. SFI yöntemi LOC tahmin diğer yöntemlere göre bazı avantajları vardır. yöntem için kavramsal bir baz LOC mikrobiyal büyümeyi düzenleyen mikrobik parçalanabilir C ve LOC fiziksel olarak erişilebilir ve toprak mikroorganizmaları tarafından kimyasal olarak bozunabilir olmasıdır. tarla koşullarında, mikrobiyal büyüme tipik olarak karbon kullanılabilirlik, besin durumu, mevcut gözenek alanı ve / veya avlanma ile sınırlıdır. Bu faktörler, yaklaşık elimi olanmikrobiyal büyüme için engelsiz koşullar yaratarak, fümigasyon ile düzensizlikler. Resim besin yöntemin inkübasyon süresi boyunca kaldırılır. Birden fazla fümigasyon ve inkübasyon döngüleri boyunca, mikrobiyal büyüme C miktarı ve kalitesi (oynaklığı) 13 ile sınırlı olur. İnkübasyon döngüleri sırasında biriken CO 2 solunuma basit bir negatif üstel modeli 11,13,19 ile LOC tahmin etmek için kullanılır. SFI yöntemi aynı anda konsantrasyonları ve LOC 11 potansiyel devir hızı tahmin çoğu diğer LOC yöntemlerine göre avantajı vardır, böylece potansiyel C devir hızı da, üstel modelin eğimi elde edilebilir. Örneğin 14 ° C olarak izleyiciler 13 kullanıldığı takdirde diğer yöntemler için, LOC potansiyel ciro oranlarına ilişkin bilgiler, sadece tespit edilebilir. SFI Dolayısıyla bu yöntem LOC ve potansiyel devinimlerinin hem ölçümlerini elde etmek için nispeten basit ve pahalı olmayan bir tekniktir.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. Birimler 20 Deneysel Alanı içinde ve Deneysel içinde Koşulların örnekleri Temsilcisini Get Toprak toplayın
- Böyle doku, yığın yoğunluğu, pH, organik ufuk derinliği, ve / veya besin konsantrasyonları da dahil olmak üzere eğim ve toprak özellikleri gibi site özelliklerinde herhangi bir farklılık tespit. araziler içinde bitki türü herhangi bir farklılık tespit. Site özellikleri önceden belirtilen göreli hata elde etmek için gerekli örneklerin sayısını tahmin etmek için varyasyon katsayılarının bilinen veya yayınlanmış tahminleri kullanın.
- site ve deneysel birim koşullarına dayanan bir desende bir burgu veya başka bir toplama cihazı kullanarak örnek toprak.
- Homojen koşulları için, her deneysel birim içinde rastgele örnekleme deseni kullanabilirsiniz.
- Deneysel biriminin içinde veya zikzak desen tamamen rasgele yerlerde ya da örnek noktaları atayın.
- Her rastgele bir noktada ya da bir zikzak desendeki atanan noktalarda örnek toprakn. Toprak örneği kazmaya burgu veya başka bir toplama cihazı kullanmadan önce mineral toprak yüzeyinden organik madde kenara fırçalayın.
NOT: SFI yöntemi Oa gelen ve 13 altında toprak ufuklar kullanılarak geliştirilmiştir. Oa Yukarıdaki ufuklar SFI yöntem kullanılarak test edilebilir, eğer daha fazla test gereklidir. - Tek bir kap içine deneysel birim içinde toplanan tüm örneklerin birleştirin ve fiziksel olarak her deneysel birim için birleşik bir örnek oluşturmak için konteyner içinde tek tek örnekleri karıştırın.
- çok daha yaygın olan heterojen koşullar için, her deneysel birim içinde bir sistematik örnekleme deseni kullanın.
- transect olan numune noktası arasındaki mesafe, deneysel birimlerine değişkenliği temsil etmek için gereken mesafeden daha küçük olacak şekilde her deney ünitesinin merkezi transect birlikte örnek topraklar.
- Her ex içinde birden çok hat boyunca örnek topraklarnispeten büyük deneysel birimleri veya değişkenlik birden fazla kaynaktan ile deneysel birimleri bir ızgara deseni oluşturmak deneysel bir birim.
- Tek bir kabın içine her transect boyunca toplanan tüm örneklerin birleştirin ve fiziksel her transect için kompozit örnek oluşturmak için konteyner içinde tek tek örnekleri karıştırın.
- Homojen koşulları için, her deneysel birim içinde rastgele örnekleme deseni kullanabilirsiniz.
2. SFI Testi için Toprak hazırlayın
- bir buz paketi yerleştirin örnekleri alanda toplandıktan sonra soğutucu hemen doldurdu.
- Tesiste girişte hangi örnekler numune hazırlama ve SFI prosedürleri yapılmaktadır kadar 4 ° C'de buzdolabında analizi, yer örneklerinin kadar saklanabilir vardır.
- 6,4 mm x 6,4 mm elekten elek toprak örnekleri. numuneler arasındaki kirlenmeyi önlemek için her bir numune arasında su ile örgü temizleyin.
- Her bir örnek için, üç adet 100 gr Alt-numûnelerin ölçülmesi ve 250 ml'lik bir beher içinde, 100 gr Alt-numûnelerin yerleştirin. kapak eacParafilm ile H beher ve 25 ° C'de 10 gün boyunca bir tezgah üzerinde bırakın.
Fırın kuru Ağırlık Tayini için 3. alın alt-numunelerin
- Toprak örnekleri, 10 günlük ön-inkübasyon sonunda, her bir numuneden Parafilm çıkarın.
- Bir alüminyum ağırlık tekne tartmak kaydedin. Tüm örneklerde toprak 1 g alın ve tekne tartmak yerleştirebilirsiniz.
- nemli toprak ağırlığını kaydedin ve tekne tartın.
- 105 ° C de bir fırında toprakla tekneler ağırlık yerleştirin. Numuneler, genellikle 48 saat sonra, rekor ağırlıkları tekne ve toprak tartmak bir sabit ağırlığa ulaşmak sonra.
- nemli ve kuru toprak kilo almak için tartmak tekne içinde nemli toprak ve kuru topraktan alınan ağırlıklar tekne ağırlığını tartın çıkarın. nemli toprak ağırlığına göre kuru toprak ağırlığının bölerek nemli toprak oranı: kuru türevi.
4. fumigasyon Toprak Örnekleri
- (Mor en az iki alt nemli bir kağıt havlu yerleştirine porselen tabaklar 10.5 L cam vakum desiccators) numune sayısına bağlı olarak gerekli olabilir.
- Tüm örnekler için, üç ayrı cam şişelere toprağın 30 g tartın. 5. bölümünde anlatılan kuluçka konteyner tasarımı kullanılırsa 40 mm açıklığı sığacak şekilde toprağın 40 gr tutmak için yeterince büyük ve yeterince dar şişeleri kullanın.
- etiketleme bant kullanarak her 30 g toprak alt örnek tanımlamak için ise fümigasyon mürekkep parçalayan, çünkü kalem kullanın.
- fümigasyon yapmak olmaz bir vakum desikatörde bir vakum fümigasyon desikatörde ve bir alt örnek her bir toprak örneği için üç 30 g alt örneklere iki koyun.
- 100 ml'lik bir cam kaba, kabın alt karşılamak için yeterli taşları kaynayan bir katman yer.
- Kaynama taş tabakası ile 100 ml'lik bir cam kaba, etanol içermeyen kloroform içinde 50 ml (CHCI3) dökün. 30 g toprak ile doldurulmuş bir desikatör merkezinde kaynama taş ve CHCI3 ile 100 mi behere koyunalınan örnekler. davlumbaz altında bu adımı gerçekleştirin.
- Davlumbaz altında, toprak numune başına alt örneklere iki takım fumigasyon için CHCl3 kaynatmak için bir vakum kullanın.
- Vakum tüp ile vakum desikatörde vakum bağlayın. Vakum başlatın ve CHCl3 kaynamaya başlar izlemek.
- Hava desikatöre geri akmasına izin vermek için desikatöre vakum tüpü 30 saniye boyunca kaynatın ve kesmek için CHCl3 izin verin. Bu adım toprak örnekleri içine CHCl3 gaz girişini teşvik etmektedir. İki kez tekrarlayın.
- Bu 2 dakika için kaynamaya izin CHCI3 bir dördüncü ve son kaynama gerçekleştirin.
- Vakum hala çalışmaktayken desikatörde içinde vakum korunur, böylece vakum desikatörde üzerinde mühür kapatın. Vakumu kapatın ve desikatörde Vakum tüp ayırın.
- desikatörde bir kapak yerleştirerek ve vakum stoper mühürleme suretiyle olmayan fumigated örnekleri içeren desikatörde Seal. P24 saat (örneğin bir kabine gibi) karanlık bir alanda Desiccators (fumigated ve non-fumigated) dantel. olmayan fumigated örnekleri içeren desikatörde üzerinde alt bölüm 4.7 vakum prosedürlerini tekrar etmeyin.
5. Toprak Numune İnkübasyon için konteynerler birleştirin
- merkezinde açılan bir delik ile bir büyüklüğü 10 lastik tıpa ile 15 cm uzunluğunda cam çubuk itin. Mil çapı rahatça delikten uygun için yeterli olması gerekmektedir.
- fumigated ve non-fumigated alt örnek tanımlama karşılık gelen kimlik ile 0.5 L saydam geniş ağızlı polipropilen şişe etiketleyin.
davlumbaz altında Desiccators 6. Evacuate Kloroform
- desikatöre içine hava akımını sağlamak için bir vakum desikatörde üzerinde stoper açın. desikatöre kapağını kaldırın ve örnekleri ve desikatörde dışında nemli havlu almak.
- Toprak örneklerinden CHCl3 gazı tahliye etmek için bir vakum kullanın.
- desikatöre kapağı yerleştirin. Vakum boru ile bir vakum desikatörde bağlayın.
- Vakum pompası açın ve pompa beş dakika çalışmasına izin. desikatöre içine hava akımına izin için desikatöre Vakum hortumunu ayırın.
- Adımı tekrarlayın 6.3.2 dört kez.
7. 10 Gün kuluçka Davranış için bir Kuluçka Konteyner (Şekil 1) içine her Toprak alt örnek Taşı
- Pipet inkübasyon kabına deiyonize su 1 mi. bir lastik bant kullanarak boyutu 10 stoper uzanan cam çubuk boş bir cam şişe bağlayın. Cam şişenin açık ucu durdurucu taban bakmalıdır. Cam şişe sıvı 40 ml kadar tutmak için yeterli boyutta olması gerekmektedir.
- Kuluçka kabına 30 g toprak alt örnek içeren bir şişe yerleştirin.
- inoculu olarak (fumigated ve olmayan fümigasyon) karşılık gelen alt örneklere her birine özgün toprak örneği olmayan fumigated toprağın 1 gr eklem.
- Pipet stoper / cam çubuğa bağlı bir cam şişe içinde 2 M NaOH ile 1 mi. İnkübasyon kabın üst kısmına stoper / cam çubuk itin. Parafilm ile inkübasyon, kabın üst kapağı.
- hiçbir toprak içeren bir kuluçka konteyner oluşturun. Üç beş no-toprak kuluçka kapları birleştirin.
NOT: lekesi kabın örnekleri titre etmek için kullanılan asit alt bölüm 9.3, aşağıda anlatılan kuluçka süresi boyunca CO2 mineralizasyon belirlenmesi için gereklidir. Böyle, birden no-toprak kaplar, yanlış kullanım ya da tüm örnekler için CO 2 mineralizasyon hesaplamada bir hata yaratacak bir hayır-toprak kuluçka kabın titrasyonu karşı bir önlem olarak oluşturulan olarak. değerlerine yakın olmalıdır no-toprak kapları örnekleri titre etmek için kullanılan asit; no-toprak kap örnekleri arasında son derece farklı asit değeri büyük olasılıkla hatalı numune alma ya da titrasyon sonucudur.- Kuluçka konteynerleri monte bölüm 5 prosedürleri takip edin.
- 7.1 ve 7.4 prosedürleri takip edin.
- 25 ° C de karanlık bir depolama alanında, tüm kuluçkalama kapları yerleştirin. 10 gün boyunca depolama alanında tüm inkübasyon kapları bırakın.
8. Kuluçka Döneminde Mikrobiyal Solunum tarafından üretilen CO 2 belirlememize Her alt örnek üzerinde Titrasyonu gerçekleştirin
- Kuluçka kabından 2 M NaOH içeren cam şişe çıkarın.
- Pipet 2 M NaOH ihtiva eden bir cam şişe içinde 1 M BaCl 2 ile 2 mi.
- Fenolftalein bir damla ekleme (Cı 20 saat 14 O 4) BaCl 2 ve NaOH karışımı içeren bir cam şişe içinde, bir pipet veya ilaç kupasında damlalık. cam şişe bir manyetik karıştırma çubuğu yerleştirin ve bir karıştırma plakası üzerinde bir cam şişe yerleştirin.
- aktive karıştırma plaka ile, yavaş yavaş yeniden kadar damlalık ile 0.1 N HCl ekleyincam şişe içinde karışımın d renklenmesi açık döner.
- cam şişe içinde karışımın renklerini değiştirmek için gerekli HCI miktarı kaydedilir.
9. Birinci Fümigasyon-inkübasyon Döngüsü 16,21,22 sırasında Toplanan Verilerin gelen Mikrobiyal Biyokütle C belirleyin
- Adım 3.8 'de elde edilen nemli ağırlık oranı: Kuru tarafından nemli ağırlığını çarpılarak her alt örnek toprağın kuru ağırlığını belirlemek.
- no-toprak kuluçka konteynerleri titre etmek için kullanılan HCl ortalama miktarını belirler.
- Formül kullanılarak 10 günlük inkübasyon sırasında CO mineralli 2 hesaplayın:

burada CO 2 = CO 10 günlük inkübasyon sırasında 2 mineralize
NS = Asit no-toprak kuluçka kapta örnekleri titre kullanılan
S = Asit inkübasyon kap içinde toprak bulunan örnekleri titre etmek için kullanılır
th M = molaritesie HCI
E = 6, eşdeğer ağırlığı
Kuluçka kap içinde ihtiva edilen toprağın B = kuru ağırlık - aşağıdaki formül kullanılarak mikrobiyal biyokütle C hesaplayın:
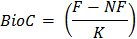
BioC Mikrobiyalbiyokütle C = burada
Fumigated edildi toprak alt örneklere F = CO 2 mineralize
Olmayan fumigated edildi toprak alt örneklere NF = CO 2 mineralize
K = Mikrobiyalbiyokütle Cı mineralize fraksiyonu 2 CO- Toprak ile ön testler veya yayınlanmış değerler 22 14 C mineralizasyon doğrudan ölçüm biri tarafından K değerini belirlemek. 0.45 değeri, genel olarak, bu deneyde 23 için K için kullanılmaktadır.
- İlk tütsüleme kuluçka döngüsünde fümigasyon edildi toprak alt örneklere için bölümler 4-8 yedi kez tekrarlayarak sıralı tütsüleme ve inkübasyon çevrimi gerçekleştirin.
10. unsurlarine Dayanıksız C ve Sekiz Fümigasyon ve Kuluçka Çevrimlerin Dersin üzerinde CO 2 Mineralize kullanma Potansiyel C Devir Hızı
- Her fümigasyon sonra numunelere ilave toprak inokulum için bir düzeltme faktörü belirlemek için aşağıdaki formülü kullanın:
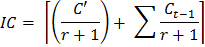
IC inokulum için düzeltme faktörü = Nerede
C '= CO 2 miktarı olmayan fumigated alt örnek ilk 10 günlük inkübasyon sırasında
İlk ilaçlama kuluçka döngüsünde fumigated toprağa aşı toprağın r = Ağırlık oranı
Cı t = inkübasyon döngüsü (1, 2 ... 8), örneğin Cı, t-1 = 0 olduğunda t = 1 olduğu - Her alt örnek için her inkübasyon sırasında salınan CO 2 tahmini için şu formülü kullanın:
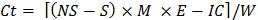
Ct = CO 2 inkübasyon sırasında salınan nerede
NS = Asit örnekleri titre için kullanılanno-toprak kuluçka kapta
S = Asit inkübasyon kap içinde toprak bulunan örnekleri titre etmek için kullanılır
IC (Adım 10.1 belirlenen) inokulum için düzeltme faktörü =
E = 6, eşdeğer ağırlığı
Kuluçka kap içinde ihtiva edilen toprağın B = kuru ağırlık - lineer olmayan regresyon kullanılarak olarak kararsız organik C türevi.
- Örnek için her bir numune tanımlayıcıları içeren bir elektronik tablo düzenleme, inkübasyon sırasında ortaya çıkan kuluçka döngü sayısı (1, 2 ... 8) ve CO2 (aşama 10.2 türetilmiş).
- doğrusal olmayan regresyon yeteneğine sahip yazılımı kullanarak, veri kümesi aşağıdaki modeli uygun:

Csum sekiz kuluçka döngüleri sırasında açığa CO 2 toplamını = nerede
LOC = toprak kararsız organik C
k = potansiyel ciro süresi
t = inkübasyon döngüsü (1, 2 ... 8)
- Potansiyel ciro t dönüştürmeknedeniyle 10 gün kuluçka döngüsü 10 ile k tersini çarpılarak gün içine adım 10.3.2 den ime.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Güneydoğu Amerika Birleşik Devletleri 24,25,26,27 yapılan deneyler bir dizi bu yazıda anlatıldığı gibi SFI yöntemi kullanılmıştır. Birlikte, bu deneyler loblolly çamı (Pinus taeda L.), switchgrass (dallı darı L.), Kavağı dahil, vejetasyon tiplerinin çeşitli kapsayan (Populus deltoides Bartram ex Marsh.) Ve soya fasulyesi (Glycine max L. Merr.). yöntem gübreleme arasında LOC ve / veya potansiyel C devir oranlarındaki...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
The SFI method is an effective protocol for detecting differences in soil LOC and potential C turnover rates over a range of management practices (such as fertilization, tillage, vegetation control, and harvest practices) and soil conditions. Soil LOC content and C turnover rate can be used to understand alterations of nutrient cycles. The SFI method also provides measurement of microbial biomass C from the first fumigation-incubation event. The ability to measure soil LOC, C turnover, and microbial biomass C concurrentl...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
The authors gratefully acknowledge Michelle Gonzales, Kenny Kidd, Brad Osbon, and all other personnel that conducted the laboratory procedures for these data. The authors are thankful for assistance from Andrew Scott in developing software coding to conduct model-fitting procedures. The authors also appreciate the funding from the U.S. Department of Agriculture National Institute of Food and Agriculture, Sustainable Agriculture and Research & Education, Sun Grant South Central region, and the National Council of Air and Stream Improvement that made possible the studies from which representative results provided in this paper were drawn.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Soil auger sampling kit | JMC | PN039 | Several other manufacturers of punch augers are available |
| Parafilm | Curwood | PM999 | |
| Aluminum weighing boats | Fisherbrand | 08-732-103 | |
| General purpose drying oven | Fisher Scientific | 15-103-0511 | Many other manufacturers of general purpose laboratory ovens are available |
| 10.5 L vacuum desiccator | Corning | 3121-250 | |
| Glass scintillation vial | Wheaton | 968560 | |
| Glass threaded vials, 41 ml | Fisherbrand | 03-339-21N | |
| Chloroform, stabilized with amylenes | Sigma-Aldrich | 67-66-3 | |
| Boiling chips | Fisher Scientific | S25201 | |
| Glass rod | Fisherbrand | S63449 | |
| Size 10 rubber stopper | Fisherbrand | 14-130P | Rubber stoppers can be purchased as solid and drilled in center to install glass rod or bought with a hole to insert glass rod |
| Wide-mouth PPCO bottle, 0.5 L | ThermoScientific | 3121050016 | |
| Sodium hydroxide, reagent grade | Sigma-Aldrich | S5881 | |
| Barium chloride | Sigma-Aldrich | 202738 | |
| Phenolphthalein indicator | Fisher Scientific | S25466 | |
| Hydrochloric acid solution, 0.1 N | Fisher Scientific | SA54-4 |
Referanslar
- Blair, G., et al. Soil carbon fractions based on their degree of oxidation, and the development of a carbon management index for agricultural systems. Aust. J. Agric. Res. 46, 1459-1466 (1995).
- Schimel, D. S., et al. Soil organic matter dynamics in paired rangeland and cropland toposequences in North Dakota. Geoderma. 36, 201-214 (1985).
- Parton, W. J., et al. Analysis of factors controlling soil organic matter levels in great-plains grasslands. Soil Sci. Soc. Am. J. 51, 1173-1179 (1987).
- Wu, H., et al. Labile organic C and N mineralization of soil aggregate size classes in semiarid grasslands as affected by grazing management. Biol. Fertil. Soils. 48, 305-313 (2011).
- Jones, D. L., et al. Plant and mycorrhizal regulation of rhizodeposition. New Phytol. 163, 459-480 (2004).
- Harrison, K. G., et al. The effect of changing land use of soil radiocarbon. Science. 262, 725-726 (1993).
- Jinbo, Z., et al. Land use effects on the distribution of labile organic carbon fractions through soil profiles. Soil Sci Soc. Am. J. 70, 660-667 (2006).
- Whalen, J. K., et al. Carbon and nitrogen mineralization from light- and heavy-fraction additions to soil. Soil Biol Biochem. 32, 1345-1352 (2000).
- Gregorich, E. G., et al. Towards a minimum data set to assess soil organic matter quality in agricultural soils. Can. J. Soil Sci. 74, 367-385 (1994).
- Hamer, U., et al. Priming effects in different soil types induced by fructose, alanine, oxalic acid and catechol additions. Soil Biol. Biochem. 37, 445-454 (2005).
- Feng, W., et al. Shifting sources of soil labile organic carbon after termination of plant carbon inputs in a subtropical moist forest of southwest China. Ecol. Res. 26, 437-444 (2011).
- Tisdall, J. M. Formation of soil aggregates and accumulation of soil organic matter. Structure and Organic Matter Storage in Agricultural Soils. Carter, M. R., Stewart, B. A. , Lewis Publishers. 57-96 (1996).
- Zou, X. M., et al. Estimating soil labile organic carbon and potential turnover rates using a sequential fumigation-incubation procedure. Soil Biol. Biochem. 37, 1923-1928 (2005).
- Cambardella, C. A., Elliott, E. T. Particulate soil organic matter changes across a grassland cultivation sequence. Soil Sci. Soc. Am. J. 56, 777-783 (1992).
- Strosser, E. Methods for determination of labile soil organic matter: an overview. J. Agrobiol. 27, 49-60 (2010).
- Jenkinson, D. A., Powlson, D. S. The effects of biocidal treatment on metabolism in soil V: a method for measuring soil biomass. Soil Biol. Biochem. 8, 209-213 (1976).
- Vance, E. D., et al. An extraction method for measuring soil microbial biomass C. Soil Biol. Biochem. 19, 703-707 (1987).
- De-Polli, H., et al. Chloroform fumigation-extraction labile C pool (microbial biomass C "plus") shows high correlation to microbial biomass C in Argentinian and Brazilian soils. Cienc. Suelo. 25, 15-22 (2007).
- Olson, J. S. Energy storage and the balance of producers and decomposers in ecological systems. Ecology. 44, 322-331 (1963).
- Pennock, D., et al. Chapter 1, Unit 1, Soil sampling designs. Soil Sampling and Methods of Analysis. Carter, M. R., Gregorich, E. G. , CRC Press, Taylor & Francis Group, LLC. (2008).
- Luizao, R. C. C., et al. Seasonal variation of soil microbial biomass: the effects of clearfelling a tropical rainforest and establishment of pasture in the central Amazon. Soil Biol. Biochem. 24, 805-813 (1992).
- Horwath, W. R., Paul, E. A., et al. Microbial biomass. Methods of soil analysis part 2: microbiological and biochemical properties. Weaver, R. W. , Soil Science Society of America, Inc. 753-773 (1994).
- Jenkinson, D. S., Ladd, J. N. Microbial biomass in soil: measurement and turnover. Soil Biochemistry. Paul, E. A., Ladd, J. N. , Marcel Dekker. 415-471 (1981).
- Blazier, M. A., et al. Poultry litter fertilization impacts on soil, plant, and water characteristics in loblolly pine (Pinus taeda L.) plantations and silvopastures in the mid-South USA. Principles, application, and assessment in soil science. Gungor, E. B. O. , InTech, Inc. 43-74 (2011).
- Blazier, M. A., et al. Straw harvesting, fertilization, and fertilizer type alter soil biophysical properties in a loblolly pine plantation in the mid-South USA. Biol. Fertil. Soils. 45, 145-153 (2008).
- Blazier, M. A., et al. Loblolly pine age and density affects switchgrass growth and soil carbon in an agroforestry system. For. Sci. 58, 485-496 (2012).
- Blazier, M. A., et al. Nitrogen and carbon of switchgrass, loblolly pine, and cottonwood biofuel production systems in the Southeast United States. For. Sci. 61, 522-534 (2015).
- Zhang, M., et al. Decomposition differences of labile carbon from litter to soil in a tropical rain forest and rubber plantation of Xishuagbanna, southwest China. Eur. J. Soil Biol. 55, 55-61 (2013).
- Nelson, D. W., Sommers, L. E. Total carbon, organic carbon, and organic matter. Methods of soil analysis. Part 3: chemical methods. Sparks, D., et al. , Soil Science Society of America, Inc. 961-1090 (1996).
- Huang, L., et al. Correlation among soil microorganisms, soil enzyme activities, and removal rates of pollutants in three constructed wetlands purifying micro-polluted river water. Soil Biol. Biochem. 70, 221-228 (2012).
- Kong, L., et al. Enzyme and root activities in surface-flow constructed wetlands. Chemosphere. 76, 601-608 (2009).
- Cui, L., et al. Evaluation of nutrient removal efficiency and microbial enzyme activity in a baffled subsurface-flow constructed wetland system. Bioresour. Technol. 146, 656-662 (2013).
- Jenkinson, D. S. Determination of microbial biomass carbon and nitrogen in soil. Advances in nitrogen cycling in agricultural ecosystems. Wilson, J. R. , CAB International. 368-386 (1988).
- Sparling, G. P., et al. Interference from plant roots in the estimation of soil microbial ATP, C, N, and P. Soil Biol. Biochem. 17, 275-278 (1985).
- Christie, P., Beatte, J. A. M. Significance of sample size in measurement of soil microbial biomass by the chloroform fumigation-incubation method. Soil Biol. Biochem. 19, 149-152 (1987).
- McLaughlin, K. K., Hobbie, S. E. Comparison of labile soil organic matter fractionation techniques. Soil Sci. Soc. Am. J. 68, 1616-1625 (2004).
- Xia, X., et al. Variation of soil labile organic carbon pools along an elevational gradient in the Wuyi Mountains, China. J. Resour. Ecol. 1, 368-374 (2010).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır