Method Article
Virionlar antijenik Spectra ve ekstrasellüler veziküllerin Analiz Virometry Akış
Bu Makalede
Özet
Viruses or extracellular vesicles were immunocaptured with 15 nm magnetic nanoparticles coupled to antibodies recognizing surface antigens. The captured virions or vesicles were labeled with fluorescent antibodies against other surface antigens. The resultant complexes were separated in high magnetic field and analyzed with conventional flow cytometers triggered on fluorescence.
Özet
Cells release small extracellular vesicles (EVs) into the surrounding media. Upon virus infection cells also release virions that have the same size of some of the EVs. Both virions and EVs carry proteins of the cells that generated them and are antigenically heterogeneous. In spite of their diversity, both viruses and EVs were characterized predominantly by bulk analysis. Here, we describe an original nanotechnology-based high throughput method that allows the characterization of antigens on individual small particles using regular flow cytometers. Viruses or extracellular vesicles were immunocaptured with 15 nm magnetic nanoparticles (MNPs) coupled to antibodies recognizing one of the surface antigens. The captured virions or vesicles were incubated with fluorescent antibodies against other surface antigens. The resultant complexes were separated on magnetic columns from unbound antibodies and analyzed with conventional flow cytometers triggered on fluorescence. This method has wide applications and can be used to characterize the antigenic composition of any viral- and non-viral small particles generated by cells in vivo and in vitro. Here, we provide examples of the usage of this method to evaluate the distribution of host cell markers on individual HIV-1 particles, to study the maturation of individual Dengue virions (DENV), and to investigate extracellular vesicles released into the bloodstream.
Giriş
çok hücreli organizmalarda hücreler, belirli bir hücre için özel olarak mevcut ya da en azından hücre özel gruplarına ait olabilir birçok bireysel özelliklere sahiptir. onların çeşitli morfoloji ile kanıtlandığı gibi, hatta kültürlü klonlanmış hücreler bireysel özellikleri göstermektedir. Ayrıca, bir hücrenin bireysellik o salgılar ürünlerde yansımaktadır. viral enfeksiyon durumunda, viral partiküller onları üreten hücrelerden proteinlerin taşıyabilir. Örneğin, HIV için birçok konakçı hücre proteinleri viral zarf gömülür ve farklı hücreler tarafından üretilen virüs, bu karakteristik proteinleri, 1, 2 ya da "hücre imza" taşıyabilir.
Hatta enfeksiyon olmadan, hücreler çevredeki medya, küçük hücre dışı veziküller (AGH) içine bırakın. Bu veziküller ve birçok durumda da yapının Biogenesis, virüsler, özellikle retrovirüsler bu benzerler. Son yıllarda netleştiBaşlangıçta "trombosit toz" 3 olarak kabul edildi AGH, hücre-hücre iletişim önemli bir fizyolojik sistem oluşturduğunun. Birlikte arası iletişim, yani hücre-hücre temas etkileşimlere ve serbest çözünür moleküllerin iki diğer sistemlerle EVS normal fizyoloji koordine etmek ve çeşitli patolojilerin viral enfeksiyonlar 6, 7 de dahil olmak üzere 4, 5 değiştirilir.
serbest viral partiküller ve hücre dışı kesecikler hem oldukça çeşitli olmasına rağmen, onların bireysel özellikleri kaybolur hangi toplu analizi ile ağırlıklı olarak karakterize edilir. Farklı yüzey antijenleri göre hücreler fenotip akış sitometrisi benzer bir yöntem olup, ayrı ayrı, viral ve viral-benzeri partiküller karakterize etmek için gereklidir. Ne yazık ki, AGH veya küçük virionlar standart akış CYTO kullanılarak analiz edilemezmetry yöntemler onlar en sitometrelerinde tetiklenmesi için dayandığı ışık saçılım sinyali üretmek için çok küçük olduğu için. Bu sınırlamayı aşmak için, tetikleme floresans uygulanabilir. AGH veya virionlar floresan antikor ile boyandı eğer Ancak, çünkü onların benzer floresan ve karşılaştırılabilir boyutlarda serbest antikorlar ve onların agrega ayırt etmek zordur.
Son zamanlarda, düzenli akış sitometre 8, 9 kullanarak bireysel küçük parçacıkların üzerindeki antijenlere karakterizasyonu sağlayan bir nanoteknoloji tabanlı yüksek verimlilik yöntem geliştirdi. Muhtelif uygulamalar 10, 11, 12, 13, diğer gruplar tarafından tarif edilmiş gibi, ilgi konusu Immunocapture partiküllerine MNPS kullanır; Ancak, bizim yeni teknik bireysel speci yakalanması için izin verirfic hedefleri serbest dalgalı antikorlar müdahalesi olmaksızın, ışık saçılması yerine tetikleme floresan kullanılarak flow sitometri ile bu yakalanan parçacıkların feno izledi. Bu yöntem geniş bir uygulama alanı vardır ve in vivo olarak hücreler tarafından üretilen herhangi bir vira- ve viral olmayan küçük bir parçacık antijenik bileşimi karakterize etmek için kullanılabilir ve in vitro olarak bir yüzey antijenine karşı spesifik floresan antikorlar durumu Resim. Biz zaten birkaç biyolojik sorunları incelemek için bu tekniği uyguladık.
Özellikle, bireysel HIV-1 parçacıkların 9 konak hücre belirteçleri dağılımını değerlendirdi, biz onların yüzey proteinleri 14 analizine dayanan bireysel Dang virüsleri (DENV) olgunlaşmasını okudu ve sağlıklı gönüllüler ve hastalar kan dolaşımına salınır AGH araştırıldı akut koroner sendrom (AKS). benzer prensiplere göre, ancakYeni yöntemin uygulanması aşağıda açıklanmaktadır özel protokoller geliştirilmesini gerektirmiştir.
Protokol
Manyetik Nanopartiküller 1. Birleştirme (MNPS)
- Ticari bağlantı prosedürü ve antikorlar (Abs) ile çift MNPS için reaktif (tipik olarak 1 mg) kullanın. Karboksilik asit, reaktif gruplar ile demir oksit nanopartiküllerinin kullanılır.
- antikorlar bir hacimde daha yüksek 0.5 ml ise, bir 100K konsantratörü kullanarak konsantre. 3-5 dakika boyunca 2.000 xg'de Spin.
- İşlem sonunda, ani soğutma tamponu, 10 ul ilave edildikten sonra, 12 mm x 75 mm tüp MNPS transferi ve 3 ml yıkama / saklama tamponu ilave edin. Manyetik separatörün merkezi delik tüp yerleştirilir ve 4 ° C'de bir gece bekletin.
- MNPS tüm tüpün yanına toplanan ve daha sonra dikkatlice sıvı dışarı pipetlemeyin emin olun. Taze yıkama / depolama tamponu 3 ml ekleyin ve arka mıknatıs yerleştirmek.
- Birkaç saat sonra, MNPS tüpün yanına toplanır kontrol ve sıvıyı pipetleyin. yıkama / depolama tamponu 2 ml kullanınMNPS tekrar süspansiyon ve 4 ° C'de depolayın.
- (Bölüm 2'de tarif edildiği gibi yakalama için bir fare monoklonal antikor kullanılması durumunda, örneğin, keçi anti-fare) ABS ilgili bir floresan Fab antikoru fragmanı ile etiketleme ile MNPS bağlanır olduğunu ve bir akış sitometresi üzerinde çalışır.
MNPS için Coupled 2. Etiketleme Antikorlar
- 1.5 ml mikrosantrifüj tüpü içinde Yakalanan Ab'nin izotip spesifik MNPS bölgesinin (koşul başına) 60 ul (3.9 x 10 ila 12 parçacıklar) ve (200 ug / ml, ticari çözelti) 5 ul etiketli Fab fragmanları, birleştirin.
- Sürekli karıştırma ile, 30 dakika boyunca oda sıcaklığında (RT) enkübe edilir.
- 5 dakika boyunca 1500 x g'de bir mikrosantrfuj fosfat tamponlu tuz (PBS) ve bir dönüş 300 ul bir 100 K konsantratör Ön ıslatma sergilemez.
- 100K sütun üzerinde etiketli kompleksleri arındırın. 200 ul PBS ile yıkayın, 5 dakika boyunca 1500 x g'de bir mikrosantrfuj adım 2.2 karışımı spin ve kurtarmakİlk hacmi.
Etiketli Ab-MNP Kompleksleri 3. İlgi parçacıklar (Virüsler veya AGH) Yakalama
- HIV (60 ul) veya EV hazırlanması (100 ul) ile önceden etiketlenmiş MNPS 60 ul (3.9 x 10 ila 12 parçacıklar) inkübe edin.
- çeşitli yöntemler kullanarak EV hazırlıklarını hazırlayın. Burada, sakaroz geçişlerini üzerinde AGH arındırmak exosome yağış reaktifler kullanılarak trombosit fakir plazmadan bunları toplamak veya plazma doğrudan izole 8.
NOT: Optimal oranları her bir deney için tespit edilmesi gerekmektedir ve hazırlık virüs / EV konsantrasyonuna bağlıdır. MNP-Ab kısmı ~ fazla 10 6 virüs / EV fraksiyonunun konsantrasyonu karşılaştırılmalıdır.
- çeşitli yöntemler kullanarak EV hazırlıklarını hazırlayın. Burada, sakaroz geçişlerini üzerinde AGH arındırmak exosome yağış reaktifler kullanılarak trombosit fakir plazmadan bunları toplamak veya plazma doğrudan izole 8.
- virüs, nazik karıştırma ile, 37 ° C'de 40 dakika veya EVS, 4 ° C 'de 1 saat inkübe edin.
- Fc yavaşça girdap bağlanmasını bloke oda sıcaklığında 3-5 dakika inkübe% 2.5 fare IgG / insan IgG ekleyin.
- Her algılama Abs üreticisi tavsiye veya titre konsantrasyonları ekleyin ve oda sıcaklığında ek 20 dakika kuluçkaya yatmaktadır.
Sınırsız Antikorlar gelen MNP-yakalanan viryonlar (veya AGH) Manyetik sütunlar kullanma 4. Ayırma
- bir ayırıcı mıknatıs yerleştirerek kullanım için manyetik ayırma kolonu hazırlayın.
- Yıkama tamponu (2 mM etilendiamintetraasetik asit (EDTA),% 0.5 sığır serum albümini, PBS içinde (BSA)) 500 ul ile kolon ön ıslatma sergilemez. yıkama tamponu sütuna akmasına izin verin.
- sütuna MNP-virüs / MNP-EV kompleksleri ekleyin ve tüm sıvı akmasına izin verin. Bütün hacmi geçmesine izin kolona yıkama tamponu 500 ul ekle.
- Yıkama tamponu 2 kez daha tekrarlayın yıkama.
- muhafaza MNP-virüs / MNP-EV komplekslerinin toplanması için x 75 mm tüp 12 mm mıknatıs ve yerden sütun çıkarın. Sütun 3 dakika mıknatıs kapalı tüp içinde bekletin. PBS 200 ul ekleyin ve izinBoncuklar PBS başka bir 200 ul ekleyin, yerçekimi tarafından aşağı akış ve elüsyon sonra 200 ul% 4 paraformaldehid ile düzeltmek.
NOT: Paraformaldehyde bir şüpheli kanserojen ve havalandırılmış kaputu ele alınmalı ve eldiven giyilmelidir. - Tek virionlar ölçmek için / AGH Yüksek Verimli Sampler (HTS) ya da hemen öncesinde edinimi sayım boncuk sitometri iyi karıştırılmış akışını eklemek üzerinde hacimsel ayarları kullanın.
MNPS yakalanan Virüsler 5. Analiz / a Akış Sitometre ile AGH
- 30 dakika boyunca flowsitometri Isınma.
- Run kalite kontrol boncuk.
- MNPS veya etiketli virüs / AGH birinin floresan Set eşik. arka plan "gürültü" azaltmak için eşik PBS süzülmüş 0.22 mikron kullanın. Olayları süzülmüş PBS hayır verir nerede düzeyinde PMT gerilimi ayarlayarak eşiğini ayarlamak, ya da çok az.
- Düşük Run örnekler. (Arkasında seri olarak yerleştirilen kılıf sıvısı için ek 0.04 mikron inline filtresi kullanınStandart 0.2 mikron kılıf filtresi daha fazla) yanlış olayları ortadan kaldırmak için.
Yakalama Etkinliğinin Değerlendirilmesi 6.
- 3.1, 3.2 anlatıldığı gibi floresan etiketli AGH veya MNP-Abs ile HIV yakalayın. (AGH bir zar boya ile veya kargo yoluyla ya da etiketli olabilir 15; HIV geni ile kodlanmış boya 16 ile, ya etiketlenmiş ya da bir zar boya 12, 17) sahip olabilir.
- (4.1-4.2) 'de tarif edildiği gibi manyetik ayırma kolonu hazırlayın.
- sütuna MNP-virüs / MNP-EV kompleksleri ekleyin ve tüm sıvı (fraksiyon akmaya) akmasına izin verin. tüp içinde fraksiyon akışı toplamak.
- (4.4-4.5) 'de tarif edildiği gibi kolon üzerinde tutulan fraksiyon ile devam edin.
- sonraki ayırma (4,1-4,5) ile 6.3 fraksiyon üzerinden akış tekrarlayın yakalama prosedürü.
- İlk ca korudu kesirler analizBu sitometresinde onları çalıştırarak pture ve ikinci yakalama AGH veya HIV floresan etiketi üzerinde tetikleme ayarlanır. etkinliğini değerlendirmek için, her iki fraksiyonda olayların sayısını karşılaştırın.
Belirli görevler için Protokol 7. Adaptasyon
Not: yukarıda tarif edildiği gibi bir protokol DENV analizi için, HIV ve EVs analizi uygulanabilir olsa da, aşağıdaki modifikasyonlar dahil edilmelidir:
- Oda sıcaklığında 30 dakika süre ile karanlıkta 1 uM DII sahip virionlar inkübe edin. İnkübasyondan sonra herhangi bir fren ile, 4 ° C'de 1.5 saat boyunca 240,000 x g hızında yoğunluk gradyan ortam içinde santrifüjleme (% 10,% 20,% 25 ve% 35) ile boyanan virüs temizler. % 20 ve% 25 yoğunluk gradyanı orta tabakaları 14 arasında fraksiyonu toplayın.
- DII oda sıcaklığında 20 dakika süre ile% 2.5 fare IgG mevcudiyetinde tespit Ab'nin İmalatçı tarafından tavsiye edilen veya titre konsantrasyonlarda DENV 1 x 10 7 (60 ul) etiketli inkübe edin.
- inkubasyonyumuşak bir karıştırma ile, 37 ° C'de 40 dakika boyunca önceden etiketlenmiş, 60 ul (3.9 x 10 ila 12 parçacıklar) MNP yakalama antikor kompleksleri ile karışım yedi.
- Yukarıda açıklanan ve akış sitometresinde analiz gibi manyetik sütun üzerinde bağlanmamış Abs ayrı bileşke kompleksleri.
Sonuçlar
HIV-1 viryonlarıyla hücresel antijenlere seçici yakalama
"Akış virometry" ile bireysel viral parçacıkların hücresel antijenleri görselleştirmek için artık mümkün. Bir örnek olarak, HIV-1, LFA-1, HLA-DR tarafından taşınan iki hücre antijenleri üzerinde odaklanmıştır. Daha önce, bu iki antijen toplu 1 'de analiz, HIV-1 preparasyonlarda tespit edilmiştir. Bu MNPS Env HIV proteini, VRC01 karşı antikorların birisi ile bağlanmış ve (periferal kan tek-çekirdekli hücreleri (PBMC), üretilen HTV-1 LAI.04 veya HIV-1 SF162), bu MNPS HİV-1 virionlar ile çekilen hazırlanabilir. Buna ek olarak, 2G12, başka bir anti-Env antikoru ile bu virionlar ile boyanmıştır. Akış virometry LFA-1 ve HLA-DR varlığı ile ilgili HIV-1 virionlar yüksek heterojen göstermiştir. Ortalama 16.7 ±% 2.0 üzerinde (n = 6) ve 8.6 ± 0.3% (n = 3), LFA-1, HLA-DR taşınan HIV-1 LAI.04 virionlar,sırasıyla. 4.8 ± 0.6% (n = 3) Tüm virionların iki antijen için pozitifti. Diğer HIV-1 suşu, HIV-1 SF162, bu antijenler 20.0 ±% 4.4 mevcut (n = 6) ve 10.8 ± 1.3% (n = 6) sırası ile virionlar, ve, her iki antijen de 6.5 ± tarafından taşınır, oysa % 0.4 (Şekil 1).
Hücresel protein dağılımı virüsü çoğaltılmış hücrelerine bağımlıdır. Enfekte PBMC tarafından üretilen gelen antijenik farklı virionlar üretilen Jurkat hücreleri, HIV-enfekte edilmiştir. Jurkat hücreleri tarafından üretilen HTV-1 LAI 0.4 virionları 1.6 ± 1.4% gerçekleştirilmiştir (n = 3) ve 1.6 ± 0.7% (n = 4), LFA-1, HLA-DR, sırasıyla. Jurkat hücrelerinde üretilen HTV-1 SF162 virionlar, bu parametreler (N = 4) 7.2 ± 2.5% (n = 3) ve 5.6 ± 2.7% idi. Bu nedenle, (en azından HLA-DR ve LFA-1) antijenik makyaj, HIV-1 LAI.04 iki farklı hücre tarafından üretilen farklı olduğutürleri (p <0.02).
Dang virüsü değerlendirilmesi uygulanan virometry Akış
DENV matürasyon viryonları üzerindeki prM proteinin ifadesi ile ilişkilidir. Biz olgun virüsleri oluşturan BHK-1 üretilen DENV ne fraksiyonu ve LoVo hücreleri değerlendirmek için akış virometry uyguladı. Viryonlar bir lipidik boya DII ile boyandı. Bireysel yakalanan virionlar Analizi 48.2 ± 5.3% üzerinde PRM ortaya (n = 8) DENVs evi. Bunun aksine, 84.5 ± 3.4% (n = 4) DENV bölgesinin prM taşınan LoVo hücreleri gösterdi. Virionlar geri kalanı, sırasıyla 51.8 ± 5.3% (n = 8) ve 15.5 ± 3.4% (n = 4) idi prM negatif (Şekil 2). Bu nedenle, akış virometry olgunlaşmamış (veya kısmen olgun) DENV vırıonlardan tam olarak olgun tek tek DENV ayırt etmek için kullanılabilir.
Ekstrasellüler veziküller sağlıklı kan dolaşımına salınırAkut koroner sendrom ile gönüllüler ve hastalar (AKS)
ACS ve sağlıklı hastalarda farklı EV alt kümelerini araştırmak amacıyla, floresan CD31, CD41a, CD63 ya da karşı antikorlarla MNPS birleştirilmiş platelet zayıf plazma (PPP) gelen EVS ele. CD31-MNPS tarafından yakalanan EVs CD41a-MNPS tarafından yakalanan EVs CD31 ve CD63 için boyandı, CD41a ve CD63 için boyandı ve CD63-MNPS tarafından yakalanan EVs CD31 ve CD41a (Şekil 3) için boyandı.
AKS hastalarında tespit antikorların bir ya da iki pozitif CD31-MNPS tarafından ve esir AGH miktarı 3359 [2328 idi; 5.472] EVs / 1.272 [714 ile karşılaştırıldığında ul; 2.157] EVs / sağlıklı gönüllülerde (p = 0.001) | il. Sağlıklı gönüllülerde ile karşılaştırıldığında AKS hastalarında CD63 tarafından yakalanan AGH tutarı 3541 [1318 idi; 5173] AGH / ul vs. 806 [488; 2112] AGH / ul (p = 0.007). 4752 [3238 vardı; sağlıklı gönüllülerin plazmasında bu sayı önemli ölçüde daha düşük iken 7,173] EVs /, CD41a-MNPS tarafından yakalanan ACS hastaların plazmasındaki 2.623 [1.927 ul; 4188] AGH / ul (p = 0,015). Genel olarak, elde ettiğimiz sonuçlar EV miktarları çoğunlukla AKS hastalarında artarken, artış büyüklüğü EVs farklı alt popülasyonlarda farklı olduğunu göstermektedir.
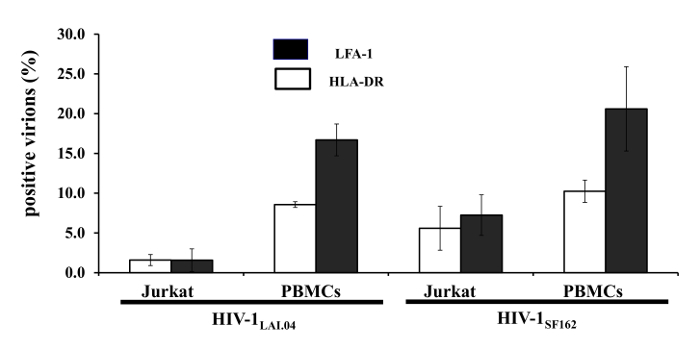
Şekil 1: Farklı hücre tipleri de replike HIV-1 virionlar hücresel antijenlere seçici olarak dahil edilmez. PBMC'ler veya Jurkat hücreleri tarafından yayımlanan, HIV (HIV-1 veya HIV-LAI.04 1 SF162) viryonlar VRC01-MNPS çekilir ve ikinci anti-gp120 antikor 2G12 ve HLA-DR ve LFA-1'e karşı özel antikorlar ile boyandı. boyama yöntemi, HLA-DR (beyaz çubuklar) ve LFA-1 (siyah BA akış analizi tabi tutulmuşturrs). Üç ila altı deneyler 9 ± SEM. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
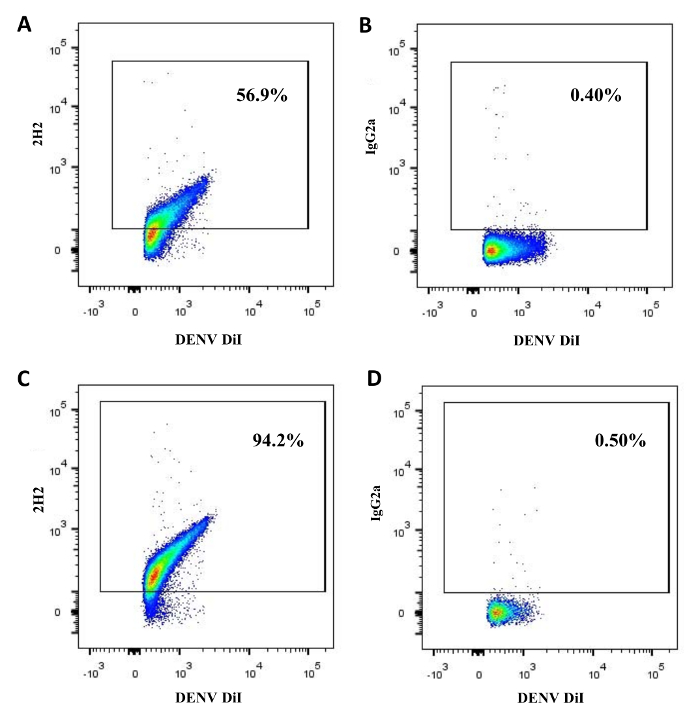
Şekil 2: DENV virionlar Olgunlaşma durumu. Üretilen DENV BHK-21 hücreleri (A, B) ya da LoVo hücrelerinin (C, D) 'de 2H2 antikorları (A, C) ya da prM proteini için boyanmış, yoğunluk gradyanlı bir ortam içinde Ultrasantrifüje edildikten sonra, lipidik boya DII ile etiketlenmiş edildi ve izotip kontrol IgG2a (B, D). Etiketli virionlar sonra 3H5-1-MNPS çekilir ve analizi 14 akış tabi tutuldu. Bu daha büyük bir versiyonunu görmek için buraya tıklayınızrakam.
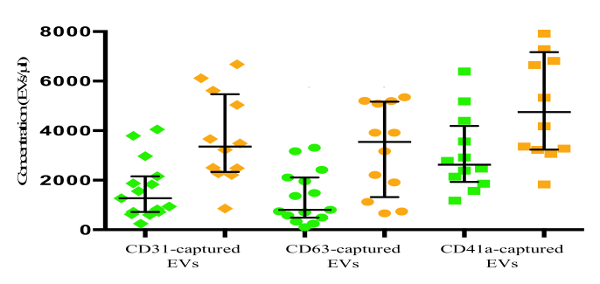
Şekil 3: AKS hastalar ve sağlıklı kontrollerden AGH analizi. Plazma EVs CD31-MNPS, CD63-MNPS ya CD41a-MNPS çekilir ve CD31 ve CD41a karşı CD41a ve CD63 karşı sırasıyla CD31 ve CD63, karşı antikorlar ile boyandı. Algılama antikorların en azından biri ile boyanmış Yakalanan EVs, görsel ve akış analizi numaralanmıştır. Veriler ortanca ve çeyrekler arası aralık (IQR) ile nokta arsa olarak sundu. Yeşil sembolleri: Sağlıklı gönüllüler (kontrol), kahverengi sembolleri: AKS hastalar. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
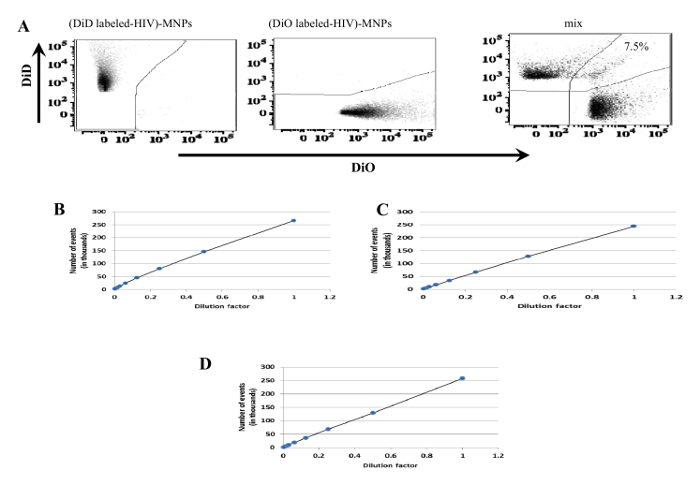
Şekil 4: erlendirmesiBireysel virionlar temsil akış olaylarının fraksiyonu üzerine. (A) HIV-1. Virionlar Süspansiyon iki bölüme ayrılır ve her iki mi (sol panel) ve DIO (orta panel) ile boyandı. Karıştırma işleminden sonra, iki farklı şekilde boyanmış virüsleri içerdi Süspansiyon, VRC01-MNPS çekilir ve virometry (sağ panel) akış tabi tutuldu. Agrega (çift renkli olaylar) toplam olayların% 10'dan az oluşturmuştur. (B - D) DENV. 1: 2: DII lekeli viryonlann Süspansiyon seri 1 iki defa seyreltilmiştir 256 ve bir akış sitometresinde (B) üzerinde HTS ile elde. DII DENVs 2H2 antikorları (C) veya DII DENVs ile etiketlenmiş 3H5-1-MNPS (D) ele geçirildi. 1: 2: Hazırlık C ve D daha sonra seri olarak 1 ile iki kat seyreltilmiştir ve 256 HTS 14 ile elde. Virionlar orada her durumda bu yana bir araya görünmemektedirseyreltme faktörü ve olayların sayısı arasında doğrusal bir ilişki olduğunu. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
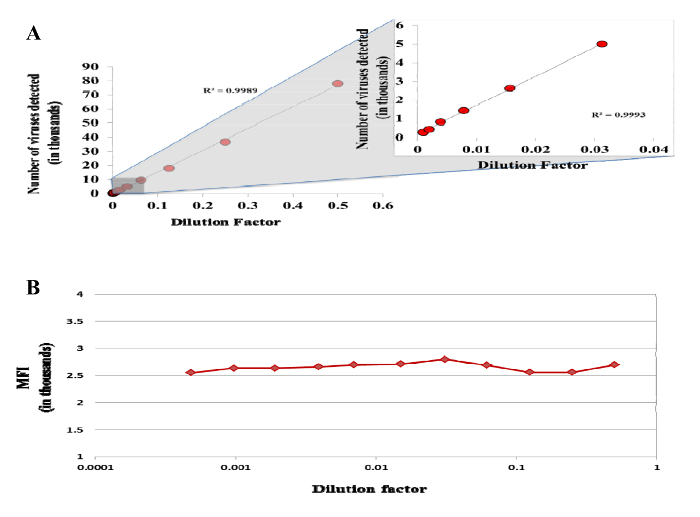
Şekil 5: akış sitometresi ile tek parçacıkların tespiti. 1: 2: DII lekeli DENV süspansiyonu seri 1 iki defa seyreltilmiştir 2.048 ve bir akış sitometresi üzerinde bir HTS kullanılarak elde. Seyreltme faktörü bir fonksiyonu olarak tespit edilen virüs (A) sayısı. (B) ortalama florasan yoğunluğu (MFI) DII DENV 14 etiketli. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.

Şekil 6: virionlar ve spesifik antikorlara bağlanmış MNPS çekilen hücre dışı veziküllerin fraksiyonunun değerlendirilmesi. Işaretli HIV-1 virionlar ya EVs MNPS spesifik antikorlara bağlı olan ve virometry akış işlemine tabi ile yakalandı. Manyetik sütun üzerinde ayrılmasından sonra, akış oranı (korunmaz) fraksiyonlar ilk aşamada cevapsız virionlar veya ilgi duyulan EVS varlığı için analiz edildi. (A) işaretli HIV-1 BaL viryonlar 2G12-MNPS (sol panel) ele geçirildi. Akış fraksiyonu yeniden yakalanıp virometry (sağ panel) akış tabi tutuldu. İlk çevrimde ilgi virionlar yaklaşık% 95 ele geçirildi. (B) olarak tanımlanan EVs, anti-CD81 MNPS çekilir ve manyetik sütun (sol panel) üzerinde izole edilmiştir. Flow-through fraksiyonu yeniden yakalanır ve (sağ panel) analiz edildi. İlk olarakilgi veziküllerin döngüsü yaklaşık% 99 8 ele geçirildi. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Tartışmalar
Geleneksel akış sitometrelerinde bireysel düzeyde 18 fiziksel ve kimyasal özelliklerine göre hücrelerin analiz etmek için önemli bir araçtır kalır. akış temel ilkeleri sitometri gelişimi beri değişmiş değil: Lazer ışınına geçer ve ışık dağıtır hücre hücre bağlı floresan antikorlar tarafından yayılan floresan spektrumları kayıt tetikleyen bir olay oluşturur. Onlar en 18 ışık toplamak yok akış sitometresi hangi büyük açılar altında daha fazla ışık dağılım olarak 300 nm altında daha küçük parçacıkların bir Sitometre yan dağılım ile tespit edilemez. Burada anlatılan teknik, tanımlama ve floresan tetikleme geleneksel akış sitometrelerinde sayısız bireysel virüs ya da AGH birden antijenlerin analizi sağlar.
protokolü içinde kritik adımlar MNPS antikorların bağlantı vardır. Bizim deneyler performan- edildiMed bir reaktif grup karboksilik asit ile 15 mil demir oksit nano-tanecikleri kullanılarak, daha önce tarif edildiği gibi 9. Üreticiye göre, her bir 15 mil MNP 20 antikorlarının fazla bağlanırlar; Biz yaklaşık 15 nm MNP başına 10 antikorları bağlarlar. Bu tahmin önce ve birleştirme sonrası antikor miktarı ve nanoparçacık karakterizasyonu ve boyutlandırma cihazlarla ölçülerek boncuk / mL sayısına dayanır. Prensip olarak, birleştirme partiküllerinin agregasyonunu neden olabilir ve istenmeyen olabilir. Bu toplama bizim protokol ile olmuyor kontrol etmek için, biz nanoparçacık karakterizasyonu ve boyutlandırma enstrümantasyon ile bu doğrulandı. Bu cihaz kaplama ve antikor katmanları ziyade sadece 15 nm çekirdek içeren parçacıklar için hidrodinamik çap ölçer. Biz birleştiğinde boncuk çoğunluğu tek bir zirvede yer aldığını (73 ± 7.3 nm altındaki tüm olayların% 90 ile 64.7 ± 4.2 nm zirveye demek) bulundu. Ab-MNP co karıştırmaSağ orantılı virionlar ya AGH mplexes MNPS EVs / virionlar daha yüksek birkaç emir konsantrasyonunda yani çok önemlidir. Bu tek EVs / virionlar analiz olduğundan emin olmak için önemlidir. Düşük debide sitometresinde çalıştırarak olayların tesadüfler kaçının. floresan üzerinde edinimi tetikleyebilir ve yakalanan kişilerin konsantrasyonunu ölçmek için hacimsel denetimlerini kullanmak için emin olun.
Bununla birlikte, çapraz bağlama MNPS veya aynı nanopartikül iki veya daha fazla virion arasında bağlanarak EVs veya virionlar burada toplayabilir. Bunu kontrol etmek için, Şekil 4'te tarif edildiği gibi toplama için bir test gerçekleştirilmelidir. Hatta tek tek yakalanan virionlar veya AGH aynı anda akış sitometresinin lazer ışınını girebilir. Bu iki farklı antijen için yanlış pozitif yaratacak. Bunu önlemek için, tarif edildiği gibi akış sitometrisi ayarlanmalıdır ve preparasyonlar seyreltilmelidir. Bir aynı kullanarak tesadüf oluyor olmadığını kontrol edebilirsinizBir önceki nokta açıklandığı gibi strateji. Ayrıca, rastlantı olmaması hazırlama seri dilüsyonları analiz etmek ve floresan lekeli antijenin ortalama florasan yoğunluğu tüm seyreltileri (Şekil 5) sabit kalırken olay sayısı dilüsyonu ile doğrusal olarak azalmaktadır ispatlanması belirlenebilir. Başka bir sorun çok az virüs / AGH yakalanabilir olmasıdır. Bunun nedeni virüsler / spesifik MNPS tarafından yakalanır hangi aracılığıyla antijenleri taşıyan AGH gerçek kıtlığı olabilir. Alternatif olarak, yakalama etkinliği çeşitli nedenlerden dolayı düşüktür (örneğin, MNPS, bu protokol için geliştirilen virionlar / AGH ile MNPS oranları sapma, vb antikorların verimsiz bağlantı). İkinci olasılığını önlemek için, yakalama etkinliği özellikle değerlendirilmelidir. Tipik haliyle, verimlilik, Şekil 6'daki gibi yaklaşık% 90 olmalıdır.
Farklı antikorlar nedeniyle engelleyebilirbirbirleriyle veya MNPS bağlı antikorlar ile sterik engelleme. Bunun üzerine serbest dalgalı Abs Daha sonraki ayrılığı Ab-MNP kompleksleri ilk floresan algılama Abs ile boyanmış olmalıdır Bölüm 7. Kısaca, virionlar veya AGH açıklanan ve daha sonra yakalanan bir ters yakalama protokolü (test edilmelidir olmadı kontrol etmek için manyetik sütunlar.
Akış virometry virionlar ya EVs antijenik bileşimi analizi, mevcut yöntemlere göre önemli avantajlara sahiptir. Rutin biyokimyasal yöntemler hazırlıklarında belirli proteinlerin genel varlığına rapor, ancak virionlar veya EVs heterojenliği hiçbir bilgi sağlar. Bu büyük ticari olarak temin edilebilen parçacıkları üzerinde virionlar ya EVs Immunocapture içerir. Bu parçacıklar çapı birkaç mikron arasında tipik olarak ve her biri virionlar ya EVs yüzlerce ya da binlerce yakalayabilir. Bu nedenle, herhangi bir sonraki analiz ortalamalara virionlar / AGH özellikleribir parçacık tarafından yakalanan. Bunun aksine, akış virometry olayların en az% 90 tek bir virion, ya da tek bir EV temsil çapında ve tarif edilen protokol ile 10-15 nm MNPS kullanır.
Ana sınırlama hazırlık virionlar veya EVs tüm nüfus analiz olmayabilir, ama sadece o yakalanır söyledi. Bu nedenle, virionlar ya EVs yakalanır, üzerinden antijen seçimi kritik hale gelir. Ayrıca farklı antijenlerin sayısı (çeşitli antijenlere karşı floresan antikorlar sayısı) sitometrisi farklı akış virionlar ya EVs küçük bir yüzey ile sınırlandırılmıştır. Son olarak, farklı antikorlar sterik nedeniyle küçük (hücrelere kıyasla) yüzeye tekrar birbirleri ile etkileşime girebilir.
Mevcut protokolü de yakalanabilir nedeniyle, özel antikorlar mevcut olduğu sürece, herhangi bir virüs ya da herhangi bir kökenli EV analizi için adapte edilebilir. Bireysel virionlar izin üzerindeki antijenlere Analizis araştırmacılar, viral popülasyonların farklı fraksiyonları patogenezi ele. Ayrıca, plazma bireysel EVs tanımlanması mümkün özellikle hücrelere EVs izini ve normal veya patolojik bu hücrelerin koşulları ve içinde bulundukları organ hakkında rapor yapabilir.
Açıklamalar
The authors declare no conflict of interest.
Teşekkürler
This work of AA, SZ, WF, J-C.G, and LM was supported by the NICHD Intramural Program. The work of MV was supported by the Russian Federation Government grant #14.B25.31.0016.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Carboxyl Magnetic Iron Oxide Nanoparticles Conjugation Kits | Ocean Nanotech | ICK-15-005 | |
| Amicon Ultra-4 Centrifugal Filter Unit with Ultracel-100 membrane | Millipore | UFC810024 | |
| 5 ml Round Bottom PP Test Tube, without Cap | Falcon | 352002 | |
| DEPC treated water | Quality Biological | 351-068-131 | |
| SuperMAG-01 magnetic separator | Ocean Nanotech | SuperMAG-01 | |
| Zenon R-Phycoerythrin Mouse IgG1 Labeling Kit | Thermo Fisher Scientific | Z25055 | |
| Nanosep Centrifugal Devices with Omega Membrane 100k | Pall Corp | OD100C34 | |
| EDTA 0.5 M | Corning Cellgro | 46-034-CI | |
| Bovine Serum Albumin solution | Sigma-Aldrich | A9576-50ML | |
| PBS | Gibco | 10010-23 | |
| Paraformaldehyde, EM Grade, Purified | EMS | 15710 | |
| 123 count eBeads | eBioscience | 01-1234-42 | |
| CytoCount beads | Dako | S2366 | |
| AccuCheck count beads | Invitrogen | PCB100 | |
| Cytometer Setup & Tracking Beads Kit (CST) | BD Bioscience | 642412 | |
| Vybrant DiI Cell-Labeling Solution | Thermo Fisher Scientific | V22885 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| µMACS column | Miltenyi Biotec | 130-042-701 | |
| OctoMACS Separator magnet | Miltenyi Biotec | 130-042-108 | |
| Nanodrop | ThermoFisher | none | |
| NanoSight NS300 | Malvern | none | |
| BD LSRII flow cytometer | BD Bioscience | none | |
| Name | Company | Catalog Number | Comments |
| Software | |||
| Flowjo software | Flowjo | ||
| BD FACSDiva software | BD |
Referanslar
- Tremblay, M. J., Fortin, J. F., Cantin, R. The acquisition of host-encoded proteins by nascent HIV-1. Immunol Today. 19 (8), 346-351 (1998).
- Santos, S., Obukhov, Y., Nekhai, S., Bukrinsky, M., Iordanskiy, S. Virus-producing cells determine the host protein profiles of HIV-1 virion cores. Retrovirology. 9, 65 (2012).
- Wolf, P. The nature and significance of platelet products in human plasma. Br J Haematol. 13 (3), 269-288 (1967).
- Piccin, A., Murphy, W. G., Smith, O. P. Circulating microparticles: pathophysiology and clinical implications. Blood Rev. 21 (3), 157-171 (2007).
- Bernal-Mizrachi, L., et al. High levels of circulating endothelial microparticles in patients with acute coronary syndromes. Am Heart J. 145 (6), 962-970 (2003).
- Rozmyslowicz, T., et al. Platelet- and megakaryocyte-derived microparticles transfer CXCR4 receptor to CXCR4-null cells and make them susceptible to infection by X4-HIV. Aids. 17 (1), 33-42 (2003).
- Bhattarai, N., et al. GB virus C particles inhibit T cell activation via envelope E2 protein-mediated inhibition of TCR signaling. J Immunol. 190 (12), 6351-6359 (2013).
- Arakelyan, A., Ivanova, O., Vasilieva, E., Grivel, J. C., Margolis, L. Antigenic composition of single nano-sized extracellular blood vesicles. Nanomedicine. 11 (3), 489-498 (2015).
- Arakelyan, A., Fitzgerald, W., Margolis, L., Grivel, J. C. Nanoparticle-based flow virometry for the analysis of individual virions. J Clin Invest. 123 (9), 3716-3727 (2013).
- Yang, H., Liang, W., He, N., Deng, Y., Li, Z. Chemiluminescent labels released from long spacer arm-functionalized magnetic particles: a novel strategy for ultrasensitive and highly selective detection of pathogen infections. ACS Appl Mater Interfaces. 7 (1), 774-781 (2015).
- Tang, Y., et al. Highly sensitive and rapid detection of Pseudomonas aeruginosa based on magnetic enrichment and magnetic separation. Theranostics. 3 (2), 85-92 (2013).
- Borlido, L., Azevedo, A. M., Roque, A. C., Aires-Barros, M. R. Magnetic separations in biotechnology. Biotechnol Adv. 31 (8), 1374-1385 (2013).
- Xi, Z., et al. Selection of HBsAg-Specific DNA Aptamers Based on Carboxylated Magnetic Nanoparticles and Their Application in the Rapid and Simple Detection of Hepatitis B Virus Infection. ACS Appl Mater Interfaces. 7 (21), 11215-11223 (2015).
- Zicari, S., et al. Evaluation of the maturation of individual Dengue virions with flow virometry. Virology. 488, 20-27 (2016).
- Lai, C. P., et al. Visualization and tracking of tumour extracellular vesicle delivery and RNA translation using multiplexed reporters. Nat Commun. 6, 7029 (2015).
- McDonald, D., et al. Visualization of the intracellular behavior of HIV in living cells. J Cell Biol. 159 (3), 441-452 (2002).
- Morcock, D. R., et al. Elimination of retroviral infectivity by N-ethylmaleimide with preservation of functional envelope glycoproteins. J Virol. 79 (3), 1533-1542 (2005).
- Shapiro, H. M. . Practical Flow Cytometry. , 101-223 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır