Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İlaç Tedavi ve
Bu Makalede
Özet
Small laboratory fish have become popular models for bone research on the mechanisms underlying human bone disorders and for the screening of bone-modulating drugs. In this report, we describe a protocol to assess the effect of alendronate on bone cells in medaka larvae with osteoporotic lesions.
Özet
osteoblastlar kemik matriksinin ciro koordine etmek kemik rezorbe osteoklast ile etkileşim ve iskelet homeostazı kontrol etmek için kemik oluşturan. Medaka ve Zebra balığı larvaları yaygın kemik oluşumu, dejenerasyon ve onarım sırasında kemik hücrelerinin davranışını analiz etmek için kullanılır. Optik netlik floresan etiketli kemik hücreleri ve mineralli iskelet matrise bağlı floresan boyalar görselleştirme sağlar. Bizim laboratuvar bir ısı şoku ile uyarılabilir promoterinin kontrolü altında osteoklast başlatıcı faktör Nükleer faktör kB Ligand (RANKL) reseptör Aktivatör transgen Medaka balık üretti. Katepsin K (ctsk) promoterinin kontrolü altında nlGFP ifadesi ile raportör çizgilerle görüntülenmiştir Aktive edilmiş osteoklastlar, aşırı oluşumuna RANKL sonuçları ektopik ekspresyonu. RANKL indüksiyon ve ektopik osteoklast oluşumunu şiddetli osteoporoz gibi fenotipleri yol açar. Bileşik transgenik Medaka lictsk ifade Nes: nlGFP erken osteoblastlarda Osterix (OS X) promoterinin kontrolü altında osteoklastlar, hem de mCherry, her iki hücre tipinde etkileşimini incelemek için kullanılabilir. Bu kemik erimesi ve onarım koşulları altında hücresel davranış in vivo gözlem kolaylaştırır. Burada, genel olarak, insan osteoporoz tedavisinde kullanılan bir ilaç test etme ve canlı görüntüleme için bir protokol tanımlamak için bu sistemin kullanımını tarif eder. Medaka modeli hücre kültürü ve farelerde çalışmaları tamamlar ve iskelet sisteminde ilaç etkisinin in vivo analizi için yeni bir sistem sunmaktadır.
Giriş
omurgalı iskelet, organlar için yapısal destek ve koruma sağlayan hareketlilik sağlar ve kalsiyum kaynağı olarak hizmet vermektedir. hayatı boyunca, hücre dışı matriks kemik sürekli kemik istikrar ve sertliği korumak için ters çevrilir. Bu işlem, sıkı bir şekilde koordine aktivitesi ve kemik oluşturan osteoblastların ve kemik erimesi ile ilgili osteoklastı etkileşimi gerektirir. Osteoblastlar multipotent mezenkimal atalarıdır türetilen ve osteoid, kemik matrisinin 10 proteinli kısmını oluşturmak üzere kolajen üretimini edilir. Osteoblastlar kemik homeostazı 7 kontrol etmek için gerekli olan hücre tipleri, her ikisi de dengeli bir etkinlik elde etmek osteoklastlar ile etkileşim. Çünkü bu karmaşık düzenleyici etkileşimlerin, ilaç tedavisi ve kemik homeostazı yanıtları tam in vitro çalışmalar kullanılarak incelenebilir edilemez. Bu nedenle, hayvan modellerinde güçlü bir talep vardır. Hücre kültürü ayarlarına göre, in vivo modellerde sağlayabilirKemik ortamında çok hücreli ağlar değerli bir fikir.
Çok sayıda fare modelleri, osteoporoz 16 de dahil olmak üzere, insan kemik bozukluklarının çeşitli ana kadar. Ancak, büyüklüğü ve fare embriyoları erişilebilirliği iskelet süreçlerin canlı görüntüleme için önemli sınırlamalar temsil etmektedir. Küçük Teleost balık, diğer yandan, in vivo görüntüleme için cazip bir alternatif olarak hizmet eder. Balığı (Danio rerio) ve Medaka (Oryzias latipes) son yirmi yıl 17, 19, 22, 24 üzerindeki kemik araştırma için popüler bir hayvan modelleri haline gelmiştir. Teleost balıklarda ve memelilerde kemik yapısal ve fizyolojik bir seviyede hem de çok benzer ve kilit düzenleyici gen ve sinyal yollarının çok 3 muhafaza edilir. Memelilerde gibi teleost balık dikkatle osteoblast ve kemik oluşumunu ve erimesini 26 denge osteoklastların aktivitesi düzenler. fi En önemlisi, optik netlikSH larva, kemik hücreleri ve canlı bir hayvanda hücresel süreçlerin 'in gözlemlenmesini kolaylaştırmaktadır kalsifiye iskelet matris 8, 9, 12, 21, 23, etiket, floresan muhabir kullanımına izin verir. Buna ek olarak, genetik bir dizi araç balık biyo-medikal ilgili araştırmaları kolaylaştırmak için oluşturuldu. Özellikle Medaka, CRISPR / Cas9 2, 6 izleme hücre soy ve site-spesifik transgenesis 14 yeni kurulan ve yaygın kullanımda 15 şimdi edilmiş hedeflenen gen mutasyonuna yöntemleri için.
Küçük Teleost larvaları başarıyla birkaç farmakolojik olarak ilgili ilaç 1, 18 keşfine yol kimyasal ekranlar için kullanılmıştır.
Balık larvaları DMSO düşük konsantrasyonlarına dayanıklı ve deriden veya mide-bağırsak, 1 ile 5 arasındaki, ya da su ortamında gelen bileşikleri emebilmektedir. Bizim laboratuvar önceden temsilcisiÇeşitli osteoblast- ve osteoklast özgü promoterlerin kontrolü altında, kemik hücrelerinde floresan haberci ifade orted transjenik Medaka hatları. 20, 21, olgun osteoblast (osteokalsin, OSC) 27 ve osteoklastlar (katepsin K ctsk) 24; bu erken osteoblast (Osterix, OS X kollajen 10a1, col10a1) içerir. Ayrıca, bir ısı şoku ile uyarılabilir promoterinin 24 kontrolü altında osteoklast başlatıcı faktör Nükleer faktör kB Ligand (RANKL) reseptör Aktivatör eksprese eden bir transgen doğru oluşturulur.
Bu sistemde RANKL endüksiyonu aktif osteoklastlar ektopik oluşumu ile sonuçlanır. Bu omur gövdelerinde büyük ölçüde azalır mineralizasyon ile, artmış kemik rezorpsiyonu ve şiddetli osteoporoz gibi fenotipe yol açar. Biz son zamanlarda bu modelde osteoklast aktivitesi bifosfonatlar Etidronate ve alendronat, tw tarafından bloke edilebilir olduğunu gösterdigenel olarak, insan osteoporoz tedavisinde kullanılan O ilaçlar, bu şekilde osteoporoz 27 için uygun bir model sistem olarak Medaka'nın doğrulanması.
Büyük olması nedeniyle kuluçka boyutu, hızlı gelişme ve embriyo küçük boyutu, transjenik Medaka larva osteoporoz ilaçların büyük ölçekli tarama ve kemik hücre davranış in vivo analizler için çok uygun olan. Medaka çalışmalar, böylece etkili bir şekilde hücre kültürlerinde ve insan kemik bozuklukları için yeni terapötik hedefler ve yeni tedavilerin keşfetmek amaçlayan farelerde deneyler tamamlayabilir.
Bu çalışmada, ortak osteoporoz ilaç, alendronat ile Medaka kemik muhabir larva tedavisi için bir protokol açıklar. monte edilir ve kemik matriks ve kemik hücrelerinin canlı görüntüleme için hazırlanmıştır nasıl tedavi larvaları Biz de ayrıntılı olarak açıklamaktadır. Bu protokoller kolayca diğer küçük kimyasal bileşiklere adapte edilebilir kemik anabolik veya anti-emici ilaç olarak ya da iş.
Access restricted. Please log in or start a trial to view this content.
Protokol
Tüm deneyler National University of Singapore (R14-293) onaylı Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC) protokollere uygun olarak yapıldı.
1. Balık Yetiştiriciliği ve Embriyolar Koleksiyonu
- Raise WT, ctsk: nlGFP 24, RANKL: HSE: OBP 24 ve osx: kontrollü ışık döngüsü altında MCherry 21 tek veya 26 ° C'de bileşik transgenik Medaka balığı (14 saat aydınlık, 10 saat karanlık) yumurtlama uyardığı.
- Işık açıldıktan sonra günlük yumurtlama ilk 30 dakika boyunca gerçekleşir. yumurta filamentler ile birlikte sopa ve birkaç saat dişinin karın eklemek. bir yumurta küme taşıyan bir kadın yetişkin yakalamak için ince örgülü net kullanın. Balık kısaca net dinlenmek ve daha sonra yavaşça dikkatlice kadın karın döllenmiş yumurta küme şerit balıkların karın masaj edelim.
NOT: Sağlıklı bir Medaka kadınYaklaşık 5 ay boyunca 20 yumurta her gün - 10 üretebilir. - 60 mm plastik Petri kabı içine yumurta yerleştirin. 5, embriyolar durulama plastik bir pipet kullanın - 10 mL en 0.3x Danieau çözeltisi (balık ortamı (19.3 mM NaCI, 0.23 mM KCI, 0.13 mM MgSO 4, 0.2 mM Ca NO 3) 2 ve 1.7 mM HEPES, pH 7.0). mantar gelişimini önlemek için% 0.25 ile 1 mL balık ortamı 2.5 L (ağ / hac) metilen mavi stok solüsyonu ekleyin.
- Yavaşça eki filamentler bir düğüm oluşturmak için yumurta küme yuvarlayın. Dikkatlice bireysel embriyolar (Şekil 1A) elde etmek için döllenmiş yumurta kümelerden eki filamentler çıkarmak için forseps kullanın.
- Iwamatsu 2004 13 göre embriyolar Sahne.
- Kültür 20 - 28 ° C inkübatör 60 mm plastik Petri kabı başına 30 embriyolar. embriyoların normal gelişimini sağlamak için her gün orta değiştirin.
NOT: kuluçka aşamasında (8 kez etrafında - 9 d postfertilization,DPF) hayatta kalma için kritiktir. temiz ortamı tutmak ve iyi larva sağkalım oranları sağlamak için serbest yüzen chorions çıkarın.
2. Transgenik Embriyo tarama
- 40X büyütme kullanılarak flüoresan raportör ekspresyonu için transgenik embriyo taranması için floresan görüntüleme ve GFP, RFP ve CFP filtrelerinin cıva lambası ile donatılmış bir stereomikroskop kullanın.
- Görsel OSX tespit: MCherry raportör ekspresyonu ile MCherry embriyolar erken oluşturucu arka kafa (Şekil 1B, ok) ve parasphenoid her iki tarafında, örneğin cleithrum olarak kafatası kemikleri, ventral kafatası merkezi bir konumda ( Şekil 1B, ok başı).
NOT: Muhabir ifade itibaren 21 5 DPF başlar. - Ctsk belirleyin: Güçlü nlGFP ifade tarafından nlGFP embriyolar kafa (Şekil 1C, ok) ve kuyruk (Şekil 1C, ok başı), başlayan6 DPF.
NOT: İçsel osteoklastlar sadece 21 DPF sonra oluştururlar. Bu erken aşamada (6 DPF) hücreleri nlGFP ifade eden, bugüne kadar uncharacterized osteoklastlar ancak diğer değil pozitif hücreler 24 ctsk. - RANKL belirlenmesi: HSE: yerde CFP sentezlenmesiyle CFP transjenik embriyoları 2 dpf veya daha tarama amacıyla yapılan 39 ° C 'de 20 dakika boyunca kısa bir ısı şoku muamelesinden sonra.
NOT: RANKL ve OBP transgenlerin aynı çift yönlü Isı Şoku Elemanı (SEÇ) kontrolü altındadır. CFP sentezleme başarılı RANKL'ın indüksiyonu 24 gösterir. - Dolayısıyla osteoporoz gibi fenotip 24 sonuçlanır gövde bölgede, ektopik osteoklastlar çok sayıda ikna etmek için daha sonra 9 DPF 2 saat ısı şoku tedavi veya - 1.5 gerçekleştirin.
NOT: endojen tetiklenir uyuyan osteoklast progenitör hücrelerin, bir ektopik aktivasyonu 9 DPF sonuçlara yol açtığı Transgenik RANKL ifade21 DPF önce. kararlı 39 ° C koşulları elde etmek için bir su banyosu kullanın. Petri içeren Medaka embriyolar su yüzeyinde yüzen izin. Emin petri kapak çanak batan önlemek için kuru olduğundan emin olun. - Bu RANKL bileşik hatları, ekran embriyolar: HSE: CFP / ctsk: nlGFP çift transgenik ve OS X: MCherry / RANKL: HSE: CFP / ctsk: nlGFP üç transjenik, her bir transgen sentezleme desenine göre yöntem.
Not: hemizigot ve homozigoz transgenik embriyo raportör transgen farklı floresan seviyeleri ile ayırt edildi. Homozigot embriyolar hemizigot transgeniklerinin kıyasla iki kat, yaklaşık bir floresan yoğunluğu vardı. HSE: CFP ve ctsk: Her iki RANKL için homozigot olan Bileşim hatları nlGFP tekrar birkaç nesil boyunca incrossing ile elde edilmiştir. MCherry / RANKL: HSE: CFP / ctsk: üçlü transgenik osx için nlGFP balık, homozigot RANKL: HSE: CFP / ctsk: mCherry taşıyıcıları: nlGFP balık homozigot osx ile geçti. Elde edilen heterozigot üç transjenik soy kaldırdı ve RANKL için homozigot embriyolar elde etmek üzere incrossed edilmiştir: HSE: CFP. RANKL: HSE: CFP transgen ektopik osteoklastların etkin indüksiyonu elde edilmesi için homozigot olması gerekir.
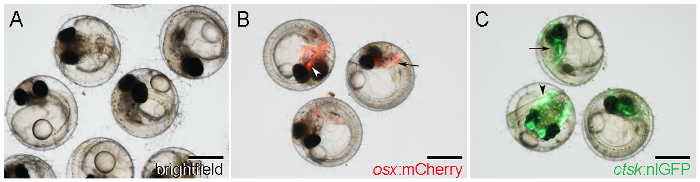
Şekil 1: WT ve 7 D postfertilization de transgenik Medaka Embriyolar (DPF). Bir. WT embriyolar aydınlık aydınlatma ile gözlemledik. B. Osx gösteren Transgenik embriyolar: cleithrum (ok) ve parasphenoid (ok) etrafında MCherry ifade. Cı. Ctsk gösteren Transgenik embriyolar: nlGFP kafa (ok) ifadesi ve kuyruk (ok başı). Ölçek çubukları: 500 mikron.025 / 55025fig1large.jpg "target =" _ blank "> bu rakamın daha büyük bir versiyonunu görmek için lütfen buraya tıklayınız.
Medaka Larva 3. Bifosfonat Tedavisi
- Doz-cevap çalışmaları bifosfonatlar (bps) farklı konsantrasyonlarda içeren solüsyonlar hazırlayın.
NOT: Bu protokolde kullanılan örnek, BP alendronat olduğunu.- Bir stok çözeltisi hazırlamak için 100 ug / ml bir konsantrasyonda balık ortam içinde alendronat çözülür.
- Tam çözünmeyi sağlamak için, bir girdaplı karıştırıcı kullanarak. 4 ° C'de stok solüsyonu saklayın.
- Konsantrasyonları bir dizi balık ortamı ile stok çözelti seyreltilerek farklı çalışma çözelti hazırlayın (örneğin, 25, 37.5, 50, 62.5 ve 75 ug / mL).
NOT: Farklı ilaçlar bu Medaka larvaları sistemi kullanarak test sırasında dikkate alınması gereken farklı emilim, dağılım, Metabolizma ve Boşaltım (DEME) parametreleri, olabilir. Ayrıca ilaç çözünürlük ve stabilite değişebilirsulu bir çözelti olarak tatbik. Daha az suda çözünür bileşikleri, ilk olarak DMSO gibi bir organik çözücü içinde çözülmüş, gerekebilir. Bu durumda, bir stok çözeltisi daha sonra balık ortamı içinde seyreltilir DMSO içinde hazırlanır. Su (balık ortamı) çalışan çözümler birkaç wk buzdolabında saklanabilir unutmayın. Ancak, DMSO ihtiva eden çözeltiler kristalleşmeyi önlemek için oda sıcaklığında muhafaza edilmesi gerekir.
- altı yuvalı plakalar içine aktarın Medaka larvaları (altı larva / oyuk) daha sonra kan basıncı (alendronat) tedavisi için kullanılabilir.
- dikkatli bir şekilde temiz bir plastik pipet kullanılarak balık Ortamı çıkarın ve her bir oyuğa alendronat çözeltinin küçük bir hacim (yakl. 0.5 mi) ilave edin.
- az konsantre alendronat çözümleri için özellikle önemlidir eklendi BP çözüm seyreltilmiş olabileceği gibi artık balık ortamı, kaçının.
- temiz bir plastik pipet ile her çukurdan alendronat çözeltisi (0,5 mL) içindeki bir küçük hacimli çıkarın ve daha büyük bir VOLU ile değiştirinalendronat çözeltisi bana (4 mL) eklenmiştir.
- Normal embriyolar gelişimini sağlamak için orta günlük olarak değiştirin.
Mineralize kemik Matrix 4. Canlı Boyama
- sırası ile,% 1 ve% 0.1 stok çözeltileri hazırlamak için ya da balık ortamı 50 mL kalseinin 0.05 g (alizarin-3-metiliminodiasetik asit ALC) Alizarin komplekson 0.5 g çözündürülür. Tam çözünmeyi sağlamak için, bir girdaplı karıştırıcı kullanarak.
Not: metilen mavisi ilave edilmeden balık ortamı Bu kullanılır ve daha sonraki adımlar, larva otofloresan azaltır. - boyama çözüm süzmek için bir şırınga ve tek kullanımlık filtre (0.2 mikron) kullanın. Oda sıcaklığında, karanlıkta, süzüldü çözelti saklayın.
NOT: süzülmüş, berrak ALC boyama çözeltisinin rengi turuncu, sarı karanlık. süzülmüş, berrak kalsein çözeltisi rengi sarı parlak. Çözümler birkaç ay boyunca kullanılabilmektedir. - Balık ortamında süzülmüş ALC veya kalsein stok solüsyonu 01:10 seyreltilirLarvalar 9 ila 17 DPF kullanıldığında, bir 28 ° C kuluçka makinesi içinde 2.5 saat (% 0.01 kalsein çözeltisi) - 2 saat boyunca (% 0,1 ALC çözelti) ya da 2 - ve 1.5 Medaka larva inkübe edin. Karanlıkta örnekleri tutun.
- temiz bir plastik pipet kullanarak taze balık ortamına larva aktarın.
- temiz bir plastik pipet ile balık orta kaldırmak ve taze balık orta ekleyin. 3 için bu adımı yineleyin - (sırasıyla, ALC veya kalsein) hayır kırmızı- veya sarı lekeli bir çözüm kadar 4 kez üzerinde bırakılır. ortamdan Epifloresans önlemek için görüntüleme için onları takmadan önce 60 dakika - 30 balık ortamda larvaları bırakın.
NOT:% 0.1 ALC boyama çözümü genişletilmiş pozlama süreleri için Medaka larva için zararlıdır. en fazla 2 saatlik inkubasyon sürelerinin larvalarının yaşamlarını sürdürmeleri etkiler. Konsantrasyon ve boyama zaman, bu nedenle optimum embriyo hayatta kalma ve boyama sonuçları elde etmek için farklı aşamaları için optimize edilmesi gerekir.
5. Canlı Floresans Görüntüleme p>
- Balık bir ortam içinde% 0.01 Tricaine (etil 3-aminobenzoat metansülfonat) ile Medaka larva anestezisi.
NOT: Anestezi larvalar 5 sonra hareketsiz hale - Tricaine çözeltisi içinde 10 dakika ve genellikle onların yüzüne ya da sırtlarında ya yalan söylemektedirler. - ilgi bölgeye göre larva yönlendirmek için plastik Microloader kullanın. Bu protokolde kullanılan larva yönü yanal olduğunu.
- görüntüleme için floresan aydınlatma ile Stereomikroskopta kullanın. larvaları (baş, ön gövde, arka gövde ve kuyruk) farklı bölgelerinde odaklanan görüntüleri çekerken yüksek büyütme kullanın. Uygun bir görüntü işleme yazılımı (Şekil 3G takmalar) kullanarak bölgeleri üst üste birlikte bireysel görüntüleri birleştirin.
NOT: Bu doğru odak düzleminde ilgili tüm vücut parçaları görüntü kalitesini artırmak için yardımcı olur. - görüntüleme sonrası iyileşme için balık ortamına larva dönün.
- onlar hareketsiz hale gelene kadar 10 dakika - 5 için balık ortamında% 0.01 Tricaine ile larva uyutmak.
- Bir mikrodalga fırında ısıtılarak balık ortamı içinde% 1.5 agaroz erime noktası düşük eritin. Serin, yaklaşık 30 ° C'ye kadar bu çözelti.
- Bir cam tabanlı Petri kabı balık ortamında agaroz sıvı% 1.5 düşük erime 1 ml - 0.5 ekleyin. temiz bir plastik pipet kullanarak çözüm içine anestezi larva aktarın.
Not: Sıvı, düşük ısıda eriyen agaroz sıcaklığı larva zarar vermeyecek kadar yeterince düşük olduğu özel önlem almak. - Agaroz katılaşır önce Petri kabı alt larva itmek için plastik bir Microloader kullanmak ve ilgi bölgeye göre larva yolunuzu. Bu protokolde kullanılan larva yönü yanal olduğunu.
NOT: agaroz tamamen katılaşır sonra numuneler konfokal canlı görüntüleme için hazırdır. - ACQ bir konfokal mikroskop kullanmakuire görüntüler.
- MCherry ve ALC boyama analizleri için 543 nm lazer hattı kullanın. nlGFP için 488 nm lazer hattı kullanın ve kalsein boyama analiz eder.
- Görüntüleme sonrası, Petri kabı balık orta eklemek ve dikkatle agaroz larvaları kaldırmak için ince şırınga iğneleri (27 G x 1½ ") bir çift kullanın. residually kurtarmak için balık ortamı ile bir Petri kabı agaroz bağlı olan larvaları transfer .
- Bir görüntü analiz yazılımı 27 kullanarak görüntüleri işleyin.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Bol miktarda yumurta sayıları, hem de larva küçük boyutu, Medaka'nın ilaç taraması için ideal bir model haline getirmektedir. Tek bir altı plaka istatistiksel olarak anlamlı bir veri sağlamak için yeterli 36 larva, kadar kültüre kullanıldı. iskelet analizi için balık kullanmanın bir diğer büyük avantajı, canlı görüntüleme yapma imkanı vardır. Balık larvaları asetat kemik hücrelerini, hem de mineralizasyon görselleştirmek için kemik matrisine bağlanır boyaların kullanımını et...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Protokol çerçevesinde kritik adımlar
Farklı numunelerin karşılaştırırken ısı şoku muamelesinden koşulları tutarlı ve stabil olması esastır. Sabit sıcaklık koşullarında, ctsk taranması doğrulanabilir Sonuç olarak, benzer osteoklast formasyonunu transgenik larvalarda RANKL indüksiyon benzer seviyelerde garanti eder ve: nlGFP ifade. Son olarak, bu ALC boyama ile doğrulanmış olarak indüklenen ektopik kemik erimesi, osteoporoz gibi lezyonlar benzer derecede olur...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar hiçbir rakip veya mali çıkarları olduğunu beyan ederim.
Teşekkürler
Bu proje Milli Eğitim Singapur Bakanlığı (MEB, hibe numarası 2013-T2-2-126) ve Sağlık, ABD Ulusal Enstitüsü (NIH, numara 1R21AT008452-01A1 hibe) hibe ile finanse edildi. TY Biyolojik Bilimler NUS Bölümü'nden mezun burs aldı. Biz onların sürekli destek için Biyogörüntüleme Bilimleri NUS Merkezi (CBIS) konfokal birimi teşekkür ederim.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Alendronate | Sigma | A4978 | |
| alizarin-3-methyliminodiacetic acid, Alizarin Complexone | Sigma | A3882 | |
| Calcein | Sigma | C0875 | |
| ethyl 3-aminobenzoate methanesulfonate (Tricaine) | Sigma | A5040 | |
| ImageJ (1.4.3.67) | National Institute of Health (NIH) | https://imagej.nih.gov/ij/ | |
| LSM 510 Meta confocal | Zeiss | ||
| LSM Image Browser (4.2.0.121) | Zeiss | http://www.zeiss.com/microscopy/en_de/downloads/lsm-5-series.html | |
| Micro-loader | Eppendorf | 5242956003 | Eppendorf ep T.I.P.S 20 μL |
| NIS-Elements BR 3.0 software | Nikon | ||
| Photoshop CS6 (13.0.0.0) | Adobe | ||
| SMZ1000 stereomicroscope | Nikon |
Referanslar
- Ablain, J., Zon, L. I. Of fish and men: using zebrafish to fight human diseases. Trends Cell Biol. 23 (12), 584-586 (2013).
- Ansai, S., Kinoshita, M. Targeted mutagenesis using CRISPR/Cas system in medaka. Biol Open. 3 (5), 362-371 (2014).
- Apschner, A., Schulte-Merker, S., Witten, P. E. Not all bones are created equal-using zebrafish and other teleost species in osteogenesis research. Methods Cell Biol. 105, 239-255 (2011).
- Bajoghli, B., Aghaallaei, N., Heimbucher, T., Czerny, T. An artificial promoter construct for heat-inducible misexpression during fish embryogenesis. Dev Biol. 271 (2), 416-430 (2004).
- Barrett, R., Chappell, C., Quick, M., Fleming, A. A rapid, high content, in vivo model of glucocorticoid-induced osteoporosis. Biotechnol J. 1 (6), 651-655 (2006).
- Centanin, L., Ander, J. J., Hoeckendorf, B., Lust, K., Kellner, T., Kraemer, I., Urbany, C., Hasel, E., Harris, W. A., Simons, B. D., et al. Exclusive multipotency and preferential asymmetric divisions in post-embryonic neural stem cells of the fish retina. Development. 141 (18), 3472-3482 (2014).
- Charles, J. F., Aliprantis, A. O. Osteoclasts: more than 'bone eaters. Trends Mol Med. 20 (8), 449-459 (2014).
- DeLaurier, A., Eames, B. F., Blanco-Sanchez, B., Peng, G., He, X., Swartz, M. E., Ullmann, B., Westerfield, M., Kimmel, C. B. Zebrafish sp7:EGFP: a transgenic for studying otic vesicle formation, skeletogenesis, and bone regeneration. Genesis. 48 (8), 505-511 (2010).
- Du, S. J., Frenkel, V., Kindschi, G., Zohar, Y. Visualizing normal and defective bone development in zebrafish embryos using the fluorescent chromophore calcein. Dev Biol. 238 (2), 239-246 (2001).
- Eriksen, E. F. Cellular mechanisms of bone remodeling. Rev Endocr Metab Disord. 11 (4), 219-227 (2010).
- Hockendorf, B., Thumberger, T., Wittbrodt, J. Quantitative analysis of embryogenesis: a perspective for light sheet microscopy. Dev Cell. 23 (6), 1111-1120 (2012).
- Inohaya, K., Takano, Y., Kudo, A. The teleost intervertebral region acts as a growth center of the centrum: in vivo visualization of osteoblasts and their progenitors in transgenic fish. Dev Dyn. 236 (11), 3031-3046 (2007).
- Iwamatsu, T. Stages of normal development in the medaka Oryzias latipes. Mech Dev. 121 (7), 605-618 (2004).
- Kirchmaier, S., Hockendorf, B., Moller, E. K., Bornhorst, D., Spitz, F., Wittbrodt, J. Efficient site-specific transgenesis and enhancer activity tests in medaka using PhiC31 integrase. Development. 140 (20), 4287-4295 (2013).
- Kirchmaier, S., Naruse, K., Wittbrodt, J., Loosli, F. The genomic and genetic toolbox of the teleost medaka (Oryzias latipes). Genetics. 199 (4), 905-918 (2015).
- Komori, T. Animal models for osteoporosis. Eur J Pharmacol. 759, 287-294 (2015).
- Mackay, E. W., Apschner, A., Schulte-Merker, S. A bone to pick with zebrafish. Bonekey Rep. 2, 445(2013).
- MacRae, C. A., Peterson, R. T. Zebrafish as tools for drug discovery. Nat Rev Drug Discov. 14 (10), 721-731 (2015).
- Mitchell, R. E., Huitema, L. F., Skinner, R. E., Brunt, L. H., Severn, C., Schulte-Merker, S., Hammond, C. L. New tools for studying osteoarthritis genetics in zebrafish. Osteoarthritis Cartilage. 21 (2), 269-278 (2013).
- Renn, J., Buttner, A., To, T. T., Chan, S. J., Winkler, C. A col10a1:nlGFP transgenic line displays putative osteoblast precursors at the medaka notochordal sheath prior to mineralization. Dev Biol. 381 (1), 134-143 (2013).
- Renn, J., Winkler, C. Osterix-mCherry transgenic medaka for in vivo imaging of bone formation. Dev Dyn. 238 (1), 241-248 (2009).
- Schilling, T. F., Kimmel, C. B. Segment and cell type lineage restrictions during pharyngeal arch development in the zebrafish embryo. Development. 120 (3), 483-494 (1994).
- Spoorendonk, K. M., Peterson-Maduro, J., Renn, J., Trowe, T., Kranenbarg, S., Winkler, C., Schulte-Merker, S. Retinoic acid and Cyp26b1 are critical regulators of osteogenesis in the axial skeleton. Development. 135 (22), 3765-3774 (2008).
- To, T. T., Witten, P. E., Renn, J., Bhattacharya, D., Huysseune, A., Winkler, C. Rankl-induced osteoclastogenesis leads to loss of mineralization in a medaka osteoporosis model. Development. 139 (1), 141-150 (2012).
- Wakamatsu, Y., Pristyazhnyuk, S., Kinoshita, M., Tanaka, M., Ozato, K. The see-through medaka: a fish model that is transparent throughout life. Proc Natl Acad Sci USA. 98 (18), 10046-10050 (2001).
- Witten, P. E., Huysseune, A. A comparative view on mechanisms and functions of skeletal remodelling in teleost fish, with special emphasis on osteoclasts and their function. Biol Rev Camb Philos Soc. 84 (2), 315-346 (2009).
- Yu, T., Witten, P. E., Huysseune, A., Buettner, A., To, T. T., Winkler, C. Live imaging of osteoclast inhibition by bisphosphonates in a medaka osteoporosis model. Dis Model Mech. 9 (2), 155-163 (2016).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır