Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Yüzeyler İnsan Norovirus Tespiti sürüntü Örnekleme Yöntemi
Bu Makalede
Özet
A macrofoam based sampling methodology was developed and evaluated for the detection and quantification of norovirus on environmental hard surfaces.
Özet
İnsan Noroviruses salgın ve dünya çapında dağınık gastroenteritin önde gelen nedenidir. En enfeksiyonlar ya çevresel yüzeylerde ya da gıda yoluyla dolaylı olarak kişiden kişiye yolla doğrudan yayılır ya, çünkü kirlenen fomitler ve cansız yüzeyler norovirus salgınları sırasında virüsün yayılması için önemli araçlardır.
Biz geliştirdik ve algılama ve sert yüzeylerde insan Noroviruses bir tiplemesi için macrofoam bezlerden kullanarak bir protokol değerlendirildi. Fiber uçlu bezlerden veya antistatik mendil ile karşılaştırıldığında, macrofoam bezlerden 700 cm2 klozet yüzeylerinden virüs kurtarma (aralık 1,2-33,6%) izin verir. Protokol spin sütunları kullanılarak viral RNA'nın bezlerden virüsün çıkarma ve bir daha konsantrasyon yapılması adımlarını içerir. norovirus gastroenterit olmuştu yolcu gemileri ve uzun süreli bakım tesislerinde yüzeylerinden toplanan olmuştu 217 sürüntü örneklerinin toplam olarak, 127 (% 58.5)RT-qPCR GII norovirusa için pozitif test bildirildi. Bu 29 (% 22.8) başarıyla genotip olabilir. Sonuç olarak, klinik örnekler mevcut olmadığında virüsün saptanması yanı sıra salgınlar sırasında çevresel kirlilik düzeyinin belirlenmesinde yardımcı olabilir geliştirilen protokolü kullanılarak çevresel yüzeylerde norovirusa tespiti; aynı zamanda iyileştirme stratejilerinin etkinliğinin izlenmesi kolaylaştırabilir.
Giriş
İnsan Noroviruses salgın ve sporadik akut gastroenterit, dünya çapında 1, 2, 3 lider nedenidir. Virüs son derece bulaşıcıdır ve iletim kişi etkileşim ya da dolaylı kirlenmiş yiyecek, su ya da çevresel yüzeylerle temas yoluyla doğrudan kişi aracılığıyla gerçekleşir. Noroviruses uzun süre tutacak ve uzun süreli çevresel yüzeyler üzerinde virüs yaşam 1, 2, 3, belgelenmiştir edilebilir. Pik ağızlık açma işlemi esnasında, virüs partiküllerinin milyarlarca dışkıların gramı başına serbest bırakılır, ve kusmuk da enfeksiyonu 4, 5, 6, 7, 8 neden viral parçacıkların yeterli sayı içerir,ef "> 9, 10. Buna ek olarak, cansız yüzeyler ve insan cilt arasındaki virüsün transferi kolayca oluşabilir 2, 11, 12. Dolayısıyla, çevresel kirlilik izleme salgını soruşturmalarda yardımcı ve temiz-up etkinliğini değerlendirmede olabilir ve dezenfeksiyon işlemleri.
Bir çok çevresel numune alma protokolleri rotavirüs saptanması için tarif edilmiştir, kolifaj MS2, kedigiller calicivirüs (FCV) ve bakteriyofaj P22 13, 14, 15, 16. Ancak, hızlı kurumaya (<1 saat) ve küçük yüzey alanları da dahil olmak üzere bu çalışmalarda, açıklanan doğrulama koşulları (25 x 100 cm 2), yeterli alan ayarlarını temsil etmeyebilir. Buna ek olarak, Çevreyi düşük kirlilik seviyeleri tahminnmental yüzeyler çok az virüs partiküllerini tespit edebiliyoruz protokolleri gerektirir.
Biz Norovirüs tespiti ve yazmak için bir macrofoam esaslı yüzey örnekleme yöntemi geliştirdi. Bu yöntem, birkaç norovirus salgınlar sırasında valide edilmiştir. protokol içerir 1) (2) nasıl en iyi laboratuvara toplama ve nakliye sırasında numunelerin bütünlüğünü korumak için, ve norovirusa 3) laboratuvar testleri ve yazarak çevresel yüzeylerden sürüntü örnekleri toplamak için nasıl.
Protokol
Alanında 1. Swab Örnekleme
- eldiven temiz bir çifti giymek.
- bir ölçüm bandı veya cetvel kullanarak yüzeyine dokunmadan örnekleme alanının boyutunu ölçün. Mümkün olduğu kadar doğru bölgeyi tahmin ve bir rapor formu (Ek Tablo 1) doldurmak için deneyin.
- olası sızıntı ve etiket örneği taşıma çantaları ve çubukla kitleri için sürüntü kiti edin.
- şu şekilde numune alanı boyunca çubukla hareket Yatay yönde bir felç, dikey yönde bir vuruş ve bir köşegen yönünde bir vuruş. 700 cm 2 den bir yüzey alanı büyük çubukla etmeyin.
- bir tüp içine her bezi yerleştirin ve güvenli kapağı sıkın.
Laboratuvara Swablar 2. Depolama ve Taşıma
- en fazla 48 saat boyunca 4 ° C 'de bezlerden tutun. daha uzun süreler boyunca depolama gerekli ise, -20 ° C 'de bezlerden saklamak (ya da -70 ° C).
- 0-4 ° C'de tüpler tutmak (örn. Toplama 24-48 saat içinde laboratuar ve gemiye taşıma sırasında izole edilmiş bir kap içinde) soğuk paketleri kullanır.
3. Virüs Konsantrasyon, Viral RNA Ekstraksiyonu ve Saflaştırılması
NOT: Aksi belirtilmedikçe tüm santrifüj adımları, oda sıcaklığında 5 dakika boyunca 5000 x g'de bir masa üstü santrifüjü kullanabilirsiniz. evrensel nükleik asit ekstraksiyon (UNEX) tamponu ile çalışırken ekstra dikkatli olun. gözlük veya yüz siperi takın.
- bir 15 ml tüp ve her bir numune için bir RNA Midi sütun etiketleyin. Her deneyde negatif çıkarma kontrolü içerir.
- 10 çubuklar için lizis çözeltisinin hazırlanması PBST 25 mL UNEX tamponu 25 ml karışımı (% 0.02 oranında içeren PBS pH 7.2 Tween-80).
- Lizis çözeltisinin 50 mL kolifaj MS2 süspansiyonu (10 6 PFU / ml) 50 ul ekleyin.
- 15 ml bir tüp içinde bir çubukla yerleştirilir ve 5 mi liz çözeltisi ilave edin. Karıştırınız ve oda sıcaklığında 10 dakika inkübe edilir.
- 10 sn için, her bir tüp ve vorteks 5 mi% 100 etanol ilave edin.
- Dikkatle 15 ml tüp çubukla kaldırmak aşırı sıvı kaldırmak ve sonra çubukla atmak için tüpün kenarına hafifçe bastırarak (o UNEX tampon içerir). Geri kalan hacim 9-10 ml arasında olmalıdır.
4. Midi Sütun Viral Nükleik Asit Ekstraksiyon
- Dikkatle bir midi sütun, santrifüj üzerine adım 3.6 4.5 mL UNEX / etanol karışımı aktarın ve süzüntü atın.
- Aynı sütun, santrifüj üzerine aynı karışımdan başka 4.5 mL yükleyin ve süzüntü atın.
- İlk yıkama için, Midi kolonu, santrifüjün üzerine,% 70 etanol 3.5 ml ilave edilir ve filtrat atılır.
- İkinci yıkama için, Midi kolonu üzerine% 70 etanol bir 3,5 ilave edin. Santrifüj süzüntü atın ve.
- kuru spin için, etanol tüm izlerini (olumsuz viral RNA kurtarma etkileyebilir) kaldırmak için Midi sütunları santrifüj.
- yeni bir 15 ml'lik santrifüj tüpüne Midi sütun. Midi kolonuna 250 ul elüsyon tamponu ekleyin; En yüksek Viral RNA iyileşmeyi elde etmek santrifüj edilmeden önce 1 dakika boyunca bekleyin.
- -70 ° C'de çıkarılan nükleik asidi saklayın veya adım 5'e hemen geçin.
RNA Temiz ve Konsantratörü Setlerini Kullanma Viral Nükleik Asit 5. Konsantrasyon
- RNA 10 saniye süreyle yukarıda adım 4.7 ve vorteks yıkandı RNA 250 uL Bağlama Tamponu 500 mcL ekleyin.
- 10 sn için 750 mcL% 100 etanol ve vorteks ekleyin.
- Her bir numune için bir spin kolon etiketleyin. spin kolona 750 uL örnek yükleyin.
- 1 dakika boyunca 12.000 xg'de dönüş sütunları santrifüj. flow-through atın.
- 1 dakika boyunca 12.000 xg'de bir spin kolon ve santrifüj üzerine kalan 750 uL yükleyin.
- ön yıkama için 1 dakika boyunca 12.000 xg'de her spin kolon ve santrifüj 400 uL RNA Hazırlık tampon ekleyin. flow-through atın.
- İlk yıkama için, 1 dakika için 12,000 x g'de her spin kolon ve santrifüj 800 uL RNA yıkama tamponu ilave edin. flow-through atın.
- İkinci yıkama için, 1 dakika için 12,000 x g'de sütun ve santrifüj dönmeye 400 uL RNA yıkama tamponu ilave edin. flow-through atın.
- kuru spin için, 2 dakika süreyle 12,000 xg'de yıkama tamponu tüm izlerini silmek için spin kolon santrifüj.
- Dikkatle temiz bir 1.5 mL mikrosantrifüj tüp spin kolon aktarın.
- Spin kolonu üzerine 25 uL elüsyon tamponu ilave edin ve oda sıcaklığında 1 dakika boyunca inkübe edin. Bu sütundan viral RNA kurtarma artacaktır.
- 1 dakika 10.000 xg'de spin kolon santrifüj edilerek RNA toplayın.
- Her iki durumda da, -70 ° C'de, RT-qPCR (aşama 6) veya mağaza RNA doğrudan devam edin.
6. Genogroup I Mutiplex RT-qPCR Algılama ve II Noroviruses ve Kolifaj MS 2 (Ek Tablo 2)
- Temiz çalışma yüzeyleri, pipettes, RNaz dekontaminasyon solüsyonu ile ve santrifüjler olası kirlenmeyi azaltmak için.
- buz üzerinde RT-qPCR reaktifler çözülme. (Ayrı bir alan / oda) buz üzerinde Çözülme RNA.
- Reaksiyonların sayısını belirlemek ve bunların en az% 10 daha fazla eklemek (10 reaksiyonlar gerektiği takdirde, örneğin, 11 master karışımı olun).
- 5 saniye için 25x RT-qPCR enzimi haricinde Vortex bireysel master miks bileşenleri. Dikkatli bir parmak ile tüp hafifçe vurarak enzimi karıştırın.
- 5 saniye süreyle kısaca santrifüj master miks bileşenleri.
- Kiti talimatlarına göre Norovirus GI ve GII gerçek zamanlı RT-PCR tespiti için ana karışım hazırlanarak, 1.5 ml mikrosantrifüj tüpü (Ek Tablo 3) norovirus spesifik oligonükleotid primerler ve problar ekleyin.
- yukarı ve aşağı 5-10 kez pipetleme ana karışımı karıştırın (vorteks tavsiye edilmez). Gerçek zamanlı PCR, 96 oyuklu plakanın her bir master karışımı kısım 22 uL.
- Vortex örnek RNA5 saniye için, ve kısa (5 s) santrifüjle toplanır.
- RT-qPCR plaka (Tablo 2 şablonu izleyin) örnek RNA ve GI ve GII pozitif kontroller 3 mcL ekleyin. no-şablon kontrolü (NTC) kuyularda nükleaz Freewater 3 mcL ekleyin.
- Optik yapışkan film ile gerçek zamanlı plaka basım.
- 1 dakika kuyularda mevcut olabilecek herhangi bir hava kabarcığı veya sıvı damlaları kaldırmak için dikkatlice 1,300 xg'de gerçek zamanlı plaka santrifüj.
- 10 dakika 1) RT adım: Bir gerçek zamanlı PCR cihazı ve set-up aşağıdaki thermocycling koşullar ayarlayın. Taq polimeraz, 45 ° C (2) aktivasyonu, 10 dak. 95 ° C ve (3) 95 ° C'de 15 saniye, 45 döngü, 60 ° C'de 60 s.
Çubuğu Örneklerinde Norovirus 7. sayısallaştırılması
- RT-qPCR sonuçları (Ek Tablo 3) doğrulamak için pozitif ve negatif kontrollerin sonuçlarını kontrol edin.
- Her bir standart eğri karşılayıp karşılamadığını belirlemekkabul edilebilir değerler Ek Tablo 2'de verilmiştir ve Eşitlik 1 kullanılarak standart eğri için genel standart sapmayı hesaplar.
(Denklem 1)% verim = 100 x 10 (ortalama Ct Değerleri-Intercept) / Eğim. - PCR termal döngü cihazı yazılımı her standart eğri için eğimi hesaplamak etmezse, eğim ve R istatistik yazılımı kullanılarak regresyon ile 2 değerleri (örneğin Excel, SPSS, ya da SAS) belirler. Buna ek olarak, denklem I aşağıdaki standart eğriler için% verimliliğini hesaplamak
- Ek Tablo 4'te belirtilen kriterlere uygun standart eğrileri dayalı tüm test numuneleri için termal döngü cihazı yazılımı tarafından hesaplanan RNA kopya numarasını kaydedin. Kriterlere uygun ya da yanlış pozitif kontroller yok, standart eğrileri t şapka ile herhangi bir örnekleri yeniden. PCR inhibisyonunu izlemek için bir iç kontrol olarak eklenmiştir kolifajla MS2, Ct değerlerini kontrol edin.
- RNA kopyası p sayısını belirlemekRT-qPCR Reaksiyon için kullanılan RNA (3 uL 5), bu, toplam RNA, yıkama sıvısı hacmi (25 ila 50 uL) oranında adım 7.2 hesaplanan RNA kopya sayısı ile çarpılarak er örneği. Alternatif olarak, analiz nesne yüzey alanı (cm2) toplam RNA kopya sayısına bölünmesi ile RNA yoğunluğunu hesaplamak.
Yan yerleştirilmiş geleneksel PCR amplifikasyonu ile gerçek zamanlı RT-PCR pozitif örnek 8. Genotiplendirme
- RT-PCR testinin her bir primer seti için ana karışımı ilk turda hazırlayın (Ek Tablo 2 ve 5).
- ana karışımı 20 mcL norovirus pozitif RNA 5 mcL ekleyin.
- aşağıdaki koşullar altında, RT-PCR deneyinde (1) içinde oda sıcaklığında 95 ° C'de, Taq polimeraz, 42 ° C (2) aktivasyonu, 15 dakika, 30 dakika boyunca aşama, ve (3) 95 ° C'de 30 saniyelik 40 döngü 50 ° C'de 30 saniye ve 72 ° C'de 60 san. 40 döngü sonrasında, 72 ° C'de ek bir 10 dakika boyunca inkübe edin.
- RT-PCR testinin her bir primer seti (Ek Tablo 2 ve 5) için mater karışımı ikinci tur hazırlayın.
- 23 uL ana karışımı ekleyin ve her tüp (ideal ilk tur ürünü RNaz içermeyen su içinde 1/10 seyreltilmiş olmalıdır) için (ilk turdan) ilk tur RT-PCR ürünlerinin 2 mcL ekleyin.
- Adımı tekrarlayın 8.3.
- (PH 8.3, 40 mM Tris, 20 mM asetik asit ve 1 mM EDTA) 100 mL 1x Tris-asetat EDTA,% 2 agaroz jel hazırlayın. Bir mikrodalga fırında karışımın ısıtılmasıyla agaroz çözüldükten sonra, 60-70 ° C'ye kadar soğutulduktan sonra karışım hazırlanmış jel, 100 ml başına nükleik asit leke 10 mcL jel dökün ve tarak yerleştirin. Jel en az 30 dakika süreyle dinlendiriniz.
- 6x yükleme boyası 3 uL her bir RT-PCR ürünü 15 ul karıştırın. Yük Her numunenin 15 uL ve 1 saat boyunca 100 V'ta agaroz jeli Electrophorese.
- Jel An uygun büyüklükte (GI için 330 bp ve GII 341 bp) tüketim hedefi RT-PCR fragmanlarıticari bir jel özütleme kiti kullanılarak RNA'yı saflaştırmak d. Arıtılmış PCR ürünü, artık Sanger sekanslama için de kullanılabilir.
Sonuçlar
Şekil 1 sürüntü örnekleme protokolünün bir akış şemasını göstermektedir. Bu protokol dört ana aşamadan oluşmaktadır; 1) numune toplama, 2) örnek depolama ve nakliye, 3) viral RNA arıtma ve konsantrasyon ve 4) RT-qPCR tahlil ve genotiplendirme.
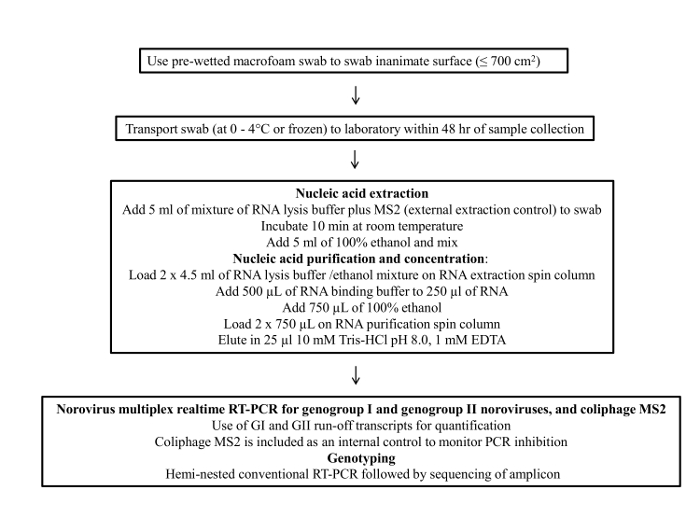
Şekil 1: norovirusa çevresel yüzey örnekleme için nihai protokol?...
Tartışmalar
Noroviruses 18 ve 10 3 virüs parçacıkları 20 arasında% 50 insan bulaşıcı dozu var. Bu nedenle, yüzeylerin bile düşük seviyeli kirlenme bir halk sağlığı riski doğurabilir. iç çıkarma kontrolü olarak taşıma sırasında 1) farklı sürüntü malzemeleri, 2) depolama koşulu bezlerden, 3) viral RNA konsantrasyonu ve 4) kolifaj MS2: çubukla örnekleme protokolünün çeşitli yönleri de dahil olmak üzere değerlendirildi.
Yakın zamana ...
Açıklamalar
Authors have no conflicting interest. The findings and conclusions in this report are those of the authors and do not necessarily represent the official position of the Centers for Disease Control and Prevention.
Teşekkürler
The authors have no acknowledgements.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Generic name for kits | |||
| Macrofoam swab | Premoistened EnviroMax Swab kit | Puritan | 2588060PFUW |
| RNA Lysis buffer | CDC UNEX buffer | Microbiologics | Cat No MR0501 |
| RNA extraction spin column | Midi column | Omega Biotek | Cat No R6664-02 |
| RNA purification spin column | Zymol RNA Clean and Concentrator kit | Zymo Research | Cat No R1016 |
| Real time RT-PCR kit | AgPath kit One-Step RT-PCR Kit | Life Technologies | Cat No 4387391 |
| Conventional RT-PCR kit | Qiagen one step RT-PCR kit | Qiagen kit | Cat No 210212 |
| Gel extraction kit | Qiagen QIAquick gel extraction kit | Qiagen kit | Cat No 28704 or 28706 |
| Coliphage MS2 | ATCC | Cat No 15597-B1 | |
| RNA run-off transcripts | |||
| Realtime PCR platform | Applied Biosystems | Model ABI 7500 | |
| Optical 96-well reaction plate | Thermo Scientific | Cat No 4316813 | |
| MicroAmp Clear Adhesive Film | Thermo Scientific | Cat No 4306311 |
Referanslar
- Isakbaeva, E. T., et al. Norovirus transmission on cruise ship. Emerg. Infect. Dis. 11, 154-158 (2005).
- Lopman, B. A., Gastañaduy, P., Park, G. W., Hall, A. J., Parashar, U. D., Vinjé, P. Environmental transmission of norovirus gastroenteritis. Curr. Opin. Virol. 2 (1), 1-7 (2011).
- Malek, M., et al. Outbreak of norovirus infection among river rafters associated with packaged delicatessen meat, Grand Canyon, 2005. Clin Infect Dis. 48 (1), 31-37 (2009).
- Atmar, R. L., et al. Norwalk virus shedding after experimental human infection. Emerg. Infect. Dis. 14 (10), 1553-1557 (2008).
- Glass, R. I., Parashar, U. D., Estes, M. K. Norovirus gastroenteritis. N. Engl. J. Med. 361 (18), 1776-1785 (2009).
- Park, G. W., et al. Evaluation of a New Environmental Sampling Protocol for Detection of Human Norovirus on Inanimate Surfaces. Appl. Environ. Microbiol. 81 (17), 5987-5992 (2015).
- Barker, J., Jones, M. V. The potential spread of infection caused by aerosol contamination of surfaces after flushing a domestic toilet. J. Appl. Microbiol. 99, 339-347 (2005).
- Tung-Thompson, G., Libera, D. A., Koch, K. L., de Los Reyes, F. L., Jaykus, L. A. Aerosolization of a Human Norovirus Surrogate, Bacteriophage MS2, during Simulated Vomiting. PloS one. 10, 0134277 (2015).
- Atmar, R. L., et al. Determination of the 50% human infectious dose for Norwalk virus. J. Infect. Dis. 209 (7), 1016-1022 (2014).
- Petrignani, M., van Beek, J., Borsboom, G., Richardus, J. H., Koopmans, M. Norovirus introduction routes into nursing homes and risk factors for spread: a systematic review and meta-analysis of observational studies. J. Hosp. Infect. 89 (3), 163-178 (2015).
- . Centers for Disease Control Prevention. Norovirus outbreak in an elementary school--District of Columbia, February 2007. MMWR. Morb. Mortal. Wkly. Rep. 56 (51-52), 1340-1343 (2008).
- Cheesbrough, J. S., Barkess-Jones, L., Brown, D. W. Possible prolonged environmental survival of small round structured viruses. J. Hosp. Infect. 35, 325-326 (1997).
- Julian, T. R., Tamayo, F. J., Leckie, J. O., Boehm, A. B. Comparison of surface sampling methods for virus recovery from fomites. Appl. Environ. Microbiol. 77, 6918-6925 (2011).
- Taku, A., et al. Concentration and detection of caliciviruses from food contact surfaces. J. Food. Prot. 65, 999-1004 (2002).
- Scherer, K., Ellerbroek, L., Schulenburg, J., Johne, R., Klein, G. Application of a swab sampling method for the detection of norovirus and rotavirus on artifically contaminated food and environmental surfaces. Food. Environ. Virol. 1 (42), 42-49 (2009).
- Herzog, A. B., et al. Evaluation of sample recovery efficiency for bacteriophage P22 on fomites. Appl. Environ. Microbiol. 78, 7915-7922 (2012).
- Vega, E., et al. CaliciNet: A Novel Surveillance Network for Norovirus Gastroenteritis Outbreaks in the United States. Emerging Infectious Diseases. 17 (8), 1389-1395 (2011).
- Rolfe, K. J., et al. An internally controlled, one-step, real-time RT-PCR assay for norovirus detection and genogrouping. J Clin Virol. 39 (4), 318-321 (2007).
- Kittigul, L., et al. Norovirus GII-4 2006b variant circulating in patients with acute Thailand during a 2006-2007 study. J. Med. Virol. 82 (5), 854-860 (2010).
- Teunis, P. F., et al. Norwalk virus: how infectious is it. J. Med. Virol. 80 (8), 1468-1476 (2008).
- Wollants, E., et al. Evaluation of a norovirus sampling method using sodium dodecyl sulfate/EDTA-pretreated chromatography paper strips. J. Virol. Methods. 122, 45-48 (2004).
- Weir, M. H., Shibata, T., Masago, Y., Cologgi, D., Rose, J. B. The Effect of Surface Sampling and Recovery of Viruses and Non-Spore Forming Bacteria on a QMRA Model for Fomites. Environ. Sci. Technol. 50 (11), 5945-5952 (2016).
- . Microbiology of food and animal feed-Horizontal method for determination of hepatitis A virus and norovirus in food using real-time RT-PCR. International Organization for Standardization (ISO). , (2013).
- Huslage, K., Rutala, W. A., Sickbert-Bennett, E., Weber, D. J. A quantitative approach to defining "high-touch" surfaces in hospitals. Infect. Control. Hosp. Epidemiol. 31 (8), 850-853 (2010).
- Wu, H. M., et al. A norovirus outbreak at a long-term-care facility: the role of environmental surface contamination. Infect. Control. Hosp. Epidemiol. 26 (10), 802-810 (2005).
- Ikner, L. A., Gerba, C. P., Bright, K. R. Concentration and recovery of viruses from water: a comprehensive review. Food Environ. Virol. 4 (2), 41-67 (2012).
- Gallimore, C. I., et al. Environmental monitoring for gastroenteric viruses in a pediatric primary immunodeficiency unit. J. Clin. Microbiol. 44 (2), 395-399 (2006).
- Ganime, A. C., et al. Dissemination of human adenoviruses and rotavirus species A on fomites of hospital pediatric units. Am J Infect Control. , (2016).
- Verani, M., Bigazzi, R., Carducci, A. Viral contamination of aerosol and surfaces through toilet use in health care and other settings. Am J Infect Control. 42 (7), 758-762 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır