Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Göreceli güç, bir Anti-TNF Monoklonal antikor (mAb) Neutralizing In Vitro Bioanalytical yöntemini kullanarak TNF tarafından belirlenmesi
Bu Makalede
Özet
Bir protokol WEHI 164 hücrelerle nötralizasyon mekanizmasını kullanarak bir anti-TNFα mAb göreli anti-apoptotik aktivitesinin belirlenmesi için burada sunulan. Bu iletişim kuralı ile aynı biyolojik işlevi farklı molekül nötralizasyon gücünü karşılaştırmak için yararlıdır.
Özet
Bu iletişim kuralı TNFα apoptotik etkinlik nötralize ölçümü bir anti-TNFα mAb kullanarak bir fare fibroblast hücre modelinde (WEHI 164) gösterir. Ayrıca, bu iletişim kuralı başka anti-TNFα moleküllerin, füzyon protein değerlendirmek için kullanılabilir. Ne zaman bir ek stres faktörü hücre kültür koşulları (Örneğin, serum yoksunluk) indüklenen hücresel modeli burada istihdam TNFα aracılı apoptosis duyarlıdır. Bu yordamı nasıl numune hazırlama, hücre seyreltme, Apoptozis indüksiyon ve başarılı sonuçlar sağlamak için kritik olan spektrofotometrik ölçümler ilgili anahtar işlemleri vurgulayarak bu analitik tahlil çalıştırmak için örneğidir. Bu iletişim kuralı apoptosis indüksiyon ve kayıt, düşük belirsizlik değerleri için önde gelen verimli sinyal ile ilgili en iyi performans koşullar ortaya koymaktadır.
Giriş
Biyolojik etki gücüne (kütle birimi cinsinden) miktarını protein içeriği fizikokimyasal bir ölçüsüdür, ancak ilgili biyolojik özellikleri için bağlı olan bölümü ürün öznitelikleri temel biyolojik aktivitesi niceliksel ölçüsüdür. KUDRET testleri, analitik diğer yöntemlerden ürün uygunluk, istikrar ve karşılaştırılabilir çalışmaları kapsamında gerçekleştirilir. Bu anlamda, kudret ölçümler ürün toplu işlemleri tüm aşamada klinik denemeler ve Pazar onaylandıktan sonra sırasında kritik kalite öznitelikleri (CQAs) veya kabul kriterlerini karşılamak olduğunu göstermek için kullanılır.
Apoptozis programlanmış hücre ölümü, hücreler hücreleri bir çevre tarafından stresli olduğunda veya bir virüs ile enfekte doğal olarak meydana gelen faktör bu uzlaşma hücresel canlılığı ve işlev1,2. Diğerleri arasında Apoptozis inhibisyon veya biyolojik nötralizasyon, mAbs, özellikle immün aracılı enflamatuar bozuklukları gibi kronik hastalıkların tedavisinde esas olarak bilinen tedavi mekanizmaları biridir. Anti-TNFα molekülleri onların tedavi edici özellikleri tümör nekrozis faktör alfa (TNFα) arasındaki etkileşimin engelleyerek böylece nihayet için hücresel apoptosis kurşun sinyal yolları engelleyen p55 ve p75 hücre yüzey reseptörleri ile3, uygulamayın.
TNFα iltihap bazı kronik hastalıklar4üretebilir. TNFα spuriously ekstraselüler ortamın nöbetçiler doğuştan gelen bağışıklık sistemi ve bu tür hastalık5ana oyuncular makrofajlar tarafından salgılanan. Ortak bir yol, TNFα deregülasyon bu hastalıkların patogenezinde ile ilişkilidir. Kontrol etmeden ve sürekli indüksiyon ve hücre stres altında TNFα sonuçta leading romatoid artrit, Crohn hastalığı ve diğer patolojik profilleri6hücre ölüm ve doku dejenerasyonu, neden olmaktadır.
TNF ve onun reseptörleri arasındaki etkileşimi engellemek TNF antagonistleri giderek belirtiler azaltmak ve bu hastalıkların ilerlemesini engellemek için etkili bir tedavi olarak kullanılmıştır. Günümüzde, anti-TNFα ilaç ürünleri yaygın olarak böylece daha fazla yer doku dejenerasyonu engelleyen bu sitokin sistemik konsantrasyonu denetlemek için kullanılır. Bu anlamda, onun biyolojik etkiyi elde etmek için bir ilaç belirli yeteneğini açıklamak için tekrarlanabilir ve sağlam bir bioassay sağlanması şarttır.
Bu protokol, kritik adımlar-nötralizasyon tahlil geliştirilmesi sırasında tespit-bio analitik yöntem yürütmek için gerekli becerileri özel bir vurgu ile biyolojik etki gücü başarılı ölçüm için vurgulanır. Bu bio analitik yöntem bir klinik olarak test edilmiş başvuru madde karşılaştırıldığında ilaç ürünleri farklı toplu işlemleri veya anti-TNFα arasında yararlı karşılaştırılabilir bilgi sağlar.
Protokol
1. medya ve çözümleri hazırlanması
- kültür ortamı hazırlamak: RPMI-%1640 10 ile FBS, pH 7.4.
- Hazırlama tahlil kültür orta: RPMI-1640 fenol red olmadan ancak % 1'ile FBS, pH 7.4.
- Hücre yıkama çözüm hazırlamak: DPBS Mg ve Ca ücretsiz Çözümle %0.02 EDTA, pH 7.4.
- Hücre dekolmanı çözümü hazırlamak: %0.125 tripsin ile 1 mM EDTA.
- % 0.25 çözüm tripsin-EDTA ve transfer steril bir 500 mL şişe 100 mL çözülme.
- Mix hücrenin 100 mL ile çözüm yıkama ve 15 mL aliquots 15 mL steril tüpler içine dağıtmak. -70-80 ° C kadar kullanım için mağaza.
- Bu çözümler 0,22-µm membran aracılığıyla filtre ve 37 ° C'ye kadar en az 30 dk kullanmak için önceden ısıtmak.
- Apoptosis indüksiyon hisse senedi çözüm TNFα çözüm 3.3 µg/mL, hazır olun.
- TNFα dissolve 20 µg ile filtre sterilize su onun birincil konteyner ve mix tam dağılmasına kadar 500 µL.
- 15 mL steril tüp içine aktarmak ve bu tüp için 5.5 mL DPBS Mg ve Ca ücretsiz çözeltisi ekleyin. Yavaşça bir girdap Mikser kullanarak karıştırın.
- Aliquot çözüm 70 µL bölümleri içine. Her aliquot 0.5 mL mikrotüpler ve-80 mağazasında içine dağıtmak ° C.
- Apoptosis indüksiyon çözüm hazırlamak: 40 ng/mL, TNFα çözüm.
- Bir aliquot için 10 dk. 25 ˚C, bir su banyosu içinde kuluçka apoptosis indüksiyon hisse senedi çözüm tezcan
- 15 mL steril tüp içinde tahlil kültür ortamının 4.939 ml 3.3 µg/mL TNFα çözüm 61 µL ekleyerek apoptosis indüksiyon hisse senedi çözüm 40 ng/ml seyreltik.
- Mix 10 girdap Mikser tarafından s; Bu çözüm gerekir hazır taze kullanılmadan önce.
- 37 ° C en az 30 dk th eneutralization assay olarak kullanmak için önceden için çözüm ısınmak.
- Substrat çözeltisi hazırlamak: caspase 3/7 Glo çözüm 7 , 8.
- Caspase arabellek çözüm (caspase 3/7 Glo arabellek) kullanmadan önce 12 h çözülme.
- İzin caspase arabellek çözüm ve substrat (caspase 3/7 Glo substrat) oturup ayrı ayrı 25 ± 5 ° C karıştırma önce 30 dk için.
- 10 mL caspase tampon çözeltisi substrat flakon ve mix INVERSION tarafından transfer.
- Tutun 25 ± 5 ° C, ışık korumalı kadar kullanmak.
Not: Çözüm için oda sıcaklığında 6 h stabildir.
2. Hücre Culturing ve sayım
- hücre çözdürme ve ilk alt kültür.
- Bir dondurucu-80 ˚C adlı bir şişe WEHI 164 hücreleri 9 kaldırmak ve bir buz banyosu için transfer.
- Yukarı ve aşağı tamamen donmuş hücreleri çözülme kadar Önceden ısıtılmış kültür orta 1 mL ile pipet.
- 9 mL 15 mL steril tüp Önceden ısıtılmış kültür ortamına dağıtmak.
- Hücre süspansiyon 15 mL steril tüp içine aktarmak ve beş kez INVERSION tarafından karışımı yavaşça.
- 125 x g 3 dk. atma, hücre süspansiyon süpernatant santrifüj kapasitesi ve hücre Pelet disaggregate.
- Kültür orta 5 mL tüp ekleyin. Mix kadar hücreleri tamamen resuspended.
- Hücre sayımı için bir 500 µL microtube ve karıştırmak ile 50 µL % 0,4 trypan mavi hücre süspansiyon 50 µL aktarın. Hücreleri saymak ve 10 6 hücre/mL x 0.5 için ayarlayın. Adım 2.2, aşağıya bakın.
- Önceden ısıtılmış kültür Orta 13 mL 75 mL hücre kültür şişe ekleyin.
- Adım 2.1.6 0.5 x 10 6 hücre/mL hücre kültür şişeye ulaşmak ve 37 ° C ve % 5 CO 2 adlı gecede kuluçkaya yeterli hücre süspansiyon birimden dağıtmak.
- Hücre sayımı.
Not: Bkz: başvuru 10.- Çözüm kullanarak 2.1.6 adımından 0.05 mL bir hemasitometre aktarmak ve hücre yoğunluğu trypan mavi dışlama kullanarak bir mikroskop altında belirlemek.
- Hücreleri ve hücrelerin toplam sayısını ölçmek.
- Ayarlamak hücre süspansiyonlar için 0.5 x 10 6 hücre/mL.
Denklem 1
V kültür orta (mL) =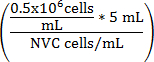
V kültür orta (mL) (5 mL - V hücre süspansiyon) =
V kültür orta (mL) ayarlanan birim WEHI 164 = hücre süspansiyon
NVC uygun WEHI 164 hücre/mL say²s²
V kültür orta (mL) 0.5 10 6 hücre/mL x ulaşmak için hücre süspansiyon ekledi tahlil kültür orta hacmi =
0.5 x 10 6 hedef hücre yoğunluğu =
- Hücre dekolmanı ve ikinci ve üçüncü alt kültür.
Not: Bir vakum sistemi çözümleri şişeler kaldırmak için kullanılabilir. Tek kullanımlık veya cam steril Pipetler kullanılabilir. Pipet pamuk takunya varsa üst kısmında kullanmadan önce kaldırılması gerekir.- Kültür Orta hücre kültürü T-şişesi 1 mL steril pipet ve bir vakum kullanarak kaldırmak.
- Hücre yıkama dağıtmak 5 mL çözüm kültür T-flask, içine karışımı yavaşça ve çözüm atın. İki kez bu işlemi tekrarlayın.
Not: Kültür orta tamamen kaldırılması için verimli hücre dekolmanı önemlidir. - Hücre dekolmanı çözümü 15 mL T-şişeye ekleyip bir kuluçka 37 ° C ve % 5 CO 2 3 dk bekletin.
- Şişesi iç duvar mikroskop altında ekli hücrelerde yokluğu doğrulayın. Hücre kültür T-şişesi 20 mL steril pipet kullanarak kaldırma ve onları 50 mL steril tüpe dağıtmak.
- 125 x g 3 dk. atma, hücre süspansiyon süpernatant santrifüj kapasitesi ve kültür ortamının başka bir 5 mL ile Pelet resuspend.
- Hücreleri saymak ve Denklem 1 göre istenen hücre toplama ulaşmak için yeterli kültür orta ekleyin.
- Bu süspansiyon bir 72 cm 2 için T-flask ekleyin ve gecede kuluçkaya 37 ° C ve % 5 CO 2 ' de.
- Alt kültür en az iki kez onları içinde nötralize kullanmadan önce hücreleri tahlil. Adımları 2.3.1-2.3.8 önümüzdeki iki gün boyunca yineleyin.
- Tahlil hücre süspansiyon.
En az üç geçer olan
- seçin WEHI 164 alt kültür. Bkz. Adım 2.1.
- Ayır ve adım 2.2 ve bu protokol 2.3 göre hücreleri saymak.
- Denklem 1 göre hücre süspansiyon için 10 6 hücre/mL x 0.5 oranında seyreltin.
- Bu hücresel süspansiyon nötralizasyon tahlil için kullanın. Tüm hücre süspansiyonlar girdap Mikser kullanmadan önce tarafından karıştırın.
3. Antikor hazırlık ve Dilutions
- mAbs Nefelometri.
Onların kitlesel yok olma katsayısı (1.39) 11 kullanarak
- belirleme başvurusu madde, denetimi örneğini ve analitik örnek 280 UV emme yoluyla konsantrasyon nm.
Not: Özgün konsantrasyonları uyuşturucu ürün etiketlerinden alınabilir. Ancak, bu UV absorpsiyonu ile doğrulanması gerekir.
- belirleme başvurusu madde, denetimi örneğini ve analitik örnek 280 UV emme yoluyla konsantrasyon nm.
- mAb dilutions.
- Dilute tüm örneklerinde bağımsız olarak nüsha, DPBS Mg ve Ca ücretsiz çözümde aşağı 2 mg/mL 2 mL mikrotüpler ile. Bu konsantrasyon nüsha DPBS Mg ve Ca ücretsiz çözüm boş parola kullanarak, UV emme tarafından teyit.
- 5 hisse senedi protein çözümleri mix bir girdap Mikser kullanarak s.
- Her 2 mg/mL mAb çözüm seyreltik 100 µL ile tahlil kültür ortamının 0.9 mL. Girdap Mikser tarafından
- Mix 5 s.
Not: 200 µg/mL bir konsantrasyon bu çözümler var. Dilutions için her nüsha yapılmalıdır.
10 ve # - sulandırmak181; Her 200 µg/mL mAb çözüm L tahlil kültür ortamının 0,99 mL ile. 5 için karışımı bir girdap Mikser kullanarak s. Bu çözümler bir konsantrasyon olarak 2 µg/mL olması. Nötralizasyon assay olarak kullanmadan önce her nüsha için seri dilutions gerçekleştirmek.
- Anti-TNFα üç bağımsız Mikroplaka mAb dilutions olun. Bir yinelenen bağımsız her nüsha üzerinden yapmak ve onları bir Mikroplaka içinde Tablo 1 ' de belirtildiği şekilde dağıtmak. Referans madde < masa fo:keep-together.within-sayfa "1" fo:keep =-ile-next.within-sayfa "her zaman" fo:text =-hizala "merkez" = > plaka 1 plaka 2 plaka 3 Wells örnek Wells örnek Wells örnek B2:B11 referans madde B2:B11 denetimi örneğini B2:B11 analitik örnek C2:C11 C2:C11 C2:C11 D2:D11 analitik örnek D2:D11 başvurusu madde D2:D11 kontrol örnek E2:E11 E2:E11 E2:E11 F2:F11 denetimi örneğini F2:F11 analitik örnek F2:F11 başvurusu madde G2:G11 G2:G11 G2:G11 Tablo 1: Mikroplaka örnek diziler. Tam nötralizasyon tahlil için G11 koordinatları B2 içinde üç Mikroplaka çalıştırılmalıdır. Rastgele kontrol örnekleri ve başvuru, analitik, dağıtımı tahlil herhangi bir önyargı doğrulamak araştırmacılar izin.
- Gerçekleştir mAb dilutions her referans örnek veya kontrolü, Tablo 2 ' de gösterildiği gibi.
Not: Bu tabloda açıklanan anti-TNFα mAb konsantrasyonları nötralizasyon tahlil son konsantrasyonlarda değildir. < td > 250
T güçlü 2: Anti-TNFα mAb dilutions. Anti-TNFα mAbs seri dilutions bu tabloda gösterilmiştir. Bu tabloda açıklanan son konsantrasyonları tahlil konsantrasyonlarda nerede anti-TNFα mAbs 3 (mAb seyreltme + kültür Orta + hücre süspansiyon) faktörüyle seyreltilmiş değildir. Kalın çizgiler hatları 3, 5, 7, 9 ve 10 geliyor dilutions gösterir; Sigara kalın çizgiler seyreltme hatları 3, 4 ve 6 gösterir. Bu seri dilutions sadece nötralizasyon tahlil yapmadan önce yapılır. Yukarı ve aşağı dilutions dağıtımı daha önce üç kez pipetting tarafından karıştırmak için bakım alınmalıdır.Plaka sütun tahlil birim kültür orta (μL) başvurusu madde birim, analitik örnek veya denetim Örnek (uL) konsantrasyon tahlil plaka (ng/mL) 2 0 230 2000 3 150 150 satırından 2 1000 4 75 75 satır 3 üzerinden 500 5 100 50 satırından 3 333 6 75 75 4 satırından 7 75 75 satırından 5 166 8 75 75 satır 6 dan 125 9 75 75 fro m satır 7 83 10 75 75 satır 9 dan 41 11 150 75 line 10 üzerinden 13 - Plakaları 25 ± 5 ° C kadar kullanımda devam.
4. Nötralizasyon tahlil WEHI 164 hücreleri ile
- Mix tarafından tüm cep süspansiyonlar (0.5 x 10 6 hücre/mL) bu protokolü herhangi bir adımda dağıtım öncesinde vortexing.
Not: Bu bölümde, her çözüm için kullanmadan 30 dk önce 37 ° c sıcak. - Transfer 50 µL her sütun 2-11 ve çizgi B G. için hareketli Mikroplaka 60 Wells hücre süspansiyon Mikroplaka içine
- transfer 50 µL mAb başvuru, örnek ve kontrol dilutions. şekil 1 ' de tasvir desen izleyin.
- Ekle 50 µL apoptosis indüksiyon çözüm için her şey.
- WEHI 164 50 µL hücresel denetimleri kullan hücreleri, üç wells reçete. Her şey son bir tahlil kültür orta ile 150 µL hacmiyle getir.
- WEHI 164 hücrelerinin 50 µL karışımı sitotoksisite kontrolünü artı 50 µL apoptosis indüksiyon çözüm kullanın. Her şey son bir tahlil kültür orta ile 150 µL hacmiyle getir.
- 50 µL apoptosis indüksiyon çözüm kullanın ve tahlil kültür orta ile 150 µL getirmek için TNFα denetimini.
- İçin boş, tahlil kültür ortamının tek başına 150 µL kullanın.
- Kalan wells kültür plaka buharlaşma etkilerinden korunmak için orta 150 µL ile doldurmak. İki kere iki Mikroplaka içinde
- Yinele adımları 4.1.1-4.1.9.
Not: Mikroplaka vardır: 0,666 mAb son konsantrasyonlarda, 0.333, 0,167, 0,111, 0,083, 0,056, 0,042, 0,028, 0,014 ve 0,004 µg/mL. - Yük Mikroplaka, örneklerinde şekil 1 ' de gösterildiği gibi.
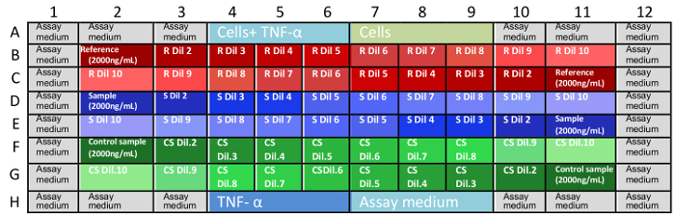
Resim 1: eğilim örneklerinde tahlil plakaları. B1 G11 için iyi koordinatları Mikroplaka ve örnek dilutions yerleştirildiği pozisyonlar açıklayan. Denetimleri ve tahlil kültür orta (A1-A12 ve H1-H12) dolu kuyu eksik koordinatlar. Bu rasgele dağıtımı örnekleri (Mikroplaka içinde ileriye ve geriye doğru dilutions), orta veya diğer değişkenler buharlaşma nedeniyle sonuçlarını önyargı ortadan kaldırmak için yardımcı olur. En iyisi her Mikroplaka teker teker bir analist tarafından yapılır. Bilgi: başvuru, S: örnek, CS: denetimi örneğini, Dil: seyreltme. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız. - 37 ° C ve % 5 CO 2 16 ± için üç tabak kuluçkaya 2 h.
- Kullanmadan önce 30 dk 25 ± 5 ° C stand caspase 3/7 Glo reaktif izin.
- Bu reaktif örnekleri ve denetimler de dahil olmak üzere tüm wells için eklemek 100 µL.
- Hemen kuyu dağıtımı sonra 25 ± 5 ° C de 3 dk Mikroplaka girdap Mikser kullanarak plakaları shake.
- Plakayı 2,5 ± 0,5 h 25 ± 5 ° C, ışıktan korunan için kuluçkaya.
- Mikrofon takınluminometer içine roplates ve sonraki bölümü tamamlayın.
5. Analiz sonuçlarının
- ışıma tespiti için bir yazılım kullanarak ışıldama modu ve bitiş noktası işlevi seçin.
- Select bir 96-şey açık-alt plaka ve sütun 1 ve 12 hariç onun 80 dahili wells.
- Seçme bir entegrasyon zaman 1,250 ms ve 10 s okuma önce Mikroplaka karıştırma için.
- Nereye başvuru madde, analitik madde ve denetimi örneğini yerleştirilir ve onların karşılık gelen konsantrasyonları ile tanımlamak kuyuları seçin.
- Mikroplaka luminometer ile yerleştirilen örnekleri okuyun.
- Dördüncü parametre denklem sonuçları analizleri için kullanın. Şekil 2 ' de gösterildiği gibi bir doz-yanıt eğrisi grafik.
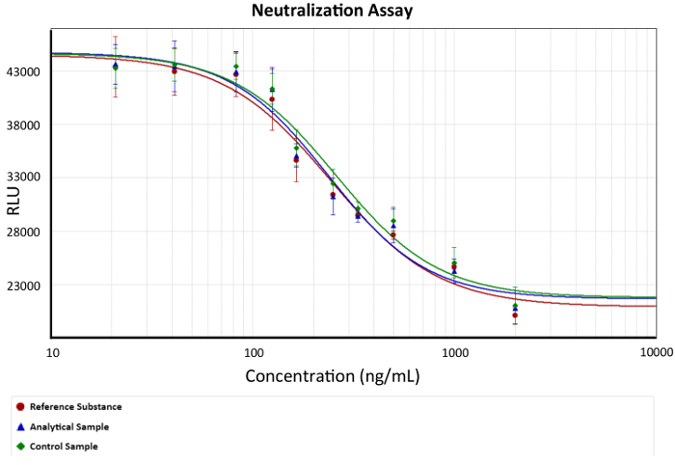
Resim 2: doz-yanıt eğrisi. Anti-TNFα mAb konsantrasyon ışıldama (hücre canlılığı) karşı tasvir edilir. MAbs anti-TNFα korunması açıklayan bir dördüncü parametre denklem bir model olarak kullanıldı. EC50 grafikte değişiklik eğim olarak örneği her tahlil % 50 hücre ölümüne neden TNFα miktarı etkisiz hale getirebiliriz mAb bölgedir. Bar ışıldama her mAb konsantrasyon için standart sapmasını tanımlar. x anti-TNFα Ab konsantrasyon temsil eder ve y temsil ederken ng/ml, logaritmik bir fonksiyonu olarak tasvir edilir rasgele ışıldama birimlerindeki ışıldama yanıt. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Not: dördüncü parametre denklemde C etkili konsantrasyonu 50 (EC50) ' dir. Bu değer referans madde, analitik örneği ve denetim örneği aracılığıyla efektör işlevi karşılaştırmak için kullanılan. - Göreli potenslerine hesaplamak, fix referans madde % 100 ve örnek potenslerine hesaplamak ve buna göre kontrol.
Not: Bu değerleri şekil 3 ' te tasvir edilmektedir.
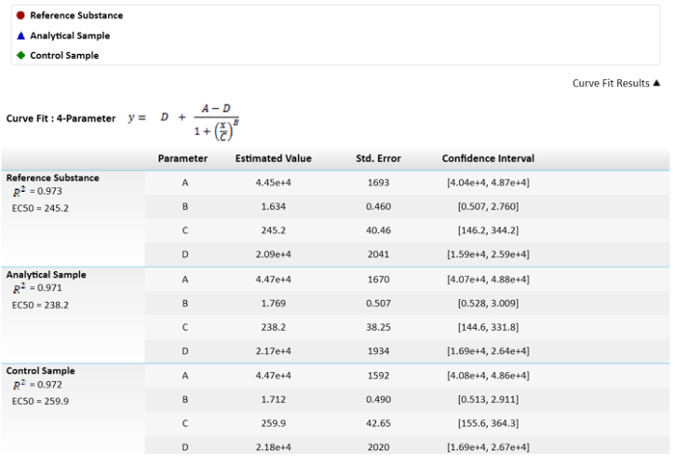
şekil 3: EC50s ve değerlerini hesaplamak için kullanılan matematiksel Denklem. EC50 değerleri veya C parametreleri, standart hata tasvir onların belirsizlik var. EC50s bir karşılaştırma göreli etki gücüne örnek ve başvuru sonuçları arasında da tasvir edilir. Güven aralığı bir α ile hesaplanır 0,05 =. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Sonuçlar
Doz-yanıt grafik (Denetim) içeren
Şekil 1 ışıldama yanıt mAb konsantrasyon karşı temsil eder. Bu sigmoidal işlev caspase 3 ve 7 Yayın tahlil kültür Orta hücre lizis nedeniyle örneğidir. Hücre ölümü serum açlık artı indüksiyon sinyal TNFα tarafından geliştirilmiştir. Bu nedenle, anti-TNFα molekül (mAb) TNF hücre reseptörü ile etkileşimi (steric engel tarafından) inhibe sitokin ile etkileşim kurar. Bu hü...
Tartışmalar
Bu karakterizasyonu pahalı ve zaman alıcı klinik yürütülen önce bir temanın bir molekül geliştiriliyor biyolojik davranışını belirlemek için yardımcı olur. Ayrıca bir onaylı uyuşturucu ürün toplu iş toplu iş serbest bırakmak için yararlıdır. Bu deneyleri bir molekül onun etki mekanizmaları ile ilgili yeterli bir biyolojik etkisi varsa belirlemek için yararlıdır kayda değer olduğunu. Bu eğitimde sunulan bio analitik yöntem kritik farklı anti-TNFα molekülleri karşılaştır...
Açıklamalar
Yazarlar ifşa yoktur
Teşekkürler
Bu eser Ulusal Bilim Konseyi tarafından desteklenen ve Teknoloji (CONACYT), Meksika PEI CONACYT 2015 220333, çalışma tasarım katılımı olmadan verin.
Malzemeler
| Name | Company | Catalog Number | Comments |
| WEHI 164 | ATCC | CRL-1751 | Fibrosarcoma cells from Mus musculus |
| RPMI-1640 Medium | ATCC | 30-2001 | Store medium at 2 °C to 8 °C |
| RPMI 1640 Medium, no phenol red | GIBCO | 11835-030 | Store medium at 2 °C to 8 °C |
| Trypsin-EDTA(0.25%),phenol red | GIBCO | 25200-056 | Store medium at -10 °C to -20 °C |
| DPBS, no calcium, no magnesium | GIBCO | 14190-136 | Store medium at 2 °C to 8 °C |
| Recombinant Human TNF-alpha Protein | R&D Systems | 210-TA-020 | Store at -20 °C to -70 °C |
| Fetal Bovine Serum (U.S), Super Low IgG | HyClone | SH3089803 | Store at -10 °C to -20 °C |
| Fetal Bovine Serum (U.S.), Characterized | HyClone | SH3007103 | Store at -10 °C to -20 °C |
| Caspase-Glo 3/7 Assay kit | Promega | G8093 | Store the Caspase-Glo. 3/7 Substrate and Caspase-Glo. 3/7 Buffer at –20 ºC protected fromLight |
| EDTA, Disodium Salt, Dihydrate, Crystal, A.C.S. Reagent | J.T.Baker | 8993-01 | -- |
| Sample mAb Adalimumab | Probiomed | NA | Final concentrations in the microplate are: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014 and 0.004 μg/mL |
| Reference and Control mAb Adalimumab | Abbvie | NA | Final concentrations in the microplate are: 0.666, 0.333, 0.167, 0.111, 0.083, 0.056, 0.042, 0.028, 0.014 and 0.004 μg/mL |
| Microplate Reader | Molecular Devices | 89429-536 | SpectraMax M3 Multi-Mode |
| Microplate reader Software | Molecular Devices | -- | SoftMax Pro 6.3 GxP |
| Incubator | Revco | 30482 | Revco RNW3000TABB Forced-Air CO2 |
| Laminar Flow Hood | The Baker Company | 200256 | Baker SG603A-HE | High Efficiency, Class II Type A2 |
Referanslar
- Elmore, S. Apoptosis: A Review of programmed cell death. Toxicol Patho. 35 (4), 495-516 (2007).
- Darwish, R. S. Regulatory mechanisms of apoptosis in regularly dividing cells. Cell Health Cytoskelet. 2 (1), 59-68 (2010).
- Tracey, D., et al. Tumor necrosis factor antagonist mechanism of action: A comprehensive review. Pharmacol Ther. 117 (2), 244-279 (2008).
- Körner, H., Sedgwick, J. Tumour necrosis factor and lymphotoxin: Molecular aspects and role in tissue-specific autoimmunity. Immunol Cell Biol. 74 (5), 465-472 (1996).
- Wong, M., et al. TNFa blockade in human diseases: Mechanisms and future directions. Clin Immunol. 126 (2), 121-136 (2008).
- Furst, D. E., Wallis, R., Broder, M., Beenhouwer, D. O. Tumor necrosis factor antagonists: different kinetics and/or mechanisms of action may explain differences in the risk for developing granulomatous infection. Semin Arthritis Rheum. 36 (3), 159-167 (2006).
- Karvinen, J., et al. Homogeneous time-resolved fluorescence quenching assay (LANCE) for caspase-3. J Biomol Screen. 7 (3), 223-231 (2002).
- Ren, Y. G., et al. Differential regulation of the TRAIL death receptors DR4 and DR5 by the signal recognition particle. Mol Biol Cell. 15 (11), 5064-5074 (2004).
- Sud, D., Bigbee, C., Flynn, J. L., Kirschner, D. E. Contribution of CD8+ T cells to control of Mycobacterium tuberculosis infection. J Immunol. 176 (7), 4296-4314 (2006).
- Strober, W. Trypan blue exclusion test of cell viability. Curr Protoc Immunol. Apendix 3, 3 (2001).
- Ramasubramanyan, N., et al. . Low acidic species compositions and methods for producing and using the same. 1, (2014).
- Masters, J. R., Stacey, G. N. Changing medium and passaging cell lines. Nat Protoc. 2 (9), 2276-2284 (2007).
- Eskandari, M. K., Nguyen, D. T., Kunkel, S. L., Remick, D. G. WEHI 164 subclone 13 assay for TNF: sensitivity, specificity, and reliability. Immunol Invest. 19 (1), 69-79 (1990).
- Hora, M. S., Rana, R. K., Smith, F. W. Lyophilized formulations of recombinant tumor necrosis factor. Pharm Res. 9 (1), 33-36 (1992).
- Ponnappan, S., Ponnappan, U. Aging and immune function: molecular mechanisms to interventions. Antiox Redox Signal. 14 (8), 1551-1585 (2011).
- Matsumaru, K., Ji, C., Kaplowitz, N. Mechanisms for sensitization to TNF-induced apoptosis by acute glutathione depletion in murine hepatocytes. Hepatology. 37 (6), 1425-1434 (2003).
- Camacho-Villegas, T., Mata-Gonzalez, T., Paniagua-Solis, J., Sanchez, E., Licea, A. Human TNF cytokine neutralization with a vNAR from Heterodontus francisci shark: a potential therapeutic use. mAbs. 5 (1), 80-85 (2013).
- Männel, D. N., Falk, W. Optimal induction of tumor necrosis factor production in human monocytes requires complete S-form lipopolysaccharide. Infect Immun. 57 (7), 1953-1958 (1989).
- Lis, K., Kuzawińska, O., Bałkowiec-Iskra, E. Tumor necrosis factor inhibitors-state of knowledge. Arch Med Sci. 10 (6), 1175-1185 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır