Method Article
İnflamatuvar Hücre İnfiltrasyonunu İncelemek İçin Murin Akciğerlerin Bronkoalveoler Lavajı
Bu Makalede
Özet
Akciğerin sağlık durumu, akciğer bronşiollerinde bulunan bağışıklık hücrelerinin türüne ve sayısına göre yansıtılır. Farelerin alt solunum yollarından yapışkan olmayan hücrelerin ve çözünür faktörlerin izolasyonunu ve çalışılmasını sağlayan bir bronkoalveolar lavaj tekniğini açıklıyoruz.
Özet
Bronkoalveolar Lavaj (BAL), devam etmekte olan bir hastalık halini anlamaya yönelik olarak ex vivo olarak akciğer lümeninin hücresel ve hücresel içeriğini incelemek için kullanılan deneysel bir prosedürdür.
Burada, özel alet veya ekipmana ihtiyaç duymadan, fare atıkları üzerinde BAL'yi gerçekleştirmek için basit ve etkili bir yöntem tarif edilmiştir. BAL sıvısı, terminal anestezi uygulanmış farelerin trakeasına bir kateteri sokarak izole edilir; buradan bronşiollere bir tuz çözeltisi damlatılır. BAL sıvı alımını en üst düzeye çıkarmak ve kesme kuvvetlerini en aza indirgemek için, damlatılmış sıvı hafifçe çekilir. Bu teknik havayollarında ve BAL sıvısındaki hücrelerin canlılığı, fonksiyonu ve yapısının korunmasını sağlar.
Akciğer hastalık durumunun daha iyi anlaşılması için birçok teknik uygulanabilir. Burada, farklı türlerde bağışıklık hücrelerinin tanımlanması ve numaralandırılması için yaygın olarak kullanılan bir tekniktarif edilen, burada sitometrisi floresan etiketli hücre yüzeyi özgü işaretlerin seçilmiş bir panel ile birleştirilir akış. Burada sunulan BAL prosedür de murin akciğerlerde enfeksiyon maddeleri, sıvı bileşenleri ya da nefesle çekilmiş olan parçacıklann analiz etmek için kullanılabilir.
Giriş
Hava yolları, inflamasyon, patojen istilası veya habis transformasyona yol açabilen çok sayıda hakaretle karşılaşır. Akciğer lümenini hizalayan epitel hücreleri, memeli vücudunun başlıca engellerinden birini oluşturur. Alveolar makrofajlarla birlikte, çevresel tehditlerin solunum yolu yoluyla sistemik sisteme girmesini önler. Bu tür tehditlere örnek olarak organik ve inorganik kimyasallar, bakteri ve virüsler verilebilir. Aynı şekilde, spesifik aşılar veya terapötik müdahaleler akciğerleri hedef alacak şekilde tasarlanabilir. Bütün bu örneklerde, uyarılmış yanıtın detaylı bir analizi, solunum sistemi içerisinde gerçekleşen biyolojik süreçleri anlamak, müdahale etmek veya önlemek için önemlidir.
Bronkoalveoler lavaj (BAL), bu tür yanıtları analiz etmek için paha biçilemez bir yöntemdir; sonuçtaki örnekler, inflamatuar yanıtlar, bağışıklık mekanizmaları ve bulaşıcı hastalık progresyonu hakkında önemli bilgiler içermektedirpulmoner solunum yolları 1, 2 oluşabilir. BAL kullanılarak, infiltre hücrelerini inceleme mümkündür. Bu, pek çok ölü ve yapışkan hücreler ile, bir "kirli" hücre popülasyonu vermek sindirilmiş akciğerler, ters düşmektedir. BAL terminal bronşiyollere bir tuz çözeltisi verilmesi ve daha sonra bu çözeltinin geri kazanılması ile gerçekleştirilir. alınan çözelti daha sonra ölçmek ve fenotipik yerleşik akciğer ve infiltratif inflamatuar hücrelerin analiz etmek için kullanılabilir. Bu yöntem, genellikle, örneğin astım gibi solunum yolu hastalık modelleri, hücresel akını çalışma uygulanır, Kronik Obstrüktif Akciğer Hastalığı (KOAH) ve enfeksiyon hastalık modelleri. Yanı sıra hücre bileşiminden, akciğer solunum yolları moleküler bileşim ayrıca BAL sıvısında yansıtılır. Bu analiz için, enzim bağlantılı immünosorbent deneyi (ELISA), immünoblot ve sitokin kordon dizisi tarafından çok sayıda sitokin aynı anda analiz edilebilirSitokinler ve kemokinler varlığının değerlendirilmesi için yapıldı.
BAL inflamatuar solunum yolu hastalığı hayvan modellerinde inflamatuvar hücrelerin akını incelemek için iyi bilinen bir yöntemdir. Değişik bir hücresel akının gözlenmesi ( örneğin artmış lenfosit, eozinofiller veya nötrofiller düzeyleri), hastalığa daha iyi kavrayışlara yol açabilir ve terapötik müdahalenin performansını değerlendirmek için objektif bir parametre olabilir.
BAL hücresel analizinin doğru ve tekrarlanabilir yorumu, BAL'nin doğru bir şekilde uygulanmasını ve toplanan sıvının düzgün bir şekilde işlenip işlenmesini gerektirir. "Bronş lavajı" terimi seksen yıl önce Stitt 3 tarafından tanıtıldı. 1961'de Myrvik, tavşan akciğerlerinin lavaj sıvısından alveolar makrofajlar elde etti. BAL, şimdi fare modelinde akciğerleri analiz etmek ve izlemek için yaygın olarak kullanılan bir yöntem olmasına rağmenbilimsel literatürde 4, 5 de standardize BAL prosedürünün hiçbir rapor hala tekrar gönderilebilir. Ayrıca, muhtemelen tekniği 3, 6, 7, 8, 9, 10, 11 kullanılarak araştırma laboratuarları olarak orada BAL gerçekleştirmek için pek çok yol vardır. BAL elde edilen veriler tüm fare akciğer temsil eder ve akciğerin sadece bir parçası olması önemlidir. değişkenlik Bu tür yorumlanması ve farklı denemeler arasındaki sonuçların karşılaştırılmasını zorlaştırmaktadır.
Burada, temel, ucuz ve yeniden üretilebilir bir BAL prosedürü fare hava yolu lümeninde var olan hücre ve çözünebilir fraksiyon toplama sağlayan tarif edilmektedir. Kısaca, bir kateter maruz trakea o altindaFa terminally anestezi fare. Katetere bir şırınga bağlanır ve etilendiamintetraasetik asit (EDTA) içeren tamponlu salin solüsyonu akciğerlere verilir. Akciğer lümeni, dalgıç çözeltinin dalgıç kullanılarak tekrar tekrar akıtılması ile örneklenir. Bu adım esnasında uygulanan negatif basınç, hava yolu çöküşünü önlemek için minimaldir. Toplama işlemini takiben, elde edilen BAL, akış sitometrisi ile hücrelerin numaralandırılması ve tanımlanması için daha da işlenmelidir.
Protokol
Bu çalışmada tanımlanan tüm hayvan deneyleri, ulusal (Belçika Yasası 14/08/1986 ve 22/12/2003, Belçika Kraliyet Kararnamesi 06/04/2010) ve Avrupa mevzuatı (AB Yönergeleri 2010/63 / AB ve 86 / 609 / EEC). Farelerdeki ve tüm hayvan protokolleri üzerindeki tüm deneyler, Ghent Üniversitesi Etik Kurulunca onaylandı (izin numaraları LA1400091 ve EC2016-027).
1. Hazırlık
- Lavaj sıvısı
- Dengeli bir tuz çözeltisi, 100 uM etilendiamintetraasetik asit (EDTA) ile hazırlayın.
NOT: BAL sıvısındaki protein düzeylerini ölçmek için, BAL sıvısında proteaz aktivitesini önlemek için proteaz inhibitörleri eklemek önerilir.
- Dengeli bir tuz çözeltisi, 100 uM etilendiamintetraasetik asit (EDTA) ile hazırlayın.
- sonda
- Şeffaf plastik polietilen 21 G tüpüne (iç çap: 0.58 mm, dış çap: 0.965 mm ve uzunluk: 0.5 cm) 23 G'lik bir iğne sokarak kateter yapın. Prematüre kateterler de kullanılabilir.
- Anesthahlakı
- Bir terminal anestetik, solunum durmasına sebep olur, tercihen bir (fosfat tamponlu tuzlu su (PBS) içinde, örneğin, sodyum pentobarbital gibi bir barbiturat (> 100 mg / kg) çözeltisi) hazırlayın.
NOT: inhale anestezi BAL sıvısı içeriğine etkisi olabileceğini gibi, yerine solunan anestezi enjekte anestezi kullanılması önerilir. CO2, örneğin kan pH'ına ve sonuç olarak farklı bileşiklerin 12 yeniden dağılımı üzerinde bir etkisi vardır.
- Bir terminal anestetik, solunum durmasına sebep olur, tercihen bir (fosfat tamponlu tuzlu su (PBS) içinde, örneğin, sodyum pentobarbital gibi bir barbiturat (> 100 mg / kg) çözeltisi) hazırlayın.
- Amonyum klorür potasyum (ACK), kırmızı kan hücre parçalama tamponu
- NH4CI 8.29 g ve 100 uM EDTA ile H2O 1 L KHCO 3 1 g çözülmesiyle bir ACK lisiz tamponu hazırlayın; kırmızı kan hücre parçalama tamponu, aynı zamanda harici bir kaynaktan temin edilebilir.
2. gerçekleştirme bronkoalveoler lavaj (BAL)
- trakea içine kateter Tanıtımı
- 26 G iğne kullanılarak bir kısa etkili barbitürat anestetik öldürücü dozda intraperitonal enjeksiyonu ile fare öldürülür. Uygun öldürücü anesthetization onaylamak için ayak refleksini kontrol etmek forseps ile fare arka pençesini çimdik.
- Cerrahi bir tabakta sırtında hayvan koyun ve uzuvları aşağı iğneleyerek fareyi sabitleyin.
- dezenfekte boyun% 70 etanol püskürtün. Bir neşter kullanılarak trake yakın boyun deride bir kesi olun.
- tükürük bezleri ortaya çıkarmak için cildi açın. sternohyoid kas açığa çıkarmak için kerpeten kullanarak tükürük bezleri ayırın. trakea maruz için kıskaçlarını kullanarak trakea etrafında kas İnsizyon.
- kıskaçlarını kullanarak trakea altındaki bir pamuk ipliği yerleştirin.
- Dikkatli bir şekilde 26 G iğne ile iki kıkırdak halkaları arasında maruz trakeanın orta delinme. Başka trakea zarar vermemeye özen gösterin.
- trakea içine 0.5 cm'lik sonda yerleştirin. Kateterizasyonu emin olunBu akciğer yapısının hasar görmesine neden olabilir olarak ter, çok uzak aşağı trakea içine takılmamış.
- Adım 2.1.5 yerleştirilen pamuk ipliği ile kateter etrafında trakea bağlayarak kateteri stabilize. Kateter yeterince bağlı değilse, enjekte edilen dengeli tuz çözeltisi yerine aşağı akciğerlere solunum yolunun üst kısmına doğru akabilir.
- lavaj sıvısı toplayın
- 100 uM EDTA ile steril dengeli tuz çözeltisi 1 ml 1 ml şırınga yükleyin.
- Kateterin 1 ml şırınga bağlayın ve yavaşça akciğer içine tuz / EDTA çözeltisi enjekte edilir.
- fare göğüs kafesi masaj yaparken hafifçe çözüm aspire. aspire sıvı şırınga içinde görünmüyorsa, dikkatlice biraz daha aşağı veya trakea yukarı kateter yerleştirin.
- iğne, şırınganın çıkarın ve buz üzerine yerleştirilmiş bir 15 ml tüp içine Toplanan lavaj sıvısı aktarın. Normal olarak, 700-900 ve# 181; BAL L enjekte solüsyonu 1 mL geri kazanılır.
- 2.2.4 iki kez daha - Tekrar 2.2.1 adımları tekrarlayın.
NOT: Amaç dışı hücresel içeriğini analiz etmek için ise, hassasiyetle sorunlar olduğunda toplanmış numuneleri konsantre önerilir.
3. BAL sıvısının hücresel ve hücresel olmayan bileşenleri Toplama
- 400 x g'de, 7 dakika ve 4 ° C'de lavaj sıvısı santrifüjleyin.
- -80 ° C'de, daha fazla analiz (örneğin, ELISA) ya da dondurularak için kullanmak hemen süpernatant toplayın ve. akciğerlerde hücresel akını analiz etmek hücre topağı tutun.
- ACK yokedici tamponda 200 uL hücre pelletini.
NOT: bozulmamış beyaz kan hücrelerini tutarken Bu adım eritrosidlerin erimesine sağlamaktadır. - Oda sıcaklığında 2 dakika süreyle inkübe edilir.
NOT: Kırmızı hücre erimesi nedeniyle varyasyonu azaltmak için, bu adım en fazla 2 dakika boyunca yapılmamalıdır. - ACK lizan tamponu seyreltmek için 1 mL soğuk PBS ekleyin.
- 400 xg'de ve 4 ° C'de 7 dakika boyunca santrifüjleyin. Süpernatantı atın ve aşağı doğru analiz için hücreleri yeterli miktarda PBS içinde yeniden süspansiyon haline getirin (aşağıya bakın).
NOT: PBS'nin hacmi gerçekleştirilecek aşağı akış çalışmasına bağlıdır.
4. BAL Akışkanındaki Farklı Hücre Çeşitlerinin Akış Sitometresi ile Analizi
NOT: Bir olasılık, akış sitometrisi uygulayarak BAL sıvısının mutlak ve göreli hücresel kompozisyonunu analiz etmektir. Bu yazının amacı BAL tekniğini geliştirmektir. Akış sitometresi, kendi başına özel bir tekniktir. Flow sitometri tekniği 13 , 14 , 15 , 16 , 17'de uzmanlaşmış kağıtları okumak önerilir. Bir floroföre bağlanmış antikorlarşapka kullanılan belirli bir hücre tipi (lar) özel yüzey antijenlerini (Tablo 1 e bakınız) tanır. bir geçitleme stratejisi kullanılarak, BAL hücre fraksiyonu T hücreleri, makrofajlar, dendritik hücreler, B hücreleri, eozinofiller ve nötrofiller belirlemek mümkündür.
| Antijen | Hücre tipi |
| farklılaşma 3 küme (CD3) | T hücreleri üzerinde ifade edilen |
| farklılaşma 11c küme (CD11c) | En dendritik hücreler üzerinde değil, aynı zamanda monositler, makrofajlar, nötrofiller ve bazı B hücreleri üzerinde yüksek ifadesi. |
| farklılaşma 11b küme (CD11) | monositler, nötrofiller, doğal öldürücü hücreler, granülosit ve makrofajlar dahil olmak üzere birçok lökositlerin yüzeyi üzerinde ifade edilir. |
| SiglecF | birLüloz makrofajlar ve eozinofiller. |
| MHC II | Normalde sadece dendritik hücreler, mononükleer fagositler ve B hücreleri gibi antijen sunan hücrelerde bulunur. |
| CD19 | B-lenfosit antijeni |
| Ly-6G | Monositler, granülositler ve nötrofiller için bir markör |
Tablo 1: İmmün Hücre Yüzey Antijenlerinin Seçimi. Bu tablo, farklı hücre tiplerini karakterize etmek için kullanılan yüzey epitoplarının bir listesini sağlar. Belirli bir hücre türünü güvenilir bir şekilde tanımlamak için çeşitli belirteçlerin kombinasyonları gereklidir.
| Numuneler | ||||
| Tüp | Hücrelere eklenecek anti-flüorofor | Antikor stok konsantrasyonu (mg / mL) | Antikor seyreltme | Toplam hacim (uL) |
| Sabitlenebilir canlılığı boya | 0.2 | 1/1000 | 50 | |
| CD11c | 0.2 | 1/800 | 50 | |
| SiglecF | 0.2 | 1/100 | 50 | |
| örnek X | MHC II | 0.2 | 1/200 | 50 |
| CD3 | 0.2 | 1/200 | 50 | |
| CD19 | 0.2 | 1/200 | 50 | |
| CD11 | 0.2 | 1/200 | 50 | |
| Ly6G | 0.2 | 1/200 | 50 | |
| Gerilim kontrolleri | ||||
| Tüp | Antijen-florofor hücrelere eklenmesini | Antikor stok konsantrasyonu (mg / mL) | Antikor seyreltme | Toplam hacim (uL) |
| lekesiz hücreler | / | / | / | 50 |
| Tek boyanmış hücreler | Sabitlenebilir canlılığı boya | 0.2 | 1/1000 | 50 |
| Tek boyanmış hücreler | CD11c | 0.2 | 1/800 | 50 |
| Tek boyanmış hücreler | SiglecF | 0.2 | 1/100 | 50 |
| Tek boyanmış hücreler | MHC II | 0.2 | 1/200 | 50 |
| Tek boyanmış hücreler | CD3 | 00,2 | 1/200 | 50 |
| Tek boyalı hücreler | CD19 | 0.2 | 1/200 | 50 |
| Tek boyalı hücreler | CD11 | 0.2 | 1/200 | 50 |
| Tek boyalı hücreler | Ly6G | 0.2 | 1/200 | 50 |
| Tazminat kontrolleri | ||||
| Tüp | Boncuklara ilave edilecek anti-flüorofor | Antikor stok konsantrasyonu (mg / mL) | Antikor seyreltmesi | Toplam hacim (μL) |
| Renksiz boncuklar | / | / | / | 200 |
| Tek boyalı boncuklar | CD11c | 0.2 | 1/2000 | 200 |
| Tek boyalı boncuklar | SiglecF | 0.2 | 1/2000 | 200 |
| Tek boyalı boncuklar | MHC II | 0.2 | 1/200 | 200 |
| Tek boyalı boncuklar | CD3 | 0.2 | 1/2000 | 200 |
| Tek boyalı boncuklar | CD19 | 0.2 | 1/2000 | 200 |
| Tek boyalı boncuklar | CD11 | 0.2 | 1/400 | 200 |
| Tek boyalı boncuklar | Ly6G | 0.2 | 1/200 | 200 |
Tablo 2. Dahil Edilecek Kontrol Listesi. Bu tablo, elde edilen sonuçların doğru bir şekilde yorumlanması için gerekli tüm kontrolleri göstermektedir.
- Hücre yüzey boyama
NOT: Bu bir impoflow sitometri analizi için tüm kritik kontrolleri dahil etmek rtant. Üç takım tüp (bakınız Tablo 2) ihtiyaç vardır: (1) örnekleri içeren tüpler; (2) tek bir leke yapmak için, her bir antikor-fluorofor için BAL hücreleri ile tüpler; Bu akış sitometresinde her kanal için gerilimler belirlenmesi için olanak sağlar; ve (3) tek bir leke yapmak için, her bir antikor-fluorofor için boncuklar ile tüpler; Bu dengeleme matrisi belirlemektir.- Uygun seyreltmelerde antikor ve Fc-blok PBS (anti-CD16 / CD32) 'in bir karışımını yapın (bakınız Tablo 2). Deney öncesinde her bir antikor için en uygun çalışma seyreltme belirlemek gereklidir.
- örnek için antikor karışımı 50 uL hücrelerin tekrar ve kritik kontrol uygun şekilde seyreltilmiş antikor, 50 uL ekleyin.
Not: boyama, 96 oyuklu, U biçimli bir plaka içerisinde gerçekleştirilebilir. Bu kolayca leke hacmi a azaltılması mümkün kılarnd numunelerin önemli miktarlarda çalıştırın. - 4 ° C'de karanlıkta 30 dakika boyunca inkübe edin.
- 400 x g'de, 7 dakika ve 4 ° C'de santrifüje. Süpernatant atılır.
- 200 uL nihai hacme PBS hücrelerin yeniden askıya.
NOT: Bu son hacim flowsitometri erişebilir asgari hacmine bağlıdır. Bu makineler arasında biraz farklılık gösterebilir. Buna ek olarak, okuma hacimli numune akış sitometresinde çalışmasına alacak hücreleri ve / veya zamanın sayısına bağlıdır. - akım sitometri analizi için numune ve kontrolleri kullanın.
NOT: Farklı hücre popülasyonlarının mutlak hücre sayısını belirlemek için, sayım boncuklar ilave edilmelidir. taneciklerin aynı sayıda ekleme hemen ölçüm öncesinde her bir numuneye (25,000 boncuk ±). Akış sitometrisi ile tespit edilebilir boncuklar sayma ileri kullanılarak ve yan saçılma ile (bakınız Şekil 1). Daha sonra, numune içinde hücrelerinin mutlak sayısı th karşılaştırılarak hesaplanabilirE boncuk olaylarının hücre olaylarına oranı. Aşağıdaki formül kullanılabilir: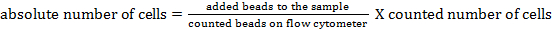
- Akış sitometrik analizi
NOT: Boyama protokolünün tamamlanmasından hemen sonra akış sitometrik analiz yapılmalıdır. Sinyal saptama için uygun lazerler ve filtreler içeren bir akış sitometresi kullanılmalıdır. Tablo 3 , bu el yazmasında tanımlanan çalışma için gerekli lazerlere ve filtrelere genel bir bakış sunmaktadır. Akış sitometrik analiz hakkında daha fazla bilgi için bkz. Adan ve ark. 18 .- Birincil kapılar, artıklar ve çiftler hariç, öne ve arkaya doğru dağılmaya dayalı olarak ayarlayın (bkz. Şekil 1 ).
- Tekli lekelenmiş hücrelerin ve boncukların yardımıyla voltaj ve spektral örtüşme telafisini ayarlayın.
NOT: Bu ayarlar her bir akış sitometresi için farklıdır ve her deneyden önce kontrol edilmesi gerekir. Fveya doğru akım analizi, öne ve yana saçılma gerilimleri kritiktir. Bir ileri doğru ve yana saçılım tanımlanması ve analiz hücre kimlik doğrulama de yardımcı olabilir. Bu voltajı belirlemek için, boyanmamış bir numune ilk çalıştırılmalıdır. - Yüzey antijeni için floresans kapıları ayarlama (bakınız Şekil 1) ve numune analiz eder.
| Lazer tipi | Filtre kurulumu | |
| 505 LP | 525/50 | |
| Mavi (488 nm) | 550 LP | 575/26 |
| 100 mW | 670 LP | 685/35 |
| 750 LP | 780/60 | |
| 405 nm menekşe | 450/50 | |
| 100 mW | ||
| Kırmızı 633 nm | 660/20 | |
| 70 mW | 750 LP | 780/60 |
Tablo 3: Bu Çalışmada Kullanılan Akış Sitometresinin Lazerleri ve Filtrelerine Genel Bakış.
Sonuçlar
tamponlu tuz çözeltisi 3x 1 mL BAL yaptıktan sonra, 2 ve 3 mL arasında bir hacmi geri alınmış olmalıdır. Bu BAL sıvısı hücresel ve hücresel olmayan içerik karakterize etmek daha da analiz edilebilir. Bir sitokin boncuk dizisi 21 ile sitokinlerin ve kemokinlerin, ELISA 19, immunoblot 20 varlığını ve birçok sitokinin aynı anda analiz araştırmak için gerçekleştirilebilir. Buna ek olarak, bu sıvının albümin ve toplam protein içeriği 22 tespit edilebilir.
Bir örnek olarak, bu yazının akış sitometrisi ile BAL sıvısının hücre içeriğini analiz açıklamaktadır. bunlar intratekal olarak lipopolisakkarid damlatıldı 24 saat sonra muayene: analiz BAL sıvısı dişi Balb / cAnNCrl fareler (7 haftalık) toplanmıştır. Aşağıdaki antikorlar, w flüorofora bağlıFarklı hücre tiplerini belirlemek için kullanılmıştır: CD11c, SiglecF, MHCII, CD3ε, CD19, Ly6g ve CD11b (bkz. Tablo 1 ve Malzeme Tablosu ). Düzeltilebilir canlılık boyası da kullanıldı. Farklı hücre popülasyonlarının yüzeylerindeki antijenlerin diferansiyel ifadesine dayalı bir geçiş stratejisi kullanarak ( Şekil 1 ), makrofajları, dendritik hücreleri, B hücrelerini, T hücrelerini, nötrofilleri ve eozinofilleri tanımlamak mümkündür.
İlk olarak, artıklar ve çiftler ileri ve yan saçılma parametrelerine dayanarak kapatıldı. Bir yaşayabilirlik boyası canlı hücreler üzerinde kapıyı kolaylaştırdı. Daha sonra, CD11c yüksek hücreleri ve CD11c düşük hücreleri tanımlandı. CD11c yüksek popülasyonunda makrofajlar ve dendritik hücreler sırasıyla MHCII ve SiglecF ifadesine dayalı olarak tanımlandı. CD11c düşük popülasyonunda sırasıyla CD3ε ve CD19 ekspresyonuna dayalı T hücreleri ve B hücreleri belirlendi. InciGeriye kalan hücre popülasyonu, nötrofiller ve eozinofiller sırasıyla CD11b ve Ly-6G markeri ekspresyonuna dayalı olarak tanımlandı.
Boncuk olaylarının hücre olaylarına oranını karşılaştırarak farklı hücre popülasyonlarının mutlak hücre sayılarını belirlemek için sayım boncukları eklendi 23 . Bu sayma boncukları ileri ve yan yayılım özelliklerine göre tespit edildi ( Şekil 1 ). Tablo 4 , naif fare ve 5 mikrogram lipopolisakkarit ile 24 saat uyarılmış bir fare BAL sıvısındaki farklı hücre popülasyonlarının mutlak hücre sayılarına genel bir bakış sunmaktadır.
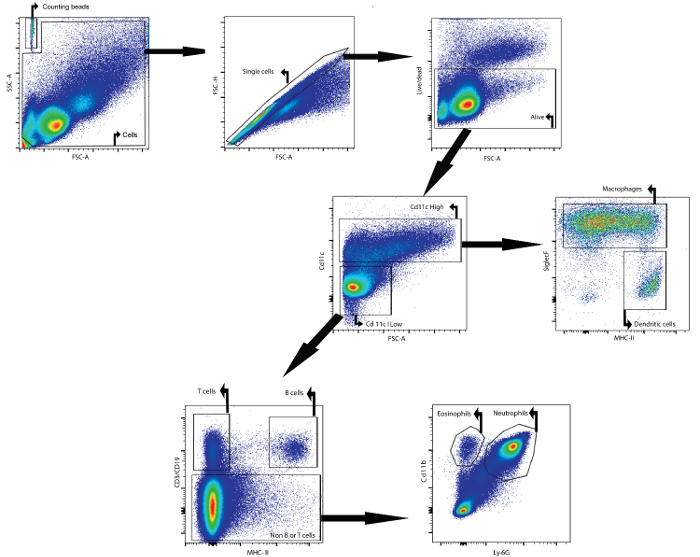
Şekil 1: Makrofajların, Dendritik Hücrelerin, T Hücrelerinin, B Hücrelerinin, Nötrofillerin ve Eozinofillerin Akım Sitometrik Tespiti İçin Gating Stratejisi iN BAL Akışkan. BAL hücreleri tarif edilen BAL protokolü kullanılarak izole edildi. Hücreler, lipopolisakkarit'in intrakrakeal instilasyonundan 24 saat sonra farelerden izole edildi. Sayma boncukları ve hücreler ileri ve yan yayılım özelliklerine dayalı olarak tespit edildi. Hücre kapısında, tek hücreler ileri ve yan saçılım kullanılarak tanımlandı. Bu son popülasyonda canlı hücreler tanımlandı. Daha sonra CD11c yüksek hücreleri ve CD11c düşük hücreleri tanımlandı. CD11c yüksek popülasyonunda makrofajlar ve dendritik hücreler sırasıyla MHCII ve SiglecF ifadesine dayalı olarak tanımlandı. CD11c düşük popülasyonunda sırasıyla CD3ε ve CD19 ekspresyonuna dayalı olarak T hücreleri ve B hücreleri belirlendi. Kalan hücre popülasyonunda nötrofiller ve eozinofiller sırasıyla CD11b ve Ly-6G ekspresyonuna dayalı olarak tanımlandı. Görüntülemek için lütfen tıklayınız.Bu rakamın daha büyük versiyonu.
| Hücre popülasyonu | Naif farelerde mutlak hücre sayısı | LPS uyarılmış farelerde mutlak hücre sayısı |
| makrofajlar | 79612 | 25439 |
| dentritik hücreler | 495 | 671 |
| T hücreleri | 45271 | 28089 |
| B hücreleri | 4164 | 2926 |
| nötrofiller | 632 | 566716 |
| eozinofiller | 3483 | 4332 |
Tablo 4: TemsilNaif ve LPS ile uyarılan Farelerin BAL Akışı Üzerindeki Flow Sitometri Analizinin Bulguları.
Tartışmalar
BAL, enfeksiyonlara veya ilaçlara yanıt olarak sitolojik ve biyokimyasal bilgi elde etmek için yararlı bir tekniktir. Başlangıçta, BAL, fosgen toksisitesi 3 olan insan hastalarda aşırı mukus üretimini yönetmek için kullanıldı. Günümüzde bu teknik, insanlarda 3 , 24 hastalıkların akciğer patogenezi, tanı ve terapötik yönetimini araştırmak için kullanılmaktadır. Laboratuvar hayvanlarında, BAL, inflamatuar cevapları, bağışıklık mekanizmalarını ve pulmoner hava yolları 1 , 2'de ortaya çıkan bulaşıcı hastalık süreçlerini izlemek için sıklıkla kullanılır.
Solunum yolu hastalığı modellerinde inflamatuvar hücresel paternin çalışılması için BAL mutlak ve diferansiyel hücre sayımı ile izlenmelidir. Mutlak hücre numarasına ek olarak, ilgili hücre sayıları da ilgilidir. Örneğin, onarım ve kanser modelleri vBAL hücre sayımı artar veya azalmaz. Bu modelde, hücresel kompozisyonun değerlendirilmesi faydalıdır. Işık mikroskopisi ile kombine edilmiş hücre boyaması kullanarak, eozinofiller, nötrofiller, makrofajlar ve limfositler gibi farklı hücre tipleri, morfoloji 25 , 26 , 27 , 28 , 29 , 30'a dayalı olarak tanımlanabilir. Akış sitometrisi, farklı T-hücresi fenotiplerini 7 , 31 belirlemek gibi spesifik değerlendirmeler için kullanılabilir. Farklı infiltre hücre popülasyonlarının tanımlanmasına ek olarak, akciğerin hücresel olmayan kompozisyonu BAL kullanılarak araştırılabilir. BAL sıvısında sitokinler, büyümeyi belirlemek için ELISA, immünoblot, sitokin boncuk dizilimi, immünohistokimya ve kantitatif polimeraz zincir reaksiyonu gibi yöntemler uygulanırFaktörler ve diğer enflamatuar bileşenler. Akciğer hasarını belirlemek için BAL sıvısındaki toplam protein ve laktat dehidrogenaz seviyeleri 32,33 olarak ölçülebilir.
Yeni teşhis aletlerinin geliştirilmesi ile yakın gelecekte BAL bileşenlerinin genomik ve proteomik karakterizasyonu mümkün olacaktır. Hesaplama yeteneklerini ve yüksek verimli gen ekspresyon teknolojilerini genişleten kombinasyon, çeşitli hastalık durumları için spesifik gen ifade profillerini tanımlamayı mümkün kılacaktır. Bu teknikleri BAL sıvısı üzerinde gerçekleştirmek, akciğer hastalıklarının farklı evrelerinde yer alan önemli molekülleri tanımlamak için gen ve protein ifade kalıpları sağlayabilir.
BAL akışkanından elde edilen verilerin temel sınırlaması, farklı araştırma çalışmaları 3 , 9 arasında karşılaştırılabilirlik eksikliğidir. Yüksek derecedeLavaj tekniği değişkenliği ve BAL sıvısının sonraki işlem. Her BAL deneme karşılaştırmak mümkün olması için, damlatılır lavaj sıvısının türü, instilasyon sitesi ve hücresel ve hücresel olmayan bileşim için analiz edilecek olan bir kısmını standardize etmek için gereklidir. Bir 14 kez 34, 35, 36 arasında değişen farklı denemeler arasında lavaj kısımların sayısı önemli farklılıklar vardır. Bu fark akciğerlerde tahmini toplam hücre sayıları üzerinde etkisi olabilir. BAL sıvısı kesir hücrelerinin çoğunluğu içeren bilmek önemlidir. Song ve ark. toplam hücre sayısının yaklaşık% 70, üç ila 22 fraksiyon bir de elde edildi göstermiştir. Ancak, diğer raporlar ikinci lavaj, 38 ilkinden 37 daha fazla hücre içerdiğini öne . Bu çalışmalardan sadece bir fraksiyonlu bir lavajın tüm akciğeri temsil etmediğini ve sonuçların yanlış yorumlanmasına yol açtığını söyleyebiliriz.
BAL sıvısının hücre dışı kompozisyonu akciğer 33 , 39 , 40'ın sağlık durumu hakkında değerli bilgiler içerir. BAL sıvısının seyreltilmesindeki değişiklikler, çözünür fraksiyonun miktarının belirlenmesindeki farklılığa ve dolayısıyla denemeler arasındaki sonuçların farklılığına katkıda bulunur. Song ve ark. Her lavaj fraksiyonunun protein ve laktat dehidrojenaz seviyelerini karşılaştırdı ve birinci lavaj fraksiyonunun ikinci fraksiyonun iki ila üç katı fazla olduğu sonucuna vardı.
Analiz için temsilci BAL örneğini almak için bazı teknik hususlar çok önemlidir. Bunlardan biri doğru anestezi uygulamaktır. Ayak refini kontrol etmek çok önemlidir.Terminal sedasyon sağlamak için fare lex. Bu yalnızca etik nedenlerden ötürü değil, aynı zamanda, fare düzgün anestezi altına alındıysa kateterin doğru konuma getirilmesi ve tutulmasının zor olması nedeniyle de önemlidir.
İkinci önemli teknik husus, kateterin trakeadaki pozisyonudur. Kateter çok derin yerleştirildiğinde, akciğer yapısına zarar verebilir. Kateterin distal ucu BAL işlemi sırasında akciğerlere ulaşmamalıdır. Kateter aynı zamanda stabilize edilmeli ve pamuklu bir ip ile bağlanmalıdır. Kateter stabilize edilmemişse, enjekte edilen tuz çözeltisi akciğerlere değil, burun boşluğuna yukarı akabilir. Salin solüsyonunun enjeksiyonu ve aspirasyonu sırasında, kateteri sabit tutmak önemlidir.
BAL sıvısından elde edilen veriler, fare atesindeki tüm akciğerini temsil etmelidir. Bu nedenle, yeterli bir hacimde tuz tamponu ( örn.1 mL her biri) 3 alikoya bölünmüş 3 mL,. hücre verimi ve BAL sıvısı verimi arasında doğrusal bir ilişki vardır. Fare göğüs kafesi masaj yaparken hafifçe çözüm toplamak için önemlidir. kesme kuvvetleri çok güçlü ise, solunum yolları ve BAL sıvısında hücrelerin canlılığı, fonksiyon ve yapı çalınmış olabilir. Aspire edilen sıvı şırınga içinde görünmüyorsa, dikkatlice kateter derin veya daha yüksek trakea hareket eder.
Özel uyarı BAL işleme ve analiz belirli yönleriyle verilmelidir. Bu BAL örneklerinden tutulan bilgiyi maksimize edecek. BAL sonra, hücreler, bir besleyici-zayıf bir tuz ortamında bulunmaktadır. BAL örnekleme sonra 1 saat içinde örnekleri işlemek için bu nedenle çok önemlidir. uzun süreli depolama gerekli ise, bir besin takviye ortamın kullanılması gerekmektedir.
hücre canlılığını korumak için, yüzeye hücre yapışmasını teşvik tüpleri kaçının. ce kaçınınHücre süspansiyonlarının hücre bütünlüğünü tehlikeye atacak veya alınan BAL hücrelerinin üniform tekrar süspansiyonunu önleyecek hızda n-santrifüjlenmesi. BAL sıvısı içeren hücreler 7 dakika boyunca 400 xg ve 4 ° C'de santrifüje tabi tutulmalıdır. İşlem sırasında hücre süspansiyonlarının 4 ° C'de tutulması gerektiğini akılda tutmak önemlidir.
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
SVH Ghent Üniversitesi Sağlık Bilimleri Fakültesi Biyomedikal Moleküler Biyoloji bir araştırma yardımcısıdır. ERJ UniVacFlu tarafından desteklenen, hibe numarası 607690. KR EC-FP7 proje FLUNIVAC tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Hanks' Balanced Salt Solution (HBSS) | Thermo Fisher Scientific | 14175-129 | |
| ethyleendiaminetetra acetic acid (EDTA) | Sigma-Aldrich | E6511 | irritating |
| 23 G x 1 1/4 needle | Henke Sass Wolf | 4710006030 | size: 0.60 x 30 mm |
| 26 G x 1/2 needle | Henke Sass Wolf | 4710004512 | size: 0.45 x 12 mm |
| plastic tubing | BD medical technology | 427411 | Polyethylene Tubing, I.D. 0.58 mm (0.023") O.D. 0.965 mm (0.38") 30.5 m (100') |
| sodium pentobarbital | Kela NV | 514 | |
| Phosphate-buffered Saline (PBS) | Lonza | BE17-516F | PBS without Ca2+ Mg2+ or phenol red; sterile filtered |
| 1 mL syringes | Henke Sass Wolf | 5010.200V0 | nonpyrogenic and nontoxic |
| Forceps | Fine Science Tools GmbH | 91197-00 | |
| Surgical scissors | Fine Science Tools GmbH | 91460-11 | |
| centrifuge tube 50 mL | TH.Geyer | 7696705 | Free from Rnase/Dnase/endotoxin |
| centrifuge tube 15 mL | TH.Geyer | 7696702 | Free from Rnase/Dnase/endotoxin |
| microcentrifuge tube 1.5 mL | Sigma-Aldrich | 0030 120.094 | polypropylene |
| Microcentrifuge | Sigma-Aldrich | 5415R | |
| Centrifuge | Thermo Fisher Scientific | 75004030 | |
| Ammonium-Chloride-Potassium (ACK) lysing buffer | Lonza | 10-548E | sterile-filtered |
| live/dead - efluor 506 | ebioscience | 65-0866-18 | fixable viability dye |
| CD11c-PE-cy7 | eBiosciences | 25-0114-81 | |
| SiglecF-PE | BD Pharmingen | 552126 | |
| MHCII-APCefluor780 | Biolegend | 107628 | |
| CD3-PE-cy5 | VWR | 55-0031-U100 | |
| CD19-PE-cy5 | eBiosciences | 15-0193-83 | |
| CD11b-V450 | BD Pharmingen | 560455 | |
| Ly6G-AF700 | Biolegend | 127621 | |
| Absolute Counting Beads | Life Technologies Europe B.V. | C36950 | |
| anti-CD16/CD32 | BD Pharmingen | 553142 | |
| 96-well 340 µl storage plate plate | Falcon | 353263 | V-bottom, natural polypropylene |
| flow cytometer | BD Biosciences | ||
| catheter | BD Biosciences | 393202 |
Referanslar
- Stankunas, K., et al. Conditional protein alleles using knockin mice and a chemical inducer of dimerization. Mol Cell. 12 (6), 1615-1624 (2003).
- Hunninghake, G. W., Gadek, J. E., Kawanami, O., Ferrans, V. J., Crystal, R. G. Inflammatory and immune processes in the human lung in health and disease: evaluation by bronchoalveolar lavage. Am J Pathol. 97 (1), 149-206 (1979).
- Gee, J. B., Fick, R. B. Bronchoalveolar lavage. Thorax. 35 (1), 1-8 (1980).
- Tornling, G., et al. Hyaluronic acid in bronchoalveolar lavage in rats exposed to quartz. Br J Ind Med. 44 (7), 443-445 (1987).
- Henderson, R. F. Use of bronchoalveolar lavage to detect respiratory tract toxicity of inhaled material. Exp Toxicol Pathol. 57, 155-159 (2005).
- Morris, A., et al. Longitudinal analysis of the lung microbiota of cynomolgous macaques during long-term SHIV infection. Microbiome. 4 (1), 38 (2016).
- Naessens, T., et al. GM-CSF treatment prevents respiratory syncytial virus-induced pulmonary exacerbation responses in postallergic mice by stimulating alveolar macrophage maturation. J Allergy Clin Immunol. 137 (3), 700-709 (2016).
- Chockalingam, A., Duraiswamy, R., Jagadeesan, M. Bronchoalveolar lavage cellular analyses in conjunction with high-resolution computed tomography imaging as a diagnostic intervention for patients with suspected interstitial lung disease. Lung India. 33 (3), 287-291 (2016).
- Crystal, R. G., Reynolds, H. Y., Kalica, A. R. Bronchoalveolar lavage. The report of an international conference. Chest. 90 (1), 122-131 (1986).
- Baughman, R. P. The uncertainties of bronchoalveolar lavage. Eur Respir J. 10 (9), 1940-1942 (1997).
- Singletary, M. L., et al. Modification of a common BAL technique to enhance sample diagnostic value. J Am Assoc Lab Anim Sci. 47 (5), 47-51 (2008).
- Angus, D. W., Baker, J. A., Mason, R., Martin, I. J. The potential influence of CO2, as an agent for euthanasia, on the pharmacokinetics of basic compounds in rodents. Drug Metab Dispos. 36 (2), 375-379 (2008).
- Menon, V., Thomas, R., Ghale, A. R., Reinhard, C., Pruszak, J. Flow cytometry protocols for surface and intracellular antigen analyses of neural cell types. J Vis Exp. (94), (2014).
- Inglis, H., Norris, P., Danesh, A. Techniques for the analysis of extracellular vesicles using flow cytometry. J Vis Exp. (97), (2015).
- Rubio-Navarro, A., et al. Phenotypic Characterization of Macrophages from Rat Kidney by Flow Cytometry. J Vis Exp. (116), (2016).
- Butcher, M. J., Herre, M., Ley, K., Galkina, E. Flow cytometry analysis of immune cells within murine aortas. J Vis Exp. (53), (2011).
- Noto, A., Ngauv, P., Trautmann, L. Cell-based flow cytometry assay to measure cytotoxic activity. J Vis Exp. (82), e51105 (2013).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. , 1-14 (2016).
- Database, J. S. E. The ELISA method. J Vis Exp. , (2016).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. J Vis Exp. (16), (2008).
- Wunderlich, M. L., Dodge, M. E., Dhawan, R. K., Shek, W. R. Multiplexed fluorometric immunoassay testing methodology and troubleshooting. J Vis Exp. (58), (2011).
- Song, J. A., et al. Standardization of bronchoalveolar lavage method based on suction frequency number and lavage fraction number using rats. Toxicol Res. 26 (3), 203-208 (2010).
- Seliger, C., et al. A rapid high-precision flow cytometry based technique for total white blood cell counting in chickens. Vet Immunol Immunopathol. 145 (1-2), 86-99 (2012).
- Daniele, R. P., Elias, J. A., Epstein, P. E., Rossman, M. D. Bronchoalveolar lavage: role in the pathogenesis, diagnosis, and management of interstitial lung disease. Ann Intern Med. 102 (1), 93-108 (1985).
- Delayre-Orthez, C., Becker, J., de Blay, F., Frossard, N., Pons, F. Exposure to endotoxins during sensitization prevents further endotoxin-induced exacerbation of airway inflammation in a mouse model of allergic asthma. Int Arch Allergy Immunol. 138 (4), 298-304 (2005).
- Delayre-Orthez, C., et al. PPARalpha downregulates airway inflammation induced by lipopolysaccharide in the mouse. Respir Res. 6, 91 (2005).
- Delayre-Orthez, C., de Blay, F., Frossard, N., Pons, F. Dose-dependent effects of endotoxins on allergen sensitization and challenge in the mouse. Clin Exp Allergy. 34 (11), 1789-1795 (2004).
- Hachet-Haas, M., et al. Small neutralizing molecules to inhibit actions of the chemokine CXCL12. J Biol Chem. 283 (34), 23189-23199 (2008).
- Ble, F. X., et al. Activation of the lung S1P(1) receptor reduces allergen-induced plasma leakage in mice. Br J Pharmacol. 158 (5), 1295-1301 (2009).
- Ble, F. X., et al. Allergen-induced lung inflammation in actively sensitized mice assessed with MR imaging. Radiology. 248 (3), 834-843 (2008).
- Reber, L. L., et al. A dissociated glucocorticoid receptor modulator reduces airway hyperresponsiveness and inflammation in a mouse model of asthma. J Immunol. 188 (7), 3478-3487 (2012).
- Drent, M., Cobben, N. A., Henderson, R. F., Wouters, E. F., van Dieijen-Visser, M. Usefulness of lactate dehydrogenase and its isoenzymes as indicators of lung damage or inflammation. Eur Respir J. 9 (8), 1736-1742 (1996).
- Henderson, R. F. Use of bronchoalveolar lavage to detect lung damage. Environ Health Perspect. 56, 115-129 (1984).
- Forget, G., et al. An adherent cell perifusion technique to study the overall and sequential response of rat alveolar macrophages to toxic substances. Environ Health Perspect. 51, 131-140 (1983).
- Sung, J. H., et al. Recovery from welding-fume-exposure-induced lung fibrosis and pulmonary function changes in sprague dawley rats. Toxicol Sci. 82 (2), 608-613 (2004).
- Majetschak, M., Sorell, L. T., Patricelli, T., Seitz, D. H., Knoferl, M. W. Detection and possible role of proteasomes in the bronchoalveolar space of the injured lung. Physiol Res. 58 (3), 363-372 (2009).
- Rehn, B., Bruch, J., Zou, T., Hobusch, G. Recovery of rat alveolar macrophages by bronchoalveolar lavage under normal and activated conditions. Environ Health Perspect. 97, 11-16 (1992).
- Kelly, C. A., Ward, C., Stenton, S. C., Hendrick, D. J., Walters, E. H. Assessment of pulmonary macrophage and neutrophil function in sequential bronchoalveolar lavage aspirates in sarcoidosis. Thorax. 43 (10), 787-791 (1988).
- Eklund, A., Tornling, G., Blaschke, E., Curstedt, T. Extracellular matrix components in bronchoalveolar lavage fluid in quartz exposed rats. Br J Ind Med. 48 (11), 776-782 (1991).
- Olsen, G. N., Harris, J. O., Castle, J. R., Waldman, R. H., Karmgard, H. J. Alpha-1-antitrypsin content in the serum, alveolar macrophages, and alveolar lavage fluid of smoking and nonsmoking normal subjects. J Clin Invest. 55 (2), 427-430 (1975).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır