Method Article
Tam Hücreli Gerilim Kelepçesi Kayıtları için Elektrofizyolojik Yöntem
Bu Makalede
Özet
Drosophila melanogaster fotoreptörlerinden alınan bütün hücreli kayıtlar, çeşitli koşullar altında kendiliğinden oluşan karanlık yumruları, kuantum darbeleri, ışığa karşı makroskopik tepkileri ve akım-voltaj ilişkilerini ölçebilir. D. melanogaster genetik manipülasyon araçları ile birlikte bu yöntem, her yerde bulunan inositol-lipid sinyal yolunu ve TRP kanalının hedefini incelemeyi mümkün kılar.
Özet
Drosophila melanogaster fotoreseptörlerinden alınan tüm hücre voltaj kelepçesi kayıtları, inositol-lipid sinyal verme ve Geçici Alıcı Potansiyel (TRP) kanallarını tek molekül seviyesinde incelemek için D. melanogaster moleküler genetiğin kullanılmasını sağlayan omurgasız görsel transdüksiyon alanını devrim yarattı. Bir avuç laboratuvar, yüksek kontrollü koşullardaki ışığa fizyolojik cevapların analizini sağlayan bu güçlü tekniği hakimiyet altına almıştır. Bu teknik, hücre içi ve hücre dışı ortamları kontrol etmeye izin verir; Membran voltajı; Ve çeşitli iyonik veya pH indikatörleri gibi farmakolojik bileşiklerin intra-ve hücre dışı medyaya hızlı uygulanması. Son derece yüksek bir sinyal-gürültü oranı ile bu yöntem, karanlık kendiliğinden ışığa neden olan üniter akımları ( örn. Spontan ve kuantum darbe) ve makroskopik Işık Tarafından Akıtan Akımları (LIC)Gle D. melanogaster fotoreseptörler. Bu protokol, hem elektrofizyolojik hem de optik kayıtları içeren bu tekniği gerçekleştirmek için gerekli olan tüm önemli adımları ayrıntılı bir şekilde özetlemektedir. Hamam odasında sağlam ve uygulanabilir ex vivo izole ommatidia elde etmek için sinek retina diseksiyon prosedürü anlatılmıştır. Tüm hücre ve floresan görüntüleme ölçümlerini gerçekleştirmek için gerekli ekipman da detaylandırılmıştır. Son olarak, uzun deneyler sırasında bu hassas preparatın kullanımındaki tuzaklar açıklanmaktadır.
Giriş
100 yıldan fazla bir süre önce başlatılan Drosophila melanogaster ( D. melanogaster) meyve sineği genetik çalışmaları, karmaşık biyolojik süreçlerin genetik diseksiyonu için son derece faydalı bir deney modeli olarak D. melanogaster sinekini kurdu. Aşağıda açıklanan metodoloji, D. melanogaster moleküler genetiğin birikmiş gücünü, tüm hücre yaması tutam kayıtlarının yüksek sinyal-gürültü oranı ile birleştirmektedir. Bu kombinasyon hem doğal ortamda hem de tekli moleküllerin en yüksek çözünürlüğünde inositol-lipit sinyallemesi ve TRP kanal düzenleme ve aktivasyonunun bir modeli olarak D. melanogaster fototransdüksiyonunun incelenmesine olanak tanır.
Tüm hücre kayıt yönteminin D. melanogaster fotoreseptörlerine uygulanması, omurgasız fototransdüksiyon çalışmalarında devrim yarattı. Bu yöntem Hardie 1 ve bağımsız olarak geliştirilmiştir.Sonsuza dek Ranganathan ve meslektaşları tarafından 2 ila 26 yıl önce ve D. melanogaster'ın geniş genetik manipülasyon araçlarından istifade etmek ve bunları fototransdüksiyon ve inositol-lipid sinyalizasyon mekanizmalarını ortaya çıkarmak için kullanmak üzere tasarlandı. İlk başta, bu teknik, detaylı niceliksel çalışmaları engelleyen, diseksiyon işlemi sırasında ışık hassasiyetinde hızlı bir düşüş ve ommatidia düşük bir hasar gördü. Daha sonra, yama pipetine ATP ve NAD ilavesi, preparatın uzun süreli niceliksel kayıtlar için uygunluğunu önemli ölçüde artırdı. Bundan sonra, moleküler düzeyde sinyal iletim mekanizmasının kapsamlı karakterizasyonu gerçekleştirildi.
Halen, D. melanogaster fototransdüksiyonu, fosfoinositid sinyali ve TRP kanallarının tek molekül çözünürlüğünde ex vivo incelenebildiği az sayıdaki sistemden biridir. Bu, D. melanogasterin fototransdüksiyonunu yapar ve benBu mekanizmayı oldukça hassas bir model sistem olarak incelemek için geliştirilen trodoloji. Bu protokol, D. melanogaster retinanın ayrıştırılacağını ve çevredeki pigment (glia) hücrelerinden izole edilmiş ommatidiyi mekanik olarak soyduğunu açıklamaktadır. Bu, fotoreseptör hücre gövdeleri üzerinde bir giga sızdırmazlık elemanı ve bir tam hücre yama kelepçesi oluşumunu mümkün kılar. Neyse ki, en sinyal veren proteinler rabdomere ile sınırlıdır ve yayılmaz. İlaveten, sinyal bölmesi ile hücre gövdesi 3 , 4 arasında bulunan kalphotin adı verilen hareketsiz bir Ca 2+ tamponu ve mikrovillide Na + / Ca 2+ eşanjörünün (CalX) yüksek ekspresyon seviyesi vardır 5 . Birlikte, rhabdomere'ye protein salıverme, calphotin tamponu ve CalX'in yüksek ekspresyonu, gerekli bileşenlerin kaybı olmadan nispeten uzatılmış (yaklaşık ~ 20 dk'ya kadar) tüm hücre kayıtlarına olanak tanırVe ışığa karşı yüksek duyarlılığı korurken. Aşağıdaki protokol izole ommatidia'yı nasıl elde edeceğinizi ve fototranskülasyon kaskadının yerli özelliklerini koruyan tüm hücre kayıtlarını nasıl yapacağınızı açıklamaktadır. Ayrılmış hamam böceği ( Periplaneta americana ) 6 ve kriket ( Gryllus bimaculatus ) 7 ommatidia üzerinde D-melanogaster için tarif edilene benzer şekilde tam hücre yama kelepçe deneyleri yapıldı . Ek olarak, file clam ( Lima scabra ) ve tarak ( Pecten irradians ) ayrıştırılmış fotoreseptörleri üzerindeki patch clamp deneyleri D. melanogaster üzerinde gerçekleştirilenlerden biraz daha farklı bir şekilde gerçekleştirildi , hem tüm hücre 8 hem de tek kanallı ölçümler yapıldı 9 . Burada, D. melanogaster'te bu tekniği kullanarak elde edilen başlıca başarılar anlatılmaktadır. Tartışma iBu tekniğin bazı tuzakları ve kısıtlamaları tanımını içermez.
Protokol
1. Reaktif Hazırlama
NOT: Tüm çözümleri, Tablo 1-4'teki talimatlara göre hazırlayın.
- Ekstraselüler Çözeltiyle (ES veya ES-0Ca 2+ , gerektiği gibi, bkz. Tablo 1 ) 10 mL şırınga doldurun ve buz üzerinde tutun.
- Tritürasyon Çözeltisinin bir şişesini hazırlayın (TS; bkz. Tablo 2 , yani ES veya ES-0Ca 2+ + FBS ve sükroz) ve bunu buzda tutun.
- Deney için yeterli ES hazırlayın ve bunu ihtiyaç duyana kadar buzda tutun.
NOT: Sürekli banyo perfüzyonuna gerek yoktur, bu nedenle ES hacmi birkaç düzine mL'den fazla olmamalıdır. - 22 μm PVDF filtre kullanarak, hücre içi çözeltiyi (bkz. Tablo 3 veya Tablo 4 ), 1 mL'lik şırıngaya elektrot doldurma uzun ucu ile doldurun. Bunu buzda tutun.
2. Diseksiyon Cihazlarının Genel Kurulumu
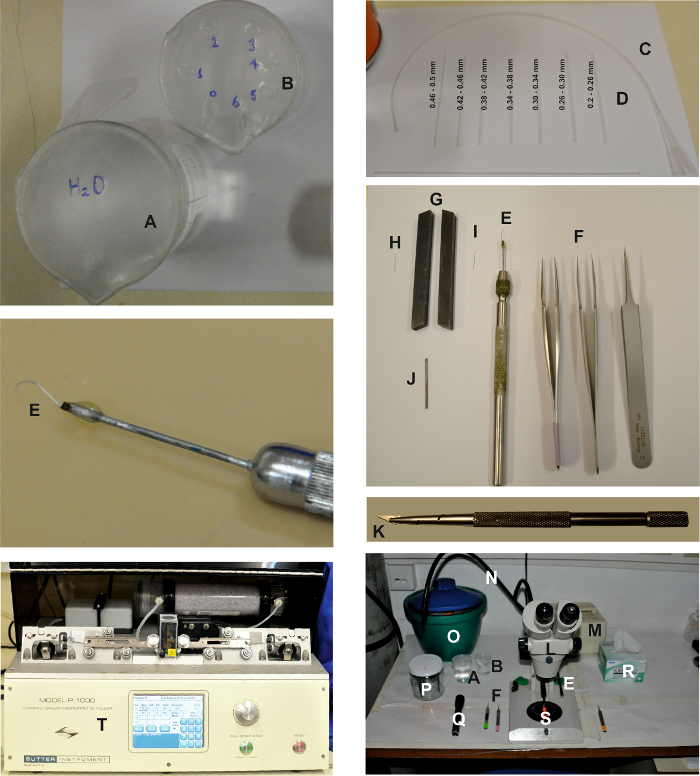
Şekil 1: İzole Ommatidya Hazırlığı Yapmak İçin Gerekli Aletler ve Cihazlar. Resimler, yukarıdaki ayrıntılı protokolde açıklandığı üzere, izole edilmiş ommatidya preparatının oluşturulması için gereken çeşitli cihazları göstermektedir. Biri suyla doldurulmuş ( A ) diğeri boruya ( C ) bağlı öğütme pipetlerini ( D ) temizlemek için etanol ( B ) ile doldurulmuş iki beher. Kesme aletleri şunlardır: 2 çift ince ve bir çift cımbız ( F ) ve bir retina kürekçisi ( E ). Retina kepçesini hazırlamak için iğnenin üst kısmını ( I ) düzleştirmek için bir tali ( G ) olarak işlev gören iki torna aleti arasında bir mikro diseksiyon iğnesi ( H ) preslenir. Daha sonra uzatılmış bir pi'ye bağlanır. Tutkal ( J ) kullanarak metalin bir ucunu tutun ve bir iğne tutucuya ( E ) takın. Tıraş bıçağı yonga ve tutacağı: Tıraş bıçağı tutucusu ( K ) kullanarak ustura tıraşı ufak üçgen çipini ayırın ve takın. Diseksiyon çalışma alanı, iki ışık kılavuzu ( N ) bulunan bir binoküler ( L ) ve serin bir kırmızı ışık kaynağı (( M) ) içerir. Dürbünün her iki tarafına, cımbız ( F ), retina kürek ( E ), bardaklar ( A ve B ), kırmızı filtreye sahip el feneri ( Q ) ve narin silecekler ( R ) gibi diseksiyon aletleri yerleştirilir. ES, FBS-ES, hücre içi çözüm şırıngaları, 60 mm Petri kabı ( S ) ve elektrot tutacağı ( P ) içeren bir buz kovası da masanın üzerine yerleştirilir. Kayıt elektrotları, yatay çekme birimi ( T ) kullanılarak çekilir.E-posta: e.com/files/ftp_upload/55627/55627fig1large.jpg "target =" _ blank "> Bu figürde daha büyük bir sürümünü görmek için lütfen tıklayınız.
- Retina izole etmek için bir retina kürek oluşturun.
- Mikrozeksiyon iğnesinin ucunu (1-4 mm) (iki boyutlu çivi çenesi arasına 12 mm uzunluğunda, 0,1 mm çaplı, entomolojik iğne) sokun ve küçük bir çekiçle dokunarak yatay konuma getirin.
- Düzleştirilen iğneyi bir mikro kesici iğne tutucuya monte edin ( Malzeme Tablosuna bakın ).
- Bir çift cımbız kullanarak, ~ 2.5 mm kavisli bir kanca oluşturmak için iğnenin düzleştirilmiş ucunu eğri.
- Omatidya ayrılması için öğütülme pipetleri oluşturun.
- Açık bir alevin üzerine 1.2 x 0.68 mm (OD x ID) cam kapiler yerleştirin ve açıklığını azaltmak için parlatarak parlatın.
- Kılcal açıklığın boyutunu bir mikroskop altında ölçün. Yaratılan ommatidial öğütme pipetlerini seve'ye göre sırala.N grupları açıklıklarının boyutlarına göre ( yani 0.2-0.5 mm). Bunları ayrı ayrı uygun kaplarda ( örn. Test tüpleri) saklayın.
- Bir küçük beher ile çift damıtılmış su (DDW) ve etanol% 70 içeren bir başka küçük beher doldurun. Her bir beheri bir parafin film tabakasıyla örtün.
- DDW beherini kaplayan parafin film tabakasına bir küçük delik açınız (bakınız Şekil 1A ).
- Parafin film tabakasında etanol beherini kaplayan yedi küçük delik açın ve 0 ile 6 arasındaki delikleri numaralayın (bkz. Şekil 1B ).
- Her paralel film deliğine her büyüklük grubundan bir ommatidial öğütme pipeti yerleştirin, böylece en geniş delikli pipet 0 numaralı delikte bulunur ve en küçük delikli pipet 6. delikte bulunur.
- 35 cm uzunluğunda, 1,57 x 1,14 mm (OD x ID) polietilen boru parçasına plastik 200 mcL pipet uç takın. ConnecTiraj pipetinin sivriltilmiş ucunun boruya bakmadığından emin olmak için tüpün diğer ucu en büyük açıklığı olan ( yani 0.46-0.5 mm) ommatidial öğütme pipetlerinden birine.
- 1 x 0,58 mm (OD x Kİ) borosilikat filament içeren cam kılcallardan patch clamp pipetleri çekerek tüm hücre kayıt pipetlerini hazırlayın.
NOT: Potasyum glukonat esaslı hücreiçi çözelti (IS1) kullanıldığında pipetlerin direnci 8-15 MΩ olmalıdır. Herhangi bir uygun yama pipet çektirici kullanılabilir (örneğin, Malzeme Tablosuna bakınız ). Alevle parlatma gerekli değildir. - Ergimiş parafin veya yüksek vakum silikon yağı kullanarak banyo haznesinin altına lamel takarak (bkz . Malzeme Tablosu ) bir kayıt odası hazırlayın (bkz. Şekil 2 ). Elektrod erişimini ve perfüzyonu mümkün kılan herhangi bir ev yapımı veya ticari oda kullanın.
- Banyoyu ters çevrilmiş mikroskop sahnesine monte edin. Perfüzyon sistemi tüpünü, emme sistemini ve zemini (Ag-AgCl tel / pelet) banyoya yerleştirin (Malzeme Tablosu ve Şekil 2'ye bakın ).
- Retina diseksiyonu ve ommatidia izolasyon basamakları sırasında kullanılmak üzere çalışma yüzeyine iki adet ince # 5 cımbız ( Şekil 1 ) yerleştirin.
3. D. melanogaster Yetiştirme
- D. Melanogaster'ı , 19-24 ° C'de standart mısır unu yemi içeren şişelerde düşük bir nüfus yoğunluğunda (6 oz şişede ~ 20 sinek) kaldırın.
NOT: Karanlık ayarlı sinekler üzerinde çalışmak tercih edilir. Işıklara karşı yüksek hassasiyeti korumak için, mutant sineklerde çeşitliliği azaltmak ve retina dejenerasyonunu önlemek. - Denemeden önce en az 24 saat sineklerin arkasında durun.
NOT: Deneyler için kullanılan sinekler rece(<2 saat) kapalı ve hala yumuşak, solgun ve mekonyumu gösteriyor. Ommatidia da pupa'dan kolayca hazırlanabilir, ancak ışığa karşı hassasiyeti daha sonra 10 yaşına bağlıdır.
4. Retina Diseksiyonu ve Ommatidia İzolasyonu: Seçenek 1
NOT: Preparatın doğru şekilde görüntülenmesi için uygun bir amplifikasyon kullanarak stereoskopik zoomlu mikroskop altında aşağıdaki adımların tümünü uygulayın (Bkz. Şekil 1 ).
- Döndürülmüş bir 60 mm Petri kabına dört damla ES-0Ca 2+ ve bir damla TS çözeltisi yerleştirin.
- Kaba cımbız kullanarak, kanatları veya vücudu ile yeni kaplanmış (ekrosiondan sonra <2 saat) sinek yakalayın. Bu noktadan itibaren, tüm işlemleri hızlı bir şekilde ve 20 ± 1 ° C'de loş kırmızı aydınlatma altında gerçekleştirin.
- Kaba cımbızlarla sinekleri hala yakalarken, sinek kafasını cesetten ayırmak için ince cımbızın ilk çifti kullanın. SubmeBaşı ilk ES-0Ca 2+ damlasına koyun.
- İkinci cımbız çifti kullanarak kafayı sajital düzlem boyunca yarım parçalara ayırın. Bu adımın sonunda, her iki gözün hâlâ sağlam durumda olmasını sağlayın.
- Başın bir yarısını ikinci ES-0Ca 2+ damla ve diğer yarısı üçüncü ES-0Ca 2+ damlasına aktarın.
- İnce cımbız kullanarak, mümkün olduğunca göz çevresindeki dokunun çoğunu çıkarın ve retina'ya zarar gelmemesine dikkat edin.
- Bir cidatın köşesini ince cımbızla sıkıca tutun ve kepçeyi kullanarak retinayı dışarı atın.
NOT: Bu adımı tamamladıktan sonra, kornea, bozulmamış bir retinadan ayrılmış ve boş bırakılacaktır. - Boruya bağlanan toz haline getirme pipetini DDW ile çalkalayın ve pipeti dördüncü damla küçük miktarda ES-0Ca 2+ ile doldurun.
NOT: Bu adım, yeni bir ommatidia-ayıran pipet her kullanıldığında yapılmalıdır ve froM etanol beherglini (pipet dolduran çözelti, retinanın içine batırıldığı çözeltiyle eşleşmelidir). - İzole edilmiş retinayı pipet içine çekmek için hafifçe ağızdan aspire edin. Pipet içine hava kabarcıkları aramak için değil, çok dikkatli olun.
- İzole edilen retinayı TS damlasına aktarın. İkinci göze 4.6-4.10 arası adımları uygulayın.
- ES-0Ca 2+ damlalarını hassas mendil kullanarak silin ve sadece Petri kabında her iki retina içeren TS damlasını bırakın. Petri kabının üstüne altı damla daha TS damlasını ekleyin. Her iki retinayı diğer TS damlalardan birine aktarın.
- Öğütülme pipetini daha küçük çaplı bir açıklık pipetiyle değiştirin. Pipet doldurmak için çözüm olarak TS kullanarak, adım 4.8'de açıklandığı gibi durulayın.
- Tüm retinadaki pigment hücrelerini soyulmuş izole ommatidia'yı ayırmaya başlamak için, her iki retinayı hızla ve tekrar tekrar emme ve sonlandırma.
NOT: İzole edilmiş ommaTidia, TS damlasında görülür ve izolasyon işlemi ilerledikçe, TS damlası daha az saydam olur. - Kalan retinayı bir sonraki TS damlasına aktarın. Tüm eski TS damlasını (izole edilmiş ommatidia içeren) pipet doldurun ve damlasını banyo haznesine boşaltın.
- Maksimum izole ommatidia elde etmek için 4.12-4.14 adımlarını tekrarlayın. İzole edilmiş ommatidyanın lavabo ve banyo odasının altına bağlanması için yaklaşık 1 dakika bekleyin.
- Perfüzyon sistemini kullanarak, banyo odasına 1,5 mM Ca 2+ içeren ES-0Ca 2+ akışını başlatın. Bölmenin alttan üste doğru çözeltiyle tamamen doldurduğundan ve zeminin tamamen çözeltiye battığından emin olun. 4-5x banyoyu yıkamaya devam edin.
5. Retina Diseksiyonu ve Ommatidia İzolasyonu: Seçenek 2
Not: Stereoskopik zum mikroskopu altında bir ampliPreparatın düzgün şekilde görüntülenmesi için uygunluk (Bkz. Şekil 1 ).
- Bir traş bıçağı yongası ve tutacağı hazırlayın. Tıraş bıçağı tutucusu kullanarak ustura bıçağının küçük bir üçgen çipini ayırın ve takın ( Şekil 1 ).
- Üreticinin talimatlarına göre bir silikon diseksiyon kabı / bloğu hazırlayın (Malzeme Tablosuna bakın ).
- Diseksiyon için, silikon diseksiyon bloğunda ES çözeltisinden büyük bir düşüş (<0.5 mL) oluşturun. 60 mm'lik bir Petri kabına TS çözeltisinin iki "rezervuar" damlası (~ 50 mcL) ekleyin
- Buz gibi bir cam tüp içine yeni kavuşmuş (<2 saat sonrası) uçmayı hareketsiz hale getirin ve kanatlarıyla cımbızla toplayın. Bu noktadan itibaren, tüm işlemleri hızlı bir şekilde ve 20 ± 1 ° C'de loş kırmızı aydınlatma altında gerçekleştirin.
- Sincap cımbızla tutarak, tutacaklı bir tıraş bıçağı çipi kullanarak sinek başını kesin. Böcek iğnesi (12 mm uzunluğunda,0,1 mm çapında) cımbızla yerleştirin ve gözler arasındaki başı delin.
- Kafayı kısmen% 70 etanol içine batırın; Bu, baş / göz yüzeyinde hava kabarcıklarının oluşmasını önler. Kafayı silikon diseksiyon çanağındaki ES damlasının altına pinleyin.
- Gözün ön kenar çizgisi boyunca testere hareketi kullanarak traş bıçak ucu kullanarak iki gözü de kesin.
- İnce cımbızlarla bir kornea kenarını sıkıca tutun.
- Scooper kullanarak retinayı çıkarın.
NOT: Bu adımı tamamladıktan sonra, kornea, bozulmamış bir retinadan ayrılmış ve boş bırakılacaktır. - Retinaya zarar vermeden yapışkan hava keselerini ve fazla beyin dokusunu nazikçe çıkarmak için cımbızı ve kepçeyi kullanın.
NOT: İzole retinanın hazırlanması, non-spesifik retina proteinlerinin 11 , tüm montaj histolojisinin ve tüm retinanın görüntülemesinin Western leke analizleri için de yararlıdır. Yama kelepçesi kayıtları aynı zamanda ph üzerinde de yapılabilirRetinadaki otoreseptörler 12 . - En büyük çapa sahip toz haline getirme pipetini alın, boruya bağlayın ve pipoyu hafifçe emdirerek ( yani ağız yoluyla) Petri kabındaki rezervuar damlalarından bir miktar TS ile doldurun. Yeni bir ommatidia öğütme pipeti her kullanıldığında bu adımı uygulayın.
- Ağzı hafifçe TS'yi iki retinaya üfleyin ve ardından izole retinayı nazik bir emme kullanarak pipet içine çekin. Hiçbir hava kabarcıklarının pipete girmesini önlemek için dikkatli olun.
- Küçük bir damla (~ 20 mcL) oluşturan Petri kabına yalıtılmış retinayı aktarın ve rezervuar damlalarından birinden TS ile bir veya iki kez yıkayın.
- Retinayı karanlıkta 20-25 dakika inkübe edin.
- Ommatidia toz haline getirme pipetini daha küçük çaplı bir delikli bir pipetle değiştirin (pipet doldurmak için basamak 4.6'daki gibi rezervuar damlalarından birinde bulunan taze TS'yi kullanın).
- hızlaIzole ommatidia'yı ayırmaya başlamak için her iki retinayı küçük bir damla (~ 20 μL) aspire edin ve sonlandırın.
NOT: İlk aşamada, çevredeki pigmentli glia çözülmelidir ve solüsyondaki görünür küçük kalıntı bırakır. - Büyük küçük çöpler biriktikten sonra, ancak birçok ommatidia ayrılmadan önce, rezervuar damlalardan birinden taze TS'yi kullanın ve retinaayı yeni küçük bir damlaya aktarın.
- Daha küçük çaplı öğütme pipeti, dolgu seçin ve öğütmeye devam edin.
NOT: Ommatidia artık ayrışmaya başlayınca, uzatılmış formları stereomikroskopun yüksek gücü altında açıkça görülmelidir. Gerekirse, öğütme pipetlerini, ommatidia'nın iyi bir verimi görene kadar daha küçük çaplara getirmeye devam edin. - Makul bir ommatidia verimi görüldüğünde ve damla yarı saydam olmadığında, izole edilmiş ommatidiyi içeren damla damlasını pipoyu doldurun ve damla damla hafifçe içine sokun.Banyo haznesinin alt kısmı ES ile önceden doldurulmuş.
- İzole edilmiş ommatidyanın lavabo ve banyo haznesinin altına yerleşmesi için yaklaşık 1 dakika bekleyin.
- Perfüzyon sistemini kullanarak, ES akışını banyo odasına başlatın. Odanın alttan üste, tamamen çözeltiyle dolduğundan ve zeminin tamamen çözeltiye battığından emin olun. 4-5x banyoyu yıkamaya devam edin.
NOT: Bundan sonra, kesintisiz perfüzyon gerekli değildir, ancak banyoda yeni bir yama pipeti kullanılmadan önce kısa bir süre boyunca yıkanmalıdır.
6. Tam Hücreli Kayıt

Şekil 2: Elektrofizyolojik ve Optik Ayara Genel Bakış. Kurulumda demir, siyah boyalı Faraday kafesi ( F ) bulunur. Ön kısım, bakır örgülü bir siyah perde ile kaplanmıştır. Bu yapılandırmaUration, preparatın herhangi bir sapık ışığa karşı tamamen kapatılmasını sağlar ve karanlık spontan darbe kayıtları için uygundur. Ters flüoresan mikroskopu ( A ) titreşim önleme tablosuna ( E ) tespit edilir. Fotoreseptör kayıt aparatı, perfüzyon girişi ( Q ), emme pipeti ( S ) ve gümüş-gümüş klorür zemini ( P ) olan ev yapımı bir akrilik cam banyo odası ( O ) içermektedir. Banyo odası ev yapımı bir adaptör ile mikroskop sahnesine ( T ) monte edilmiştir. Kayıt pipeti, gümüş-gümüş klorür teli vasıtasıyla, amplifikatör basamağına ( C ) bağlı bir akrilik cam tutacağı bağlanır. Basamak daha sonra ince bir XYZ mekanik mikromanipülatör ( B ) üzerine monte edilmiş kaba mikromanipülatör üzerine monte edilir. Perfüzyon sistemi ( D ) bir şırınga takımından oluşurken likit akışıD, sıkıştırma valfleri ( H ) tarafından kontrol edilir. Raf, Faraday kafesindeki tüm ekipmanın bağlandığı aynı merkezi zemine elektriksel olarak bağlanmış ve bir patch clamp amplifikatörü ( N ), bir osiloskop ( J ), bir darbe / fonksiyon üreteci ( K ), bir A ila D dönüştürücü ( L ), bir perfüzyon denetleyicisi ( I ) ve bir filtre tekerleği ve panjur denetleyicisi ( M ). Görüntüleme deneyleri için soğutulmuş (-110 ° C, Malzeme Tablosuna bakınız ) CCD kamera bir yan bağlantı noktası ( G ) vasıtasıyla bağlanır. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
NOT: Aşağıdaki adımların tümünde yalnızca loş kırmızı ışıkla aydınlatma kullanın ve ommatidia'nın ışığa maruz kalmasının minimal olmasını sağlayın ( yani hızlı çalışın veOmmatidyumu izlemeyi talep etmeyen görevleri yerine getirirken ommatidia'yı görüntülemek için kullanılan diseksiyon ışık kaynağını ve oda kırmızı aydınlatmasını kapatın). Buna ek olarak, standart elektrofizyolojik protokole göre aşağıdaki adımların tümünü uygulayın.
- Tersine dönük bir mikroskop altında (40X objektif) banyodaki tüm ommatidia'yı dikkatle inceleyin ve deney için uygun bir ommatidyum seçin.
- Ommatidyumun dış zarının düzgün ve bozulmamış olduğundan, uzun eksenin elektrot yaklaşma yönüne göre yaklaşık olarak doğru bir açıyla ( Şekil 3A'da görüldüğü gibi) olduğundan ve ommatidyumun distal bölümünün herhangi birinin tarafından çevrilmediğinden emin olun Fazla doku. Tekli aydınlatmayı sağlamak için seçilen ommatidyumu objektif merceğin optik eksenine (görüş alanının merkezinde) yerleştirin.
- Hücre içi çözüm (IS1 veya IS2) içeren bir yama pipet doldurun.
NOT: Mea içinEmin yoğunluk tepki ve darbe analizi, IS1 kullanın. Işık-hassas kanalların ters potansiyelini ölçmek için IS2 kullanın. - Yama pipetini elektrot tutucusuna takın.
- Pipoyu, elektrot tutucusuna bağlanan tüp aracılığıyla ağız yoluyla püskürtün, pozitif basınç ile doldurmasına neden olun. Basıncı korumak için boru valfını kapatın.
- Mikromanipülatörü kullanarak elektrotu banyo odasına yerleştirin.
- Elektrodu, ommatidyumun distal bölümüne yaklaştırın, böylece ommatidyumda küçük bir çukur (yama pipetindeki pozitif basınçtan dolayı) görene kadar, elektrod ve ommatidyum arasında hiçbir temas olmaz.
- Kayıt yazılımını açın (Malzeme Tablosuna bakın ). 100 Hz hızında 2 mV'luk sürekli kare voltaj darbeleri uygulamak için "membran test modülü" nü açın.
- Birleşim potansiyelini uygun kno ayarlayarak "sıfır" olarak ayarlayınB, kare darbesinin tabanını "sıfır" akımına ayarlamak için patch clamp amplifikatöründe
NOT: Elektrofizyolojik kurulum, bir amplifikatöre ( örn., Ikinci aşamada amplifikasyon) bağlanan bir kafa kademesi ( yani, birinci kademe yükseltme) içerir. Güçlendirilmiş analog sinyal, bir PC bilgisayarına kurulu yazılım tarafından kontrol edilen A / D dönüştürücüyü kullanarak dijital bir sinyale dönüştürülür. - Elektrot tutucusuna bağlı borunun valfını açarak pipet içindeki pozitif basıncı serbest bırakın. Hücre zarına pipet iletimine yol açan tüp dışarı emerek yavaşça pipet içinde negatif basınç yaratın. Basıncı korumak için boru valfını kapatın.
- Bilgisayar ekranında görülen elektrod direncinin 100 - 150 MΩ'a yükseltildiğinden emin olun. Elektrot tutucusuna bağlı olan borunun valfini manuel olarak açarak pipet içindeki negatif basıncı serbest bırakın.
- ElEctrode direnci en az 1-2 GΩ'a yükseltilir.
NOT: Bu noktada, elektrot ve fotoreseptör arasında bir conta oluşturulmuştur. - Yama kelepçe amplifikatöründeki uygun düğmeyi ayarlayarak pipetin kapasitif akımlarını uzaklaştırın.
- Elektrodda hızlı, kısa ve kuvvetli bir negatif basınç atışı oluşturun, elektor tutucusuna bağlanan borudan ağız yoluyla emerek fotoreseptör zarına "kırın" ve bütün hücreli bir konfigürasyon oluşturun. Alternatif olarak, "0.1 ms" süresi ile başlayarak kısa, dikdörtgen elektriksel darbeler uygulamak için "Zap düğmesini" kullanın veya her iki yöntemin bir kombinasyonunu uygulayın.
NOT: Tüm hücre konfigürasyonunun oluşumu, pipet kapasitesinde ani bir artış (genellikle vahşi tip R1-6 fotoreseptör için ~ 60 pF, yalnızca ~ 20 pF'lik bir kapasitans vasıtasıyla bir R7 fotoreseptöründen bir kayıt gösterir; ~ 90 pF, ikifotoreseptör). - El fleksi amplifikatöründeki uygun topuzu kullanarak fotoreseptörün tutma potansiyelini gerekli voltaja (genellikle -70 mV) ayarlayın.
NOT: Bir mühür elde edildikten (adım 6.11) sonra ve tüm hücre konfigürasyonuna ulaşılmadan önce bu adımı gerçekleştirmek mümkündür. - Kapasitif akımları ve seri direnci (25 MΩ'dan yüksek ölçülen seri direnç değeri, elektrot pipetinin tıkalı olduğunu gösterir) ve gerekirse ( yani daha büyük akımlar için), patch clamp amplifikatöründeki uygun düğmeleri kullanarak seri direnç telafisi uygulayın .
- Maksimum karanlık ve elektrik izolasyonu elde etmek için Faraday kafesinin siyah ön perdesini kapatın.
- Yazılımı kullanarak kayıt işlemine başlayın ve istenen deney prosedürüne göre ışık uyarılarını ve / veya farmakolojik maddeleri uygulayın.
7. Simultane WhOle Hücre Kayıtları ve Ca 2+ Görüntüleme
- Genetik olarak kodlanmış Ca 2+ göstergeleri için, yukarıda açıklandığı gibi ommatidiyi, GCaMP6f ifade eden D. melanogaster sinekleri kullanarak izole edin 13 . Floresans ölçümü için bir CCD kamera kullanın ( Malzeme Tablosuna bakın ) ve mikroskopta uygun uyarılma ve emisyon filtreleri ve bir dikroik ayna ile donatılmış olduğundan emin olun (bkz . Malzeme Tablosu ) 4 .
- Ekzojen Ca 2+ göstergesinin kullanımı için ( Şekil 4 , Malzemelerin Tablosuna bakın ) ommatidyayı yukarıda tarif edildiği gibi izole edin. Buna ek olarak, pipet çözeltisinin 20-100 μM kalsiyum göstergesi içerdiğinden emin olun.
- 40 Hz hızında görüntü elde etmek için görüntüleme yazılımını kullanın (Malzeme Tablosuna bakın ). 10 saniye karanlık bir süre boyunca görüntü alımını gerçekleştirin ve ardından yoğun 2 saniye ışık sti uygulayınformülasyonunda.
- Görüntüleme yazılımını kullanın ve bir İlgi Alanı (ROI) tanımlayın. ROI'deki floresan yoğunluğunu ölçün. Ortalama karanlık floresan (F D ) ve ışık (F L ) uyarımı (F L -F D ) sırasında floresans kayıtlarından çıkartın. Işık uyarımının başlangıcındaki floresan yoğunluğuna (F L 0 ) göre bu ölçümleri normalize edin.
Sonuçlar
Tanımlanan yöntem, spontan ve ışığa uyarılmış kuantum darbeleri üreten temel birim akımların doğru kayıt edilmesini sağladı ve bu kuantum darbe, makroskopik yanıtı tanımlanmış koşullar altında ışığa dönüştürmek için toplandı. Ayrıca, kritik sinyal moleküllerinde kusur bulunan vahşi tip ve mutant sinekler arasındaki karşılaştırmaya izin verildi ( Şekil 3 ve 5 ) 14 , 15 , 16 , 17 , 18 . Buna ek olarak, bi-iyonik koşullar altında geri dönüşüm potansiyelini ölçme kabiliyeti, TRP ve TRP benzeri (TRPL) kanalların temel biyofiziksel özelliklerini ortaya çıkardı 18,19. Aynı zamanda, TRP'nin gözenek alanındaki amino asit substitüsyonlarının etkilerini, Ca2 +Geçirgenlik 20 .
Yama klemp tam hücreli kayıtlarla elde edilen ışık tepkisi, ışık yoğunluğunda doğrusal olarak en az 4 derece büyüklüğüne bağlıdır. Bu, ERG ve hücreiçi kayıt yöntemleri kullanılarak çözülemedi. Buna göre, artan şiddetin kısa süreli yanıp sönmesi ve yoğunluk tepki fonksiyonunun bir çizimi üzerine bir dizi yanıt, artan ışık şiddeti ile yanıp sönme tepkisinin katı bir doğrusallığını ortaya çıkardı. Sıkı doğrusallık en az yüz pA kadar tutar, ancak bundan sonra lineerlik mi yoksa kısmi kıvrılma kontrolü olup olmadığı tartışmalıdır ( Şekil 6 ). Bu sonuçlar, ışığa karşı makroskopik yanıtların, ışığa verilen üniter tepkilerin doğrusal bir toplamı olduğunu göstermektedir ( yani, kuantum darbeleri).
Işık uyarı ışığını dim eden voltaj kayıtları kullanılarak iyi kurulmuştur.Birçok omurgasız türde ayrı voltaj dalgalanmaları ( yani kuantum darbeleri). D. melanogaster kuantum tümsekleri, ~ 15 TRP kanallarının ve ~ 2 TRPL kanallarının çarpma zirvesinin 18 en üstünde uyumlu bir şekilde açılmasından kaynaklanır. Her darbe, tek bir fotonun emilmesi ile üretilirken, daha yoğun ışıklara makroskopik tepki, bu temel tepkiler 14 , 21'in toplamıdır. Uyarıcı koşulları aynı olsa bile, darbeler, gecikme, zaman yönü ve genlikte önemli ölçüde değişir. Damga üretimi, her etkili emilen fotonun sadece bir yumru oluşturduğu Poisson istatistiği tarafından tanımlanan stokastik bir süreçtir. Tekli foton-tekli-yumru ilişkisi, kademeli kademedeki her adımın sadece etkili bir "açma" mekanizmasını değil aynı zamanda etkili bir "kapatma" mekanizmasını içermesini gerektirir. Fonksiyonel avantajı, birGörsel sistemin gerektirdiği zamansal çözünürlük ve hassaslık için çok hızlı bir geçici tepki veren çok hassas foton sayacı. Aktif bir kapatma mekanizması için gereklilik, aktif fotopigment ( yani metarodopezin, M) veya hedefi G q α'nın etkisiz hale getirilmesinde başarısız olması ve ışık kesildikten sonra uzun süre buruşukluk üretimine neden olması durumunda ortaya çıkar. 3 ) 15 , 22 , 23 , 24 .
Darbe TRP / TRPL kanallarının bir mikrovillus içindeki kooperatif faaliyetini temsil eder. Bu nedenle, kanal aktivasyonunun herhangi bir hipotezi kooperatif kanal aktivasyonunu da açıklamak zorundadır. Son zamanlarda, Hardie ve meslektaşları fotoreptörlerin hızlı kasılmalarını uyandırdığını göstermişler ve ışık hassasiyetininE kanalları (TRP / TRPL) mekanik olarak kaplanabilir 25 . Bu mekanik aktivasyon, PLC aracılı PIP 2 hidrolizi ile açığa çıkan gözlenen protonlarla birlikte TRP / TRPL kanallarının açılmasını teşvik eder ve yumru üretiminin kooperatif doğasını açıklar 26 . Şu anda, D. melanogaster fotoreseptörleri fosfoinositid sinyali ve TRP kanallarının in vivo incelenebildiği az sayıdaki sistemden biridir ve böylece D. melanogaster fototransdüksiyonu yapmaktadır ve bu mekanizmayı oldukça değerli bir model sistem olarak incelemek için geliştirilen metodoloji.
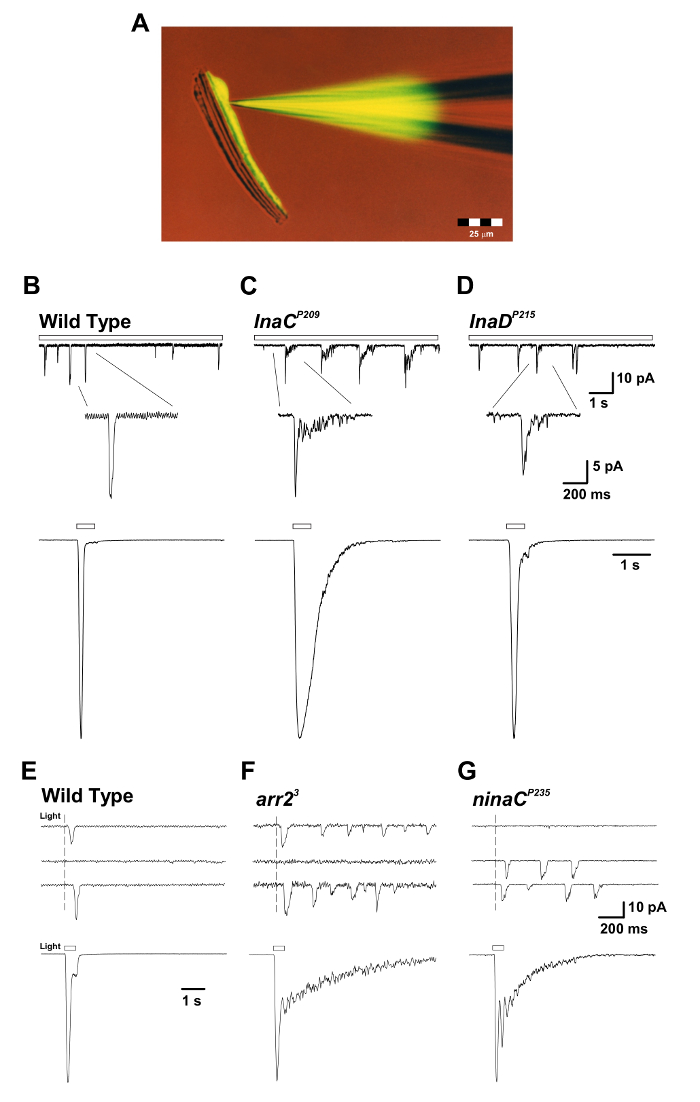
Şekil 3: inaC P209 ve inaD P215 Mutantları, Işık ve Tekli Kuantum Tümsekleri için Makroskopik Yanıtın Yavaş Yanıt Vermesinin Sona Ermesi'ni Ortaya Çıkarmaktadır. ( A ) İzole edilmiş ommatidyum prepaFloresan Lucifer Yellow CH boya (uyarma: 430 nm; emisyon: 540 nm) ile doldurulmuş bir yama pipeti ile rasyon, bütün hücre kayıt sırasında sunulmuştur. Floresan boya, tek bir fotoreseptör hücre gövdesine yayılmış ve etiketlenmiştir ve fotoreseptör hücre gövdeleri, uzatılmış aksonlarından ayrılır, ancak canlı kalırlar. Bu preparat aynı anda tüm hücre kayıtları ve görüntüleme deneyleri için uygundur. ( BD ) Üst paneller: WT, inaC P209 ve inaD P215 mutant sineklerinde sürekli loş ışığa (açık çubuk) tam hücreli voltaj sıkıştırmalı kuantum darbe tepkileri. InaC P209 ve inaD P215 mutantlarında WT sineklerine göre darbelerin yavaş yavaş sonlandırılması gözlemlenir. Aşağıdaki ilaveler, tek dirseklerin büyütülmüş şeklini görüntüler. Alt paneller: Yukarıdaki vahşi türün 500-ms'lik bir ışık darbesine (1.5 x 105 foton / s) normalleştirilmiş tam hücreli makroskopik tepkiler Ve mutant sinekler. (EG) Üst paneller: Vahşi tip, arr2 3 ve ninaC P235 mutant sineklerde tek foton yanıtları ortaya çıkaran kısa (1 ms), loş ışıkta tam hücreli voltaj sıkıştırmalı kuantum çarpma tepkileri. Arr2 3 ve ninaC P235 mutantlarında gözlemlenen darbenin trenini tek bir foton emilimine tepki olarak not edin. Alt paneller: Karşılık gelen mutantlarda 500 ms ışık pulsuna (1.5 x 104 foton / s) tam hücreli voltaj sıkıştırmalı normalleştirilmiş tepkiler. Arr2'de gözlenen makroskopik tepkilerin yavaş sonlandırılmasına dikkat edin 3 Ve ninaC P235 mutant WT'ye göre uçar. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
D / 55627 / 55627fig4.jpg "/>
Şekil 4: Sinyal ile indüklenen Ca 2+ Akışı Takip Eden Hücresel Ca 2+ Dinamiği, Calphotin'den etkilenir. Işık uyarımı sırasında Ca 2+ göstergesinin flüoresansını gösteren vahşi tipli ve Cpn % 1'lik fotoreptör görüntülerin bir zaman dizisi. Ham yoğunluk görüntüleri sahte renk kodlaması kullanılarak çizilir (çubuk = 10 μm; ok uçları pipete işaret eder). Şekil, Weiss ve diğerlerinin izniyle tekrar basıldı . 4 . Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
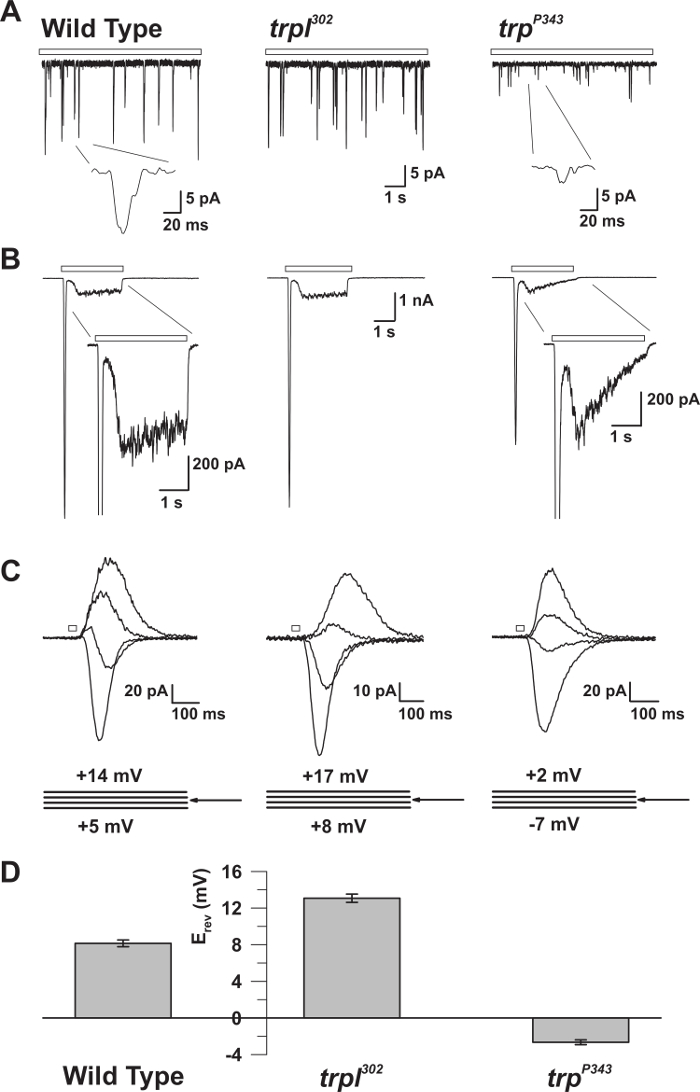
Şekil 5: WT, trp ve trpl Mutantlarının Elektrofizyolojik Özellikleri. ( A ) Tam Hücreli voltaj kelepçesi recoWT, trpl 302 ve trp P343 boş mutant sineklerde sürekli loş ışığa (açık çubuk) yanıt olarak kuantum darbe sayısı. Trp P34 3 darbelerinin oldukça azaltılmış amplitütleri gözlemlenir. Inset: Yabanıl tip ve trp P343 boş mutant sineklerin büyütülmüş tek kuantum darbeleri gösterilmiştir . ( B ) Yabani tipin ve ilgili mutantların 3 saniyelik ışık darbesine yanıt olarak tüm hücre voltaj kelepçesi kayıtları. Trp P343 mutantının geçici kararlı durum yanıtı gözlemlenir . Başlangıç: WT ve trp P343 mutantlarının büyütülmüş ışık yanıtları gösterilmiştir. ( C ) Yukarıdaki sinek suşlarının ışıkla indüklenen akıntılarının bir ailesi, ters potansiyel (E devir ) etrafında ölçülen 3 mV'luk voltaj adımlarında 20 ms'lik bir ışık darbesine yanıt olarak ortaya çıkmıştır. ( D ) Vahşi türün ve çeşitli mutanların ortalama E rev'sini gösteren bir histogramts. Hata çubukları SEM'dir WT'nin geri dönüş potansiyeli (E rev ), yalnızca TRP'yi ifade eden trpl 302'nin pozitif E rev değeri ile yalnızca TRPL'yi ifade eden trp P343 boş mutantın E rev'idir. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
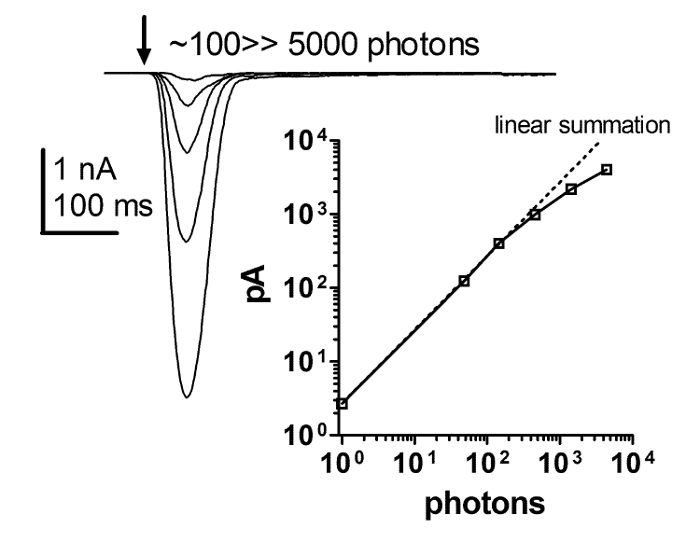
Şekil 6: Işık Yoğunluğu Artan Işık Tepkisi Kesinlikle Doğrusaltır.
Artan ışık yoğunluğunun kısa süreli yanıp sönmeye karşı bir dizi güncel yanıt ve kısa yanıp sönen ışık yoğunluğuna ışık tepkisinin tepe amplitüdünün bağımlılığının bir çizimi. Bu ilişki, flaş tepkisi ile artan ışık yoğunluğu arasında katı bir doğrusallık ortaya koymaktadır. Bu katı doğrusallıkDoğrusallık mı yoksa sonradan kırılan kelepçe kontrolü olup olmadığı tartışılabilir iken, ışık şiddeti 4 dereceden fazla alanla en az yüz pA kadar tutmaktadır. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
| pH | 7.15 (NaOH ile ayarlanır) |
| reaktif | Konsantrasyon (mM) |
| NaCl | 120 |
| KCl | 5 |
| MgCI2 | 4 |
| TES | 10 |
| Proline | 25 |
| alanin | 5 |
| -20 ° C'de saklayın. | |
| Not: Bu çözüm nominal olarak Ca 2+ içermez ancak Ca 2+ tamponları eklenmez ve dolayısıyla yaklaşık 5 - 10 μM iz Ca 2+ olacaktır. Ekstraselüler çözelti (ES) = 0.5 veya 1 M stok solüsyonundan CaCl2'yi ES-0Ca 2+' ye ekleyerek yapılan 1.5 mM CaCl2 ile ES-0Ca 2+ . | |
Tablo 1: Ca +2 içermeyen Ekstrasellüler Solüsyon (ES). Kimyasal tanımlama ve Ca +2 içermeyen ES üretmek için gereken spesifik miktarlar.
| reaktif | Tutar |
| FBS | 15 mL |
| sakaroz | 1.5 g |
| 1.5 mL'lik şişelerde 150 uL'lik alikotlara bölün ve -20 ° C'de saklayın 76 ° C. | |
| Toz haline getirme çözeltisi (TS) | Diseksiyon sırasında kullanılan çözeltiyle eşleşecek şekilde, stok solüsyonunun 150 mL'sinin 1 şişesini 1.350 mL ES veya ES-0Ca 2+ ile doldurun. |
Tablo 2: Fetal Sığır Serumu (FBS) + Sakroz - Stok Çözeltisi. Kimyasal tanımlama ve fetüs sığırı serumu (FBS) + sakaroz stok solüsyonu üretmek için gereken spesifik miktarlar.
| pH | 7.15 (KOH ile ayarlayın) |
| reaktif | Konsantrasyon (mM) |
| Potasyum glukonat (Kglu) | 140 |
| MgCI2 | 2 |
| TES | 10 |
| ATP magnezyum tuzu (MgATP) | 4 |
| GTP sodyum tuzu (Na2GTP) | 0.4 |
| Β-Nicotinamid adenin dinükleotid hidrat (NAD) | 1 |
| -20 ° C'de saklayın. |
Tablo 3: Hücre içi çözelti (IS1). Kimyasal tanımlama ve çoğunlukla yoğunluk yanıtı ve kuantum darbe ölçümleri için kullanılan IS1 üretmek için gereken spesifik miktarlar.
| pH | 7.15 (CsOH ile ayarlanır) |
| reaktif | Konsantrasyon (mM) |
| CsCl | 120 |
| MgCI2 | 2 |
| TES | 10 |
| ATP magnezyum tuzu (MgATP) | 4 |
| GTP sodyum tuzu (Na2GTP) | 0.4 |
| Β-Nicotinamid adenin dinükleotid hidrat (NAD) | 1 |
| Tetra-etil-amonyum klorür (TAE) | 15 |
| -20 ° C'de saklayın. |
Tablo 4: Hücre içi çözelti (IS2). Kimyasal tanımlama ve çoğunlukla ışık kaynaklı akımın ters potansiyel ölçümleri için kullanılan Hücre içi Çözüm IS2'yi üretmek için gereken spesifik miktarlar.
Tartışmalar
Tüm hücre kayıtlarının D. melanogaster fotoreseptörlerine uygulanması TRP kanalları 27 , 28 , 29 ve INAD 30 , 31 , 32 iskele proteini gibi yeni sinyal proteinlerinin keşfedilmesine ve işlevsel aydınlatılmasına izin verdi. Bu tekniğin ilk tanıtımından bu yana, ışık tepkisinin iyonik mekanizması ve voltaja bağımlılığı ile ilgili uzun vadeli temel soruları çözdü. Bu, zar voltajını ve hücre dışı ve hücre içi iyonik kompozisyonu 19 , 28 doğru bir şekilde kontrol etme konusundaki yeteneği nedeniyle meydana geldi.
D. melanogaster'deki yama sıkıştırma tekniğinin büyük bir engeli izole ommatidia prepa'nın kırılganlığı olmuşturrasyon. Ayrıntılı çalışmalar, phototransduction makinelerinin bütünlüğünün, özellikle ATP'nin büyük bir tüketimine yol açan, ışık maruziyeti sırasında, ATP'nin kesintisiz beslenmesine eleştirel olarak bağlı olduğunu ortaya koymuştur. Ne yazık ki, yama pipeti ile fotoreseptör zarına ulaşmak için gerekli olan pigment ( yani glia) hücrelerinin mekanik olarak çizilmesi, ATP üretimi için gerekli metabolitlerin ana kaynağını ortadan kaldırmaktadır 33 . Harici ATP'nin kayıt pipetine uygulanması, büyük oranda ATP gereksinimini kısmen yerine getirmektedir. Kısa bir ATP kaynağı, TRP kanallarının kendiliğinden aktivasyonuna ve ışık aktive kanallardan fototransdüksiyon mekanizmalarının ayrışmasına yol açar, bu da hücresel Ca2 + ' da büyük bir artışa ve normal tepkinin 34 , 35'e ortadan kalkmasına neden olur. Bu olaylar dizisi,Fotoreseptörlere, aksine de ATP'nin hücresel tükenmesine yol açar. Bu olayların meydana gelmesini önlemek ve normal ışık tepkileri sağlamak için, fotoreseptörler, yoğun ATP ışıklarını tüketen yoğun ışıklara maruz bırakılmamalıdır. Ayrıca, muhtemelen mitokondriyumda ATP üretimini kolaylaştırmak için NAD, kayıt pipetine dahil edilmelidir 18 , 36 . Spontan ve kuantum tümseklerin ölçümleri için yukarıdaki zorluk minimumdur, çünkü yalnızca loş ışıklar kullanılır. Uygulamada, kararlı bir tam hücreli kayıt ~ 20-25 dakika süreyle muhafaza edilebilir, ancak tepki kinetiği bu süre zarfında yavaşlama eğilimi gösterir. Ayrışmış ommatidia'nın tek bir preparatı 2 saate kadar kullanılabilir kalabilir.
İzole edilen ommatidia preparasyonunun ek bir eksikliği, mikropların erişilememesidir ve bu da TRP'ye erişilememesine veTRPL kanallarını kayıt pipetine koyarak tek kanallı kayıtları engeller. Geliştirdikleri bir yöntemle Bacigalupo ve meslektaşları, doğrudan rhabdomere 37'den tek kanallı etkinlik kaydetmeyi başardı. Bununla birlikte, bu kanal aktivitesi, doku kültürü hücrelerinde heterolog olarak ifade edilen TRPL kanallanndan ve izole ommatididen elde edilen atımlı ses analizinden türetilen TRP kanal aktivitesinden farklıdır 34 . Muhtemelen disseksiyon prosedürü bu yöntemi kullanırken fotoreseptör hücrelerine büyük zarar vermiştir.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu araştırmanın deneysel kısmı ABD-İsrail Bi Ulusal Bilim Vakfı (BM ve IL'ye), İsrail Bilim Vakfı (ISF), Deutsch-İsrail Projeksiyon İşlemi (DIP) (BM'ye) ve Biyoteknoloji Ve Biyolojik Bilimler Araştırma Konseyi (BBSRC Hibe Numaraları: BB / M007006 / 1 ve BB / D007585 / 1) RCH'ye
Malzemeler
| Name | Company | Catalog Number | Comments |
| 10 mL syringe | |||
| 5 mL syringe | |||
| 1 mL syringe with elongated tip | |||
| Petri dish | 60 mm | ||
| Syringe filters | Millex | 22 µm PVDF filter | |
| Capillaries (for omatidia separation) | Glass, 1.2 x 0.68 mm (~7.5 cm each) | ||
| Polyethylene Tubing | Becton Dickinson | 1.57 x 1.14 mm (35 cm) | |
| 2 small beakers | 50 mL or less | ||
| 2 paraffin film sheets | Parafilm M | ~5 x 5 cm | |
| Bath chamber | home-made | ||
| Cover slips | 22 x 22 mm No. 0 | ||
| Paraplast Plus | Sigma | Paraffin – polyisobutylene mixture | To glue the coverslip onto the bottom of the bath chamber |
| Ground | Warner Instruments | 64-1288 | Hybrid Assembly Ag-AgCl Wire Assembly |
| Headless micro dissection needle | Entomology, 12 mm | ||
| Micro dissecting needle holder | |||
| Vise | |||
| 2 fine tweezers + 1 rough tweezers | Dumont #5, Biology | 0.05 x 0.02 mm, length 110 mm, Inox | |
| Stereoscopic zoom Microscope | Nikon | SMZ-2B | |
| Cold light source | Schott | KL1500 LCD | |
| Filter (Color) for cold light source | Schott | RG620 | |
| Delicate wipers | Kimtech | Kimwipes | |
| Electrode holder | Warner Instruments | QSW-T10P | Q series Holders compatible with Axon amplifiers, straight body style |
| Silver Wire | Warner Instruments | 0.25 mm diameter, needs to be chloridized | |
| Micromanipulator | Sutter Instruments | MP 85 | Huxley-Wall Style Micromanipulator |
| Faraday cage | home made | Electromagnetic noise shielding and black front curtain | |
| Anti-vibration Table | Newport | VW-3036-OPT-01 | |
| Osilloscope | GW | GOS-622G | |
| Perfusion system | Warner Instruments | VC-8P | Pinch valve control system |
| Perfusion valve controller | Scientific instruments | BPS-8 | |
| Suction system | |||
| Amplifier | Molecular Device | Axopatch-1D | |
| Head-stage | Molecular Device | CV - 4 | Gain: x 1/100 |
| A/D converter | Molecular Device | Digidata 1440A | |
| Clampex | Molecular Device | 10 | software |
| pCLAMP | Molecular Device | 10 | software |
| Light source (Xenon Arc lamp) | Sutter Instruments | Lambda LS | |
| Light detector | home made | phototransistor | |
| Filter wheel and shutter controller | Sutter Instruments | Lambda 10-2 with a Uniblitz shutter | |
| Filters (Natural density filter) | Chroma | 6,5,4,3,2,1,0.5,0.3 | |
| Filter (Color) | Schott | OG590, Edge filter | |
| Xenon Flash Lamp system | Dr. Rapp OptoElecftronic | JML-C2 | |
| Light guide | Quartz | ||
| Pulse generator | AMPI | Master 8 | |
| Microscope | Olympus | IX71, Inverted | |
| Red illumination filter (Microscope) | RG630 / RG645 ø45mm | ||
| Microscope objective | Olympus | X60/0.9 UplanFL N air or X60/1.25 UplanFI oil | |
| CCD Camera | Andor | iXon DU885K | |
| NIS Element | Nikon | AR | software |
| Ca+2 indicator | Invitrogen | Calcium green 5N | |
| Excitation & emission filters and dichroic mirror | Chroma | 19002 - AT - GFP/FITC Longpass set | |
| Vertical pipette puller | Narishige | Model PP83 | Use either vertical or horizontal puller, as preferred. |
| Horizontal pipette puller | Sutter Instrument | Model P-1000 Flaming/Brown Micropipette Puller | |
| Filament | Sutter Instrument | 3 mm trough or square box | |
| Capillaries | Harvard Apparatus | borosilicate glass capillaries | 1 x 0.58 mm |
Referanslar
- Hardie, R. C. Whole-cell recordings of the light induced current in dissociated Drosophila photoreceptors: evidence for feedback by calcium permeating the light-sensitive channels. Proc. R. Soc. Lond. B. 245, 203-210 (1991).
- Ranganathan, R., Harris, G. L., Stevens, C. F., Zuker, C. S. A Drosophila mutant defective in extracellular calcium- dependent photoreceptor deactivation and rapid desensitization. Nature. 354, 230-232 (1991).
- Martin, J. H., Benzer, S., Rudnicka, M., Miller, C. A. Calphotin: a Drosophila photoreceptor cell calcium-binding protein. Proc. Natl. Acad. Sci. U.S.A. 90 (4), 1531-1535 (1993).
- Weiss, S., et al. Compartmentalization and Ca2+ buffering are essential for prevention of light-induced retinal degeneration. J Neurosci. 32 (42), 14696-14708 (2012).
- Wang, T., et al. Light activation, adaptation, and cell survival functions of the Na + /Ca 2+ exchanger CalX. Neuron. 45 (3), 367-378 (2005).
- Weckstrom, M., Hardie, R. C., Laughlin, S. B. Voltage-activated potassium channels in blowfly photoreceptors and their role in light adaptation. J. Physiol. Lond. 440, (1991).
- Frolov, R. V., Immonen, E. V., Weckström, M. Performance of blue- and green-sensitive photoreceptors of the cricket Gryllus bimaculatus. J Comp Physiol A Neuroethol Sens Neural Behav Physiol. 200 (3), 209-219 (2014).
- Nasi, E. Whole-cell clamp of dissociated photoreceptors from the eye of Lima scabra. J Gen Physiol. 97 (1), 35-54 (1991).
- Nasi, E., Gomez, M. P. Light-activated ion channels in solitary photoreceptors of the scallop Pecten irradians. J. Gen. Physiol. 99, 747-769 (1992).
- Hardie, R. C., Peretz, A., Pollock, J. A., Minke, B. Ca 2+ limits the development of the light response in Drosophila photoreceptors. Proc. R. Soc. Lond. B. Biol. Sci. 252, 223-229 (1993).
- Kohn, E., et al. Functional Cooperation between the IP3 Receptor and Phospholipase C Secures the High Sensitivity to Light of Drosophila Photoreceptors In Vivo. J Neurosci. 35 (6), 2530-2546 (2015).
- Hevers, W., Hardie, R. C. Serotonin modulates the voltage dependence of delayed rectifier and Shaker potassium channels in Drosophila photoreceptors. Neuron. 14 (4), 845-856 (1995).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Henderson, S. R., Reuss, H., Hardie, R. C. Single photon responses in Drosophila photoreceptors and their regulation by Ca 2. J. Physiol. Lond. 524 (Pt 1), 179-194 (2000).
- Scott, K., Zuker, C. S. Assembly of the Drosophila phototransduction cascade into a signalling complex shapes elementary responses. Nature. 395 (6704), 805-808 (1998).
- Elia, N., Frechter, S., Gedi, Y., Minke, B., Selinger, Z. Excess of G betae over G qalphae in vivo prevents dark, spontaneous activity of Drosophila photoreceptors. J. Cell Biol. 171 (3), 517-526 (2005).
- Katz, B., Minke, B. Phospholipase C-Mediated Suppression of Dark Noise Enables Single-Photon Detection in Drosophila Photoreceptors. J. Neurosci. 32 (8), 2722-2733 (2012).
- Hardie, R. C., et al. Molecular basis of amplification in Drosophila phototransduction. Roles for G protein, phospholipase C, and diacylglycerol kinase. Neuron. 36 (4), 689-701 (2002).
- Reuss, H., Mojet, M. H., Chyb, S., Hardie, R. C. In vivo analysis of the Drosophila light-sensitive channels, TRP and TRPL. Neuron. 19, 1249-1259 (1997).
- Liu, C. H., et al. In vivo identification and manipulation of the Ca 2+ selectivity filter in the Drosophila transient receptor potential channel. J. Neurosci. 27 (3), 604-615 (2007).
- Ahmad, S. T., Natochin, M., Barren, B., Artemyev, N. O., O'Tousa, J. E. Heterologous expression of bovine rhodopsin in Drosophila photoreceptor cells. Invest Ophthalmol Vis Sci. 47 (9), 3722-3728 (2006).
- Scott, K., Sun, Y., Beckingham, K., Zuker, C. S. Calmodulin regulation of Drosophila light-activated channels and receptor function mediates termination of the light response in vivo. Cell. 91 (3), 375-383 (1997).
- Liu, C. H., et al. Ca 2+ -dependent metarhodopsin inactivation mediated by calmodulin and NINAC myosin III. Neuron. 59 (5), 778-789 (2008).
- Cook, B., et al. Phospholipase C and termination of G-protein-mediated signalling in vivo. Nat. Cell Biol. 2 (5), 296-301 (2000).
- Hardie, R. C., Franze, K. Photomechanical responses in Drosophila photoreceptors. Science. 338 (6104), 260-263 (2012).
- Huang, J., et al. Activation of TRP channels by protons and phosphoinositide depletion in Drosophila photoreceptors. Curr. Biol. 20 (3), 189-197 (2010).
- Minke, B., Wu, C. F., Pak, W. L. Isolation of light-induce response of the central retinular cells from the electroretinogram of Drosophila. J. Comp. Physiol. 98, 345-355 (1975).
- Hardie, R. C., Minke, B. The trp gene is essential for a light-activated Ca2+ channel in Drosophila photoreceptors. Neuron. 8, 643-651 (1992).
- Niemeyer, B. A., Suzuki, E., Scott, K., Jalink, K., Zuker, C. S. The Drosophila light-activated conductance is composed of the two channels TRP and TRPL. Cell. 85 (5), 651-659 (1996).
- Huber, A., et al. The transient receptor potential protein (Trp), a putative store- operated Ca 2+ channel essential for phosphoinositide-mediated photoreception, forms a signaling complex with NorpA, InaC and InaD. EMBO J. 15 (24), 7036-7045 (1996).
- Shieh, B. H., Niemeyer, B. A novel protein encoded by the InaD gene regulates recovery of visual transduction in Drosophila. Neuron. 14 (1), 201-210 (1995).
- Tsunoda, S., et al. A multivalent PDZ-domain protein assembles signalling complexes in a G-protein-coupled cascade. Nature. 388 (6639), 243-249 (1997).
- Tsacopoulos, M., Veuthey, A. L., Saravelos, S. G., Perrottet, P., Tsoupras, G. Glial cells transform glucose to alanine, which fuels the neurons in the honeybee retina. J. Neurosci. 14 (3 Pt 1), 1339-1351 (1994).
- Hardie, R. C., Minke, B. Spontaneous activation of light-sensitive channels in Drosophila photoreceptors. J. Gen. Physiol. 103, 389-407 (1994).
- Agam, K., et al. Metabolic stress reversibly activates the Drosophila light-sensitive channels TRP and TRPL in vivo. J Neurosci. 20 (15), 5748-5755 (2000).
- Agam, K., Frechter, S., Minke, B. Activation of the Drosophila TRP and TRPL channels requires both Ca2+ and protein dephosphorylation. Cell Calcium. 35 (2), 87-105 (2004).
- Delgado, R., Muñoz, Y., Peña-Cortés, H., Giavalisco, P., Bacigalupo, J. Diacylglycerol activates the light-dependent channel TRP in the photosensitive microvilli of Drosophila melanogaster photoreceptors. J Neurosci. 34 (19), 6679-6686 (2014).
- Parnas, M., Katz, B., Minke, B. Open channel block by Ca2+ underlies the voltage dependence of Drosophila TRPL channel. J. Gen. Physiol. 129 (1), 17-28 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır