Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Kardiyak Kas Hücresine Dayalı Aktüatör ve Kendiliğinden Sertleşen Biorobot - Bölüm 2
Bu Makalede
Özet
Bu çalışmada, biyolojik bir aktüatör ve fonksiyonelleştirilmiş elastomerik konsol kollarıyla birlikte kendinden stabilize olan yüzme biorobotuna kardiyomiyositler ekildi, kültürlendi ve biyokimyasal ve biyomekanik özellikleri zamanla karakterize edildi.
Özet
Son yıllarda, sentetik bir mekanik omurga ile entegre edilmiş canlı bir hücreden veya doku bileşeninden oluşan hibrid cihazlar geliştirildi. Biorobotlar adı verilen bu cihazlar, yalnızca yaşayan bileşenin kontraktil aktivitesinden üretilen kuvvetle güçlendirilir ve birçok içsel avantajlarından dolayı geleneksel tam yapay robotlara bir alternatif olabilir. Burada, biyolojik aktüatörü ve bu iki parçalı makalenin ilk bölümünde tasarlanmış, imal edilmiş ve işlevselleştirilen bir biorobot'u tohumlamak ve karakterize etmek için yöntemleri açıklıyoruz. Bir polidimetilsiloksan (PDMS) tabanı ve bir ince film konsolundan müteşekkil biyolojik harekete geçirici ve biorobot cihazlar fibronektin ile hücre bağlantısı için işlevselleştirildi. Fonksiyonelleştirmeden sonra, neonatal sıçan kardiyomiyositleri PDMS konsol koluna yüksek yoğunlukta tohumlandı ve konfluent bir hücre tabakası elde edildi. Cihazlar her gün görüntülendi ve kantinin hareketiKol kolları analiz edildi. Tohumlamadan sonraki ikinci günde, spontan kasılmalar sırasında hücrelerin uyguladığı kuvvetler nedeniyle konsol kollarının bükülmesini gözledik. Konsol bükülmesinin niceliksel analizi üzerine, hücrelerin zaman içinde olgunlaştıkça uyguladığı yüzey gerilmesinde kademeli bir artış gözlenmiştir. Aynı şekilde, bir kanatçık rolündeki PDMS konsol kolunun harekete geçirilmesinden dolayı biorobotun hareketini gözlemledik. Cihazların yüzme profillerinin nicelenmesi üzerine, fin'in dinlenme açısı tarafından etkilenen çeşitli tahrik modları gözlemlendi. Hareket yönü ve dayak frekansı da yüzgeçin dinlenme açısı ile belirlendi ve 142 μm / sn maksimum yüzme hızı gözlendi. Bu yazıda, fabrikasyon cihazları kardiyomiyositlerle doldurmanın yanı sıra biyolojik harekete geçiricinin ve biorobot aktivitesinin değerlendirilmesi için prosedürü açıklıyoruz.
Giriş
Biorobotlar, canlı hücrelere dayanan, genellikle PDMS ya da hidrojel 1 gibi yumuşak, elastik malzemelerden oluşan mekanik omurgaya dahil edilen cihazlardır. Hücreler, spontan olarak veya uyarılara yanıt olarak ritmik kasılmalara girerler ve böylece bir aktüatör olarak işlev görürler. Hücrenin kasılmasından elde edilen güç çeşitli biorobotları yönlendirir. Memeli kalp hücreleri (kardiyomiyosit) ve iskelet kası hücreleri biorobot hareketi için sıklıkla kontraktil özelliklerinden dolayı kullanılır. Kardiyomiyosit ve iskelet kası hücrelerinin yanı sıra, böcek kas dokuları 2 ve eksplante edilen kas dokuları 3 gibi diğer hücre tipleri de kullanılmıştır. Böcek kas dokuları oda sıcaklığında biyolojik aktüatörlerin çalışmasını sağlar.
Bir biorobotun işlevi ve performansı, biyolojik aktüatörün gücü ve tutarlılığı ile belirlenir ( örn.. Kas hücreleri) mekanik omurga yapısı öncelikle hareket, kararlılık ve güç mekanizmalarını belirler. Bu cihazlar yalnızca hücreler tarafından üretilen kuvvetler tarafından yönlendirildiğinden kimyasal kirleticiler veya çalışma sesleri yoktur. Bu nedenle, diğer klasik robotlara enerji açısından verimli bir alternatif oluşturuyorlar. Çeşitli literatür kaynakları, canlı hücreleri ve dokuları biorobotlara entegre etmenin farklı yöntemlerini tartıştılar 1 , 4 , 5 . Mikrofabrikasyon ve doku mühendisliği tekniklerindeki ilerlemeler, yürüyebilir, tutabilir, yüzebilir veya pompalayabilen biorobotların gelişimini sağlamıştır 5,6 . Genel olarak, hücreler, konfluent bir hücre tabakası olarak mekanik (polimerik) omurgaya doğrudan doğruya kültürlenirler veya halkalar ve şeritler gibi iskele içinde 3 boyutlu tahrik yapılarına kalıplanırlar. Çoğunlukla, biorobotlarKardiyomiyosit plakaları 6 , 7 kullanılarak imal edilmiş olup, bu hücreler, harici uyaranlar olmadan kendiliğinden kasılma sergileme kabiliyetine sahiptir. Öte yandan, iskelet kası hücre yapraklarına ilişkin raporlar , membranın depolarizasyonunu başlatmak için in vitro kontraksiyonları başlatma uyaranlara ihtiyaç duymaları nedeniyle sınırlıdır 8 .
Bu protokol, ilk olarak, ince bir PDMS konsolundan yapılmış, işlevselleştirilmiş bir biyolojik harekete geçiriciye kardiyomiyositlerin nasıl tohumlandıracağını açıklar. Daha sonra, yüzme profillerinin ekimi ve analizini detaylı olarak anlatıyor. Konsol, fibronektin gibi bir hücre yapışkan proteini ile işlevselleştirilir ve kardiyomiyositlerle konfluent olarak tohumlanır. Cihazlar sözleşmede tohumlanan hücrelerle konsolun bükülmesine ve böylece bir aktüatör olarak görev yapmasına neden olurlar. Zamanla, hücreler olgunlaştıkça cihazdaki videoları analiz ederek cihazdaki yüzey gerilimindeki değişiklikleri izledik.Konsol bükme. Burada geliştirilen biyolojik harekete geçirici, farklılaşmaya maruz kaldıkça fibroblastlar veya uyarılmış pluripotent kök hücreler gibi herhangi bir hücre türünün kontraktil özelliklerini belirlemek için kullanılabilir.
Daha önceki biorobots araştırmalarının çoğu, biyolojik aktüatörler geliştirmeye odaklanmışken, biorobot mimarisinin ve işlevsel yeteneklerin optimizasyonu büyük oranda ihmal edilmiştir. Son zamanlarda, doğadan esinlenen biorobotlarda yüzme modlarının uygulanmasını gösteren birkaç çalışma yapılmıştır. Örneğin, 6 nolu bayrak kökenli hareketli yüzme biorobotları, denizanması tahriki 9 ve biyo-hibrid ışınları 4 tasarlandı. Edebiyattaki diğer eserlerden farklı olarak burada kendinden dengelenen bir yapı oluşturmak için mekanik omurga özelliklerini değiştirmeye odaklanıyoruz. Bu çalışmada geliştirilen biorobot, sabit bir adım, rulo ve bulma yeteneğine sahiptirYüzen dalgalanma derinliği. Bu parametreler, her temel bileşiğin kalınlığının değiştirilmesi ile değiştirilebilir. PDMS aktüatörünün, dalgıç biorobotun ve cihazın işlevselleştirilmesinin geliştirilmesinde kullanılan üretim adımları, bu iki bölümlü makalenin 1. Bölümünde ve son çalışmalarımızda detaylı olarak anlatılmıştır. 7. Burada geliştirilen teknik, Kargo teslimatı gibi çeşitli uygulamalar için yeni, yüksek verimli biorobotların geliştirilmesi için bir yol.
Bu çalışmada izlenen yalıtım süreci, daha önceki bir çalışmada 10 ve yakın zamanda yayınlanan çalışmada 7 benzer şekilde anlatılmıştır. PDMS aktüatörlerini ve biorobot cihazlarını imal etmek için kullanılan mikrofabrikasyon yöntemleri, bu iki bölümlü el yazmasının 1. Kısmı'nda ayrıntılı olarak açıklanmıştır. Bu yazının protokol bölümü, kardiyomiyositlerin, üretilen PDMS a üzerine ekilmesi aşamalarını veCtuator ve biorobot, hücre yapışkan proteinlerle işlevselleştikten sonra.
Protokol
Burada açıklanan tüm prosedürler, onaylanmış bir protokol kullanılarak ve Notre Dame Üniversitesi Kurumsal Hayvan Bakımı ve Kullanım Komitesi düzenlemelerine uygun olarak gerçekleştirilmiştir.
1. Hücre Tohumculuğu ve Kültürü
- Başlamadan önce gerekli öğeleri hazırlayın: küçük bir huni, pipetler ve% 10 Fetal Sığır Serumu (FBS) ve% 1 penisilin antibiyotiği (DMEM tamamlanmış) ile takviye edilmiş sıcak Dulbecco Modifiye Kartal Ortamı (DMEM).
- Içinde T-25 şişeleri işlevselleştirilmiş cihaz (biyolojik aktüatör veya biorobot) ile birlikte alın. Aygıt hazırlama, işlevselleştirme ve hücre ekiminden önce depolamayla ilgili ayrıntılar için bu iki bölümlü elyazmasının 1. Bölümünün 4. Bölümüne bakın.
- Küçük, kare plastik bir levha yuvarlayarak yapılabilecek bir huniyi hazırlayın. T-25 şişesinin içindeki biyolojik harekete geçiriciye veya biyolojik botun üzerine yerleştirin. Cihazın tamamına uyacak şekilde geniş uç çapını ayarlayınVe yükseklik, böylece şişenin üstü sıkıldığı zaman rahatça uyması için.
- Biorobotlar için, tohumlama işlemi boyunca cihazı şişeyi altta tutmak için bir mıknatıs kullanın.
Not: Burada, tek bir neodimyum diskli mıknatıs (çap olarak 1.26 ") kullanılmıştır, ancak biorobot'u manyetik nikel-PDMS bileşik tabanı ile tutmak için benzer boyut ve mukavemete sahip herhangi bir mıknatıs kullanılabilir. - En az 30 dakika önce plastik tabletin UV sterilizasyonu.
- Biorobotlar için, tohumlama işlemi boyunca cihazı şişeyi altta tutmak için bir mıknatıs kullanın.
- Huninin tabanı ile balon arasında büyük bir boşluk olmadığından emin olun.
- 1.6 x 10 7 hücre / mL'lik bir yoğunluğa sahip olan DMEM'de kardiyomiyositleri tekrar süspansiyon haline getirin ve huniden cihazı yavaşça süspansiyon 400 μL bırakın. Elde edilen hücre sayısını belirlemek için bir hemocytometer veya başka bir hücre sayacı kullanın.
- Cihazı ve huniyi zahmetsizce yavaş yavaş inkübatöre taşıyınhin. 37 ° C'de 24 saat kültür.
- Kuluçka döneminden sonra yavaşça huniyi çıkarın, numuneyi yavaşça PBS ile yıkayın ve balona tam 10 mL taze DMEM ile tekrar doldurun.
Not: Biorobotlar için mıknatısı çıkarın, böylece cihaz yüzer hale gelir.
2. Biyokimyasal Karakterizasyon
- Kalsiyum akı deneyi
Not: Kalsiyum akı tahlili, hücre bağlantısızlığını değerlendirmek için yapılır. Hücrelerin flüoresan, kalsiyum iyonuna özgü boya ile yüklenmesi prosedürü, önceden kurulmuş bir protokol 11'de tarif edilen işlemi takip eder.- Önce gerekli malzemeleri, kalsiyum fluo-4-asetometil (AM) esteri, noniyonik sürfaktan poliolünü ( Malzeme Tablosuna bakınız ) ve Tyrode tuz çözeltisini hazırlayın .
- Cihazı kullanarak, uzun cımbız kullanarak, kültür şişesinden yavaşça, 2 mL Tyrode tuz solüsyonu ile 35 mm'lik bir Petri kabına aktarın siyon.
- Ayrı bir santrifüj tüpünde, 1 mL sıcak Tyrode solüsyonu (37 ° C'ye kadar ısıtıldı) ve 3-5 μL stok kalsiyum fluo-4 AM boyası (çalışma konsantrasyonu: 3-5 uM) ve iyonik olmayan yüzey aktif maddenin eşit bir parçası ekleyin Poliol (çalışma konsantrasyonu:% 0.2). Örnek solüsyonu, kalsiyum indikatör boya, fluo-4 ve% 0.2 noniyonik sürfaktan ile takviye edilmiş sıcak Tyrode solüsyonu ile değiştirin. 37 ° C'de 25-30 dakika inkübe edin.
- Boya çözeltisini çıkarın ve numuneyi taze Tyrode çözeltisiyle hafifçe yıkayın. Görüntülemeden önce numuneyi 37 ° C'de 30 dakika daha tamamlamak için 2 mL'lik yeni DMEM'de tekrar inkübe edin.
Not: Bu tahlilin sonuçları ve ilgili video daha önce yayınlanan çalışmada sunulmuştur.
- İmmünoflöresan
Not: Bütün numunelerin çift immün boyanması, önceden kurulmuş protokol> 12.- İlk olarak, dihidrojen,% 0.1 hücre lize deterjan (bakınız Malzeme Tablosu ), fosfat tamponlu salin solüsyonu (PBS),% 4 paraformaldehid (PFA), PBS, birincil antikorlar (anti (Monoklonal antikor kardiyak troponin-1 ve anti-tavşan monoklonal antikor conneksinler-43), ikincil antikorlar (Alexa 594 konjuge ve keçi anti-fare IgG (H + L) Alexa 488 konjugatı) ve DAPI.
Dikkat: Paraformaldehit kanserojeniktir. - Şişeden ilgi örnek çıkarın ve hafifçe PBS ile iki kez yıkayın. Numunenin hazırlanması ve işlevselleştirilmesi ile ilgili ayrıntılar için bu iki bölümlü elyazmasının 1. Bölümünün 4. bölümüne bakınız.
- Küçük bir lamel üzerine bir damlacık PBS ekleyin (çap: 12 mm veya 15 mm). Cihazın tabanını cımbızla hafifçe tutun ve ince PDMS kollarını (konsol, Resim 1 ), başın üst kısmına bağlandığı ucundan makas kullanarak kesine. Konsol kollarını hücrelere yapışmış taraf yukarı gelecek şekilde damlacık üzerine aktarın. PBS damlası hücrelerin kurumasını engeller.
- Örnekleri% 4'lük PFA ile düzeltin ve daha önce tarif edildiği gibi numunelerin çiftli immün boyası gerçekleştirin 12 .
- Bağışıklık sonrası, örnekleri temizleme öncesi bir anti-solmaya karşı reaktif ile slayt üzerine monte edin ve karanlıkta 24 saat süreyle sakin bir yere koyun.
- İşlemi tüm numuneler için tekrarlayın.
Not: Bu tahlilin sonuçları ve ilgili görüntüler, daha önce yayınlanan çalışmada ayrıntılı bir şekilde tartışılmıştır.
- İlk olarak, dihidrojen,% 0.1 hücre lize deterjan (bakınız Malzeme Tablosu ), fosfat tamponlu salin solüsyonu (PBS),% 4 paraformaldehid (PFA), PBS, birincil antikorlar (anti (Monoklonal antikor kardiyak troponin-1 ve anti-tavşan monoklonal antikor conneksinler-43), ikincil antikorlar (Alexa 594 konjuge ve keçi anti-fare IgG (H + L) Alexa 488 konjugatı) ve DAPI.
3. Görüntüleme
- T-25 şişesi bir CO2 inkübatörüne dik yerleştirin ve kuluçka makinesi içinde görüntüleme sistemini hazırlayın. Cihazı, bir zoom lensiyle (bkz . Malzeme Tablosu ) bir fotoğraf makinesi kullanarak kaydedin (bkz . Malzeme Tablosu ). Bir ışık kaynağı için,Bir dizi LED ışığı kullanın.
Not: Burada bir beyaz ışıklı LED şeridi kullanılmıştır, ancak normal LED'ler de çalışacaktır. - Kamerayı bir işletim sistemine bağlayın ve kameraya özgü yazılımı açın (bkz . Malzeme Tablosu ). Tüm kamera seçeneklerini açmak için üst paneldeki "Dosya" sekmesinin altındaki kamera görüntüsünü tıklayın ve doğru kamerayı seçin.
- Yazılımdaki üst paneldeki sekmeler listesinden "canlı" seçeneğini seçin.
- Mercek kadranını ayarlayarak görüntüyü odak haline getirin. Üst panelde "Cazibe alanına kırpma (ROI)" nı seçin. Ardından, ROI'yi işaretlemek için biyolojik aktuatör cihazını ve konsol kollarını kapatarak video çerçevesine elle bir dikdörtgen çizin.
Not: Uygun ROI seçimi, görüntü dosyalarının boyutunu en aza indirir.- Biorobotlar durumunda, cihazın yüzme hareketini kaydetmek için tüm ekranı yakalayın.
NOT: Biorobotlar için bir ROI çizmeye gerek yoktur
- Biorobotlar durumunda, cihazın yüzme hareketini kaydetmek için tüm ekranı yakalayın.
- Kayda başlamadan önce, ekrandaki üst paneldeki sekmelerden birinde "Kamera Ayarları" nı seçin. Canlı görüntünün pozlama ve piksel oranını her biri için çubuğu kaydırarak veya değerleri manuel olarak girerek ayarlayarak kare hızını ayarlayın. Kare hızlarını yaklaşık 30 ± 2 fps olarak ayarlayın.
Not: Pozlama ve piksel oranının değiştirilmesi, canlı görüntünün parlaklığını ve kontrastını değiştirir. - Aktüatörlerin videolarını 1.000 x 1.000 piksel çözünürlükle tam 30 saniyeye kadar kaydetmeye başlamak için yazılımın üst panelindeki "Kayıt" düğmesine tıklayın. İşlemi tüm numuneler için tekrarlayın.
4. Biyolojik Aktüatörlerin Sabit Bir Tabanda Görüntü Analizi
- Özel betiği çalıştıran bir programlama yazılımı ( örn. Matlab) kullanarak görüntüleri analiz edin. Malzeme Tablosu'na bakın ve Ek Dosya'ya bakınız.
Not: Komut, kaydedilen videoların her karesini görüntüler, görüntü üzerine konsolun noktalarının koordinasyonunu kaydetmek için kullanıcının fare girişini alır, giriş noktalarını en aza indirgeyen çember boyunca geçen çemberin çapını ve merkezini hesaplar ve Girilen ve hesaplanan verilerin tümünü daha ileri bir kullanım için dışa aktarır.- Simgeyi tıklayarak programlama yazılımını açın. Üstteki menü çubuğundan "Dosya" -> "Aç" ı tıklayın ve görüntü analizi için .m komut dosyasını seçin. Kaydedilmiş TIFF görüntülerinin .m dosyasıyla aynı klasöre konduğundan emin olun. Komut dosyasını çalıştırmak için "Çalıştır" ı tıklayın.
Not: Değişiklik yapmak için etkileşimli bir ekran açılır. - Gerçek programı başlatmak için "oynat" a basın. "Aç" düğmesini tıklayın ve analiz edilecek TIFF dosyasını bulun.
- "Taban ve #34; Düğmesini tıklayın ve konsolun üstteki tabana bağlandığı noktayı tıklatın; Girmek vurmak. Bu, konsol tabanının yerini belirtecek şekilde her çerçeveye görüntü üzerine bir kare işaret koyacaktır.
- "Ölçek" düğmesini tıklayın ve cam boncuğun bir kenarını manuel olarak tıklayın. Fare işaretçisini cam boncuğun karşı tarafına getirin ve "Enter" tuşuna basın.
Not: Bu, cam boncuk çapını ölçen bir çizgi çizmelidir. Cam boncuk çapı 3 mm olduğundan gösterilen piksele 3 mm iliĢkilidir. - "Analiz et" düğmesini tıklayın. Konsol boyunca konsol tabanını temsil eden ilk kare işaretçiden kısa bir mesafede tıklayın.
- "Analiz et" düğmesini tıklayın. Daha sonra, konsol dayanağı konsanını temsil eden ilk kare işaretleyiciden kısa bir mesafede tıklayın. Uç dahil olmak üzere konsol boyunca ilerlemeye devam edin veyapılır. Bu, konsol üzerine tıklanan her noktaya "x" yerleştirir.
Not: Kare işaretin koordinasyonuna ve x işaretlerine dayalı olarak, bir dairenin merkezi ve çapı, en küçük karelerle uydurma fonksiyonu kullanılarak hesaplanır (kullanılan betiğe ekli ek dosyaya bakınız). X işaretlerini ve kare imalatçısını geçen daire, görüntüye otomatik olarak üst üste bindirilir. - Üst üste yerleştirilmiş dairenin konsol profilini doğru şekilde izleyip girmediğini kontrol edin.
Not: Konsol çok düz olduğunda, konsol profilinin doğru şekilde çizilip gösterilmediğini değerlendirmek zordur. Şekil 3'e başvurun. - "Sonraki çerçeve" düğmesini tıklayın. Bu, TIFF dosyasındaki bir sonraki kareye geçecektir. Taban ve ölçek bir önceki adımda zaten ayarlanmış.
- TIFF dosyasındaki tüm kareler tamamlanıncaya kadar 4.1.5 ile 4.1.7 arasındaki adımları tekrarlayın. Tüm çerçeveler işlemden geçirildiğindeShed, "Dışa Aktar" düğmesini tıklayın.
Not: Bu, analiz edilen konsolun TIFF dosya adıyla bir elektronik tablo dosyası oluşturacaktır. Dosya adını, konsolun hangi tarafının (sol veya sağ) analiz edildiğini de içerecek şekilde düzenleyin.
- Simgeyi tıklayarak programlama yazılımını açın. Üstteki menü çubuğundan "Dosya" -> "Aç" ı tıklayın ve görüntü analizi için .m komut dosyasını seçin. Kaydedilmiş TIFF görüntülerinin .m dosyasıyla aynı klasöre konduğundan emin olun. Komut dosyasını çalıştırmak için "Çalıştır" ı tıklayın.
- Elektronik tablodaki stres hesaplama.
- Kontak üzerindeki yüzey gerilimi "σ" hesaplamak için aşağıdaki denklemi kullanın:
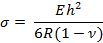
Burada E, R, v ve h, Young modülü, eğrilik yarıçapı, Poisson oranı ve konsol kalınlığıdır.
Not: Konsolun kalınlığı hassasiyeti değiştirmek için değiştirilebilir. Bu çalışmada, değerler aşağıdaki gibidir: E = 750 kPa, v = 0.49 ve h = 25 μm 13 , 14 . - Adım 4.2.1'deki denklemi kullanarak yüzey gerilimi hesaplayın. Aç .Xls elektronik tablo dosyası. Çıktının, önce tabanın ve dairenin x ve y koordinatlarını, daha sonra eğrilik yarıçapını gösteren birden çok sütun bulunduğuna dikkat edin. Bunlara dayalı olarak tıklanan her bir noktanın x ve y koordinatlarını hesaplayın.
Not: Zaman atlamalı görüntü çerçeveleri üzerindeki gerilmeleri çizmek, konsol üzerindeki kuvvetin zaman içindeki değişimlerini gösterir. Çukurluklar, kardiyomiyositlerin gevşetilmesi sırasında konsoldaki stresi veya hücrenin çekiş kuvvetleri nedeniyle konsol üzerinde uygulanan statik gerilimi göstermektedir. Doruklar, kardiyomiyositlerin dövülmesiyle uygulanan konsol üzerindeki dinamik strese işaret eder. Bu değer, kardiyomiyositlerin kasılmasıyla oluşturulan maksimum kuvvet miktarına karşılık gelir.
- Kontak üzerindeki yüzey gerilimi "σ" hesaplamak için aşağıdaki denklemi kullanın:
5. Yüzme Biorobotlarının Analizi
- Görüntü analiz yazılımını kullanarak biorobotun konumunu kaydedin.
Not: Kullanılan yazılımın Malzemeler listesine bakınız.Bölümdür.- Görüntü analiz yazılımını açın ( örn., ImageJ). "Dosya" ve "Aç" a basın ve yüzme biorobot video dosyasını seçin. "Tamam" ı tıklayın ve programın dosyayı yüklemesine izin verin. Elektronik tablo yazılımını açın.
- Yüklenen biorobot videoda, bilinen boyutların bir referansını bulun ( örneğin, biyolojik aktüatöre gömülü olan 3 mm çaplı cam boncuk).
Not: Boyut bilen herhangi bir nesne işe yarayacaktır. Bu, her video için piksel ile boy oranları belirleyecektir. - Cam boncukta bir çizgi çizmek için "Düz" aracını kullanın. "Analiz Et" i tıklayın ve "Ölçek ayarlayın" ı seçin. "Bilinen mesafe" alanını "3000 μm" olarak ayarlayın ve "Tamam" ı tıklayın.
Not: Bu, x ve y koordinatlarını mikrometreye ayarlar. - Cihaz üzerinde, işaretleyici olarak hareket etmesi için çerçeveler arasında dalgalanmayan bir nokta seçin.
Not:Tabanın bir köşesini seçmeniz önerilir. - İlk karede 5.1.4'te seçilen noktaya gelin. Elektronik tablodaki x ve y koordinatlarını kaydedin.
- Görüntü analiz yazılımı penceresine geri dönün ve bir sonraki kareye geçmek için sağ ok tuşuna basın. İşaretçiye tekrar gelin (adım 5.1.4'ten) ve elektronik tabloda x ve y koordinatlarını kaydedin.
- Tüm kareler için 5.1.6. Adımı tekrarlayın.
- Koordinatların elektronik tablosunu kullanarak biorobotun yüzme parametrelerini hesaplayın 7 .
- Her bir videonun bilinen kare hızından çerçeveler arasındaki periyodu hesaplayın.
- Toplam mesafe de dahil olmak üzere taşınan mesafeyi bulmak için çerçeveler arasındaki x ve y koordinatlarındaki değişikliği hesaplayın.
- Y ekseni boyunca maksimum değişimden gelen daralma genliğini hesaplayın. İki kasılma arasındaki periyodun tersinden her biorobot için vurma frekansını belirleyin.
- CX yönünde hareket eden toplam zaman ve mesafeden her cihazın yüzme hızını hesaplayın.
- Analiz edilen her biorobot video için 5. adım tekrarlanır.
- Ölçülen her parametreyi normalize edin.
Not: Farklılıkları daha iyi görselleştirmek için tüm değerleri normalleştirin. Bu protokol, düşük frekanslı kasılmaları olan yatay mod biorobot (yatay LF) ile ilgili normalleşmeyi göstermektedir ( Şekil 4 ).
6. Protein İfadesinin Analizi
Not: Adım 2.2.4 ve 2.2.5'de hazırlanan monte edilmiş numuneler konfokal mikroskop kullanılarak görüntülendi. Görüntüler aynı anda üç kanalda 20X, 40X ve 60X büyütme ile elde edildi: 460 nm, 488 nm ve 594 nm. 40X büyütmede, her örnek için farklı konumlardan 5 resim kümesi yakalandı ve her kanal bir birey olarak kaydedildi .TIFFdosya. Pozlama ayarı, kullanılan objektifin büyütülmesi ile belirlendi ve bu büyütmede tüm görüntüler için sabit olarak ayarlandı.
- Görüntü analiz yazılımını açın ve resimleri yüklemek için "Dosya" -> "Aç" ı seçin.
- ROI'yi işaretlemek için görüntü çerçevesine dikdörtgen bir çokgen çizin. Ortalama flöresan yoğunluğunu ölçmek için "Analiz Et" -> "Ölçme" yi seçin.
- Tüm numunelerden yoğunluk ölçümleri toplamak için adım 6.2'yi tekrarlayın ve her durum için ilgili ortalama yoğunluğu hesaplayın.
Not: Burada, farklı bir koşul, gün 1, gün 2 ve gün 6'daki gibi farklı zaman noktalarını belirtir. - Sonuçları daha istatistiksel analizler ve veri arsaları üretimi için bir elektronik tabloya aktarın.
Sonuçlar
Şekil 1'deki cihazların şematik ve ekran görüntüsünde gösterildiği gibi, ince bir PDMS konsoldan (kalınlık 25 μm) ve kardiyomiyositlerden yapılmış biyolojik harekete geçirici, yüzme biorobotunun çekirdeğini oluşturur. Hücreler kültürde 24 saat sonra kasılmalara başlamış ve konsol kollarının bükülmesi 2. günde gözlemlenmiştir. Cihazın yan profili her gün kaydedilmiştir ve yüzey gerilimi konsol kollarının bükülmesinden Özelleştirilmiş görü...
Tartışmalar
Burada özetlenen prosedür, kardiyomiyositlerin bağlanmasını kolaylaştıran, PDMS tabanlı aktüatörler ve biorobotlar için başarılı bir ekim yöntemini anlatmaktadır. Dahası, görüntü elde etme süreci ve hücrelerin davranışını karakterize eden daha sonraki analizler ve cihazların performansı anlatılmıştır.
24 saat sonra konsol kollarında spontan kontraksiyon hücreleri gözlemledik; Kasılmaların yoğunluğu zamanla istikrarlı bir şekilde artmaya devam etti ve ...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
MT Holley, Regents Louisiana Board of Graduate Fellows programı tarafından desteklenmektedir ve C. Danielson, Howard Hughes Tıp Enstitüsü Profesör Programı tarafından desteklenmektedir. Bu çalışma NSF Grant No: 1530884 tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Chemicals and reagents | |||
| Cardiomyocytes (primary cardiac cells) | Charles River | NA | Isolated from 2-day old neonatal Sprague Dawley rats |
| Dulbecco’s modified eagle’s media (DMEM) | Hyclone Laboratories | 16750-074 | with 4500 mg/L glucose, 4.0 mM L-glutamine, and 110 mg/L sodium pyruvate |
| Fetalclone III serum | Hyclone industries, GE | 16777-240 | Fetal bovin serum (FBS) |
| Dulbecco’s phosphate buffer (PBS) | Sigma-Aldrich | D1408-100ML | |
| Penicillin-G sodium salt | Sigma-Aldrich | P3032 | |
| Goat serum | Sigma-Aldrich | G9023 | |
| 4,6-diamidino-2-phenylindole dihydrocholride powder (DAPI) | Sigma-Aldrich | D9542 | |
| Fibronectin from bovine plasma | Sigma-Aldrich | F1141 | Solution (1 mg/ml) |
| Calcein-AM and ethidium homodimer-1 kit (Live/Dead Assay) | Molecular Probes | L3224 | |
| Calcium Fluo-4, AM | Molecular Probes | F14217 | calcium indicator dye |
| Tyrodes salt solution | Sigma-Aldrich | T2397 | buffer solution |
| Pluronic F-127 | Molecular Probes | P3000MP | nonionic surfactant-20 % solution in Dimethylsiloxane (DMSO) |
| 16% Parafomaldehyde | Electron microscopy | 15710 | Caution: Irritant and combustible |
| Triton x-100 | Sigma-Aldrich | X-100 100 mL | cell lyses detergent, (4-(1,1,3,3-Tetramethylbutyl)phenyl-polyethylene glycol, t-Octylphenoxypolyethoxyethanol, Polyethylene glycol tert-octylphenyl ether) |
| ProLong gold antifade reagent | Molecular Probes | P10144 | Mounting agent |
| Alexa Fluor 594 Phalloidin | Molecular Probes | A12381 | Actin filament marker |
| Goat anti-rabbit IgG (H+L) secondary antibody, Alexa Fluor 594 conjugate | Molecular Probes | A-11012 | |
| pha | Molecular Probes | A-11001 | |
| Anti-connexin 43 antibody | Abcam | ab11370 | Gap junction marker |
| Anti-cardiac troponin I antibody | Abcam | ab10231 | Contractile protein |
| 16% EM grade paraformaldehyde solution | Electron microscopy | 100503-916 | |
| Polydimethylsiloxane (PDMS) | Elsevier | Sylgard 184 | |
| Materials and Equipment | |||
| Camera | Thor Labs | DCC1545M | |
| LED light strip | NA | NA | Any white LED without spectrum emission |
| Confocal microscope | Nikkon C2 | NA | Confocal microscope with three filter set. |
| Zooming lens | Infinity | Model# 252120 | |
| Software | |||
| Matlab | Mathworks | NA | Used in Section 4) for biological actuator analysis. |
| Image J | National Institute of Health | NA | Java-based image processing software. Used in Section 5) for biorobot analysis. Free Image Processing and Analysis software in java. (https://imagej.nih.gov/ij/) |
| Thor Cam | Thor Labs | NA | Camera operating software |
Referanslar
- Feinberg, A. W. Biological Soft Robotics. Annu. Rev. Biomed. Eng. 17, 243-265 (2015).
- Akiyama, Y., et al. Room Temperature Operable Autonomously Moving Bio-Microrobot Powered by Insect Dorsal Vessel Tissue. PLOS ONE. 7, 38274 (2012).
- Herr, H., Dennis, R. G. A swimming robot actuated by living muscle tissue. J. NeuroEng Rehabil. 1, 6 (2004).
- Park, S., et al. Phototactic guidance of a tissue-engineered soft-robotic ray. Science. 353 (6295), 158-162 (2016).
- Cvetkovic, C., et al. Three-dimensionally printed biological machines powered by skeletal muscle. Proc. Natl. Acad. Sci. 111, 10125-10130 (2014).
- Williams, B. J., Anand, S. V., Rajagopalan, J., Saif, M. T. A. A self-propelled biohybrid swimmer at low Reynolds number. Nat. Commun. 5, (2014).
- Holley, M. T., Nagarajan, N., Danielson, C., Zorlutuna, P., Park, K. Development and characterization of muscle-based actuators for self-stabilizing swimming biorobots. Lab. Chip. 16, 3473-3484 (2016).
- Hopkins, P. M. Skeletal muscle physiology. Contin Educ Anaesth Crit Care Pain. 6, 1-6 (2006).
- Nawroth, J., et al. A tissue-engineered jellyfish with biomimetic propulsion. Nat Biotechnol. 30 (8), 729-797 (2012).
- Ehler, E., Moore-Morris, T., Lange, S. Isolation and Culture of Neonatal Mouse Cardiomyocytes. J. Vis. Exp. JoVE. (79), e50154 (2013).
- Bers, D. M. Calcium Fluxes Involved in Control of Cardiac Myocyte Contraction. Circ. Res. 87, 275-281 (2000).
- Shin, S. R., et al. Carbon-Nanotube-Embedded Hydrogel Sheets for Engineering Cardiac Constructs and Biological actuators. ACS Nano. 7, 2369-2380 (2013).
- Park, J., et al. Real-Time Measurement of the Contractile Forces of Self-Organized Cardiomyocytes on Hybrid Biopolymer Microcantilevers. Anal. Chem. 77, 6571-6580 (2005).
- Tamayo, J., et al. Quantification of the surface stress in microcantilever biosensors: revisiting Stoney's equation. Nanotechnology. 23, 475702 (2012).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nat. Methods. 10, 781-787 (2013).
- Louch, W. E., Sheehan, K. A., Wolska, B. M. Methods in Cardiomyocyte Isolation, Culture, and Gene Transfer. J. Mol. Cell. Cardiol. 51, 288-298 (2011).
- Alford, P. W., Feinberg, A. W., Sheehy, S. P., Parker, K. K. Biohybrid thin films for measuring contractility in engineered cardiovascular muscle. Biomaterials. 31, 3613-3621 (2010).
- Sfakiotakis, M., Lane, D. M., Davies, J. B. C. Review of fish swimming modes for aquatic locomotion. IEEE J. Ocean. Eng. 24, 237-252 (1999).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır