Method Article
Flaş-ve-Freeze: Elektron Mikroskobu ile Membran Dinamikler Yakalama Yeni Bir Tekniği
Bu Makalede
Özet
Biz msn zamansal çözünürlüğe sahip membran dinamiklerinin görüntülenmesini sağlayarak elektron mikroskobu, "flaş-and-donması" içinde yeni bir teknik geliştirdi. Bu teknik, yüksek basınçlı dondurma nöron Optogenetic uyarılmasını birleştirir. Burada, prosedürleri göstermek ve ayrıntılı protokolleri açıklar.
Özet
Hücreler sürekli zar mimarisini ve protein dağılımı değiştirmek, ancak sırasıyla ms ve nm sipariş üzerine zamansal ve uzamsal çözünürlükte bu olayları görselleştirmek için son derece zordur. Biz optogenetics ile hücresel olayları neden ve stimülasyon sonrasında belirli zaman aralıklarıyla hücrelerini dondurarak çıkan zar dinamiklerini görselleştiren bir zaman çözümlü elektron mikroskobu tekniği, "flaş-and-donması" geliştirdik. Bu teknik göstermek için, fare hipokampal nöronlar channelrhodopsin, ışığa duyarlı bir katyon kanalı olarak ifade edilmiştir. Bir ışık flaş nöronal etkinliği artırır ve sinaptik veziküllerin füzyon yoluyla sinaptik terminallerinden nörotransmitter salımını indükler. nöronların Optogenetic uyarılması sinaptik iletim sırasındaki morfolojik değişiklikleri takip etmek için yüksek basınçlı dondurma ile birleştirilir. Ticari bir enstrüman kullanarak, sinaptik veziküllerin füzyon ve Syna kurtarılmasını yakalananptic vezikül membranı. olaylar dizisi görselleştirmek için, büyük veri setleri üretilmiş ve morfolojik değişiklikler, zaman içinde farklı hücrelerde takip edildi çünkü, kör analiz edilmiştir. Bununla birlikte, flash ve dondurma msn zamansal çözünürlüğe sahip elektron mikrografiklerinde membran dinamikleri görselleştirme sağlar.
Giriş
bir hücre içinde membran ve protein dinamikleri görselleştirme belirli işlemlerin hücre biyolojisi anlama yolunda önemli bir adımdır. Dinamik trafik olayları açık veya floresan mikroskobu kullanarak yakalanabilir. Hücre alt yapıları tamamen boyalar veya floresan prob tarafından "boyalı" ve mekansal olarak çözümlenmiş ve spektral olarak 1, 2 edilemez Ancak, hücre altı bağlam büyük ölçüde bu tür görüntülerde eksik. elektron mikroskobu en ince ayrıntısına kadar hücre altı mimarisini tasvir edebilir ederken örnekler görüntüleme öncesi düzeltilmesi gerekir çünkü Öte yandan, bu, hücresel dinamiklerini yakalamak olamaz. Böylece, tamamen tek bir görüntüleme tarzı kullanılarak hücresel dinamiklerini anlamak için genellikle yeterli değildir.
ışık ve elektron mikroskobu sınırlamaları aşmak için, bağıntılı mikroskopi teknikleri geliştirilmiştir. Korelatif Işık ve Elektron Mikroskopi(CLEM) ışık mikroskopisi ve elektron mikroskopi ile altta yatan hücre içi yapıları kullanılarak hücre içi dinamikleri görselleştirir. Clem, bu tür sitokinez ve endositoz 3, 4, 5, 6 gibi çeşitli işlemlerle, yapan hücrelerin, canlı görüntülenmiş ve daha sonra, elektron mikroskopi için işlemden geçirilir. CLEM hücre içi dinamikleri bazı yönlerini yakalar, bu yaklaşımın faydasını sınırlamak dört faktör vardır. Min nedeniyle yavaş difüzyonu ve fiksatifler 7 reaksiyona - İlk olarak, zamansal çözünürlüğe hücreleri tipik s alır, immobilize edilebilir ne kadar hızlı ile sınırlıdır. İkinci olarak, hücre içi mimari görülmektedir post facto 8; Böylece, dinamik morfolojik değişiklikler bu yaklaşımı kullanılarak çekilen edilemez. Üçüncü olarak, floresans ve elektron mikrografları tam doku sh nedeniyle nmayabilirElektron mikroskobu 9, 10, örnek hazırlama sırasında dehidrasyon neden rinkage. Dördüncüsü, sitokinez ve endositoz gibi olaylar her hücrede 5, 11 aynı anda yer almayan ve bu nedenle, olayın yapan belirli bir hücre hücrelerinin büyük bir nüfustan tanımlanmalıdır. Bu süreç genellikle zahmetli bir iştir. Bu durumda, yeni bir yöntem, her hücrede belirli olayların uyarılmasına ve belirlenen zaman noktalarında hücrelerin hızlı immobilizasyon ile elde edilen selüler dinamiklerini gereklidir.
Son zamanlarda, çeşitli araçlar ışık (optogenetics) kullanılarak belirli hücresel dinamikleri ikna etmek geliştirilmiştir. Channelrhodopsin 13, 12 reinhardtii Chlamydomonas izole edilen bir ışığa duyarlı, seçici olmayan bir katyon kanaldır. channelrhodopsin Neurona eksprese edildiğindelitre membran, bir ışık kısa flaş nöronlara sodyum iyonlarının akışını indükler ve 14, 15, potansiyel bir işlem tetikler. Aksiyon potansiyeli daha sonra sinaptik veziküllerin 18 Bu nedenle, channelrhodopsin nöronal aktivitenin neden milisaniye 16, 17 içinde sigorta sinaptik terminallerinden içine yayar. sinaptik terminallerindeki membran dinamikleri takip etmek için, nöronların ms hassasiyetle stimülasyon sonrasında belirli zaman aralıklarıyla hareketsiz olmalıdır.
Nöronal aktiviteyi uyaran sonra membran dinamikleri elde etmek için, yüksek basınç 17, 18, 19 ve donan hafif uyarılması bağlanmıştır. Yüksek basınçlı dondurma düşük bir buz kristali oluşumu 20 olan hücrelerin neredeyse anlık immobilizasyon için izin verir. Buz kristalleri can zarları ve hücre altı mimariyi 21 bozabilir. uyarılması ve dondurma arasındaki zaman aralıklarını değiştirerek, sinaptik terminallerinden içinde membran trafik aksiyon potansiyelinin indüksiyonundan sonra yakalandı.
Burada, bu çiftler, yüksek basınçlı dondurma hafif bir uyarım ms zamansal kontrol bir ticari yüksek basınçlı dondurucu kullanılarak, deneysel prosedürler göstermektedir. Işık uyarılması ve donma kontrolü için bir dış aygıt gerektiren diğer araçlar farklı olarak, ışık uyarımı bu sistemde tam entegre ve MS hassas 19 ile uygulanabilir. Bu süreç birden adımdan oluşur. 1) fare hipokampal nöronlar safir diskler üzerinde kültüre ve lentivirüs channelrhodopsin 18 için bir ifade vektörünü taşıyan bulaştırılır. 2) Nöronlar uyarılır ve stimülasyon sonrasında belirli zaman aralıklarıyla dondurulur. 3) vitrifiye su yerine geçerorganik bir çözücü ile d, lipitler ve proteinler ise hücreler arası mimari korumak için fiksatif tarafından çapraz bağlanmalıdır. 4) Numuneleri infiltre ve epoksi reçine içine gömülü olan. 5) ince kesitler ultramikrotom kullanılarak toplanır. 6) ince kesitler bir transmisyon elektron mikroskobu ile görüntülenmiş. 7) Görüntü edinimi ve analiz süresi noktaları veya genotipler ile ilgili körlemesine gerçekleştirilmiştir. Hücresel dinamikleri zaman çözümlemeli görüntülerin 17, 18 yeniden inşası yoluyla belirlenebilir. Bir hafta gerektirir, ancak daha sonraki görüntü analizi bir yıl aylar gerektirir - Numune Hazırlama (yukarıdaki 5 2. adımları).
Protokol
Deneylerin tamamı Ulusal Sağlık Enstitüleri tarafından kural ve hayvan kullanımının yönetmeliklere göre yapılmıştır. protokol Johns Hopkins Tıp Fakültesi Hayvan Bakım ve Kullanım Komitesi (IACUC) tarafından onaylanmıştır.
1. İzolasyon ve Kültür Fare hipokampalinden
- Bir doğum sonrası gün 0 korteks teşrih - gün 2 (P0 - 2) fare beyni 18. korteks astrositler izole edin.
NOT: Fare beyni dekapitasyon sonra izole edildi. Astrositler hipokampal nöronlar için bir besleyici tabaka olarak görev yapar. - astrositler ayırmak için 37 ° C'de 15 dakika boyunca% 0.05 tripsin-EDTA, 800 uL korteks tedavi edin.
- Kültür,% 10 fetal sığır serumu (FBS) ve% 0.2 penisilin-streptomisin bir hafta 37 ° C'de ve% 5 CO2 içeren DMEM 13 mL bir T-75 balon jojesi içerisinde astrositler.
- Bir asitle yıkanmış ve steril 18 mm cam lamel pe yerleştirin12 kuyucuklu bir plakanın R de.
- Kısaca,% 70 etanol içinde iki adet 6 mm karbon kaplı safir diskleri yıkayın ve her bir cam lamel üzerine yerleştirin.
- fare kuyruk kolajeni ile 1 mL PDL 1 mL (1 mg / ml) ile 17 nM, asetik asit, 3 mL karıştırılarak Poly-D-Lisin (PDL) çözeltisi hazırlayın. Oda sıcaklığında 5 dakika boyunca safir diskler ve cam lameller PDL çözeltisi 200 uL uygulanır.
- PDL çözüm ve hava kuru çıkarın. ultraviyole ışığı altında, 30 dakika boyunca 1.6 - kullanmak adımda 1.4 de hazırlanan plaka sterilize etmek için önce.
- 1.6 - adımda 1.4 de hazırlanan plaka / oyuk 5x10 4 hücre yoğunluğunda DMEM 2 mL adım 1.3 astrositler tohum. Bir hafta boyunca CO2 37 ° C'de büyüyebilir ve% 5.
- nöronlar kültür önce en az birkaç saat boyunca her bir oyuğa (80 uM son konsantrasyon), floro-deoksiüridin 20 uL ekleyin.
NOT: Floro-deoksiüridin astrosit bölümü durur. - nöronal bas 1.5 mL ortam değiştirme% 1 L-alanil-L-glutamin (Malzemelerin Tablo), nöronal hücrelerin% 2 serumsuz ek (Malzemelerin Tablo) ve% 0.2 penisilin-streptomisin içeren arkadaşları ortamı (Malzemelerin Tabloya bakınız) .
- Enzim çözeltisi, 5 mL (1.65 mM sistein, 1 mM CaCl2, ve DMEM içinde 0.5 mM EDTA) içinde papain 20 adet ilave edilerek papain çözeltisi hazırlayın. 20 dakika boyunca CO2 gazı geçirilerek çözelti asitlenir. 0.22 um bir filtre ile filtre-sterilize edin.
- 2 fareyi 18 - Bir P0 gelen beyin Hasat. Hemen buz soğukluğunda Hanks'-dengeli tuz çözeltisi (HBSS) beyin aktarın. HBSS batırılmış doku tutarak, bir stereo mikroskop altında hippocampi teşrih.
- Adım 1.11 hazırlanan papain çözeltisi 1 mL, iki Hippocampi yerleştirin. 37 ° C'de ve 750 rpm'de bir termomikserinde 1 saat süreyle inkübe edin.
- ihtiva eden çözelti inaktive 1 mL papain yerinetripsin inhibitörü olarak 2.5 mg ila DMEM mL'si başına albümin 0,5 mg. 37 ° C'de 5 dakika süreyle inkübe edilir. inaktive çözümü kapalı aspire.
- İzole hipokampusa nöronal bazal ortam (Malzemelerin Tabloya bakınız), 200 uL ekleyin. hücreleri ayırmak için 200 uL bir pipet kullanarak toz haline getirin. ayrışmamış hücreler dibinde biriken kadar bekleyin. Dikkatle üstten hücrelerle aracını çıkartın.
- Adımı tekrarlayın 1.15 3x. Havuz yeni bir 1.5 ml'lik bir santrifüj tüpüne bütün ayrılmış hücreleri.
- Bir hemasitometre kullanarak hücreleri sayın. Plaka 6.5 x 10 4 hücre yoğunluğunda nöronlar / göz ile ilgili adımları 1.1 hazırlanan astrosit tabakasının üst - 1.10.
- Lentivirüs DIV 3 (in vitro 3 d) 18 channelrhodopsin ifade ile nöronların Infect.
- adımlarda 2.1 açıklandığı gibi, DIV 14 flaşı-ve-donma gerçekleştirin - 2.5 aşağıda.
2. Flash birD-Freeze
- Sabitleme Hazırlanması
- glutaraldehit 2.5 mL (aseton içindeki% 10 stok), ozmiyum tetroksit 0.25 g, su, 0.25 mL, ve susuz aseton 22.25 mL: kimyasal bir başlık altında, fiksatif hazırlamak için bir konik tüp aşağıdaki maddeleri ekleyin.
Not: her bir bileşenin son konsantrasyonunun aseton içinde% 1 olmalıdır. Glutaraldehit dondurularak ikame sırasında protein yapılarını korumak için ilave edilir. DİKKAT: osmiyum tetroksit akut toksisite yüksektir. dumanlara maruz kalmak gözün kornea zarar verebilir. Sadece sertifikalı kimyasal kaputu ele alınmalıdır. - Kısım sayılı kriyojenik şişeler (2 mL) içine sabitleyici 1 mL. kullanılana kadar sıvı nitrojen içinde dondurulmuş fiksatif tutun.
Not: Osmiyum tetroksit ve glutaraldehit çapraz reaksiyona girmekte ve çökeltilmesi; Bu şekilde, bir defa tüpler kap ve fiksatif dondurmak için sıvı azot içinde kriyotüplere daldırın hemen kısım karıştırılır. kriyo numaraya bir kalem kullanıntanımlanan gen şişeler, çünkü aseton işaretçileri yıkayın olabilir.
- glutaraldehit 2.5 mL (aseton içindeki% 10 stok), ozmiyum tetroksit 0.25 g, su, 0.25 mL, ve susuz aseton 22.25 mL: kimyasal bir başlık altında, fiksatif hazırlamak için bir konik tüp aşağıdaki maddeleri ekleyin.
- Fizyolojik Saline hazırlanması
- Hepes (10 mM, pH 7.5), NaCl (140 mM), KCI (2.4 mM) ve glükoz (10 mM) ile muamele edilmiştir, fizyolojik tuzlu su çözeltisi olun.
NOT: Bu değerler nihai konsantrasyonları vardır. Kriyo-koruyucu maddeler tek tabaka kültürleri için kullanılmamaktadır. Bununla birlikte, uygun bir kriyo-koruyucu 5 um'den daha kalın numuneler için gereklidir. % 20 BSA kullanımı genellikle tavsiye edilir. Maya yapıştırın ve E. coli OP50 da sinek larvaları ya da C. elegans için kriyo-koruyucu olarak kullanılabilir. - 1 mM nihai konsantrasyonlarda, 4 mM MgCl2 ve de CaCl2 ekleyin.
Not: Örneğin CaCI2 ve MgCl2 içerikli konsantrasyonları deneyler bağlı olarak değişir. Ekzositik ara-yakalanmasını sağlamak için, 4 mM kalsiyum veziküllerin 18 salınım olasılığını arttırmak için bu özel deneyler için kullanılır. - kontrolBir osmometresi kullanılarak ozmolarite. 300 ± 5 mOsm olduğundan emin olun.
- 30 uM'lik bir son konsantrasyon elde 3 uM ve GABA alıcı antagonisti (bicuculline) bir son konsantrasyona kadar, AMPA reseptör antagonisti (NBQX) ekleyin.
NOT: Nörotransmitter reseptör antagonistleri nöronal uyarım 18 aşağıdaki tekrarlayan ağ etkinliğini engellemek için eklenir. - kullanım için, 37 ° C'ye kadar, fizyolojik tuzlu su ısıtın.
- Hepes (10 mM, pH 7.5), NaCl (140 mM), KCI (2.4 mM) ve glükoz (10 mM) ile muamele edilmiştir, fizyolojik tuzlu su çözeltisi olun.
- Uzmanlaşmış Yüksek basınç Dondurucu ve bir Otomatik Freeze değişikliği Birimi hazırlanması
- Yüksek basınçlı Dondurma öncesinde sıvı azotla tankının -90 ° C'ye kadar otomatik bir dondurularak ikame ünitesini soğutmak.
- numune odasının içine yerleştirerek ° -90 küçük bir kap içinde aseton soğutun.
- Sıvı nitro ile yüksek-basınç dondurucu sıvı azot devar ve depolama devar (Malzemelerin Tablo) doldurungen.
- Dokunmatik ekranlı monitörü kullanarak ışık uyarım protokolünü ayarlayın.
- Hafif stimülasyon penceresinde yanındaki "Program adı" için "Düzenle" tıklayarak programı adı. Başka bir pencere açılacaktır.
- "Pulse" in "15,000 ms" "karanlık faz", "100 ms süre" içerisinde "" "10 ms" yazarak bir program ayarlama ve "1" 10, tek bir uyarıcı "zaman sayısı" olarak MS. Hücreler 90 ms sonra (Şekil 1C) dondurun.
NOT: "Karanlık faz" hücreler numune yükleme sırasında ışığa maruz kalmaktan kurtarmak için izin verir. "Süre" uyarım frekansı belirler. uyaran 20 Hz uygulanmalıdır Örneğin, bu sütun, 50 ms olarak ayarlanmalıdır. "Pulse" hafif uyarıcı süresini tanımlar. Son olarak, "dönemlerin sayısının" uygulanan uyarıcıya sayısını tanımlar. Yüksek frekanslı stimülasyonu kurma için lütfen Şekil 1E.
- ışığında "hayır uyarım" kontrol, tip "15" s "karanlık faz", "zaman sayısı" in "0 dönemi" "MS", "1 ms" "darbe" ve "0" için, stimülasyon ayar penceresi olarak aşama 2.3.4 tarif edilmiştir.
NOT: Varsayılan olarak, en az 1 ms olmalıdır "darbe". - Ana ekranda, ışık uyarımı için kutusunun işaretli olduğundan emin olun.
- Ana ekranda "Numune Depolama" tıklayarak depolama protokolünü ayarlayın. Tıklayın "Düzenle". "-," (toplam 3 kanalları), her bir kanal 2 disk saklamak için "2" seçmek için aşağıdaki penceresinde, "+" ya da kullanım. Kontrol "Depolama LN2 sağladı."
- Numune Yükleme ve Yüksek basınç Dondurucu içinde dondurulması
NOT: Tüm örnek montaj ve yükleme aşamaları bir 7.5-60X büyütme aralığına sahip bir stereo mikroskop altında yapılır. bir tweezörnekleri işlemek için 2.4.4 - er adımlarla 2.4.1 kullanılmaktadır. Deneyler fizyolojik sıcaklıkta gerçekleştirilmelidir.- Hücre tarafı siyah, orta plaka (Şekil 1B) oyuk içinde, yukarı bakacak şekilde, bir safir diski yerleştirin.
- Safir disk (Şekil 1B) üzerinde 100 nm'lik bir ara halka yerleştirin.
- Adım 2.2 önceden ısıtılmış tuzlu su çözeltisi içinde diskinin bir tarafı daldırma sonra ara halka (Şekil 1B) üzerinde boş bir safir diski yerleştirin. hava kabarcığı iki safir diskler arasında sıkışıp emin olun.
- Başka bir 100 um ara halka ve bir 400 mikron ara halkası (Şekil 1B) yerleştirin. Filtre kağıdı kullanarak ekstra sıvıyı çıkarın.
- Iki saydam yarı silindir (Şekil 1A) arasındaki aşama 2.4.3 aksamı yerleştirin. donma sürecini başlatmak için üst kırmızı kapağını kapatın.
NOT: Kapak kapatıldıktan sonra önceden ayarlanmış protokol otomatik olarak çalışır. Numune dondurma bölmesinin aynı yönlenmede kalır, ve hafif bir flaş örnek tertibatının üstten uygulanır. kırmızı kapak yukarı otomatik dondurma işlemi tamamlandıktan sonra geri çıkar. - Depolama Termostaki numune saklayın.
Not: Dondurma işleminden sonra numune otomatik sıvı nitrojen ile dolu bir depolama termos içine damlatılır ve daha sonra işlenene kadar orada saklanır. Depolama termos üç odacığa sahiptir, ve her bir bölmenin en fazla 3 örneğe kadar tutabilir. Tipik olarak, iki numune, aynı uyarım koşulları altında dondurulur ve yüksek basınç dondurucu aynı hücre içerisinde depolamak için programlanır. - Her örnek için 2.4.6 - Tekrar 2.4.1 adımları tekrarlayın.
- Tüm odaları dolu bir kere 2.5 adıma geçin.
NOT: Cihaz bir seferde depolama Termostaki 6 adet numune kadar saklamak için kuruldu. Bu nedenle, her 6. örnek sonra, aşama 2,5 gerçekleştirilmelidir. 2.4.6 - yüksüz kez tekrarlayın 2.4.1 adımları.
- Örnek Toplama ve bir Otomatik Freeze-ikame Birimine transfer
- yüksek basınçlı dondurucunun masanın altında bulunan depolama Dewar, kapıyı açın. Depolama devar çıkarın ve masa üstü yerleştirin.
- eller kullanılarak, Dewar numune odası çıkarın ve sıvı azot ile doldurulan özel örnek tepsiye aktarılır. Numune kabı serbest bırakmak için düğmeyi açın.
- sıvı nitrojen ile cımbız ipuçları önceden soğutulduktan sonra bir çift cımbız ile numune fincan saydam yarım silindir çıkarın (~ -196 ° C). Dikkatle sıvı azot ihtiva eden bir küçük bardağa orta siyah plaka aktarın.
Not: cımbız uçları sıvı azot sıcaklığına soğutulmuş olması gerekir. Numune buz kristal oluşumunu önlemek için her zaman sıvı azot altında tutulmalıdır.
Au 3. dondur Değişikliktomated Freeze-ikame Birimi
- (~ -196 ° C'de ipuçları) soğutulmuş cımbız kullanarak, hızlı bir şekilde önceden soğutulmuş aseton adım 2.5.3 gelen orta plaka transfer (-90 ° C).
- hafifçe sallayarak veya dokunarak orta plakadan safir diski ayırın.
NOT: Bazen, orta plakadan safir diski ayırmak zor olabilir. Böyle bir durumda, önceden soğutulmuş aseton içinde orta plakayı terk (-90 ° C) bir kaç dakika. cımbız ile yumuşak vuruş da orta plakadan safir ayırmak için yardımcı olur. - ikame ünitesinin bir numune bölmesi içindeki fiksatif (aşama 2.1) ihtiva eden bir kriyojenik şişe yerleştirin. kriyojenik şişeye safir diski aktarın ve şişenin üzerine bir kapak yerleştirin.
- - 30 saat, (ii) -90 - -20 ° C, 14 saat (5 ° C / saat) 'de, (iii), -20 ° C (i) -90 için 5 ° C aşağıdaki gibi donma ikame programı ayarlama 20 ° C 'de 4 saat (10 ° C / saat) - 12 saat, ve (iv), -20 ° C sıcaklıkta.
NOT: du-90 ° C de ilk aşamanın oranı değiştirilebilir. dondurularak ikame toplam süresi, sonraki aşamaların gündüz gerçekleştirilebilir, böylece programı 8 am sabah (~ 1.5 d postexperiment) 'de sona erer şekilde ayarlanır.
Epoksi reçine ile 4. Sızma ve plastik gömülmesi
- Program sona erdikten sonra, bir kimyasal kaput ikame ünitesinin numune haznesinden safir diskleri içeren kriyojenik şişeler aktarmak için eldivenli ellerini kullanın.
- Bir pipet kullanarak, her bir kriyojenik bir şişeye, aseton ile (oda ısısı) ekleyin ve her bir safir diski 4 yıkayın - 2 saat - 1 6x.
- İlave kontrast gerekirse isteğe bağlı olarak, 1 saat boyunca% 0.1 uranil asetat içinde örnekleri inkübe edin. 4 yıkayın - 2 saat - 1 üzerinde aseton ile 6x.
Not: DİKKAT: üst solunum yolu tahriş uranil asetat, teneffüs aşağıdaki dahili maruz kalma ile ilişkili bir risk vardır. Yüksek maruziyet tellerine hasar olabilire kan hücreleri. uranil asetat ile yapılan çalışma emmeli havalandırma altında yapılmalıdır. Koruyucu giysi önerilmektedir. - gliserol poliglisidil eter, 6.2 g, bisfenol-A epoksi reçinesi, 4.4 g, ve dodesenil süksinik anhidrit (DDSA) 12.2 g ağırlığında sıvı epoksi reçine orta hazırlayın. İyice karıştırın ve karıştırma sırasında benzil dimetilamin (BDMA) 800 mcL ekleyin. 10 dakika süre ile de gaz.
- Adım 4.4'te hazırlanan% 100 epoksi reçine, aseton içinde, 30, 70, ve% 90 epoksi reçine hazırlanması.
- safir diskleri içeren kriyojenik şişelere% 30 epoksi reçine ilave edin ve 2 için inkübe - 120 rpm'de bir orbital çalkalayıcı içinde oda sıcaklığında 3 saat.
- pipetle% 70 epoksi reçine ile% 30 epoksi reçine yerine ve 3 için inkübe - orbital çalkalayıcı içinde oda sıcaklığında 4 saat.
- cımbız kullanarak, bir gömme kapsül kapağı, her safir disk, hücre tarafı yukarıya aktarın. kapağa% 90 epoksi reçine ekleyin. 4 ° C'de O / N inkübe edin.
- Sonraki gün, Aşama 4'te olduğu gibi, taze epoksi reçinesi maddesi hazırlamak0,4.
- Bir gömme kapsül kap, yukarı bakan her safir disk hücre tarafı aktarın. taze hazırlanmış% 100 epoksi reçinesi ile kapağı doldurun. Üç defa tekrar taze% 100 epoksi reçineye her 2 saatte bir değiştirin.
- 48 saat polimerize etmek için bir 60 ° C fırına yerleştirin.
5. Montaj Örnekler
- Safir, disk reçine bloğun üst kısmında yer alır, böylece stereomikroskop ile ilgili örnek baş aşağı yerleştirin. bir jilet ile kazıyarak üstten epoksi reçinesinin ince bir tabaka çıkarın.
- Bir traş makinesi bıçak kullanarak, safir diskin kenarı boyunca sığ bir kesme hattı; Bu hat adım 5.3 epoksi reçineden safir diski ayırmak için yardımcı olur.
- Yaklaşık 10 saniye için sıvı azot içine daldırma ile epoksi reçineden safir diski ayırın.
NOT: Hücreler epoksi reçine kalacak. - safir diski ayrılmasından sonra, (hücreler ile bir alan bulmak için kesici bir alan kullanımı4-10X büyütme). bir tıraş makinesi bıçağı kullanılarak ilgi bölgesi (~ 2 x 2 mm) yaklaşık kesim (çift kenarlı). Numune mikroskop yüzeyine bantlanmış ise yerinde numune tutmak için, bu adımı gerçekleştirin.
- epoksi reçineden yapılmış bir silindirik sözde blok ile etil siyanoakrilat içeren bir yapıştırıcı kullanarak hücreleri içeren plastik küçük bir parça (~ 2 x 2 x 5 mm) monte edin. 1 saat boyunca 60 ° C 'de blok inkübe edin.
6. Kesit
- bölümüne bir ultramikrotom örnek kullanın.
- 3 mm / s'lik bir hızla 200 nm / bölümünün bir kalınlıkta cam bıçakla plastik gömülmüş numunesinin yüzeyini kesin. astrositler bulunduğu yüzeyden 5 bölümleri - 4 kesin.
- 0.8 mm / s'lik bir hızda, 40 nm / bölümünün bir kalınlıkta bir elmas bıçak ve kesit geçin. 25 bölümden - 20 kesin.
- % 0.7 polivinil asetat ile kaplanmış tek girişli bakır ızgaralar bölümlere kurdeleler toplayın (bkzMalzemelerin tablo).
bir transmisyon elektron mikroskobu (TEM) kullanılarak 7. Görüntüleme
- , Görüntüleme TEM 5 dakika boyunca metanol içerisinde% 2.5 uranil asetat ile bölüm leke önce.
- % 50 metanol içinde ızgara 15x yıkayın. Daha sonra, 30 saniye süren her yıkama ile, ultra saf su 15x yıkayın.
- Kısaca bölümüne hava kurutmak ve TEM bir numune tutucu içine kılavuz getirin.
- 93,000X büyütmede görüntüsü.
- görüntüler elde.
NOT: Görüntüleme tipik zaman noktaları veya genotiplere kör yapılır ve genellikle ~ 200 resim / zaman noktası toplanır.
8. Resim Analizi
- Özel bir makro (yayınlanmamış Watanabe, Davis ve Jorgensen,) ile bir yazılım (örn ImageJ) kullanarak görüntüleri analiz edin.
Not: X / Y koordinatları veziküllerden kaydedilir, plazma membranı, aktif bölgesi, membran ve sinapslarda diğer zara bağlı organeller. metin filbilgileri içeren es başka yazılımlar (örneğin Matlab) ihraç edilmektedir. Veri ayrıca özel programları kullanılarak analiz edilir.
Sonuçlar
Yukarıda açıklanan protokolü kullanarak, fare hipokampal nöronlar "flash ve dondurma" deneyleri channelrhodopsin ifade seslendirdi. Bu nöronlar, 15 ms ya da hafif başlangıcından sonra 100 ms ya donduruldu. Daha önce sinaptik veziküllerin ekzositozu endositoz sinaptik 15 ms'de terminali ve 100 ms zaman noktalarında, sırasıyla 18 meydana göstermiştir. Bu olaylar, başarılı bir şekilde (Malzemelerin Tablo) flaş-ve-dondurularak yapılan deneyler seçilen özel bir yüksek basınçlı dondurucu gerçekleştirilebilir öne uygun zamanlarda (Şekil 2) ele geçirildi.
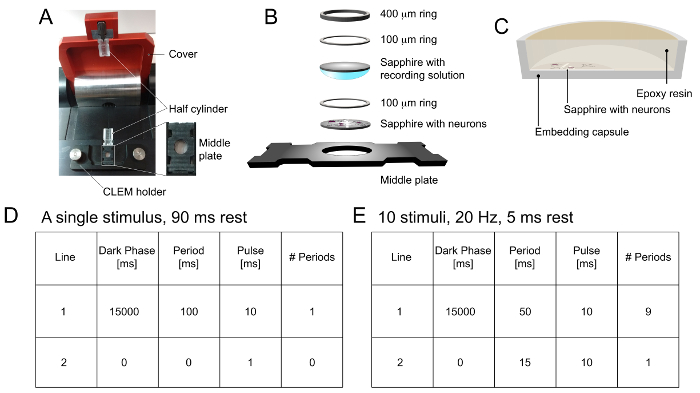
Yüksek basınç Dondurucu Şekil 1. Örnek Yükleme ve Programlama. Yüksek p A) Örnek yükleme tablasıressure dondurucu. Yapısal detay için ust ilavesinde gösterilen orta plaka, örnek yükleme için bir CLEM muhafaza içine yerleştirilir. yarı silindir bir numune yükleme tablonun alt kısmında yerleştirilmiştir ve diğer üst kapak için bir klip ile takılır. Numune yüklendikten sonra, orta plaka alt yarım silindir ileri itilir ve kapak dondurma başlatmak için kapatılır. B) Örnek tertibatı. nöron içeren safir, disk, hücre tarafı yukarı gelecek şekilde, orta plaka oyuğuna yerleştirilir. 100 um halkanın doğrudan kuyu içine safir disk üzerine yerleştirilir. Daha sonra, fizyolojik tuzlu su içinde daldırma boş safir diski aşağı çözelti tarafına yerleştirilir. Hava kabarcıkları kaçınılmalıdır. Son olarak, bir 100 um halkası ve bir 400 mikron halka sıkıca üzerine yerleştirilmiştir. İlave bir sıvı filtre kağıdı ile çıkarılır. C) epoksi reçine içine daldırılmış safir diski ile birlikte bir gömme kapsülün bir enine kesitini göstermektedir. sappişe Disk hücre tarafı yukarı gelecek şekilde, kapsül altına yerleştirilir ve infiltrasyonu ve yerleştirilmesi için epoksi reçinesi ile kaplıdır. Tek bir 10 ms uyarıcı için yüksek basınçlı dondurucu Programlama D). Örnekler ışık darbesinden sonra 90 ms dondurulur. E) 20 Hz'de 10 uyaranlara için yüksek basınçlı dondurucu Programlama. Numuneler son ışık darbesinin ardından 5 ms donmuş. Bu rakamın büyük halini görmek için buraya tıklayın.
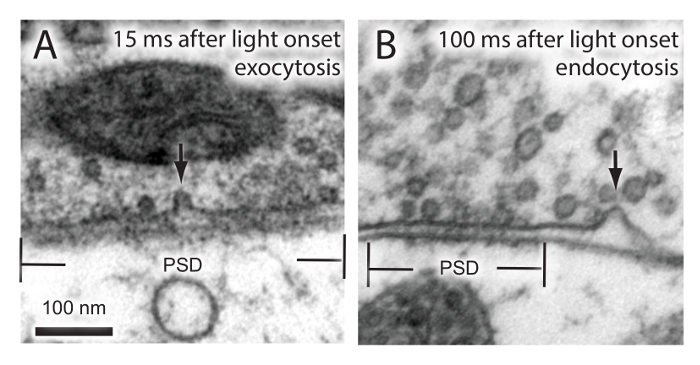
Fare Hipokampal Nöronlar ekzositozu ve endositoz 2. Görselleştirme Şekil. Hipokampal nöronlar bir kez uyarılır ve belirtilen sürelerde donmuş. Elektron mikroskobu, bir sinaptik vezikül A ekzositoz) ve ultrahızlı endositoz göstermek B). PSD, post-sinaptik yoğunluğu. Bu rakamın büyük halini görmek için buraya tıklayın.
Tartışmalar
"Flaş ve dondurma" yaklaşımı optogenetics ile belirli bir hücre etkinliği uyararak ve stimülasyon 19 sonra belirli zaman hücreler dondurma ile membran dinamikleri görselleştirir. Bu gösteri, nöronlar teşvik etmek için, channelrhodopsin, ışığa duyarlı bir katyon kanal için ve sinaptik terminallerindeki füzyon ve sinaptik veziküllerin kurtarma ele. Son yıllarda, birçok Optogenetic araçları flaş-and-dondurma ile uyumlu olan, her biri 22, 23, geliştirilmiştir. Örneğin, organel trafik Kriptokrom'un ve CIB1 24 ışık kaynaklı heterodimerizasyonu kullanılarak indüklenebilir. Benzer bir şekilde, plazma membran lipid kompozisyonu, plazma membranı 25 fosfoinositid fosfatazların ışık kaynaklı translokasyonu ile değiştirilebilir. Bundan başka, azobenzen ch gibi küçük, ışığa duyarlı bileşiklerinaydınlatma dalga boylarında bağlı ange konformasyon. Bu konformasyonal değişiklik ligand kapılı kanalları etkinleştirmek veya zar 26, 27 lipid kompozisyonu değiştirmek için kullanılabilir. Kafesli bileşimler de hücresel aktiviteyi artırdığı için kullanılabilir. Bununla birlikte, mevcut kurulumunda kullanılan LED uncaging için yeterli bir enerji oluşturacak olmayabilir; Bu şekilde, sistemin daha iyi duruma muhtemelen gereklidir. Bununla birlikte, bu ışık ile aktive edilebilen araçları uygulamaları esnek birçok hücresel olaylar bir flaş ışığına karşı indüklenebilir bulunmaktadır. "Flash ve dondurma" Ortaya çıkan zar dinamiklerini yakalayabilir.
"Flash ve dondurma" yöntemine iki ana sınırlamalar vardır. Birincisi, farklı hücrelerden belirli bir olayın "anlık" yakalar. Başka bir deyişle, belirli bir süre boyunca tek hücrede membran dinamikleri takip etmek mümkün değildir. Bu durumda, herhangi bir hücresel rekonstrüksiyonu için bilet, alınan ve her bir örnekten ve her bir zaman noktasında bir görüntü sayıda analiz gerekir. Fare hipokampal nöronlar 18, 28 sinapsların% 30 - sinaptik veziküllerin füzyon sadece 20 içinde yer alır Bundan başka, nöronlarda, görüntülerin daha da büyük bir sayı, gereklidir. Böyle büyük bir veri kümesi analizi zaman büyük miktarda gerektirir. Gelecekte, görüntü toplama ve analiz 29, 30 yaklaşım daha verimli kılmak için otomatik gerekmektedir.
İkinci bir kısıtlama yüksek basınçlı dondurma tekniği doğası tarafından uygulanır. Hücreler donduğunda hücresel suyun donma hızı 100 K / s 21 altında ise buz kristalleri meydana getirmek üzere yeniden düzenlenir. Bu buz kristalleri zarlarına nüfuz ya da membran yırtılması ile sonuçlanır yerel ozmotik basıncı değiştirmek için çözünmüş konsantre olabilir. Buz kristalleri önlemek için, HIGh basıncı (~ 2.000 atm) numuneler uygulanır. Nedeniyle, süper-soğutma etkisi, 100 K / s'lik bir dondurma oranı, bu basınç 21 buz kristallerinin oluşturulması su önlemek için yeterlidir. Teorik olarak, 500 um buz kristalleri olmadan dondurulabilir ancak buz küp şeklindeki formları kalın dokuda oluşturma eğiliminde olarak yaklaşık 200 um morfolojisi ödün, muhtemelen pratik sınırı kadar kalın ve numune. işlem daha kalın 5 um ve numune zaman, BSA gibi uygun bir kriyo-koruyucu maddenin kullanımı gereklidir. Bununla birlikte, BSA çözeltisi ozmolaritesini değişecek ve hücrelerin fizyolojik yanıtı etkileyebilir. Bu nedenle, geniş bir kontrol deneyleri özel sistemler BSA kullanımını geçerli kılmak için gerekmektedir. Numuneler kazara sıvı azot banyosu kaldırılır ise buz kristalleri yüksek basınç dondurulmasından sonra meydana gelebilir. Bu nedenle, her zaman sıvı azot içinde örnekleri tutmak için ve önceden soğutulmuş forseps kullanımı kritiktirOnları manipüle.
deneyler planlarken, aşağıdaki üç puan düşünülmelidir. 8,0 mW / mm2 - İlk olarak, ışığın maksimum yoğunluğu (460 nm hattı) 5.5. Bu yoğunluk aktiviteyi teşvik etmek için yeterli olup olmadığı flash ve dondurucu deneyler öncesinde bir floresan mikroskop üzerinde canlı hücre görüntüleme ile doğrulanması gerekir. İkinci olarak, deneyler, fizyolojik sıcaklıkta gerçekleştirilmelidir. Yüksek basınçlı dondurucunun aşamada fare hipokampal nöronlar 31 deney boyunca 37 ° C 'ye kadar ısıtılır. Son olarak, zaman noktaları dikkatle membran dinamiklerini yakalamak için seçilmelidir. İlk çalışmalar endositoz uyarımı 100 ms sonra tam olduğunu göstermiştir. Bu nedenle, üç ek zaman noktaları (15, 30, 50 ms) aynı zamanda membran dinamikleri 17, 18 takip etmek için incelenmiştir. Bu zaman noktaları membran kaçakçılığı olayı görselleştirmek için gerekliydisinaptik iletimi sırasında s. Ancak, zaman noktalarının sayısı için gereksinim her hücresel olay farklıdır. Bu nedenle, birkaç zaman noktaları büyük veri kümesi koleksiyonunu başlamadan önce örneklenmiş edilmelidir.
Açıklamalar
Bu yazının Açık Erişim yayın Leica Mikrosysteme GmbH tarafından sponsor oldu.
Teşekkürler
Bu çalışma, Johns Hopkins Üniversitesi (GB) fon tarafından desteklenmiştir. Biz onların teknik destek için Tıp Mikroskop Tesisi Johns Hopkins Okulu teşekkür ederim. Biz tekniğin geliştirilmesi için Erik Jorgensen ve Christian Rosenmund ve laboratuarlar üyelerine teşekkür. Biz ilk cihazın tasarımı için M. Wayne Davis teşekkür ederim. Biz onların teknik yardım için Paul Wurzinger, Cveta Tomova ve Delgermaa Luvsanjav teşekkür ederim. Ayrıca yazının eleştirel okuma Natalie R. Hamilton ve Grant F. Kusick teşekkür ederim.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Freeze-substitution and Low-temperature Embedding System for Light and Electron Microscopy -AFS II | Leica | ||
| High Pressure Freezer - EM-ICE | Leica | EM ICE is a specialized high pressure freezer that allows precise control of light stimulation and freezing. | |
| Osmometer | Gonotec | ||
| Ultramicrotome UC7 | Leica | ||
| Oven | Blue M | ||
| Razor blade | Personna | ||
| Glutaraldehyde | EMS | 16530 | |
| Osmium tetroxide | EMS | RT19132 | Toxic, open only under certified chemical hood |
| Acetone | EMS | RT10016 | |
| HEPES | Emdmillipore | 391340-250GM | |
| Glucose | Sigma | 49159-1KG | |
| KCl | Sigma | 746436-1KG | |
| NaCl | Sigma | S7653-1KG | |
| CaCl2 | Sigma | 21115-250ML | |
| MgCl2 | J.T.Baker | 2444-01 | |
| Liquid epoxy resin Eponate 12 | Ted Pella | 18028 | |
| Bisphenol A epoxy resin Araldite 502 | Ted Pella | 18028 | |
| Dodecenyl succinic anhydride (DDSA) | Ted Pella | 18028 | |
| Benzyl dimethyl amine (BDMA) | Ted Pella | 18241 | |
| Special embedding (BEEM) capsule | EMS | 70021 | |
| Copper Grid | Ted Pella | 1GC12H | |
| Polyvinyl acetate (Pioloform F) | Ted Pella | 19244 | |
| Uranyl acetate | Polysciences | 21447-25 | |
| Ethyl cyanoacrylate (Super glue) | Scotch | 170497 | |
| Trypsin-EDTA | Themo scientific | 25300-120 | |
| DMEM (Dulbecco's Modified Eagle's Medium) | Thermo scientific | 10569-044 | Should be warmed to 37 °C before use |
| FBS (Fetal Bovine Serum) | Thermo scientific | 26140-079 | |
| Pen-Strep | Thermo scientific | 15140-122 | |
| Fluoro-deoxyuridine (FUDR) | Sigma | F0503 | |
| Glass cover slip | Fisher | S175223 | Should be acid-washed |
| Sapphire disc | Technotrade | 616-100 | |
| Acetic acid | Emdmillipore | 1000631011 | |
| Poly-D-Lysine (PDL) | Sigma | P6407 | |
| Rat tail collagen | Thermo scientific | A10483-01 | |
| Neurobasal A | Fisher | 10888022 | Should be warmed to 37 °C before use |
| L-alanyl-L-glutamine (Glutamax) | Fisher | 35050-079 | |
| Seraum free supplement (B-27) | Fisher | 17504044 | |
| Hanks'-balanced Salt Solution (HBSS) | Thermo scientific | 24020117 | |
| Papain | Worthington | LS003126 | Active Unit should be calculated for each batch |
| Thermomixer | Eppendorf | Thermomixer C | |
| Trypsin inhibitor | Sigma | T9253 | |
| NBQX | Tocris | 03-731-0 | |
| Bicculine | Tocris | 01-091-0 | |
| Whatman I filter paper | GE | ||
| Transmission Electron Microscope | Philips CM20 |
Referanslar
- Li, D., et al. ADVANCED IMAGING. Extended-resolution structured illumination imaging of endocytic and cytoskeletal dynamics. Science. 349 (6251), aab3500 (2015).
- Betzig, E., et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313 (5793), 1642-1645 (2006).
- Sjollema, K. A., Schnell, U., Kuipers, J., Kalicharan, R., Giepmans, B. N. G. Correlated light microscopy and electron microscopy. Methods Cell Biol. 111, 157-173 (2012).
- Redemann, S., Müller-Reichert, T. Correlative light and electron microscopy for the analysis of cell division. Journal Microsc. 251 (2), 109-112 (2013).
- Kukulski, W., Schorb, M., Kaksonen, M., Briggs, J. A. G. Plasma membrane reshaping during endocytosis is revealed by time-resolved electron tomography. Cell. 150 (3), 508-520 (2012).
- Kobayashi, S., Iwamoto, M., Haraguchi, T. Live correlative light-electron microscopy to observe molecular dynamics in high resolution. Microscopy (Oxford, England). 65 (4), 296-308 (2016).
- Start, R. D., Layton, C. M., Cross, S. S., Smith, J. H. Reassessment of the rate of fixative diffusion. J Clin Pathol. 45 (12), 1120-1121 (1992).
- Müller-Reichert, T., Srayko, M., Hyman, A., O'Toole, E. T., McDonald, K. Correlative Light and Electron Microscopy of Early Caenorhabditis elegans Embryos in Mitosis. Cellular Electron Microscopy. 79, 101-119 (2007).
- Bykov, Y. S., Cortese, M., Briggs, J. A. G., Bartenschlager, R. Correlative light and electron microscopy methods for the study of virus-cell interactions. FEBS Lett. 590 (13), 1877-1895 (2016).
- Casanova, G., Nolin, F., Wortham, L., Ploton, D., Banchet, V., Michel, J. Shrinkage of freeze-dried cryosections of cells: Investigations by EFTEM and cryo-CLEM. Micron. 88, 77-83 (2016).
- Kukulski, W., Schorb, M., Welsch, S., Picco, A., Kaksonen, M., Briggs, J. A. G. Correlated fluorescence and 3D electron microscopy with high sensitivity and spatial precision. J Cell Biol. 192 (1), 111-119 (2011).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proc Natl Acad Sci U.S.A. 100 (24), 13940-13945 (2003).
- Nagel, G., et al. Channelrhodopsin-1: a light-gated proton channel in green algae. Science. 296 (5577), 2395-2398 (2002).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neurosci. 8 (9), 1263-1268 (2005).
- Nagel, G., Brauner, M., Liewald, J. F., Adeishvili, N., Bamberg, E., Gottschalk, A. Light activation of channelrhodopsin-2 in excitable cells of Caenorhabditis elegans triggers rapid behavioral responses. Curr Biol. 15 (24), 2279-2284 (2005).
- Heuser, J. E., Reese, T. S. Structural changes after transmitter release at the frog neuromuscular junction. J Cell Biol. 88 (3), 564-580 (1981).
- Watanabe, S., et al. Ultrafast endocytosis at Caenorhabditis elegans neuromuscular junctions. eLife. 2, e00723 (2013).
- Watanabe, S., et al. Ultrafast endocytosis at mouse hippocampal synapses. Nature. 504 (7479), 242-247 (2013).
- Watanabe, S. Flash-and-Freeze: Coordinating Optogenetic Stimulation with Rapid Freezing to Visualize Membrane Dynamics at Synapses with Millisecond Resolution. Front Synaptic Neurosci. 8, 24 (2016).
- Moor, H. . Cryotechniques in Biological Electron Microscopy. , (1987).
- Dubochet, J. The physics of rapid cooling and its implications for cryoimmobilization of cells. Methods Cell Biol. 79, 7-21 (2007).
- Weitzman, M., Hahn, K. M. Optogenetic approaches to cell migration and beyond. Curr Opin Cell Biol. 30, 112-120 (2014).
- Niu, J., Ben Johny, ., Dick, M., E, I., Inoue, T. Following Optogenetic Dimerizers and Quantitative Prospects. Biophys J. 111 (6), 1132-1140 (2016).
- van Bergeijk, P., Adrian, M., Hoogenraad, C. C., Kapitein, L. C. Optogenetic control of organelle transport and positioning. Nature. 518 (7537), 111-114 (2015).
- Idevall-Hagren, O., Dickson, E. J., Hille, B., Toomre, D. K., De Camilli, P. Optogenetic control of phosphoinositide metabolism. Proc Natl Acad of Sci U.S.A. 109 (35), E2316-E2323 (2012).
- Kramer, R. H., Fortin, D. L., Trauner, D. New photochemical tools for controlling neuronal activity. Curr Opin Neurobiol. 19 (5), 544-552 (2009).
- Frank, J. A., Franquelim, H. G., Schwille, P., Trauner, D. Optical Control of Lipid Rafts with Photoswitchable Ceramides. J Am Chem Soc. 138 (39), 12981-12986 (2016).
- Rosenmund, C., Clements, J. D., Westbrook, G. L. Nonuniform probability of glutamate release at a hippocampal synapse. Science. 262 (5134), 754-757 (1993).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLoS Biology. 2 (11), e329 (2004).
- Knott, G., Marchman, H., Wall, D., Lich, B. Serial section scanning electron microscopy of adult brain tissue using focused ion beam milling. J Neurosci. 28 (12), 2959-2964 (2008).
- Watanabe, S., et al. Clathrin regenerates synaptic vesicles from endosomes. Nature. 515 (7526), 228-233 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır