Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Drosophila melanogaster Malpighi tübül epiteli optik Quantification intrasellüler pH floresan genetik olarak kodlanmış pH göstergesi
Bu Makalede
Özet
Hücresel iyon taşıma kez değerlendirilen hücre içi pH izleyerek (pHben). Genetik olarak kodlanmış pH-göstergeler (GEpHIs) olduğu gibi hücrelerde hücre içi pH optik miktar sağlar. Bu iletişim kuralı aracılığıyla hücresel ex vivo canlı görüntüleme, Drosophila melanogaster Malpighi tübüllerin pHerry ile hücre içi pH miktar detayları, sözde ratiometric genetik olarak kodlanmış pH göstergesi.
Özet
Epitel iyon taşıma sistemik iyon homeostasis gibi temel hücresel elektrokimyasal gradyan bakımından önemlidir. Hücre içi pH (pHı) birçok iyon taşıyıcılar tarafından etkilenir ve böylece pHben izleme ışınlama etkinliğini değerlendirmek için yararlı bir araçtır. Modern genetik olarak kodlanmış pH-göstergeler (GEpHIs) optik miktar pHben sağlam hücrelerde, hücre ve hücre altı ölçekte sağlar. Bu iletişim kuralı hücresel pHben yönetmelikte Malpighi tübüllerin (MTs) Drosophila melanogaster ex vivo canlı görüntüleme yoluyla pHerry, sözde ratiometric GEpHI pK, gerçek zamanlı miktar açıklar bir sitozol pH değişiklikleri izlemek için oldukça uygundur. Ayıklanan yetişkin sinek MTs tek hücre katmanı epiteli morfolojik ve fonksiyonel olarak ayrı bölümden oluşmaktadır ve epitel taşıma incelenmesi için erişilebilir ve genetik olarak uysal bir model olarak hizmet verebilir. GEpHIs geleneksel pH duyarlı floresan boyalar ve iyon-seçici elektrot çeşitli avantajlar sunuyor. Uygun organizatörü öğeleri kullanılabilir olması şartıyla GEpHIs farklı hücre popülasyonlarının etiketleyebilirsiniz. Bu etiketleme ex vivo, in vivove doğal olarak heterojen situ hazırlıklar, özellikle kullanışlı olur. GEpHIs da sağlam dokularda ezelî lüzum için tekrarlanan boya tedavi veya doku dışa zamanla pHi miktar izin. Birincil geçerli GEpHIs yanıt olarak doku hasarı sitozolik kapanımlar toplamak ve aşırı ifade oluşturmada eğilimi dezavantajıdır. Bu eksiklikler, çözümleri ve GEpHIs doğal avantajları bu protokolü demiri proton (H+) taşıma ayıklanan sineğin MTs işlevsel olarak ayrı asıl ve Yildiz Seklinde hücrelerdeki değerlendirilmesi ile gösterilen. Teknikleri ve analiz açıklanan çeşitli omurgalı ve omurgasız hazırlıkları için kolayca uyarlanabilir ve tahlil sofistike labs karmaşık iyon akı belirli taşıyıcılar yoluyla belirlenmesi için öğretim ölçeklendirilebilir.
Giriş
Bu protokol miktar hücre içi pH (pHi) bir genetik olarak kodlanmış pH-gösterge (GEpHI) kullanarak açıklamak ve bu yöntem demiri H+ Ulaştırma modeli böcek (ö. değerlendirmek için nasıl kullanılabileceğini göstermek için hedeftir melanogaster) böbrek yapısı, Malpighi tübül (MT). MTs meyve sineği boşaltım organları hizmet ve işlevsel olarak birkaç anahtar bakımdan1memeli nefron benzer. MTs tübüllerin (anterior ve posteiror) göğüs ve karın anında 2 çift olarak düzenlenir. Tek hücreli epitelyal tüp her MT metabolik olarak aktif asıl hücreleri ile farklı apikal oluşmaktadır (luminal) ve demiri (hemocoel) polarizasyon gibi Yildiz Seklinde hücre ara. Anterior MTs 3 oluşan morfolojik, işlevsel olarak, ve gelişimsel olarak farklı kesimleri, özellikle ilk kesimi, geçiş bölütü ve üreter2' ye katıldı salgı ana segment büyümüş. Hücresel ölçekte trans-epitel iyon taşıma Lümen içine bir apikal plazma zarı V-ATPaz3 ve bir alkali-metal/H+ Eşanjör gibi bir demiri Na+-K+tarafından gerçekleştirilir-ATPaz4, içe-doğrultucu K+ kanal5, Na+-Cl−/HCO3− Eşanjör (NDAE1)6ve+Na -K+tahrik-2 Cl− cotransporter (NKCC; Yildiz Seklinde hücre Cl- aracılık ve su taşıma8,9Ncc69)7. Bu karmaşık ama erişilebilir fizyolojik sistemi farklı genetik ve davranışsal toolsets Drosophilaile birleştirildiğinde endojen iyon taşıma mekanizmaları incelenmesi için mükemmel fırsatlar sağlar.
Bu iletişim kuralı için gerekçe epitel iyon taşıma hücreden Tümleştirme davranış ve araçları diğer sistemleri modellemek için ihracat potansiyeli ile çalışmak için genetik olarak yumuşak bir sistemi açıklamak için yapıldı. PHerry10ifadesi, bir füzyon kırmızı pH-duyarlı mCherry13, MTs ve yeşil pH duyarlı süper tutulum pHluorin11,12 (SEpH) türetilmiş bir GEpHI miktar H+ taşıma izni Tek MT hücreleri ile yüksek K+/nigericin kalibrasyon tekniği14. Birçok iyon taşıyıcılar H+ eşdeğerleri geçtiğinizde, hücre içi pHben bir miktar iyon hareketi taşıyıcılar çeşitli yoluyla fonksiyonel bir temsili olarak hizmet vermektedir. Drosophila MT modeli sistem Ayrıca doku özgü transgene15 ve hücresel görüntüleme ve bütün organ deneyleri17 ile birlikte RNA müdahale (RNAi)16 ifade güçlü genetik araçlar sunar , 18 , 19 tübül işlevinin davranışına molekülleri üzerinden dikey entegrasyon ile sağlam bir araç kümesi oluşturmak için. Bu Buna ek olarak diğer birçok protokolün epitel biyoloji, tarihsel olarak bu tür ölçümler üzerinde karmaşık yararlanmıştır olarak değerlendirilmesi ve mikro-diseksiyon, sofistike iyon-seçici elektrot20,21yıldırıcı anlamına gelir, ve pahalı pH duyarlı22 kısıtlayıcı yükleme gereksinimleri ve türdeş olmayan dokularda zavallı hücresel özgüllük ile boya. GEpHIs kapsamlı pHben hücre türleri23çeşitli ölçmek için kullanılmaktadır. Erken dönem çalışmaları doğal pH-duyarlılık, yeşil flüoresan Protein (pHben kültürlü epitel hücreleri24 içinde izlemek için GFP) yararlanan ama son yirmi yılda nöronlar25, glia26, mantar27 kullanılan GEpHIs gördün mü , ve bitki hücreleri28. GAL4/UAS ifade sistem15 ve Drosophila MT fizyolojik erişilebilirliğini genetik yapıları, hücresel hedefleme için potansiyel kombinasyon bu araştırmalar pHiçin ideal bir hazırlık yapmak ben düzenlemesi ve epitel iyon taşıma.
pH yönetmelikben yıllardır okudu ve yaşam için çok önemlidir. Fizyoloji pH yönetmelikben öğretmek ama aynı zamanda gerçekleştirmek için güçlü bir modeli pHi yönetmelik ex vivo ve içinde vivosofistike MT hazırlık kursları sunar. Bu iletişim kuralı miktar H+ hareketinin Drosophila NH4Cl darbe asit tekniği21yükleme kullanarak MT epitel hücrelerinin demiri membran arasında açıklar, ancak pH göstergesi olarak genetik olduğunu kodlanmış, bu yöntemler ve teorik çerçeve herhangi bir hazırlık transgenesis mükellef ve canlı görüntüleme için uygulanabilir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Bu iletişim kuralı tüm adımlarını Mayo Clinic (Rochester, MN) hayvan kullanım yönergelerle uyumlu olmak.
1. yetiştirme fly
- Zam uçar ve set standart yetiştirme29göre haçlar.
Not: Floresan muhabir ifade GAL4/UAS sistem tarafından sıcaklığı ile doğru orantılıdır ve böylece sıcaklık yetiştirme ifade düzeyini değiştirmek için ayarlanabilir. Yüksek ifade düzeyleri genellikle daha iyi bir sinyal / gürültü oranı yol GFP kırmızı floresan Protein (RFP) fusion kullanarak oluşturur pHerry10gibizaman bu durum aynı zamanda artan sitozolik ve organellar toplamları ile ilişkili ise, 30,31. Toplama kaçınılmaz miktar gerçekleştirerek hala mümkün ise, Gelin kalibrasyonlar her deney ve normalleştirme verilerde böyle 1.0 Floresans oranında pHben 7.0 karşılık gelir (bkz. adım 7,4 kalibrasyon aşağıdaki notta). - Haçlar homozigoz Çapar-GAL432 erkeklerin homozigoz UAS-pHerry10 bakire kadın ve homozigoz c724-GAL42 erkek görüntüleme izni için homozigoz UAS-pHerry bakire kadın için ayarla pHben asıl hücreler ve MT Yildiz Seklinde hücreleri, anılan sıraya göre. Gıda ve 28 ° C'de dostum bırak taze ampul 3 GAL4 erkek 6 UAS-pHerry kadınlarla yerleştirin
Not: Larvalar 4 d içinde belirgin olmalı ve yetişkin eclose gün yaklaşık 10 başlayacaktır. - Dişi sinek eclosion üzerine toplamak ve yaş 28 ° C'de 10 d için kenara
Not: Deneme zamanlaması hücre içi canlı pH görüntüleme için ilişkili herhangi bir kısıtlayıcı davranış deneyleri (gibi Ramsay salgı tahlil17,19) karşılık gelecek şekilde ayarlanabilir. Erkek sinek kullanılabilir ancak tübüllerin kadın üzerinden çoğu kez daha büyük ve daha güçlü.
2. slaytlar Poly-L-lizin hazırlanması.
- Standart 75 x 25 mm'lik slaytlar üst çevresinde hidrofobik PAP kalemle 40 x 20 mm Kenarlık Çiz ve slaytları optik görüntüleme ile uyumlu değilse RT. kullanım büyük coverslips de 15 dakika kurumasını bir kenara koyun.
- Hisse senedi % 0,01 Poly-L-lizin (PLL) çözüm her slayt üzerine 2 mL transfer ve bir kenara koyun için 1 h RT.
- Bir pipet ile aşırı PLL kaldırın. Çözüm 50 mL konik şişe ileride kullanmak üzere kaydedin. 4 ° C'de mağaza
- Kalan herhangi bir çözüm bir vakum hattı ile Aspire edin. Vakum hattı çözüm slaytlar üzerinde kalmasını sağlamak için tüm slayta yüzey üzerinde çalıştırın.
- 1 ek h bir kenara slaytlarını kullanmadan RT önce ayarlayın. En fazla 1 ay içinde bir standart slayt kitap slaytları RT kuru depolama.
3. yemek ve cam çubuklar dissekan hazırlık
- Elastomer 35 x 10 mm polistren Petri kabına RT bir derinlik, 5 mm. Mix bir tek kullanımlık pipet ucu ile üretmek için temel 4.5 mL 0.5 mL elastomer kür Aracısı ekleyin. O/N, RT. tedavisi elastomer izin
Not: Açık ve ücretsiz Bubbles Elastomer olmalıdır. Takas baloncuklar elastomer plakaları 10-15 dk için vakum kavanozda dökme sonra tutarak kolaylaştırılmış olacak. - 5 mm çapında cam çubuk eller arasında tutun ve merkezi çubuk üzerinde yanan Bunsen burner sonuna ayrı kablolarıylaberaber eritebilir. Cam gibi erir bir ince (0,1 mm) ve Konik Şaft (şekil 1) hızlı bir şekilde üretmek için daha fazla çek.
Not: Şaft 45 ° açıyla kez tübüllerin işleme yardımcı olur. Bu bıçağı (bkz. şekil 1) çekilmiş gibi bir yandan azaltarak elde edilebilir. - İnce şaft orta Karbonlu çelik tek taraflı jilet kör tarafı ile bölünürler. İnce çubuk aradan temiz olduğundan emin olmak için bir diseksiyon kapsamı altında sonuna bakarak kontrol edin.
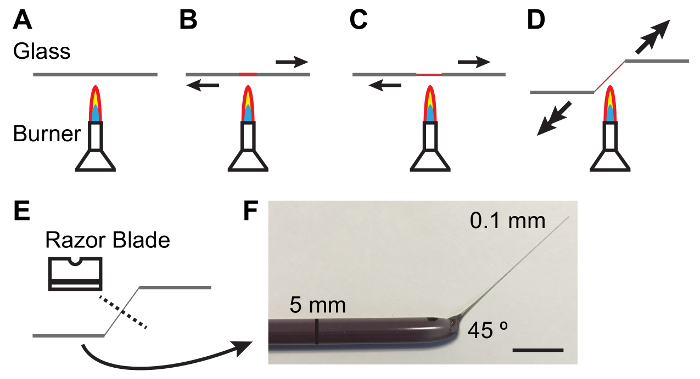
Resim 1: Cam çubuklar Malpighi tübüllerin işlemek için imalatı.
A - E. Isıtma ve bir mum tıkıp üretmek ve açı bir cam çubuk MTS'yi okları işleme için uygun çekme işlemi göstermek yönü ve büyüklüğü uygulanacak kuvvet. F. bir uygun şekilde fabrikasyon cam araç fotoğrafı. Ölçek çubuğu 10 mm. = Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
4. çözümler ve perfüzyon sistemi hazırlanması
Not: Perfüzyon sistemleri üreticisi tarafından farklıdır. Bu iletişim kuralı bir yerçekimi beslenen 8-kanal açık rezervuar bir giriş akış hızı regülatör ve elektrikli tahrik çıkış ama MTs burada açıklandığı gibi herhangi bir perfüzyon sistemi ile çalışmaya adapte edilebilir montaj yöntemi ile dayanmaktadır.
-
Aşağıdaki çözümleri hazırlayın:
- Aliquot Schneider'ın orta (50 mL konik tüpleri içine 40 mL) ve 4 ° C'de mağaza
- Çözümler hazırlamak (Yani böcek Phosphate-Buffered serum fizyolojik (iPBS) ve iPBS NH4Cl) adlı Tablo 1göre gerektiğinde RT). RT sıcak çözümler deneme gününde kullanmadan önce.
Not: iPBS ve iPBS 40 mM NH4Cl ile büyük miktarlar (1 L veya daha fazla) hazırlanan ve 4 ° C'de depolanan - 500 mL cilt pH 8 kalibrasyon çözüm hazırlamak 5.0, 6.0, 6.5, 7.0, 7.3, 7,6, 8.0 ve 9.0 Tablo 1 ve stok 4 ° C'de gösterildiği gibi = Her çözüm pH titrasyonu N-metil-D-glucamine (NMDG) ve HCl ile ayarlayın.
- Deneyler günü, 5 mL aliquots kalibrasyon çözüm RT için sıcak ve hisse senedi nigericin çözüm (Dimetil sülfoksit (DMSO) 20 mM) 10 µM son bir konsantrasyon ekleyin.
Dikkat: nigericin eldiven ile başa. Nigericin tek kullanımlık olarak temas geliyor tüm ekipman tedavi. Nigericin cam ve plastik üzerinde kalır ve donanımları yeniden varsa biyolojik hazırlıklar tehlikeye sokacaktır.
-
Perfüzyon sistemi:
- Perfüzyon sistemi tüm su depoları (Şekil 2) GKD2O ile doldurarak Başbakan. Bir seferde tüm satırlarını doldurmak için akış hızı regülatör proksimal izin vermek için bir kanal açın.
Not: Durdu kanal açıp bir dalgıç sürücü akışı için rezervuar kullanarak satırları hava temizlemek gerekli olabilir. - 2 kanal açmak ve drenaj GKD2O izin vermek. Rezervuarlar neredeyse boş olduğunda, iPBS ve NH4Cl Geniş puls iPBS ile ikinci rezervuar ile ilk rezervuar doldurun. Akış hızı akış hızı regülatörü ile maksimuma ayarlayın ve distal satırlarını doldurmak 1 dk akmaya her çözüm izin verin ve sonra akışı (Resim 2) durdurmak.
- Pozisyonu 2 görüntüleme mikroskop Sahne Alanı'nda "eller yardım" kelepçeler lehimleme ayarlar. Bir kelepçe görüntüleme platformu her yanına koyun.
- Dikkatlice ısı kapiller cam parçası distal 0,5 inç (iç çap dış çap 0,86 mm, uzunluğu 1.5 mm 100 mm) Bunsen brülör üzerinde. Bir 45 °'lik dirsek yerçekimi tarafından katlayın için distal uç sağlayan ve bir kez istenen açıda elde alev cam kaldırma oluşturun. İkinci bir kılcal cam parçası ile bu işlemi tekrarlayın.
- Bükülmüş cam kılcal akış olmayan çizgi ve vakum bağlı çıkış hattı, sırasıyla Ekle ve "helping hands" mount onları mikroskop (şekil 3) görüntüleme sahne alanı ile hizalamak için.
- Perfüzyon sistemi tüm su depoları (Şekil 2) GKD2O ile doldurarak Başbakan. Bir seferde tüm satırlarını doldurmak için akış hızı regülatör proksimal izin vermek için bir kanal açın.

Resim 2: Perfüzyon sistemi ve yapılandırma görüntüleme.
MT demiri taşıma fonksiyonu sayesinde aynı anda fizyolojik değerlendirilmesi için gerekli bileşenleri Floresans görüntüleme ve hızlı çözüm değişimi yaşıyor. Gaz satırları isteğe bağlıdır ve genişleme deneyler HCO3- taşıma değerlendirilmesi için izin vermek. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
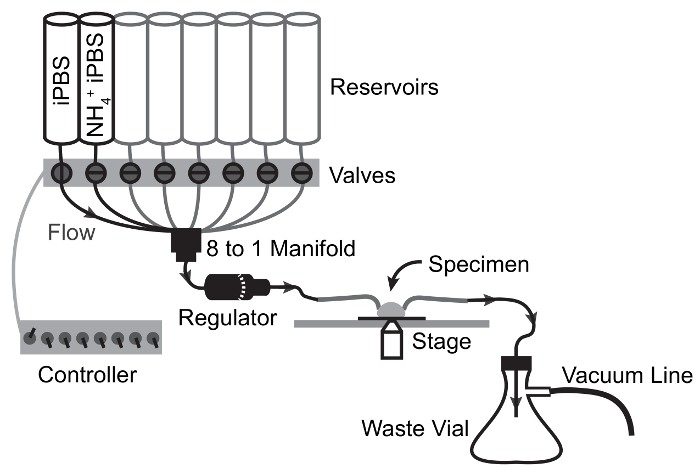
Şekil 3: Akış şeması perfüzyon cihazları, NH4Cl darbe için deneyler.
Oklar akış yolunu ve Vana noktaları geçiş tasvir. Çözüm rezervuar numune için yerçekimi akışı tarafından hareket ve numune odasından atık şişeye vakum emme tarafından çizilir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
5. yetişkin Drosophila ön Malpighi tübüllerin diseksiyon.
- Diseksiyon çanak toplamak ve çekti bölümünden 3 cam çubuk, PLL kaplı slayt bölümünde 2, yapışkan bir perfüzyon-şey bölücü, vakum yağ, bir 4 x 2" şerit film sızdırmazlık, # 5 2 Çift ince forseps ve 40 mL aliquots buz gibi Schneider'ın orta ve RT iPBS.
- Vakum yağ sızdırmazlık bandı üzerinde yayılmış ve yağ ile alt kat için teyp üzerine yapışkanlı perfüzyon-şey bölücü tuşuna basın. Yapışkanlı perfüzyon-şey bölücü soyma ve yağ yan aşağı bir PLL kaplamalı slayt üzerine yerleştirin. Hidrofobik yağ ile takip wells bireysel numune bırakmak perfüzyon-şey bölücü kaldırın.
- RT iPBS yağ çevrili içinde yer 200 µL PLL kaplamalı slayt üzerinde iyi ve stereoscope altında slayt taşımak.
- Boş bir sinek yer UAS-pHerry/Çapar-GAL4 sinekli şişe ve onları 10 dakika buzda anestezi.
Not: Bu yöntem anestezi, CO2, aksine sinekler değil kurutmak sağlar. - Buz gibi Schneider'ın orta diseksiyon çanak içine dökün ve iyi forseps altında diseksiyon stereoscope çanak içine bir tek imzalat dişi sinek aktarmak için kullanın.
- Toraks forseps bir dizi tarafından anında tutun ve diğer yavaşça karın arka kavrama için kullanın. Kısacası, forseps kullanarak anında kasıtlı hareketleri arka çekerek açın. Hindgut görünür olduğunda, distal uç kavrama ve tekrarlayan, kısa tugs vücuda uzak hindgut çekerek temel tracheoles ücretsiz olarak gut ve MTs.
Not: Anterior ve posteiror MTs midgut ve hindgut üreter ile buluştuğu görünür. MTs posterior tübüllerin hindgut sarmak gibi özgür irade büyük olasılıkla olmak ilk çifti. Bunlar olabilir (şekil 4A) göz ardı. - Kapalı üreter, anterior MTs MTs ikinci kümesi karın Ücretsiz olduğunda iyi Forseps ile çimdik. Bu ön MTs gut ayırmak ve üreter kapatın.
- Ücretsiz ön MTs çekti cam çubuk ile öyle ki her iki tarafına tübüllerin düşmek altında üreter çubuk kaydırarak almak. MTs çözüm dışarı düz yukarı kaldırın.
- Öyle ki MTs ve üreter çubuk alt yapıştırılır vardır ve üreter düz aşağı slayt alt cam çubuk açın. Üreter yapıştırmayın ve MTs distal ucunun üreter aşağı cam slayt (şekil 4B) bastırarak kapatın. MTs gerekenden daha fazla işlemek değil. MTs kadar çözümde slayda demirlemiş üreter ile yüzüyor.
- Cam çubuk iyi sonu yavaşça her tübül slayt yüzey üzerinde süpürme için kullanın. Çubuk tübül kırma önlemek ve hareket proksimal, PLL kaplı slayt (şekil 4 c) yüzeyine her tübül tam uzunlukta iliştirmek için distal tübül tepesinden çubuk slayt için slayt karşı hazırla.
- Yapışkanlı perfüzyon-şey bölücü de takılı tübül sıvı dolu küçük oluşturmak için sürgüyü geri yerleştirin.
- Numune mikroskop sahnesinde yerini. Giriş akımı getirin ve kılcal damarlar giriş ve çıkış açılması iyi, perfüzyon üzerinde sırasıyla çıkış.
Not: bir açık perfüzyon odası istenirse iyi bölücü bırakılabilir. Bu durumda giriş ve çıkış kılcal bir görüntüleme iyi ters tarafı için hizalanabilir.
6. doğrulama protokolü ve tübül sağlık görüntüleme
Not: Bu protokol bir ters geniş alanlı epifluorescent mikroskobu GFP (SEpH) ve RFP (mCherry) filtre setleri ile gerçekleştirilir (470/40 nm uyarma (ex), 515 nm longpass emisyon (em), 500 nm dikroik ve 546/10 nm ex, 590 nm longpass em, 565 nm dikroik), 10 X / 0.45 hava amacı, tek renkli kamera canlı görüntü yakalama ve düşsel bilgisayar yazılımı için. Protokol için herhangi bir dik adapte olur veya en uygun pozlama süreleri, ışık şiddeti ve binning parametrelere göre değişir, ancak mikroskop GFP ve RFP optik ve görüntü edinme şalter bilgisayar yazılımı arasında otomatik filtre ile ters. Her kanaldaki bir yatırım Getirisi ile kullanarak arka plan çıkarma hiçbir Floresans sinyal ROI bitişik içerir sonra tüm analizi, faiz (ROI), bölgedeki ortalama piksel yoğunluğu olarak floresan yoğunluğu analiz edilmelidir.
- Mikroskop, ışık kaynağı ve görüntüleme sistemi açın.
- Açık ilişkili düşsel bilgisayar yazılımı.
- Mercek ile bakmak ve MT Lümen iletilen ışık altında açıkça görünene kadar odak el ile ayarlayın.
- Görüntü analiz yazılımı "Satın alma" sekmesini tıklatın ve "2" x 2 "Satın alma modu" bölümündeki "Binning" aşağı açılır menüsünde seçin.
- %5 nötr yoğunluk filtresi aydınlatma ışık azaltmak ve photobleaching en aza indirmek için ışık yolunu yerleştirin.
- GFP (SEpH) kanalı "Kanallar" menüsünde tıklatın, sonra kamera ile floresan sinyal gözlemlemek için "canlı"'yı tıklatın.
- En parlak piksel yoğunluğu çubuk grafik en büyük değeri yaklaşık % 40 değerler gibi çekim hızı ayarlamak için "Zaman" kaydırıcıyı ayarlayın, daha sonra "aydınlatma durdurmak için" Durdur'u tıklatın.
- Tekrar RFP (mCherry) 6,6-6,7 adımda kanal ve ön MT dilate ilk segmentinin varlığını doğrulamak ve sitozolik mCherry yokluğu (doku hasarı veya overexpression gösterge) toplar (şekil 4 d).
Not: Dilate segment olarak en proksimal tübül parçasını ve bu kesimi iç Lümen çapı ~ 20 µm bitişik geçiş bölütü daha büyük olduğunu açıkça belli olmalıdır. 2 x 2 piksel binning kez yeterli ama daha da gerekli Aydınlatma şiddeti azaltmak için artmıştır. Tipik pozlama süreleri 150 & 800 ms/kanal arasında vardır. Photobleaching en aza indirmek için mümkün olduğunca az ışık olarak kullanın. Photobleaching en aza iki fluorophores bağımsız olarak, böylece herhangi bir oranı kalibrasyon geçersiz duruma getirmelerini bleach gibi pHerry gibi çift-fluorophore göstergeleri kullanmak çok önemlidir. - Hızlandırılmış bir görüntüleme Protokolü "Saat serisi" onay kutusunu tıklatarak etkinleştirin.
- "Maksimum resim alma hızı ile toplam yakalama süresini ayarlamak için süresi" 10 dk ve "Aralığı" kaymak "Saat serisi" bölümünde açılan menüde 0 ayarlayın. Toplam edinme oranı 0,2 Hz kez yeterlidir.
- GFP (SEpH) ve "Kanallar" bölümünde RFP (mCherry) kutuları kontrol edin.
- Uygun Vana denetleyicisi etkinleştirerek perfüzyon sistemi iPBS satırı açın ve "Başlangıç deneme." tıklayarak görüntüleme Protokolü başlatın NH4Cl darbe çözüm için 20 1 dakika sonra geçmek uygun vana açma ve kapama iPBS satır tarafından s sonra geri iPBS için NH4Cl hat kapatma ve yeniden iPBS Vana açılması. Perfüzyon sistemi durdurmadan önce tamamlamak tam görüntüleme iletişim kuralı sağlar.
Not: Hızlandırılmış inceleme istikrarlı mCherry sinyal ve NH4huzurunda Cl artırır, başarısızlık quenches ve yavaş yavaş kurtarır bir SEpH sinyali ortaya. - 2 nokta kalibrasyon gerçekleştirin.
- Temel slayt uzak soyulması tarafından iyi ayırıcıyı kaldırmak ve perfüzyon kılcal ve kelepçeler görüntüleme iyi kaldırın.
- 200 µL kalibrasyon iPBS (pH 7.4, 10 µM nigericin) 200 µL pipet ile iyi görüntüleme için geçerlidir. Pipet ile iyi görüntüleme çözümü kaldırın, sonra kalibrasyon çözüm başka bir 200 µL ile değiştirin. Bu işlem tam çözüm değişimi sağlamak için 4 kere tekrar edin.
- 30 dk önce görüntüleme kalibrasyon çözüm hazırlıklarında kuluçkaya. 6.6-6.11 adımlarda belirlenen aynı parametreleri kullanarak görüntüleme Protokolü tekrar ediyorum, sadece 1 dk görüntünün değişiklik ile yakalamak.
Not: Perfüzyon sistemi ve kılcal Bu adımda gerekli değildir ve görüntüleme için eklenmelidir değil de kılcal nigericin için kullanılmasını önlemek için. - 200 µL pipet ile iyi görüntüleme için 200 µL kalibrasyon iPBS (pH 9.0, 10 µM nigericin) ekleyin. Pipet ile iyi görüntüleme çözümü kaldırın, sonra kalibrasyon çözüm başka bir 200 µL ile değiştirin. Bu işlem tam çözüm değişimi sağlamak için 4 kere tekrar edin.
- 10 dk önce görüntüleme ikinci kalibrasyon çözüm hazırlıklarında kuluçkaya. Adım 6.13.3 olduğu gibi görüntüleme Protokolü yineleyin.
- Her iki kanaldaki pikselleri "Demek ROI" tıklayarak ve yine de görüntü yığını hiçbir değer yoğunluğu histogram içinde bildirilen gözlemleyerek ederken "Çerçeve" kaydırıcı ile kaydırma doygun onaylamak için görüntü analiz yazılımı Yakalanan Görüntü yığınında gözden geçirin en büyük tespit değer ulaşmak. Herhangi bir çerçeve maksimum tespit yoğunluğu ulaşmak piksel içeriyorsa, pozlama süresi veya aydınlatma yoğunluğu ve tekrar Bölüm 6 azaltmak.
Not: Kez kurulan değişmez görüntü parametreleri ayraç deneyler veya kalibrasyon noktası kalibrasyonlar her hazırlanmasında kullanılacak olmadıkça (bkz. Adım 8.3).
- Floresan yoğunluğu ve floresan oranı (SEpH/mCherry) zaman bir fonksiyonu çizmek için görüntü yığını analiz.
- "ROI demek" tıklatıp serbest biçim aracı seçin. MT. ~ 50 µm uzunluğu izlemek için sol tıklayın tutun ROI çizim bitirmek için sağ tıklatın, sonra bir arka plan yatırım Getirisi (şekil 5A) tanımlamak için MT bitişik bir alanda yineleyin.
- "Ortalama yoğunluğu" "Ölçümleri." altında'ı tıklatın Tıklatarak yoğunluk değerleri tablosu oluşturma "İhracat > veri tablosu > Oluştur."
- Yapılandırma dişli simgesini tıklatın ve "Zaman" ve "Yoğunluk demek." dışındaki tüm parametrelerden seçimini kaldırıyorsunuz. Yeni oluşturulan veri tablosu sekmesini sağ tıklatın, "Farklı Kaydet" seçin ve verileri bir .csv dosyası olarak verin.
Not: Benzer ölçümleri ImageJ gibi ücretsiz yazılımlar kullanılarak da yapılabilir. - Bir elektronik tabloyu açın ve veri tablosu "Dan tarafından metin" takip "Veri" sekmesini seçerek alabilirsiniz.
- SEpH arka plan yoğunluğu SEpH sinyal şiddeti, her zaman bir noktada dan çıkarmak için elektronik tabloda fonksiyonlarını kullanın. MCherry sinyal için bu işlemi yineleyin.
- Zaman ve yoğunluğu veri arka plan-düzeltilir ve sonra tıklatın içeren sütunlar seçerek her kanal yoğunluğu zamanın bir fonksiyonu olarak çizmek "Ekle > dağılım (grafikler) > düz çizgileri olan dağılım" (şekil 5B).
- Elektronik tablo işlevleri, her zaman bir noktada SEpH/mCherry floresan oranını hesaplamak için kullanın.
- Arsa Floresans oranı zaman süresi ve oranı veri ve sonra tıklatın içeren sütunlar seçerek bir fonksiyonu olarak "Ekle > dağılım (grafikler) > düz çizgileri olan dağılım" (şekil 5C).
7. tam kalibrasyonu Malpighi tübüllerin Ex VivopHerry.
- İncelemek ve anterior MTs yeni bir set 5 bölümde açıklandığı gibi monte edin.
- İPBS kalibrasyon iPBS (pH 7.4, 10 µM nigericin) için 6.13.2 adımda anlatıldığı gibi değişimi. 30 dk için kuluçkaya.
- MTs bulun ve 6.1-6.11 adımlarda açıklandığı gibi SEpH/mCherry görüntülerin toplamak. Çözüm iPBS 6.13.4, adımda anlatıldığı gibi 10 dakika bekleyin ve tekrar görüntü kalibrasyon başka bir hisse senedi ile değiştirin. SEpH/mCherry oranı tüm çözümlerinde görüntüsü kadar bu işlemi yineleyin. PH 9.0 görüntü elde son örnek, nadiren yüksek pH kurtarır.
- SEpH Floresans oranı mCherry için sekiz numune kalibrasyonlar üzerinden empoze pHben bir fonksiyonu olarak 6.14.9 adımda anlatıldığı gibi arsa. Denklem 1 (şekil 5 d) göre tam kalibrasyon işlevi elde etmek için bir Boltzmann eğrisi calibration verilerle uygun. Veri tutarsız, kalibrasyon kümeleri pHi için 7.0 1.0 Floresans oranında karşılık gelen öyle ki normalleştirilmiş her örnekten arsa ve (şekil 5E) yeniden analiz.
Not: ikinci işlem gerekli ise bireysel deneyleri kendi iç noktası kalibrasyonlar33 gerekir (miktar aşağıdaki yordama (Adım 8.3) bakın). -
Denklem 1
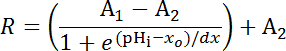
Nereye R SEpH/mCherry oranı ve1,2, xove dx = eğri uydurma parametreleridir en az Floresans oranı, en fazla Floresans oranı, pKbirve işlev genişliğini temsil eden anılan sıraya göre. xo belirgin pKbir 7.1 ve hücre tipi ve tam kalibrasyon koşullara bağlı olarak 7.4 arasında değişebilir pHerry, =.
8. demiri asit ekstrüzyon Ex Vivo Malpighi tübül epiteli gelen miktar.
- Görüntü pHerry ifade Yildiz Seklinde hücreleri ve pHerry ifade etmek müdür hücreleri aynı anda.
- 5 bölümde açıklandığı gibi ön UAS-pHerry/Çapar-GAL4 karıncayı MTs teşrih ama MTs diseksiyon Schneider'ın ortamından iyi görüntüleme için aktarılmaz.
- UAS-pHerry/c724-GAL4 karıncayı 5 bölümde özetlenen yordamı kullanarak aynı diseksiyon tabak içinde ön MTs incelemek.
- MTs 2 kümesi aynı 5.8-5.11 adımlarda açıklandığı gibi de Imaging içine aktarın.
Not: asıl ve Yildiz Seklinde hücre pHerry ifade görüntülenir aynı alan () içinde zaman arms MTS slayt aşağı süpürme, MTs UAS-pHerry/c724-GAL4 ve birbirine yakın UAS-pHerry/Çapar-GAL4 tübüllerin yerleştirin Şekil 6A).
- NH4Cl prepulse 6.12. adımda açıklandığı gibi geçerli.
Not: tutarlı kalibrasyon (şekil 4B) elde değil, bir nokta kalibrasyon sonra yapıştırıcı 7.0 kalibrasyon iPBS (pH 7,0, 10 µM nigericin, 30 dk kuluçka) ile her deneme sonunda pHi ayarlayarak gerçekleştirin perfüzyon-şey bölücü ve perfüzyon ekipman kaldırılmıştır. - İzlemleri farklı MT parçaların (mutlak veya normalleştirilmiş oranı uygun şekilde kullanarak) Yildiz Seklinde ve asıl hücrelerden denklem 2 ile kalibre ve Üstel çürüme işlevlerini kullanarak uygulayarak NH4Cl çekilme sonra kurtarma aşaması analiz istatistiksel analiz yazılımı ve çürümesine sabit (τ) (şekil 6B) kaydetti.
Denklem 2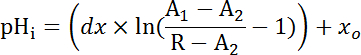
Nereye R SEpH/mCherry oranı ve1,2, xove dx = eğri ayarı'nda adım 7,4 (Denklem 1) tarafından belirlenen uygun parametreleridir.- Asit ekstrüzyon oranı (JS +, bkz: Denklem 3) pHben ve hazırlıklar34arasında yükleme asit dinlenme içinde çeşitleri için hesap için pHben bir fonksiyonu olarak hesaplayın. 8.3. adımda elde edilen Üstel fonksiyonların türevi pHben zaman ile ilgili olarak her zaman aralığında ve hesaplamak için kullanın.
Denklem 3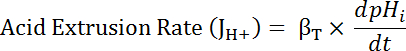
- İçsel tamponlama kapasitesi (βi; hesaplamak Denklem 4) pH sitozol, önceki edebiyat dayalıben adım 8.3.1 her aralıkta başlangıcını ( Denklem 4bakınız).
Not: Drosophilaiçinde βben en kapsamlı karakterizasyonu larva motor sinir terminallerine35 gelir ve bu veriler MT hücrelerin yokluğunda, diğer kullanılabilir veri tutmak için kabul edilebilir.
Denklem 4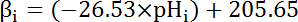
- JS + (Denklem 3) belirlemek için βT (Kimden adım 8.3.2)ve bendpH /dt (Kimden adım 8.3.1) ürün hesaplamak.
Not: sözde bikarbonat ücretsiz çözümler Bu protokol için açıklananlar gibi bikarbonat kaynaklı tamponlama kapasitesi (βb) olduğu varsayılır ~ 0 mM. Toplam kapasite (βT) tampon toplamıdır βben veβbve böylece βben = βT HCO3-co236yokluğunda. - JH + adım 6.14.9 belirtildiği gibi her zaman aralığının başında pHben bir fonksiyonu olarak çiz.
- Üstel çürüme işlevler istatistiksel analiz yazılımı kullanarak pHben içinde üst üste tüm veri kümeleri bölümüne uygulanır. Değişim elde edilen fonksiyonların hücreler ve MT kesimleri (şekil 6C) arasındaki asit ekstrüzyon oranlarını karşılaştırmak fiyatları karşılaştırın.
Not: tek bir üstel eğri uydurma için kullanılan en uygun işlev her zaman olmayabilir. Uyum iyiliği geliştirmek Eğer diğer işlevleri yerine. - Asit hesaplamak için hücre boyutu ve şekli hesap pHben bir fonksiyonu olarak (bkz: Denklem 5) akı.
Denklem 5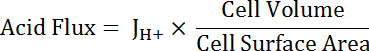
Not: Cep boyutları doğrudan Albümdeki ölçülen veya sonuna benzetilir. Asıl hücreleri aşağıdaki boyutları ile içi boş bir tüp yarısı olarak temsil: iç çapı 24 µm; dış çapı 48 µm; Yükseklik 50 µm. geçiş Yildiz Seklinde hücre değişken ama kabaca silindir yükseklikleri 50 µm ve çapları 10 µm olarak temsil edilebilir. Temsilcisi sonuçları aşağıdaki son paragrafa bakın. - Üstel çürüme işlevler istatistiksel analiz yazılımı kullanarak pHben içinde üst üste tüm veri kümeleri bölümüne uygulanır. Hücreler ve MT kesimleri (şekil 6D) arasındaki asit Cerayanlar karşılaştırmak için elde edilen fonksiyonların değişim oranlarını karşılaştırmak.
- Asit ekstrüzyon oranı (JS +, bkz: Denklem 3) pHben ve hazırlıklar34arasında yükleme asit dinlenme içinde çeşitleri için hesap için pHben bir fonksiyonu olarak hesaplayın. 8.3. adımda elde edilen Üstel fonksiyonların türevi pHben zaman ile ilgili olarak her zaman aralığında ve hesaplamak için kullanın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Sağlıklı doku ve uygun ön MTs tanımlaması bu protokolü başarısı için önemlidir. Diseksiyon sırasında doğrudan dokunmak MTs özen gösterilmelidir ve tek tanıtıcısına onları doğrudan MTs sürükleyici olarak üreter tarafından kırılması (- 4A şekil B) götürecek. MTs düz slayt süpürüldü vardır, tübüllerin mümkün olduğu kadar az değiştirilmesi gereken ve aşırı hareket bu kadar kaçın?...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Miktar pHben in başarısında Drosophila MTs tamamen ayıklanan MTs ve montaj ve diseksiyonu (Şekil A - C) kalitesini sağlığı üzerinde bağlıdır. Bu nedenle, dikkatli işleme doku açıklanan zorunludur. Taze PLL içinde kaplı slaytlar önemli ölçüde daha fazla yapışkan olma eğilimi olarak yardım MT montaj daha önce kullandığı eriyik-e doğru kayıyor. Dikkatli montaj da ayrı MT kesimleri (Şekil D) tanımlamas...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Bu eser NIH DK092408 tarafından desteklenen ve DK100227 MFR. AJR için T32-DK007013 tarafından desteklenmiştir. Yazarlar Dr Julian A.T. Dow Çapar-GAL4 ve c724-GAL4 için teşekkür etmek istiyorum Drosophila stokları. Ayrıca Jacob B. Anderson deneysel sinek haçlar sürdürmek yardım için teşekkür ediyoruz.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Poly-L-Lysine (PLL) Solution | Sigma-Aldrich | P4832 | Store at 4 °C, can be reused. |
| Nigericin Sodium Salt | Sigma-Aldrich | N7143 | CAUTION: Handle with gloves. Store as aliquots of 20 mM stock solution in DMSO at 4 °C. |
| Adhesive Perfusion Chamber Covers, adhesive size 1 mm, chamber diameter × thickness 9 mm × 0.9 mm, ports diameter 1.5 mm | Sigma-Aldrich | GBL622105 | Can be substituted as needed to match perfusion system. |
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | Available from multiple vendors. |
| Helping Hands Soldering Stands | Harbor Freight Tools | 60501 | Available from multiple vendors. |
| Open Gravity-fed Perfusion System with Valve Controller, 8 to 1 Manifold and Reserviors | Bioscience Tools | PS-8S | Any comparable perfusion system can be used. |
| Flow Regulator | Warner Instruments | 64-0221 | Can be substituted as needed to match perfusion system. |
| Schneider's Medium | Fisher Scientific | 21720024 | Store at 4 °C in sterile aliquots. |
| #5 Inox Steel Forceps | Fine Science Tools | 11252-20 | Can be substituted based on experimenter comfort. |
| 35 x 10 mm polystyrene Petri dish | Corning Life Sciences | Fisher Scientific 08-757-100A | Exact brand and size are unimportant. |
| 75 x 25 mm Microscope Slides | Corning Life Sciences | 2949-75X25 | Exact brand and size can vary as long as perfusion wells are compatible. |
| Filimented Borosilicate Capillary Glass, ID 1.5 mm, OD 0.86 mm, thickness 0.32 mm | Warner Instruments | 64-0796 | Filiment not necessary, glass can be substituted to match perfusion tubing and perfusion wells. |
| Tygon Tubing, ID 1/16", OD 1/8", thickness 1/32" | Fisher Scientific | 14-171-129 | Available from multiple vendors, can be substituted to match perfusion system. |
| Vacuum Silicone Grease | Sigma-Aldrich | Z273554 | Available from multiple vendors. |
| Plastic Flow Control Clamp | Fisher Scientific | 05-869 | Available from multiple vendors, sterility not required |
| Glass rods, 5 mm diameter | delphiglass.com | 9198 | Exact size is personal preference, multiple vendors available |
| PAP Hydrophobic Pen | Sigma-Aldrich | Z377821 | Available from multiple vendors. |
| Sealing Film | Sigma-Aldrich | P7668 | Available from multiple vendors. |
| 15 mL Falcon tube | BD Falcon | 352096 | Available from multiple vendors. |
| 50 mL Falcon tube | BD Falcon | 352070 | Available from multiple vendors. |
| HEPES; 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid | Sigma-Aldrich | H3375 | Available from multiple vendors. |
| MES; 4-Morpholineethanesulfonic acid monohydrate | Sigma-Aldrich | 69892 | Available from multiple vendors. |
| TAPS; N-[Tris(hydroxymethyl)methyl]-3-aminopropanesulfonic acid | Sigma-Aldrich | T5130 | Available from multiple vendors. |
| 10X/0.45 Air Objective | Zeiss | 000000-1063-139 | Comparable objectives can be substituted. 40X objectives can be used for single cell imaging. |
| Dissecting Stereoscope | Zeiss | Discovery.V8 | Any dissecting stereoscope can be used. |
| UAS-pHerry transgenic Drosophila melagnogaster | Available from Romero Lab | First published: Citation 10 | |
| capaR-GAL4 driver line Drosophila melagnogaster | Available from Romero Lab | First published: Citation 32 | |
| c724-GAL4 driver line Drosophila melagnogaster | Available from Romero Lab | First published: Citation 2 | |
| Monochromatic High Sensitivity Digital Camera | Zeiss | Axiocam 506 mono | Exact brand and model can vary, can be replaced with any monochromatic high-sensitivity camera suited to live cellular imaging. |
| GFP/FITC filter set, 470/40 nm ex., 515 nm longpass em., 500 nm dichroic | Chroma | CZ909 | Any GFP/FITC filer set can be substituted. |
| RFP/TRITC filter set, 546/10 nm ex., 590 nm longpass em., 565 nm dichroic | Chroma | CZ915 | Any GFP/FITC filer set can be substituted. |
| Inverted Epifluoescent Microscope | Zeiss | Axio Observer Z.1 | Any comparable microscope with motorized filter switching can be used. Upright microscopes can be used with open perfusion baths and water-immersion objectives. |
| Statistical Analysis Software | Microcal | Origin 6.0 | Any software with comparable functionality can be substituted |
| Image Analysis Software | National Institutes of Health | ImageJ 1.50i | Any software with comparable functionality can be substituted |
| Image Acquisition Software | Zeiss | Zen 1.1.2.0 | Any software with comparable functionality can be substituted |
| Single-edged Carbon Steel Razor Blade | Electron Microscopy Sciences | 71960 | Available from multiple vendors. |
| Microscopy Slide Folder | Fisher Scientific | 16-04 | Available from multiple vendors. |
| Bunsen Burner | Fisher Scientific | 50-110-1231 | Available from multiple vendors. |
| Polystrene Drosophila Rearing Vials with Flugs | Genesee Scientific | 32-109BF | Comparable items can be substituted. |
| 2.5 L Laboratory Ice Bucket | Fisher Scientific | 07-210-129 | Available from multiple vendors. |
| NMDG; N-Methyl-D-glucamine | Sigma-Aldrich | M2004 | Available from multiple vendors. |
| 200 uL barrier pipette tips | MidSci | AV200 | Available from multiple vendors. |
| 200 μL variable volume pipette | Gilson Incorporated | PIPETMAN P200 | Available from multiple vendors. |
Referanslar
- Dow, J. A. T., Romero, M. F. Drosophila provides rapid modeling of renal development, function, and disease. Am J Physiol Renal Physiol. 299 (6), F1237-F1244 (2010).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. P Natl Acad Sci USA. 94 (10), 5207-5212 (1997).
- Davies, S. A., et al. Analysis and inactivation of vha55, the gene encoding the vacuolar ATPase B-subunit in Drosophila melanogaster reveals a larval lethal phenotype. J Biol Chem. 271 (48), 30677-30684 (1996).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. P Natl Acad Sci USA. 101 (37), 13689-13693 (2004).
- Evans, J. M., Allan, A. K., Davies, S. A., Dow, J. A. Sulphonylurea sensitivity and enriched expression implicate inward rectifier K+ channels in Drosophila melanogaster renal function. J Exp Biol. 208 (Pt 19), 3771-3783 (2005).
- Sciortino, C. M., Shrode, L. D., Fletcher, B. R., Harte, P. J., Romero, M. F. Localization of endogenous and recombinant Na(+)-driven anion exchanger protein NDAE1 from Drosophila melanogaster. Am J Physiol Cell Physiol. 281 (2), C449-C463 (2001).
- Ianowski, J. P., O'Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207 (Pt 15), 2599-2609 (2004).
- O'Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274 (4 Pt 2), R1039-R1049 (1998).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. P Natl Acad Sci USA. 111 (39), 14301-14306 (2014).
- Rossano, A. J., Kato, A., Minard, K. I., Romero, M. F., Macleod, G. T. Na+ /H+ -exchange via the Drosophila vesicular glutamate transporter (DVGLUT) mediates activity-induced acid efflux from presynaptic terminals. J Physiol. 595 (3), 805-824 (2017).
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The use of pHluorins for optical measurements of presynaptic activity. Biophys J. 79 (4), 2199-2208 (2000).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat biotechnol. 22 (12), 1567-1572 (2004).
- Thomas, J. A., Buchsbaum, R. N., Zimniak, A., Racker, E. Intracellular pH measurements in Ehrlich ascites tumor cells utilizing spectroscopic probes generated in situ. Biochemistry. 18 (11), 2210-2218 (1979).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Dietzl, G., et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448 (7150), 151(2007).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Hirata, T., et al. In vivo Drosophilia genetic model for calcium oxalate nephrolithiasis. Am J Physiol Renal Physiol. 303 (11), F1555-F1562 (2012).
- Schellinger, J. N., Rodan, A. R. Use of the Ramsay Assay to Measure Fluid Secretion and Ion Flux Rates in the Drosophila melanogaster Malpighian Tubule. J Vis Exp. (105), (2015).
- Caldwell, P. C. An investigation of the intracellular pH of crab muscle fibres by means of micro-glass and micro-tungsten electrodes. J Physiol. 126 (1), 169-180 (1954).
- Boron, W. F., De Weer, P. Intracellular pH transients in squid giant axons caused by CO2, NH3, and metabolic inhibitors. J Gen Physiol. 67 (1), 91-112 (1976).
- Rink, T. J., Tsien, R. Y., Pozzan, T. Cytoplasmic pH and free Mg2+ in lymphocytes. J Cell Biol. 95 (1), 189-196 (1982).
- Bizzarri, R., Serresi, M., Luin, S., Beltram, F. Green fluorescent protein based pH indicators for in vivo use: a review. Anal Bioanal Chem. 393 (4), 1107-1122 (2009).
- Kneen, M., Farinas, J., Li, Y., Verkman, A. S. Green fluorescent protein as a noninvasive intracellular pH indicator. Biophys J. 74 (3), 1591-1599 (1998).
- Raimondo, J. V., Irkle, A., Wefelmeyer, W., Newey, S. E., Akerman, C. J. Genetically encoded proton sensors reveal activity-dependent pH changes in neurons. Front Mol Neurosci. 5, 68(2012).
- Raimondo, J. V., et al. Tight Coupling of Astrocyte pH Dynamics to Epileptiform Activity Revealed by Genetically Encoded pH Sensors. J Neurosci. 36 (26), 7002-7013 (2016).
- Bagar, T., Altenbach, K., Read, N. D., Bencina, M. Live-Cell imaging and measurement of intracellular pH in filamentous fungi using a genetically encoded ratiometric probe. Eukaryot Cell. 8 (5), 703-712 (2009).
- Gjetting, K. S., Ytting, C. K., Schulz, A., Fuglsang, A. T. Live imaging of intra- and extracellular pH in plants using pHusion, a novel genetically encoded biosensor. J Exp Bot. 63 (8), 3207-3218 (2012).
- Greenspan, R. J. Fly pushing: the theory and practice of Drosophila genetics. , 2nd ed, Cold Spring Harbor Laboratory Press. (2004).
- Raimondo, J. V., et al. A genetically-encoded chloride and pH sensor for dissociating ion dynamics in the nervous system. Front Cell Neurosci. 7, 202(2013).
- Koivusalo, M., et al. Amiloride inhibits macropinocytosis by lowering submembranous pH and preventing Rac1 and Cdc42 signaling. J Cell Biol. 188 (4), 547-563 (2010).
- Terhzaz, S., et al. Mechanism and function of Drosophila capa GPCR: a desiccation stress-responsive receptor with functional homology to human neuromedinU receptor. PloS one. 7 (1), e29897(2012).
- Boyarsky, G., Ganz, M. B., Sterzel, R. B., Boron, W. F. pH regulation in single glomerular mesangial cells. I. Acid extrusion in absence and presence of HCO3. Am J Physiol. 255 (6 Pt 1), C844-C856 (1988).
- Chesler, M. The regulation and modulation of pH in the nervous system. Prog Neurobiol. 34 (5), 401-427 (1990).
- Rossano, A. J., Chouhan, A. K., Macleod, G. T. Genetically encoded pH-indicators reveal activity-dependent cytosolic acidification of Drosophila motor nerve termini in vivo. J Physiol. 591 (7), 1691-1706 (2013).
- Roos, A., Boron, W. F. Intracellular pH. Physiol Rev. 61 (2), 296-434 (1981).
- Vaughan-Jones, R. D., Wu, M. L. pH dependence of intrinsic H+ buffering power in the sheep cardiac Purkinje fibre. J Physiol. 425, 429-448 (1990).
- Buckler, K. J., Vaughan-Jones, R. D., Peers, C., Nye, P. C. Intracellular pH and its regulation in isolated type I carotid body cells of the neonatal rat. J Physiol. 436, 107-129 (1991).
- Bevensee, M. O., Schwiening, C. J., Boron, W. F. Use of BCECF and propidium iodide to assess membrane integrity of acutely isolated CA1 neurons from rat hippocampus. J Neurosci Methods. 58 (1-2), 61-75 (1995).
- Arosio, D., et al. Simultaneous intracellular chloride and pH measurements using a GFP-based sensor. Nat Methods. 7 (7), 516-518 (2010).
- Wu, Y., Baum, M., Huang, C. L., Rodan, A. R. Two inwardly rectifying potassium channels, Irk1 and Irk2, play redundant roles in Drosophila renal tubule function. Am J Physiol Regul Integr Comp Physiol. 309 (7), R747-R756 (2015).
- Schulte, A., Lorenzen, I., Bottcher, M., Plieth, C. A novel fluorescent pH probe for expression in plants. Plant Methods. 2, 7(2006).
- Shen, Y., Rosendale, M., Campbell, R. E., Perrais, D. pHuji, a pH-sensitive red fluorescent protein for imaging of exo- and endocytosis. J Cell Biol. 207 (3), 419-432 (2014).
- Johnson, D. E., et al. Red fluorescent protein pH biosensor to detect concentrative nucleoside transport. J Biol Chem. 284 (31), 20499-20511 (2009).
- Mahon, M. J. pHluorin2: an enhanced, ratiometric, pH-sensitive green florescent protein. Adv Biosci Biotechnol. 2 (3), 132-137 (2011).
- Li, Y., Tsien, R. W. pHTomato, a red, genetically encoded indicator that enables multiplex interrogation of synaptic activity. Nat Neurosci. 15 (7), 1047-1053 (2012).
- Tantama, M., Hung, Y. P., Yellen, G. Imaging intracellular pH in live cells with a genetically encoded red fluorescent protein sensor. J Am Chem Soc. 133 (26), 10034-10037 (2011).
- Matlashov, M. E., et al. Fluorescent ratiometric pH indicator SypHer2: Applications in neuroscience and regenerative biology. Biochimica et biophysica acta. 1850 (11), 2318-2328 (2015).
- Kogure, T., et al. A fluorescent variant of a protein from the stony coral Montipora facilitates dual-color single-laser fluorescence cross-correlation spectroscopy. Nat biotechnol. 24 (5), 577-581 (2006).
- Llopis, J., McCaffery, J. M., Miyawaki, A., Farquhar, M. G., Tsien, R. Y. Measurement of cytosolic, mitochondrial, and Golgi pH in single living cells with green fluorescent proteins. P Natl Acad Sci USA. 95 (12), 6803-6808 (1998).
- Poburko, D., Santo-Domingo, J., Demaurex, N. Dynamic regulation of the mitochondrial proton gradient during cytosolic calcium elevations. J Biol Chem. 286 (13), 11672-11684 (2011).
- Stornaiuolo, M., et al. KDEL and KKXX retrieval signals appended to the same reporter protein determine different trafficking between endoplasmic reticulum, intermediate compartment, and Golgi complex. Mol Biol Cell. 14 (3), 889-902 (2003).
- Makkerh, J. P., Dingwall, C., Laskey, R. A. Comparative mutagenesis of nuclear localization signals reveals the importance of neutral and acidic amino acids. Curr Biol. 6 (8), 1025-1027 (1996).
- Zacharias, D. A., Violin, J. D., Newton, A. C., Tsien, R. Y. Partitioning of lipid-modified monomeric GFPs into membrane microdomains of live cells. Science. 296 (5569), 913-916 (2002).
- McGuire, R. M., Silberg, J. J., Pereira, F. A., Raphael, R. M. Selective cell-surface labeling of the molecular motor protein prestin. Biochem Biophys Res Comm. 410 (1), 134-139 (2011).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır