Method Article
Ex Vivo İnsan akciğer tümörü içinde ikamet CD8 T lenfositlerin görüntüleme Confocal mikroskobu kullanma dilim
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu iletişim kuralı insan akciğer tümörü dilimleri içinde fluorescently eşleşmiş antikorlar ile etiketli görüntü ikamet tümör infiltre CD8 T hücreleri bir yöntem açıklanır. Bu teknik CD8 T hücre göç confocal mikroskobu kullanarak gerçek zamanlı analiz izin verir.
Özet
CD8 T hücre kansere karşı mücadelede anahtar oyuncular vardır. CD8 T hücreleri tümör hücrelerini öldürmek için tümör girmeniz gerekir amacıyla, tümör microenvironment içinde göç ve yeterince tümör antijenleri için yanıt. 2-Foton mikroskobu gibi gelişmiş görüntüleme yaklaşımların son gelişmeler ve güçlü fare tümör modellerinin kullanımı bazı anti-tümör T hücre aktivitelerini düzenleyen mekanizmalar ışık. Oysa bu tür sistemlere değerli bilgiler vermişlerdir, onlar her zaman insani tepkilerin tahmin. İnsanda, alanında bizim bilgi çoğunlukla sabit tümör örnekleri vitro çalışmalar yanı sıra insan hastalar için bir açıklama gelir. Ancak, vitro modelleri karmaşık üç boyutlu tümör ortamın olmaması ve bu nedenle, in vivo eksik yaklaşımları T hücre faaliyetlerdir. Explanted dokudan yapılmış taze dilimleri co kültürlü çalışmaları ve hayvan modelleri arasında önemli bir bağlantı olarak hareket edebilir bir karmaşık çok hücreli tümör ortamı temsil eder. Aslında fare lenf düğümleri1 ' ayarlanır ve daha önce açıklanan bir Jüpiter makale2', bu yaklaşım hem kaplama3 hem de ikamet T hücreleri4dinamiklerini incelemek için insan tümörü şimdi aktarılması.
Burada, insan akciğer tümörü dilimleri hazırlanması, immunostaining ikamet CD8 T ve tümör hücrelerinin ve CD8 T lenfosit confocal mikroskobu kullanarak tümör microenvironment içinde izleme için bir protokol açıklanmıştır. Bu sistem benzersiz olduğunu için roman immünoterapi ajanlar tümör T hücre göç lehine ekran yerleştirilmiş.
Giriş
CD8 T hücreleri kansere karşı savaşta önemli bir rol oynar. Ancak, birçok süpresif mekanizmaları T lenfositler Malign hücreler öldürmesini engellemek. Geçen yıllar içinde T hücreleri frene serbest bırakmak birkaç umut verici stratejileri geliştirilmiş ve klinik5' te kullanılan. Bağışıklık denetim noktası hedefleme büyük ilgi korumak iki yaklaşım vardır antikorlar, anti-PD-1 ve aynı zamanda evlatlık T hücre tedavileri gibi. Yine de, son başarıları rağmen yalnızca bir alt kümesini hastalar bu terapiler6' dan yararlanabilirsiniz. Kanserli hastalarda direnç mekanizmaları daha etkin tedavileri geliştirmek için tanımlamak için büyük bir sorun olduğunu. Hangi romanda terapileri olabilir ile karakterize ve onların etki gücüne ve güvenliği için test modeli sistemleri geliştirmek için başka bir sorundur. Şimdiye kadar bu deneyleri en kötü tümör doku karmaşıklığı taklit vitro hücre kültür sistemleri üzerinde temel alır.
Ex vivo dokusu dilimlerin özgün doku microenvironment7korur gibi gelecek vaat eden bir teknik olduğunu. Yıllar boyunca, biz T lenfositler çeşitli dokularda dinamikleri izlemek için bu yaklaşım belirledik. Bizim sonuçları fluorescently etiketli T hücreleri fare lenf nodu dilimleri eklendi dokusu içine göç ve onların uygun microenvironmental ipuçları1,2' ye tepki gösterir. Benzer şekilde, insan akciğer tümörü dilimleri bindirilmiş T lenfositler hızla tümör stroma3işe. Bu tekniği kullanarak, hücre dışı matriks dağıtım ve geçiş içinde insan tümörler3,4T hücrelerinin denetlenmesinde önemli bir unsur olarak belirledik. Ex vivo davranışını saflaştırılmış ve kaplama T hücreleri mutlaka ikamet intratumoral T lenfositler davranışını yansıtmamaktadır çünkü son zamanlarda bu yaklaşım4iyileştirdiyseniz.
Burada ikamet T lenfositler taze insan akciğer tümörleri yapılan dilimleri içinde izlemek için bir protokol açıklayın. Endojen T hücreleri floresan antikor taze tümör dilimleri ve izlenmesi ile boyama (özel gömme ve katıştırılmış dokusunun vibratome kesit dahil olmak üzere) insan akciğer tümörü dilim hazırlanması farklı adımları oluşur Bu hücreler ile confocal mikroskop.
Protokol
İnsan tümörler Fransız Etik Komitesi ve Fransız kanun madde L.1121-1 ile uygulamadaki yardım Publique Hôpitaux de Paris (AP-HP) tarafından anlaşma ile elde edilmiştir. Yazılı Onam dahil çalışmada önce hastalardan elde edildi.
1. insan akciğer tümörleri alma
- Taze akciğer tümörü örneklerini sahne ı-III küçük hücreli dışı akciğer kanseri ile onların akciğer tümörleri4tam bir cerrahi rezeksiyon yapılan hastalardan almak.
- 15 mL konik tüp buz gibi Roswell Park Memorial Enstitüsü (RPMI 1640) orta içeren sabit olmayan taze tümör taşıma. Bir kenara 30 dakika buzda adım kadar 2.7 koyun.
Not: tümör öğleden sonra aldığında, onları gecede 4 ° C ve işlem ertesi gün koyunuz. Bu durumda, % 5 fetal sığır serum (FBS) ile RPMI-1640 medya ek.
2. özel gömme ve vibratome insan akciğer tümörleri Dilimleme
Not: 2.10 steril koşullarda kadar tüm adımları gerçekleştirin.
- % 5 özel çözüm 1 g düşük erime noktası özel 20 ml steril fosfat tamponlu tuz (PBS) kalsiyum ve magnezyum olmadan çözülerek gömmek için hazırlayın. Özel tamamen eriyene kadar bu çözüm mikrodalga. 37 ° C'de yanında duvar ilanı belgili tanımlık eriyik 5 min için bir kuluçka-37 ° C'de soğutmak özel izin.
- Bir doku kültürü başlık, % 10 fetal sığır serum (FBS), 4 mM L glutamin ve 1 x penisilin ve streptomisin içeren tam RPMI-1640 orta (olmadan fenol red) hazırlayın.
- 1.1 mL tam RPMI-1640 orta iyi başına bir 6-şey hücre kültür plakasına eklemek ve bir 30 mm hücre kültür eklemek her kuyuya yerleştirin. Plaka kuluçka 37 ° C'de 30 dk kadar adım 2.12 bir kenara.
- Yer paslanmaz çelik düz rondelalar (dış çapı 10 mm ve kalınlığı 1 mm 5 mm iç çap) RPMI tam orta ile dolu bir 35 mm plastik tabak içinde sterilize. Contalar, antikorlar vibratome-cut dilim üzerinde konsantre olmaya daha fazla kullanılır.
- Tümör biyopsi bir 10 cm plastik tabak yerleştirin ve tümör yaklaşık 5 x 5 mm Uzunluk küçük küp şekil parçalara keskin bir bıçakla kesti.
- Kuluçka makinesi üzerinden özel çıkar ve çözüm bir 35 mm plastik tabak içine dökün.
- Forseps çifti dikkatle tümör parçaları orta fazlalığı silmek için bir doku temizleme işlemi aktarmak için kullanın. Özel parçalar eklemek ve plastik tabak dibinde pozisyon. Özel jel buz kuvvetlendirmek 5 min için açık bırak.
- Bir kez özel katılaşır, plastik tabak ters çevir ve tüm jel serbest bırakmak için bir spatula kullanın.
- 3-5 mm jel etrafında doku bırakarak tümör parçası çevreleyen aşırı özel kırpmaya keskin bir bıçak kullanın.
- Her özel blok vibratome numune disk toksik olmayan butil siyanoakrilat doku tutkal bir damla ile bağlama. Vibratome arabellek tepsi steril buz gibi PBS ile doldurun ve numune disk tepsisine yükleyin.
- Kesme özel doku 350 µm kalınlığında dilimler halinde gömülü. Bir yavaş aralığı hızda vibratome ayarlarını (0.2-0.3 mm/s) ve orta menzilli (1.5 mm) titreşim frekansında.
- Onlar kesilmiş olma ve düz hücre kültür ekler (Adım 2.3) 6-şey plaka koyun gibi iyi forseps kullanarak, tümör dilimlerini dikkatli bir şekilde toplayın. 1 dilim üzerinde her ekleme aktarın. Büyük kolayca zarar görebilir olarak dilimleri ele alırken dikkatli olun.
- İyi forseps bireysel her dilim üzerinde paslanmaz çelik contalar eklemenizi sağlar. Contalar de tümör doku çevreleyen özel konumlandırıldığından emin olun.
- Kültür plaka 10 dk. devam et immunostaining bir % 5 CO2 oksijen kuluçka 37 ° C'de korumak.
3. Immunostaining ikamet CD8 T hücreleri ve tümör hücreleri
- Antikorlar (son konsantrasyonu 10 µg/mL) ve RPMI-1640 medya fenol red olmadan nükleer boya (son konsantrasyonu 1 µg/mL) oranında seyreltin.
Not: fluorescently birleştiğinde anti-CD8 kullanın (fare IgG, SK1 clone) ve anti-EpCAM (epitel hücre adezyon molekül) (fare IgG HEA-125) antikorları CD8 T lenfositler ve tümör epitel hücreleri, sırasıyla etiketlemek için. Fluorescently birleştiğinde anti-CD90/Thy1 (fare IgG, klon 5E10) antikor etiket fibroblastlar ve aktive endotel hücreleri için kullanın. 4', 6-diamidino-2-phenylindole (DAPI) doku viability değerlendirmek için güvenliği aşılan bir plazma zarı içeren hücrelerin çekirdeği etiketlemek için kullanın. - Kültür plakaları kuluçka makinesi kaldırmak ve paslanmaz çelik contalar içine herhangi bir sıvı Aspire için bir pipet kullanın. Hücre kültür ekler (Adım 2.3) altında yerleştirilen 1.1 mL RPMI-1640 medya kaldırmaz.
- Dilimi dokunmaktan ve pipet ucu kullanarak olmadan 40 µL her tümör dilimin üzerine antikorlar içeren çözüm ekleyin.
- Antikor boyama izin vermek 15 dakika 37 ° C'de plaka kuluçkaya.
- İyi Forseps ile contalar kaldırmak için dilim ve DIP onları 10 s RPMI-1640 medya fenol red olmadan dışarı çıkar. Geri hücre kültür ekler üzerine dilimler yerleştirin ve fenol red-Alerjik RPMI-1640 bir damla ekleyin her bireysel dilim üzerinde orta. Plaka 10 dk. devam et için 37 ° C'de görüntüleme için korumak.
4. görüntüleme ve ikamet CD8 T hücre göç insan akciğer tümörü dilimleri içinde analiz
Not: Bu protokol için kullanılan confocal mikroskop bir dik bir 25 x su daldırma amacı ile donatılmış disk iplik olduğunu (25 x / 0.95 N.A.).
- Mikroskop kurulum hazırlama
- Mikroskop ısı-odası sıcaklık görüntüleme oturum başlamadan önce bir kaç saat 37 ° C'de ayarlayın.
- Sürekli tümör dilimleri ile sıvı için bir sistem kurmak oksijenli (%5 CO2, % 95'i O2) fenol red-Alerjik RPMI orta (şekil 1). Peristaltik pompa görüntüleme odasına perfüzyon medya akışı ve bir atık toplama şişesi çözümü Aspire edin için kullanın.
- Peristaltik pompa oksijenli çözüm perfüzyon tüpler gitmek için izin çalıştırın.
- 6-şey plaka ve 35 mm plastik tabak için fenol red-Alerjik RPMI orta ile dolu transfer dilimden iyi Forseps ile çıkar. Dilim 19.7 mm çap dilim gövde ile aralıklı 2 mm-iplik ile hareketsiz. Petri kabına mikroskop düşsel sahnesinde yerini. Giriş ve çıkış ipuçları perfüzyon sistemi bağlayın. Perfüzyon sistemde açın ve medya akış hızı 0.8 mL/dk için ayarlayın.
- Dilim için su-daldırma hedefi indirin. Parlak alan ışığı dilimle üst odaklan.
Not: Sadece bir azınlık kesme yüzeyinden birkaç mikron, DAPI pozitif hücrelerinin sağlıklı bir dilim içerir.
- 3 fluorophores floresan sinyal şiddeti bağlı olarak 50-800 ms ve lazer yoğunluğu % 20-40 arasında arasında pozlama süresi ayarlayın.
- Z yığın kalınlık tümörün dilim içinde görüntü için seçin.
Not: Burada, 10-12 optik uçak toplam z boyut 60-70 µm derinliğe kapsayan ele geçirildi. - Aşağıda ilk etiketli CD8 T hücreleri yaklaşık 10 µm, başlangıç konumu seçin.
- Her z-yığın görüntü 10-30 arasında arasındaki zaman aralığını tanımlamak s ve toplam kayıt süresi 10-30 dk arasında.
- Bir izleme yazılımı için veriyi aldıktan sonra her CD8 T hücre için noktalar alanında oluşturun. Hücreleri çapını ve görüntülü floresan hücreleri üzerinde göre algılama eşik ayarlayın.
- Parçaları incelemek ve alakasız herhangi bir parça bunları silerek kaldırabilirsiniz. Bağlanma ve farklı izler ve farklı zaman noktaları aynı parça kesme tarafından doğru parça. (Parça hız, takip öteleme süresi) verileri bir elektronik tablo yazılımı için verin.
Sonuçlar
İnsan akciğer tümörleri genellikle son derece tercihen stroma3,4' te bulunan CD8 T hücrelerinde sızmış. Bu iletişim kuralı takip ederek bir immunostained CD8 T insan akciğer tümörü dilimleri içinde çok sayıda görselleştirmek bekleyebilirsiniz. Bir anti-EpCAM ve anti-CD90 antikorları ile birlikte etiketleme tümör adacıkları ve stromal alanları betimlemek için izin. Fibriler kollajen, tümör stroma bol bir iki fotonlu mikroskop3,4ikinci harmonik üretimi kullanarak eksojen boyama olmadan görüntülenmeyecektir. Not Bazı insan akciğer tümörleri tümör adacıkları ve stroma ayırımı yoktur açık mevcut. Bu tür tümör hücre nekroz non-spesifik bağlama antikorların ve DAPI boyama ile tanınan geniş alanlar sunan numune yanı sıra atılmalıdır. Yayınlanan sonuç elde ile tutarlı insan akciğer ve yumurtalık karsinomlar, ikamet CD8 T hücreleri daha tümör adacıkları4' e göre stroma içinde yoğunlaşmıştır. CD8 T hücre dağıtım tümör hücreleri ve CD90 ile ilgili olarak temsil edici bir örnek Şekil 2' de gösterilmiştir.
Dilim tahlil farklı tümör bölgelerinde ikamet T hücre hareketliliği analizi için izin verir. CD8 T hücre hareketliliği farklı bölgelerdeki karşılaştırmak için yararlı ölçüt ortalama hız (örnek zaman süresine yol uzunluğu) ve deplasman uzunluğu (başında ve sonunda bir parçanın arasında vektör) içerir. Kıt her ne kadar tümör adacıkları, CD8 T hücreleri (şekil 3) stroma karşılaştırıldığında bu yerde daha aktif göç eder. Ortalama, ortalama hız bireysel CD8 T hücrelerinin tümör stroma yüksek iç ve arası tümör variabilities44 µm/min yakın olması gerekir. Tümör stroma ikamet T hücreleri hareket güçlü yoğunluğu ve hücre dışı matriks lifleri3,4yönünü tarafından etkilenir. Başarılı bir deneme daha az T hücreleri gevşek matris bölgeler, yayımlanmış sonuçları3,4ile tutarlı göre yoğun matris alanlarda mevcut neden olur.
Bazı insan akciğer tümörleri görüntüleme ikamet T hücrelerinin iyileştirmelerden autofluorescence çok yüksek bir düzeyde sergi unutmayın. Böyle özelliği hızla görüntüleme oturumun başlangıcında görülmektedir. Autofluorescent tümörler atılmalıdır. Temsil edici bir örnek bir autofluorescent tümör ikamet CD8 T hücrelerinin şekil 4' te gösterilmiştir.

Şekil 1: fotoğraf perfüzyon sistemi. A) fenol red-Alerjik RPMI çözüm %5 C02' de, % 95'i O2zenginleştirilmiştir. B) çözüm sonra Peristaltik pompa tarafından periosteum. C) RPMI çözüm yolu ile giriş kültür çanak girer. Çıkış, çözüm Pompa Odası üzerinden bir atık konteyner içine emişli. Aspirasyon ucu bir düzeyde çözüm yüksekliği belirlemek için ayarlanır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
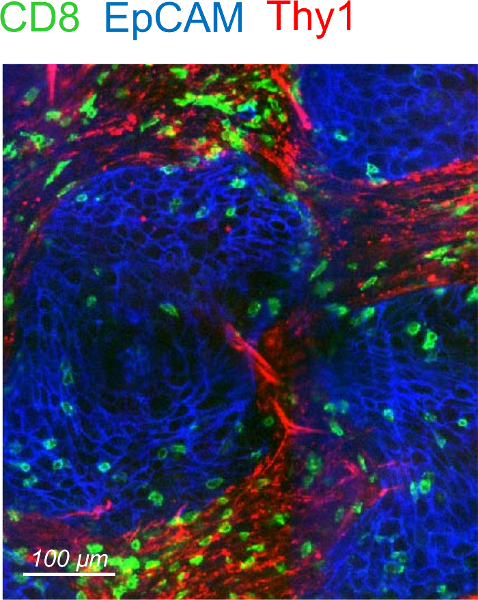
Şekil 2: dağıtım ikamet CD8 t hücreleri bir insan akciğer tümörü. Bir insan akciğer tümörü dilim temsilcisi görüntü EpCAM (mavi) ve CD90 (yeşil) CD8 (kırmızı) lekeli. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
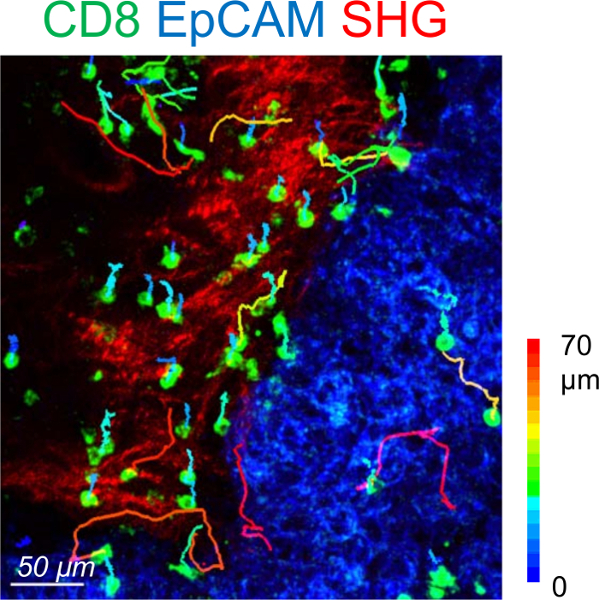
Şekil 3: hareketliliği ikamet CD8 t hücreleri bir insan akciğer tümörü. Yörüngeler stromal (kırmızı) ve tümör hücre (mavi) bölgelerde bir insan akciğer Karsinomu dilim bireysel ikamet CD8 T hücrelerinin. Dilimi ile belirtilen antikorlar lekeli ve 20 dk confocal mikroskop görüntüsü. Fibrillary kollajen sonunda ikinci harmonik üretimi (SHG) üzerinde iki fotonlu mikroskop kullanarak tespit edildi. Parça CD8 T hücre deplasman uzunluğuna göre renk kodlu. Bu görüntü 4ile değiştirildi. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
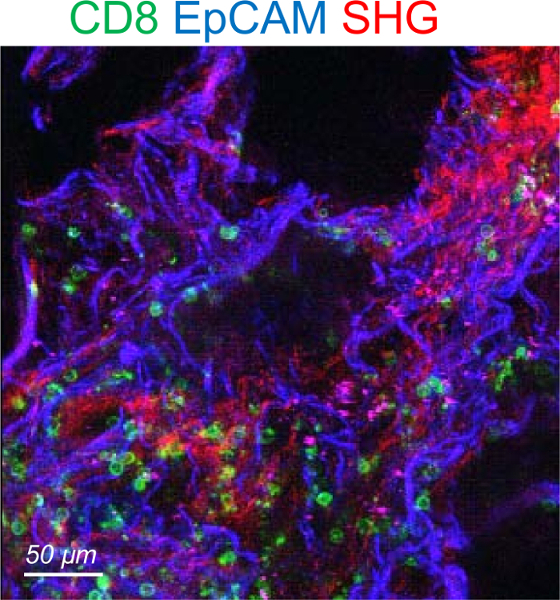
Şekil 4: bir autofluorescent insan akciğer tümörü temsilcisi görüntüsünü. Tümör dilim CD8 (yeşil) ve EpCAM (mavi) lekeli. SHG sinyal kırmızıdır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Tartışmalar
İnsan akciğer tümörü dilimleri ve ikamet CD8 T hücrelerinin dinamik davranış değerlendirilmesi confocal bir mikroskop kullanarak bir korunmuş tümör ortamında oluşturmak için basit, hızlı ve güçlü bir teknik açıklanmıştır. Bu bir arıtma kaplama T hücreleri üzerine fare lenf nodu dilimleri2izleme açıklar önceki Jüpiter yazı bir protokoldür.
Floresan boyalar ağartma floresein isothiocyanate ve phycoerythrin gibi ilk nesil boyalar ile özellikle dikkate alınmalıdır. Antikorların birleştiğinde-doğrudan belirgin bir photobleaching İki fotonlu mikroskop ile oluştu bulundu. Bunun tersi olarak, en az photobleaching confocal mikroskoplar özellikle son zamanlarda geliştirilen parlak floresan boyalar kullanılarak, fark edildi.
Antikorlar nispeten büyük moleküllerdir ve bu nedenle onların penetrasyon doku içine zor olabilir. Bu adımı kuluçka süresi artırarak geliştirilebilir. Buna ek olarak, daha küçük bir kullanım gibi doğrudan eşleşmiş reaktifler antikorlar temsil Fab parçaları iyi bir alternatif boyama.
Bu protokol için açıklanan tüm antikorlar önceden doğrulanmış ve parlak boyama4üretmek bilinmektedir. Bu nedenle, izotip denetimleri gerekli değildir. Bu yöntem diğer antikorları kullanarak değişiklik isterseniz, ancak, o zaman izotip kontrol antikor kullanımı önerilir.
Bu deneysel sistem bazı sınırlamalar sunar. Kesme yordamı CD8 T hücreleri, özellikle kesme yüzeye yakın davranışını etkileyebilir doku zarar verir. Buna ek olarak, bir dizi çözünür faktörler (örneğin kemokinler) T hücrelerinin geçiş kontrolünde enstrümantal kaybolabilir. Bu sorunların atlamak için bir yol mikron muhtemelen sağlıklı doku bölgelerinde yüzeyinden birkaç onlarca konumundaki T hücreleri izleme tarafından çok önemlidir. Yayımlanmış deneyler T hücreleri derin doku içinde lokalize kesmek yüzey4lokalize T hücreleri daha etkin bir şekilde geçirmek ortaya koyuyor. Biz-si olmak kullanılmış confocal mikroskoplar çalışmalarımız için ancak iki fotonlu mikroskoplar Uzaysal çözünürlük derinliği artacak yüksektir.
Bu yaklaşım nötr moleküller değildir fluorescently birleştiğinde antikorlar kullanımına dayanıyor. Tam boyutlu antikorlar normal T hücrelerinin farklı şekillerde çalışması etkilemeye yatkındır. İlk olarak, anti-CD8 antikorlar lenfosit sitoiskeleti etkileyen yeteneğine sahip bir hücre içi sinyal cascade tetikleyen tarafından T hücre göç değiştirebilirsiniz. İkinci olarak, anti-CD8 antikorlar CD8 ve MHC arasındaki etkileşimi modüle sınıf ı molekülleri, Antijen tanıma sürecinde önemli bir adım. Üçüncüsü, bozulmamış antikorlar tarafından birçok myeloid hücrelerin tümör içinde dağıtılmış ve bu nedenle duyarlı ifade Fc reseptörü non-spesifik sinyal artırmak için bağlayabilirsiniz. FC reseptörü ikamet myeloid hücre kültüründe hücreleri immünglobulin tümör ortamın içinde mevcut ile doygun çünkü biz muhtemelen böyle bir sorun bizim veri etkilenen hiçbir belirti vardır. Nitekim, serum ek etiketleme işlemi, ücretsiz Fc reseptörü, engellemek için bilinen bir işlem sırasında immün boyama değişmedi. Yine de, onların Fc bölgede antikorlar, Fc bölge, aynı zamanda antikorlar yoksun Fab parçaları mutasyona ve Devegiller elde edilen antikor parçaları8 ikamet hücreleri ile floresan tarayıcıları izlemek için diğer alternatif stratejileri temsil eder.
Son on yıl içinde birkaç model sistemleri geliştirilmiş ve T lenfositleri gerçek zamanlı görüntüleme için kullanılan. Bunlar, vitro hazırlıkları T hücreleri daha önce saflaştırılmış ve kültürlü ile antijen sunan hücreler içerir. Bu tür hazırlıklar Antijen tanıma ve yanıt verme mekanizmaları tanımlamalarındaki kayda değer ilerleme sağladı. Ancak, onlar doku ortamının karmaşıklığı eksikliği. Diğer hazırlıklar daha yakından bir yerel doku yapısı taklit kurulmuştur. Örnekler için üç boyutlu kollajen jel matrisler arıtılmış T hücreleri, yanı sıra kültür reaggregated doku parçaları T lenfositler dinamik davranışı teknolojileri9 Imaging floresan ile izlemek için kullanılan katıştırılmış . Bu sistemler bir mimari yerel doku yakın avantajı mevcut ama diğer önemli hücresel ve çözünür faktörler eksik. Fare, İki fotonlu intravital mikroskobu T hücreleri bir bozulmamış organ10gerçekten fizyolojik ortamında izlemek için istihdam edilmiştir. Ancak, böyle bir yaklaşım tuzağa düşürmek teknik olarak zordur. Ayrıca, fare modelleri insan fizyolojisi ile dikkate değer farklılıklar gösterir.
Bu protokol için açıklanan tekniği ortak kültür çalışmaları ve hayvan modelleri arasında önemli bir bağlantı olarak hareket için benzersiz olarak konumlandırılmış bir karmaşık çok hücreli tümör ortamı temsil eder.
Burada açıklanan protokol diğer hücreleri CD8 T lenfositler antikor oluşturulmuş olan daha hareket izlemek için de kullanılabilir. Ayrıca, teknik diğer insan ve fare tümörleri ve dokular için adapte edilebilir. Örneğin, biz gerçek zamanlı B hücreleri dinamikleri etiketli görüntü taze insan bademcikler bir anti-CD19 antikor ile mümkün olmuştur.
Bu protokol için açıklanan tekniği tedavi molekülleri T hücre hareketliliği dokularda kontrol ekranına sağlar. Kültür sisteminin erişilebilirlik bazı farmakolojik reaktifler uygulamak ve sonuçlarını T hücre göç test etmek için izin verir. Şimdi tümörler büyüyor, CD8 T hücreleri düşük geçiş sergi kabul edilir ve tümör hücreleri11kişilerle düşük. Önemlisi, T hücreleri tümör hücre bölgelerde kıt varlığı ile kötü bir sonucu ilişkilidir ve T hücre tabanlı kanserli hastalarda için direnç mekanizmaları olarak kabul edilir. Birden çok engeller T hücre tümörleri içinde göç dan sınırlama yoğun bir hücre dışı matriks de dahil olmak üzere tespit edilmiştir. Bu bağlamda, moleküller kötü huylu hücreleri ile etkileşim ve T hücre hareket geri yükleme olanağınız tanımlaması kanserli hastalarda önemli bir adım temsil eder. Bir önceki çalışmada bulduk kollajen collagenase, akut insan akciğer dilimlere uygulanan ile kısmi bozulma T hücrelerinin tümör hücreleri ile ilgili geliştirir.
Son olarak, olasılığı kadar birkaç gün7,12,13 için kültüründe insan tümör dilimleri tutmak için umut verici uygulamalar içinde dönem-in T hücreleri ve immünoterapi sunmaktadır.Ancak, uzun vadeli kültür sırasında modeli sisteminin istikrarı iyice değerlendirilmesi gereken bir önemli parametredir.
Taze ve sağlıklı doku almak iyi immunostaining kalite dilimlerle CD8 hücreleri, tümör hücreleri ve stromal öğeleri üretmek için kritik bir faktördür. Tümör biyopsi işlemeden önce 4 ° C'de tutmak çok önemlidir.
Dilimleri ince Forseps ile işlenmesi bu protokol içinde başka bir kritik adımı temsil etmektedir. Özel kolayca zarar görebilir gibi bu büyük bir özenle yapılmalıdır. Özel bir kesim çözümleri içeren antikor bir sızıntı kaynaklanan paslanmaz çelik çamaşır makinesi tarafından yapılan mühür tehlikeye sokacaktır.
Açıklamalar
Hiçbir çıkar çatışmaları ilan etti.
Teşekkürler
Mikroskoplar ile Pierre Bourdoncle ve Thomas Guilbert tesisin Cochin Imaging (Institut Cochin, Paris) tavsiye ve yardım için teşekkür etmek istiyorum. Bu eser kısmen Fransızca Ligue Nationale contre le CARPEM (kanser araştırmaları için kişiselleştirilmiş tıp), tarafından kanser gelen hibe Fondation de France ve Avrupa Birliği'nin ufuk 2020 araştırma ve yenilik program kapsamında hibe tarafından desteklenen bir durumdu Sözleşme No 667980 (ayar).
Malzemeler
| Name | Company | Catalog Number | Comments |
| Upright confocal microscope | Leica | The use of a spinning disk confocal is recommended | |
| Imaris software | Bitplane | This sofware is used for visualization of images and tracking of T cell migration | |
| Vibratome | Leica | VT1200S | |
| Fine Forceps | World Precision Instruments | 14142 | |
| 30 mm Culture inserts | Millipore | PICM0RG50 | |
| Roswell Park Memorial Institute (RPMI) medium, GlutaMAX Supplement | ThermoFisher | 61870010 | Complete RPMI-medium is made by adding 10 % heat-inactivated fetal calf serum and Penicillin/streptomycin |
| Phosphate-buffered saline (PBS) | ThermoFisher | 20012019 | |
| Hanks’ Balanced Salt Solution (HBSS) | Invitrogen | 14170088 | |
| Low gelling temperature Agarose, type VII-A | Sigma-Aldrich | A0701 | |
| Non-toxic butyl Cyanoacrylate Glue, Vetbond | 3M | 1469 | |
| Slice anchors, 19.7 diameter, 2 mm spacing threads | Warner Instruments | 64-1415 | |
| Stainless steel washers, 5 mm of inner diameter | Amazon | B004K1FDGQ | |
| BV605-conjugated anti-CD8 (clone SK1) | BD Biosciences | 565289 | |
| FITC-conjugated anti-EpCAM (clone HEA-125) | Miltenyi Biotec | 130-098-113 | |
| BV510-conjugated anti-CD90 (clone 5E10) | Biolegend | 328125 | |
| 4',6-diamidino-2-phenylindole (DAPI) | ThermoFisher | D1306 |
Referanslar
- Asperti-Boursin, F., Real, E., Bismuth, G., Trautmann, A., Donnadieu, E. CCR7 ligands control basal T cell motility within lymph node slices in a phosphoinositide 3-kinase- independent manner. J Exp Med. 204 (5), 1167-1179 (2007).
- Salmon, H., et al. Ex vivo imaging of T cells in murine lymph node slices with widefield and confocal microscopes. J Vis Exp. (53), e3054 (2011).
- Salmon, H., et al. Matrix architecture defines the preferential localization and migration of T cells into the stroma of human lung tumors. J Clin Invest. 122 (3), 899-910 (2012).
- Bougherara, H., et al. Real-Time Imaging of Resident T Cells in Human Lung and Ovarian Carcinomas Reveals How Different Tumor Microenvironments Control T Lymphocyte Migration. Front Immunol. 6, 500 (2015).
- Mandal, R., Chan, T. A. Personalized Oncology Meets Immunology: The Path toward Precision Immunotherapy. Cancer Discov. 6 (7), 703-713 (2016).
- Wolchok, J. D., et al. Nivolumab plus ipilimumab in advanced melanoma. N Engl J Med. 369 (2), 122-133 (2013).
- Vaira, V., et al. Preclinical model of organotypic culture for pharmacodynamic profiling of human tumors. Proc Natl Acad Sci U S A. 107 (18), 8352-8356 (2010).
- Rashidian, M., et al. Noninvasive imaging of immune responses. Proc Natl Acad Sci U S A. 112 (19), 6146-6151 (2015).
- Wolf, K., et al. Collagen-based cell migration models in vitro and in vivo. Semin Cell Dev Biol. 20 (8), 931-941 (2009).
- Germain, R. N., Robey, E. A., Cahalan, M. D. A decade of imaging cellular motility and interaction dynamics in the immune system. Science. 336 (6089), 1676-1681 (2012).
- Joyce, J. A., Fearon, D. T. T cell exclusion, immune privilege, and the tumor microenvironment. Science. 348 (6230), 74-80 (2015).
- Gerlach, M. M., et al. Slice cultures from head and neck squamous cell carcinoma: a novel test system for drug susceptibility and mechanisms of resistance. Br J Cancer. 110 (2), 479-488 (2014).
- Holliday, D. L., et al. The practicalities of using tissue slices as preclinical organotypic breast cancer models. J Clin Pathol. 66 (3), 253-255 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır