Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Fotoğrafa Duyarlı Polimerik Nanokarbonlardan SiRNA Salınımının Spatiotemporal Kontrolü ile Gen Silenceresinin Öngörülmesi
Bu Makalede
Özet
Saptanabilir hedef dışı etkiler olmaksızın gen susturulmasının daha verimli dağılma zamanı kontrolü için foto-tepki blok kopolimerleri kullanan yeni bir yöntem sunuyoruz. Ek olarak, gen ekspresyonundaki değişiklikler basit siRNA salım deneyleri ve basit kinetik modelleme kullanılarak tahmin edilebilir.
Özet
Yeni malzemeler ve yöntemler iyi gen aktivitesi kontrol gerektiren uygulamalarda geniş bir nükleik asitlerin serbest bırakılması genel bağlanma kontrol etmek için ihtiyaç vardır. Özellikle, gen ekspresyonu üzerine geliştirilmiş spyatemporal kontrol ile yeni uyarı-tepki veren malzemeler, ilaç keşfi ve rejeneratif tıp teknolojilerinde çevrilebilir platformların kilidini açacaktır. Dahası, nükleik asit salınımını kontrol eden gelişmiş bir yetenek, materyallerin nano taşıyıcı etkinliğini önceden tahmin etmede aerodinamik yöntemlerin geliştirilmesini sağlayarak, teslimat araçlarının hızlandırılmış taramasına neden olabilir. Burada, gen susturucu etkinliklerini tahmin etmek ve modüler bir foto-tepki veren nanocarrier sistemi vasıtasıyla gen ekspresyonu üzerine spatiotemporal kontrol sağlamak için bir protokol sunuyoruz. Küçük müdahale edici RNA (siRNA) mPEG- b -poli (5- (3- (amino) propoksi) -2-nitrobenzil metakrilat) (mPEG- b -P (APNBMA)) fo polimerler ile kompleks haline getirilirAyarlanabilir, açma / kapama siRNA'yı serbest bırakmak için ışıkla kontrol edilebilen rm kararlı nanokarbonlar. Floresan korelasyon spektroskopisi ve jel elektroforezini kullanarak, hücre içi ortamları taklit eden solüsyondan alınan siRNA salınımının doğru bir şekilde hesaplanması için iki tamamlayıcı analizin ana hatlarını çiziyoruz. Bu tahlilden elde edilen bilgiler, çeşitli ışık uyarı koşullarına karşı dinamik susturma tepkilerini öngörmek için basit bir RNA girişim (RNAi) kinetik modeline dahil edildi. Buna göre, optimize edilmiş ışınlama koşulları, spesifik olmayan gen sessizliğini kontrol etmek için yeni bir protokolün arıtılmasına izin verdi. Bu yöntem, hücre-hücre çözünürlüğü ve belirlenemeyen hedef dışı etkileri olmayan gen ekspresyonunda hücresel modeller üretebilir. Birlikte ele alındığında, yaklaşımımız gen ifadesinde dinamik değişiklikleri tahmin etmek ve mekanda ve zaman zarfında siRNA etkinliğini tam olarak kontrol etmek için kullanımı kolay bir yöntem sunmaktadır. Bu test seti çok çeşitli otBiyomedikal araştırma ve tıbbında çok sayıda uygulamayla ilgili temel zorlukları gidermek için uyarıcı tepkisel sistemler.
Giriş
Az yer kaplayan RNA'lar (siRNA'lar), son derece spesifik, güçlü ve hemen hemen her hedef gen 1 için uyarlanabilir bir katalitik RNAi yolu ile transkripsiyon sonrası gen susturulmasına aracılık eder. Bu umut verici özellikler, siRNA terapötiklerinin insan klinik çalışmalarında metastatik melanom ve hemofili 2 , 3 dahil birçok hastalığın tedavisinde ilerlemesine imkân sağladı. Bununla birlikte, önemli dağıtım sorunları devam etmektedir 4 çeviri engelledi. Özellikle, nakil araçları istikrarlı kalmalı ve siRNA'ları hücre dışı bozulmadan korumalı, aynı zamanda sitoplazmada 5 yükü serbest bırakmalıdır. Dahası, birçok RNAi uygulaması siRNA terapötiklerinin 7 yan etkilerini azaltacak ve dönüştürücü a'yı etkinleştiren, gen silencingini uzayda ve zamanda 6 düzenlemeye yönelik gelişmiş yöntemler gerektirir.İlaç keşfi 8 için hücre mikroarray'lerinden rejeneratif iskelelerde hücre tepkilerinin modülasyonuna kadar uzanan uygulamalardaki gelişmeler 9 . Bu zorluklar siRNA nano taşıyıcılar içinde serbest bırakılması vs bağlayıcı yeni malzemeler ve daha iyi kontrol yöntemlerine duyulan ihtiyacı vurgulamaktadır.
SiRNA salınımını kontrol etmek ve spatiotemporal regülasyonu arttırmak için en umut verici stratejilerden biri uyarana cevap veren materyallerin kullanılmasıdır 10 . Örneğin, değiştirilmiş redoks potansiyeli veya pH, ya da uygulanan manyetik alanlar, ultrason ya da ışık 11'e yanıt olarak değişebilir nükleik asit bağlanma afinitesi ile çok çeşitli biyomalzemeler geliştirilmiştir. Bu sistemlerin birçoğu nükleik asit aktivitesi üzerinde gelişmiş kontrol sağladığına rağmen, ışığın tetikleyici olarak kullanılması, ani geçici tepki, hassas mekansal çözünürlük ve ayarlanabilirlik kolaylığı nedeniyle özellikle avantajlıdır 12. Dahası, gen ekspresyonunu düzenleyen foto-duyarlı teknolojilerin potansiyeli, en modern teşvik edici promotör ve optogenetik düzenleyici sistemler tarafından gösterilmiştir; Bununla birlikte, bu sistemler, sınırlı endojen genleri düzenleyen kapasitelerin böyle immünojenisite gibi güvenlik kaygıları ve çok bileşenli tertibatları 13, 14, 15 teslim zorluklar dahil olmak üzere çeşitli zorluklar çeker. Foto-duyarlı siRNA nanokarbonları, bu dezavantajların üstesinden gelmek ve gen ekspresyonunu spesifik olarak modüle etmek için daha basit ve daha sağlam bir yaklaşım sağlamak için idealdir ( 16 , 17 , 18) . Ne yazık ki, ortaya çıkan protein knockdown tepkisini doğru bir şekilde öngörmeye yönelik yöntemler kaçınılmaz kalmaktadır.
Kilit bir zorluk, siRNA salımının kantitatif değerlendirilmesidirBu değerlendirmeler yapılmaktadır bile az 19, 20, ve, bu da siRNA / protein devir dinamiklerinin analizlere bağlanmış edilmemiştir. Hem salınan siRNA miktarı hem de kalıcılığı / ömrü, ortaya çıkan gen susturucu dinamiklerinde önemli belirleyicilerdir; Dolayısıyla, böyle bir bilginin eksikliği, RNAi 21'deki doz yanıtının doğru şekilde tahmin edilmesine engel olan önemli bir bağlantı kesitidir. Bu zorluğun çözülmesi, nanocarrier'lerde uygun yapı-fonksiyon ilişkilerinin formülasyonunu hızlandıracak ve biyomateryal tasarımları daha iyi bilgilendirecektir 22 . Dahası, bu gibi yaklaşımlar, daha etkin siRNA dozlama protokollerinin geliştirilmesini mümkün kılabilir. Dinamik susturma tepkisini anlama girişiminde, birkaç grup RNAi 23 , 24 , 25'in matematiksel modellerini araştırdı. Bu çerçeveler;Gen ekspresyonunda siRNA aracılığındaki değişikliklere ilişkin görüş sunma ve hızı sınırlayan aşamaları tanımlama konusunda başarılı olma 26 . Bununla birlikte, bu modeller kontrol siRNA salım yeteneğine sahip değildir ticari gen iletim sistemleri (örneğin, Lipofektamin ve polietilenimin (PEI)) tatbik edilmiştir, ve model karmaşıklık, faydalarını büyük ölçüde 27 sınırlıdır. Bu eksiklikler, hassas ve ayarlanabilir kinetik modellerle birlikte hassas ayarlanabilir siRNA salınımı yapabilen yeni malzemeler için karşılanmamış bir gereksinimi vurguluyor.
Metodumuz, serbest siRNA ve model RNAi dinamiklerini nicelleştirmek için ışığa duyarlı bir nanocarrier platformunun birleştirilmiş yöntemlerle bütünleştirilmesiyle bu zorlukların hepsini ele alır. Özellikle, platformumuzun tam olarak kontrol edilen siRNA salınımı 28 , kapsüllenmiş ve karşılanmamış miktarları doğru bir şekilde ölçmek için iki tamamlayıcı yöntemle izlenirBağlı siRNA. Bu tahlillerden elde edilen deneysel veriler, a priori 29 gen sessizleştirme etkinliklerini tahmin etmek için basit bir kinetik modele girilmektedir. Son olarak, nanocarrierlerin açık / kapalı doğası, hücresel uzunluk ölçeğinde uzamsal kontrolle gen ifadesinde hücre kalıpları oluşturmak için kolayca sömürülmektedir. Bu nedenle, bu yöntem, hücre davranışının zaman-zamanlı düzenlenmesinden fayda sağlayacak çeşitli uygulamalarda gen susturulmasını kontrol etmek ve tahmin etmek için kolayca adapte edilebilir bir yöntem sağlar.
Protokol
1. siRNA Nanokarbonlarının Formülasyonu
- PH 6.0'da 20 mM 4- (2-hidroksietil) piperazin-1-etansülfonik asit (HEPES) tamponunda seyreltilmiş eşit hacimlerde siRNA ve mPEG- b- P'nin (APNBMA) ayrı çözeltileri hazırlayın.
- 20 mM HEPES solüsyonuna 32 ug / mL konsantrasyonda siRNA ekleyin.
NOT: siRNA hedeflenmemiş, evrensel bir negatif kontrol dizisidir; Bununla birlikte, siRNA ilgi konusu herhangi bir geni hedef alacak şekilde tasarlanabilir. - MPEG- b- P (APNBMA) polimerlerini bir 20 mM HEPES çözeltisine çözün. N / P oranının (mPEG- b- P (APNBMA) üzerindeki N, amin grupları; siRNA üzerinde P, fosfat grupları) 220 μg / mL'lik bir solüsyon elde etmek için uygun bir miktarda mPEG- b- P (APNBMA) 4'tür.
NOT: mPEG- b- P (APNBMA) polimerleri için sentetik protokol, başka yerlerde bildirilmiştir 30 .
- 20 mM HEPES solüsyonuna 32 ug / mL konsantrasyonda siRNA ekleyin.
- MPEG- b- P (APNBMA) solüsyonunu damla damla eşit volümeE'yi yavaş yavaş bir vorteks makinesinde karıştırırken. Polimer ilavesinin ardından 30 saniye vorteks uygulamaya devam edin. Numuneleri 30 dakika boyunca oda sıcaklığında karanlıkta inkübe edin.
2. Jel elektroforezini kullanarak siRNA salınımının ölçülmesi
- Nanocarrier'leri adım 1.1-1.2'ye göre formüle edin ve hacimleri istediğiniz numune sayısına uyacak şekilde ölçekleyin.
- Nanokarrier'i sodyum dodesil sülfat (SDS) ile karıştırın.
- Su içinde 1 mg / mL SDS çözeltisi hazırlayın. S / P oranı (S, SDS üzerinde sülfat grupları, siRNA üzerinde fosfat grupları) olan çözeltiler üretmek için gereken SDS çözeltisinin miktarını ayırın.
NOT: Polipplex solüsyon 1 μg siRNA içeriyorsa, S / P oranı 15 olarak elde etmek için 13 μg SDS eklenmelidir. - Her bir nanocarrier solüsyonuna damla damla SDS solüsyonu ekleyerek hafifçe bir vorteks makinesi üzerine karıştırın. SDS ilave edildikten sonra 30 saniye boyunca girdaba devam edin.
- Örnekleri 3,000 xg'de 5 saniye boyunca santrifüjleyin. Numuneleri 30 dakika boyunca oda sıcaklığında karanlıkta inkübe edin.
- Su içinde 1 mg / mL SDS çözeltisi hazırlayın. S / P oranı (S, SDS üzerinde sülfat grupları, siRNA üzerinde fosfat grupları) olan çözeltiler üretmek için gereken SDS çözeltisinin miktarını ayırın.
- Kalibrasyon yapın ve 365 nm filtre ile 200 W / m'lik bir yoğunluğa UV lazeri ayarlayın. Işık yoğunluğunun, numune çözeltisinin tabanının oturacağı yerden ölçülmesini sağlayın.
- Nanocarrier / SDS solüsyonunu kauçuk bir conta ile ayrılmış cam kayalardan oluşan bir cam bölmeye yükleyin.
- Cam slaytları su içinde 7: 3 (v / v) etanol / su solüsyonunda yıkayın ve tamamen kurutun. Bir delik (~ 2 x 3 cm dikdörtgen) kauçuk contaya kesin. Kauçuk contayı bir cam slayt üzerine yerleştirin.
- Nanocarrier / SDS solüsyonunu kauçuk contanın deliği içindeki cam slayt üzerine pipetleyin. Kauçuk contayla temas etmeyi önlerken cam slayt üzerine fazla miktarda bir solüsyon yükleyin (fazla 20 μL).
NOT: Sonraki aşamalarda bir miktar sıvı kaybolacaktır. - İkinci camı yerleştirinSürgülü contanın üzerine sürün. Hava kabarcıklarının oluşmasını önlemek için, önce sürgünün bir ucunu aşağıya yerleştirin ve ardından diğer ucunu yavaşça indirin.
- Kapalı tutmak için cam bölmenin her iki yanına bağlayıcı klipsler takın.
- 200 W / m'lik bir şiddette 365 nm'lik bir filtre ile UV lazeri kullanarak numuneleri istenen uzunlukta ( örneğin , 0-60 dakika) radyasyon uygulayın. Bağlayıcı kelepçelerini çıkarın ve bölmeyi açın.
- Işınlanmış nanocarrier / SDS numunelerinden 25 μL'lik bir mikrosantrifüj tüpüne pipetleyin. Çözeltileri 30 dakika boyunca oda sıcaklığında karanlıkta inkübe edin.
- Standart protokoller 31'e göre Tris / Borat / EDTA (TBE) tamponlanmış solüsyonda 0.5 μg / mL etidyum bromür ile önceden boyanan% 2 agaroz jeli hazırlayın. 3: 7 (v / v) gliserol / sudan oluşan bir yükleme tamponunu hazırlayın.
- Her nanocarrier / SDS örneğinden 25 μL'ye yükleme tamponu çözeltisinden 5 μL ekleyin. Numuneleri karanlıkta inkübe edinOda sıcaklığı 10 dakika boyunca.
- Her nanocarrier / SDS örneğinin 30 μL'sini% 2 agaroz jeline yükleyin. Karanlıkta jel 30 dakika boyunca 100 V'de çalıştırın. Etidyum bromür filtreli jel görüntüleme sistemi kullanarak jel görüntüsü alın. Jel görüntü dosyalarını kaydedin ve bant yoğunluğu niceliklemesi için adım 2.10'a geçin. Şerit yoğunluklarının, sinyallerin doygunluğunun görülebileceği kadar parlak olmadığı kadar parlak olduğundan emin olun.
- Halka açık ImageJ yazılımı 32 kullanarak bant yoğunluklarını ölçün.
- ImageJ'nin ROI aracını kullanarak, her bir şeritte bulunan serbest siRNA bantlarının flüoresan yoğunluğunu, her bir bandın etrafına bir dikdörtgen çizerek belirleyin. Her şeridin yoğunluk eğrilerini çizin ve eğri altındaki alanı, yoğunluk eğrileri boyunca yatay bir çizgi çizerek ve kapalı alanların içindeki izleme çubuğunu tıklayarak entegre edin.
- Her şeridin göreli yoğunluğunu cu altındaki alanı bölerek hesaplayınSiRNA pozitif kontrol eğrisinin altındaki alanla (mPEG- b- P (APNBMA) eklenmedi ve SDS eklenmedi) her bir numunenin rve'si eklendi. Her numunenin normalleştirilmiş bant yoğunluğu olarak salınan siRNA yüzdesini rapor edin.
3. Fluoresans Korelasyon Spektroskopisi (FCS) Kullanılarak Ölçülen siRNA Salınımı
- Algılama ipliğinin 5 'ucunda tek bir floroforla işaretlenmiş siRNA elde edin.
NOT: siRNA istenilen yere konjuge edilen etiketlerle önceden tavlanmış olarak satın alınabilir. Florofor, foto dengede olmalı ve mPEG- b- P (APNBMA) ile UV ışığı söndürme ve enerji transferini önlemek için 450 ila 750 nm arasında emici / emici olmalıdır. - Etiketli siRNA kullanarak adım 1.1-1.2'ye göre nanokarbonları formüle edin. İstenen örnek sayısına uyacak şekilde hacimleri ölçeklendirin.
- Çözeltileri SDS'de inkübe edin ve adımlar 2.2-2.6'ya göre istenilen süre boyunca ışınlayın.
- preparFCS numune odasının atılması.
- Cam slayt 7: 3 (v / v) etanol / su çözeltisiyle yıkanır ve bir silme bezi ve hava akımı kullanarak camı tamamen kurutun.
- Çift taraflı yapışkan ara parçasını ortaya çıkarmak için kağıt parçalarını bir çift taraflı yapışkanlı ayırıcıdan çıkarın. Yerleştiriciyi bir cam lameline tutturun.
- Nanocarrier / SDS çözeltisini, yapışkan ara parçasından deliğin ortasındaki kapak kaymasına pipetleyin.
- Cam kapağı lamellerin üzerine yerleştirin. Cam sürgüsünün ve lamelinin iyi bağlandığından emin olmak için cam sürgüsünü itin ve bir sızdırmazlık oluşturun.
- FCS ölçümleri için konfokal bir mikroskop kullanın 33 . 1.2'lik sayısal açıklık ile 40X daldırma apokromat objektif kullanın. Numune başına her biri 10 s en az 30 ölçüm toplamak için uygun uyartım lazer kanalı (488 nm) kullanın 34 . Lazer yoğunluğunun ve dedektör hizalamasının korunduğundan emin olunHer numune için aynıdır.
- Deneysel örneklere ek olarak aşağıdakileri içeren kontrolleri ölçün: etiketli siRNA içermeyen boş bir numune; Ve etiketli siRNA fakat mPEG- b- P (APNBMA) içermeyen bir serbest siRNA örneği.
- FCS'ye özgü yazılımı kullanarak verileri analiz edin. Nano taşıyıcıların konfokal hacimden 29 geçmediği bir süre boyunca kararlı sayım oranını belirleyerek her numunenin başlangıç sayım oranını belirleyin.
- Boş örneklemin sayım oranını her örnek başlangıç sayımı oranı değerinden çıkarın. Serbest siRNA 35'in yüzdesini hesaplamak için elde edilen değerleri normal siRNA kontrolüne normalize edin.
4. Gen Susturmayı Öngörene Kinetik Modelleme
- Gen susturma tahmini için sıradan diferansiyel denklemlerin basit bir setini kullanarak matematiksel bir programlama dili ile komut dosyası oluşturma 29.
NOT: Komut dosyaları istek üzerine kullanılabilir hale getirilebilir.- Adi diferansiyel denklem setini şu şekilde yazarsınız:
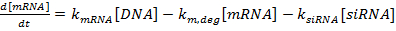 (1)
(1)  (2)
(2) 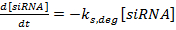 (3)
(3)
NOT: 1-3 denklemleri için, sırasıyla k mRNA , k siRNA ve k prot terimi sırasıyla mRNA, siRNA ve proteinin üretimi için hız sabitleridir. Sırasıyla, mRNA, siRNA ve proteinin parçalanması için hız sabitleri olduğu k m, deg , k s, deg ve kp , deg terimleri. Bozulma hızı sabitleri bileşen yarı ömürleri temel alınarak hesaplanır ve üretim hızı sabitleri, mRNA ve protein sabit durum değerlerine,F siRNA.- Referans 36'da açıklandığı gibi deneysel olarak veya literatürden (bkz. Tartışma ) ilgili gen (ler) için mRNA ve proteinin yarı ömürlerini belirleyin. Ayrıca, hücre hattı için katlama süresini belirleyin. Bu değerleri uygun parçalanma oranı ifadelerine girin.
- Üretim hızı sabitlerini ayarlayın, böylece eğer gen ekspresyon seviyeleri hiçbir siRNA verilmemişse normalleştirilmiş 100 değerinde sabit kalacaktır. Spesifik olarak, [siRNA] 'yı sıfıra ayarlayın ve [mRNA] ve [protein]% 100'lük ilk normalleştirilmiş değerin% 1'i içinde kalana kadar k mRNA , k siRNA ve k protatif üretim hızı sabitlerinin değerlerini değiştirin. Simülasyon.
- Daha önce tarif edilen jel elektroforezi ve FCS tahlillerinden tahliye edilen nispi miktarlarda siRNA kullanarak tahmini olarak, senaryodaki siRNA'nın başlangıçtaki nispi konsantrasyonunu ayarlayın. Özellikle, [siRNA] salınan siRNA'nın nispi miktarı ile orantılı olmalı ve maksimum miktara karşılık gelen 100 değeri 29 olmalıdır .
- Adi diferansiyel denklem setini şu şekilde yazarsınız:
5. Hücre Kültürü ve In Vitro siRNA Teslimatı
- Tedarikçiden gelen protokollere göre NIH / 3T3 fare embriyonik fibroblastları kültürü.
- Hücreleri büyüme ortamı içinde büyütün (Dulbecco'nun Modifiye Kartal Ortamı (DMEM),% 10 ısı ile inaktive edilmiş fetus sığır serumu ve% 1 penisilin-streptomisin ile takviye edilmiştir). % 5 CO2 ile nemlendirilmiş bir atmosfer altında 37 ° C'de hücreler koruyun.
- 6 oyuklu doku kültürü muamelesi yapılan plakalardaki hücreleri tohumlandı.
- Tedarikçiden önerilen alt kültür yöntemini uygulayın. Hemocytometer kullanarak hücreleri sayın. Eklenen büyüme ortamındaki hücreleri, 75.000 hücre / mL'lik bir konsantrasyona kadar seyreltin.
- 2 mL hücre süspansiyonu (75,000 hücreS / mL) 6 oyuklu plakanın her oyuğuna ilave edildi. Hücrelerin inkübatöre 24 saat boyunca yapışmasına ve iyileşmesine izin verin.
- Fosfat tamponlu tuzlu su (PBS) ile yıkayarak ve her bir göze serum ve antibiyotiksiz transfeksiyon ortamı ( Madde Tablosuna bakınız) 1.5 mL ilave ederek transfeksiyon için hücreleri hazırlayın.
- SiRNA nanokarbonları, adım 1.1-1.2'ye göre formüle edin. Her oyuğa 30 pmol siRNA içeren 25 μL nanokarrier solüsyonu ekleyin. Karıştırmak için yavaşça medyayı yukarı ve aşağı pipetleyin. Hücreleri inkübatöre 3 saat yerleştirin.
- Transfeksiyon medyasını çıkarın ve her oyuğu PBS ile yıkayın. Eklenen büyüme ortamı 1 mL ekleyin ve 30 dakika için kurtarmak için kuluçka hücrelerini yerleştirin.
- Hücreleri, bir ışık uyarısı ile tedavi için hazırlamak için, ilave büyüme ortamını çıkarın. Her göze 1 mL transfeksiyon ortamı (fenol kırmızısı olmadan) ilave edin.
NOT: Transfeksiyon ortamının fenol kırmızısı içermediğinden emin olun. - Kalibrasyon yapın ve 365 nm filtre ile 200 W / m'lik bir yoğunluğa UV lazeri ayarlayın. Işık yoğunluğunun, hücre plakasının tabanının oturacağı yerden ölçülmesini sağlayın.
- Hücreleri 37 ° C'ye ayarlanmış sıcak bir tabağa koyun. Hücrelerin plaka kapağını çıkarın. 200 W m- 2 yoğunluğunda bir 365 nm filtre ile UV lazeri kullanarak hücreleri plakanın üstünden istenen zamanda (20 dakikaya kadar) radyasyon uygulayın.
- Transfeksiyon ortamı çıkarın ve 2 mL eklenmiş büyüme ortamı ekleyin. İnkübatörde daha fazla analiz yapılıncaya kadar yerleştirin ( örn. , QPCR için 24 saat ve Western blotlama için 48 saat).
- Western blotlama 37 ve qPCR gibi çeşitli teknikler kullanarak gen ekspresyonundaki değişiklikleri ölçün. 38 GFP gibi görünür sinyallere sahip genler için, floresan mikroskopisi 29 kullanın.
NOT: Bu teknikler, kullanım kolaylığı ve doğruluğu nedeniyle önerilmektedirGen ifadesinin nicelleştirilmesinde
- Western blotlama 37 ve qPCR gibi çeşitli teknikler kullanarak gen ekspresyonundaki değişiklikleri ölçün. 38 GFP gibi görünür sinyallere sahip genler için, floresan mikroskopisi 29 kullanın.
6. Bir Genetiksiz Ortada Silencenin Kontrol Edilmesi
- 5.1-5.7. Adımlara göre kültür, tohum ve transfect hücreler.
- Tamamen 365 nm ışığı bloke eden ve yansımaları en aza indiren bir fotomask hazırlayın.
NOT: Bu durumda sırasıyla ışığı engellemek ve yansımaları azaltmak için 10 x 10 cm boyutlarında alüminyum folyo ve siyah yaprak kağıdı kullanılmıştır. Alüminyum folyo ve inşaat kağıdı, tek bir ünite oluşturmak üzere birlikte yapıştırılmıştır.- İstenen şekli fotomakize kes / punch / machine. Örneğin, düz kenarlı bir desen (~ 5 cm uzunluğunda) ve fotomaskda dairesel bir desen (~ 7 mm çap) oluşturmak için keskin kenarlı bir bıçak ve delik açıcı kullanın.
- Yansıtıcısız tarafı olan hücreleri içeren kuyunun altında ortalanmış olarak, 6-kuyucuklu plakanın tabanına fotomakoz yapıştırın ( ör . Siyah cOnstruction kağıdı) tabağa bakar. Tutkalın desenin kenarına (~ 3 mm içinde) yerleştirilmemesine dikkat edin.
- İki halka stantını yaklaşık 25 cm'lik aralıklarla kurun ve platformların eşit yükseklikte olmasını sağlamak için her halka standına bir platform takın. Plakayı platformların üstüne dayayarak iki ayaklık arasında hücre plakasını askıya alın. Plakanın düz olduğundan emin olun.
- 200 W / m 2 yoğunluğunda bir 365 nm filtre ile UV lazeri kullanarak hücreleri istenilen süre boyunca (20 dakikaya kadar) numunenin altından ışınlandırın.
- Transfeksiyon ortamı çıkarın ve 2 mL eklenmiş büyüme ortamı ekleyin. En az 24 saat boyunca iyileşmek için inkübatöre yerleştirin. Floresan mikroskobisini tanımlanan hücreleri 29 tarif edin.
Sonuçlar
Nanokarbonların formülasyonunu takiben, in vitro transfeksiyonlarda kullanılacak ışınlama koşullarını bildirmek için siRNA salım deneyleri gerçekleştirildi. Serbest bırakılan siRNA yüzdesini belirlemek için çeşitli ışık dozajları uygulandı. Birinci analizde, serbest siRNA moleküllerini polimer ile halen kompleksleşmiş / ilişkili olan siRNA moleküllerinden ayırmak için jel elektroforezi kullanılmıştır. Işık ile işlem görmeyen nanokarbonlar k...
Tartışmalar
Metotta özellikle kritik olan birkaç adım vardır. Nanokarbonları formüle ederken, bileşen ekleme ve karıştırma hızı sırası, etkinliği etkileyen iki önemli parametredir 39 . Bu protokol, katyonik bileşen olan mPEG- b- P'nin (APNBMA) anyonik bileşene, siRNA'ya vorteks yaparken damla damla eklenmesini gerektirir. Toplam formülasyon hacmine bağlı olarak, bu karıştırma işlemi 3-6 s sürer. Nanokarbonların düzgün şekilde oluşturulup oluşturulmadığını ...
Açıklamalar
Yazarlar, rekabet eden mali çıkarlarının olmadığını beyan ettiler.
Teşekkürler
Yazarlar, P20GM103541 hibenin yanı sıra P20GM10344615 hibe numarası altında bir Kurumsal Gelişim Ödülü (IDeA) aracılığıyla maddi destek için Ulusal Sağlık Enstitüleri Ulusal Sağlık Bilimleri Enstitüsüne (NIH) teşekkür ederler. Buradaki ifadeler NIH'nin görüşlerini yansıtmamaktadır. Ayrıca, İleri Teknoloji Biyosistem Merkezi (Bioscience CAT) ödülü (12A00448) aracılığıyla maddi destek için Delaware Biyoteknoloji Enstitüsü'nü (DBI) ve Delaware Ekonomik Kalkınma Ofisi'ni (DEDO) kabul ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| siRNA | Sigma-Aldrich | SIC001 | non-targeted, universal negative control |
| mPEG-b-P(APNBMA) | synthesized in our lab | N/A | photo-responsive polymer |
| HEPES | Fisher Scientific | BP310-100 | |
| sodium dodecyl sulfate | Sigma-Aldrich | 436143 | |
| rubber gasket | McMaster-Carr | 3788T21 | 0.5 mL thick |
| UV laser | Excelitas Technologies | Omnicure S2000 | collimating lens and 365 nm filter used |
| agarose | Fisher Scientific | BP160-100 | |
| ethidium bromide | Fisher Scientific | BP1302-10 | |
| siRNA labelled with Dy547 | GE Healthcare Dharmacon, Inc. | custom order | fluorophore conjugated to 5’ end of sense strand |
| microscope slide | Fisher Scientific | 12-550-A3 | pre-cleaned glass |
| Secure-Seal Spacer | Life Technologies | S24735 | double-sided adhesive |
| LSM 780 | Carl Zeiss | N/A | confocal microscope |
| ZEN 2010 | Carl Zeiss | N/A | FCS analysis software |
| MATLAB | MathWorks | N/A | programming language |
| NIH/3T3 cells | ATCC | ATCC CRL-1658 | |
| DMEM | Mediatech | 10-013-CV | growth media |
| fetal bovine serum | Mediatech | 35-011-CV | heat-inactivated |
| penicillin-streptomycin | Mediatech | 30-002-CI | |
| 6-well plates | Fisher Scientific | 08-772-1B | |
| Opti-MEM | Life Technologies | 11058021 | transfection media |
Referanslar
- Forbes, D. C., Peppas, N. A. Oral delivery of small RNA and DNA. J Control Release. 162 (2), 438-445 (2012).
- Davis, M. E., et al. Evidence of RNAi in humans from systemically administered siRNA via targeted nanoparticles. Nature. 464 (7291), 1067-1070 (2010).
- Bouchie, A. Companies in footrace to deliver RNAi. Nat Biotechnol. 30 (12), 1154-1157 (2012).
- Burke, P. A., Pun, S. H., Reineke, T. M. Advancing Polymeric Delivery Systems Amidst a Nucleic Acid Therapy Renaissance. ACS Macro Lett. 2 (10), 928-934 (2013).
- Gooding, M., Browne, L. P., Quinteiro, F. M., Selwood, D. L. siRNA Delivery: From Lipids to Cell-penetrating Peptides and Their Mimics. Chem Biol Drug Des. 80 (6), 787-809 (2012).
- Motta-Mena, L. B., et al. An optogenetic gene expression system with rapid activation and deactivation kinetics. Nat Chem Biol. 10 (3), 196-202 (2014).
- Wang, X., Chen, X., Yang, Y. Spatiotemporal control of gene expression by a light-switchable transgene system. Nat Methods. 9 (3), 266-269 (2012).
- Ziauddin, J., Sabatini, D. M. Microarrays of cells expressing defined cDNAs. Nature. 411 (6833), 107-110 (2001).
- Saltzman, W. M., Olbricht, W. L. Building drug delivery into tissue engineering. Nat Rev Drug Discov. 1 (3), 177-186 (2002).
- Mura, S., Nicolas, J., Couvreur, P. Stimuli-responsive nanocarriers for drug delivery. Nat Mater. 12 (11), 991-1003 (2013).
- Shim, M. S., Kwon, Y. J. Stimuli-responsive polymers and nanomaterials for gene delivery and imaging applications. Adv Drug Delivery Rev. 64 (11), 1046-1058 (2012).
- Kelley, E. G., Albert, J. N. L., Sullivan, M. O., Epps, T. H. Stimuli-responsive copolymer solution and surface assemblies for biomedical applications. Chem Soc Rev. 42 (17), 7057-7071 (2013).
- Weber, W., Fussenegger, M. Emerging biomedical applications of synthetic biology. Nat Rev Genet. 13 (1), 21-35 (2012).
- Konermann, S., et al. Optical control of mammalian endogenous transcription and epigenetic states. Nature. 500 (7463), 472-476 (2013).
- Shimizu-Sato, S., Huq, E., Tepperman, J. M., Quail, P. H. A light-switchable gene promoter system. Nat Biotechnol. 20 (10), 1041-1044 (2002).
- Huschka, R., et al. Gene Silencing by Gold Nanoshell-Mediated Delivery and Laser-Triggered Release of Antisense Oligonucleotide and siRNA. ACS Nano. 6 (9), 7681-7691 (2012).
- Li, H. -. J., Wang, H. -. X., Sun, C. -. Y., Du, J. -. Z., Wang, J. Shell-detachable nanoparticles based on a light-responsive amphiphile for enhanced siRNA delivery. R Soc Chem Adv. 4 (4), 1961-1964 (2014).
- Braun, G. B., et al. Laser-Activated Gene Silencing via Gold Nanoshell-siRNA Conjugates. ACS Nano. 3 (7), 2007-2015 (2009).
- Gilleron, J., et al. Image-based analysis of lipid nanoparticle-mediated siRNA delivery, intracellular trafficking and endosomal escape. Nat Biotechnol. 31 (7), 638-646 (2013).
- Wittrup, A., et al. Visualizing lipid-formulated siRNA release from endosomes and target gene knockdown. Nat Biotechnol. 33 (8), 870-876 (2015).
- Roth, C. M. Quantitative measurements and rational materials design for intracellular delivery of oligonucleotides. Biotechnol Prog. 24 (1), 23-28 (2008).
- Mao, S., et al. Influence of polyethylene glycol chain length on the physicochemical and biological properties of poly(ethylene imine)-graft-poly(ethylene glycol) block copolymer/SiRNA polyplexes. Bioconjugate Chem. 17 (5), 1209-1218 (2006).
- Raab, R. M., Stephanopoulos, G. Dynamics of gene silencing by RNA interference. Biotechnol Bioeng. 88 (1), 121-132 (2004).
- Cuccato, G., et al. Modeling RNA interference in mammalian cells. BMC Systems Biology. 5, 1 (2011).
- Varga, C. M., Hong, K., Lauffenburger, D. A. Quantitative analysis of synthetic gene delivery vector design properties. Mol Ther. 4 (5), 438-446 (2001).
- Chen, H. H., et al. Quantitative comparison of intracellular unpacking kinetics of polyplexes by a model constructed from quantum Dot-FRET. Mol Ther. 16 (2), 324-332 (2008).
- Bartlett, D. W., Davis, M. E. Insights into the kinetics of siRNA-mediated gene silencing from live-cell and live-animal bioluminescent imaging. Nucleic Acids Res. 34 (1), 322-333 (2006).
- Foster, A. A., Greco, C. T., Green, M. D., Epps, T. H., Sullivan, M. O. Light-Mediated Activation of siRNA Release in Diblock Copolymer Assemblies for Controlled Gene Silencing. Adv Healthc Mater. 4 (5), 760-770 (2015).
- Greco, C. T., Epps, T. H., Sullivan, M. O. Mechanistic Design of Polymer Nanocarriers to Spatiotemporally Control Gene Silencing. ACS Biomater Sci Eng. 2 (9), 1582-1594 (2016).
- Green, M. D., et al. Catch and release: photocleavable cationic diblock copolymers as a potential platform for nucleic acid delivery. Polym Chem. 5 (19), 5535-5541 (2014).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose Gel Electrophoresis for the Separation of DNA Fragments. J Vis Exp. (62), e3923 (2012).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9 (7), 671-675 (2012).
- Marquer, C., Leveque-Fort, S., Potier, M. C. Determination of Lipid Raft Partitioning of Fluorescently-tagged Probes in Living Cells by Fluorescence Correlation Spectroscopy (FCS). J Vis Exp. (62), (2012).
- Staaf, E., Bagawath-Singh, S., Johansson, S. Molecular Diffusion in Plasma Membranes of Primary Lymphocytes Measured by Fluorescence Correlation Spectroscopy. J Vis Exp. (120), e54756 (2017).
- Buyens, K., et al. Monitoring the disassembly of siRNA polyplexes in serum is crucial for predicting their biological efficacy. J Control Release. 141 (1), 38-41 (2010).
- Eden, E., et al. Proteome Half-Life Dynamics in Living Human Cells. Science. 331 (6018), 764-768 (2011).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad. Sci U S A. 76 (9), 4350-4354 (1979).
- Wittwer, C. T., Herrmann, M. G., Moss, A. A., Rasmussen, R. P. Continuous Fluorescence Monitoring of Rapid Cycle DNA Amplification. Biotechniques. 54 (6), 314-320 (2013).
- Cho, S. K., Dang, C., Wang, X., Ragan, R., Kwon, Y. J. Mixing-sequence-dependent nucleic acid complexation and gene transfer efficiency by polyethylenimine. Biomater Sci. 3 (7), 1124-1133 (2015).
- Liu, Y. M., Reineke, T. M. Poly(glycoamidoamine)s for gene delivery: Stability of polyplexes and efficacy with cardiomyoblast cells. Bioconjugate Chem. 17 (1), 101-108 (2006).
- Schwanhausser, B., et al. Global quantification of mammalian gene expression control. Nature. 473 (7347), 337-342 (2011).
- Greco, C. T., Muir, V. G., Epps, T. H., Sullivan, M. O. Efficient tuning of siRNA dose response by combining mixed polymer nanocarriers with simple kinetic modeling. Acta Biomater. 50, 407-416 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır