Method Article
ODELAY: Maya Büyümesinin Çok Parametreli Niceleşmesi İçin Büyük Ölçekli Bir Yöntem
Bu Makalede
Özet
Maya mayalarındaki canlı hücrelerin bir hücreli katlanarak değerlendirilmesi (ODELAY) olarak adlandırılan zaman atlamalı mikroskobi kullanarak katı miyar üzerinde kolonilere dönüşürken tek tek maya hücrelerinin büyüme fenotiplerini ölçmek için bir yöntem sunuyoruz. Kolonilere dönüşen genetik olarak özdeş hücrelerin popülasyon heterojenliği doğrudan gözlemlenebilir ve nicelenebilir.
Özet
Mikroorganizmaların büyüme fenotipleri, temel genetik uygunluğunun güçlü bir göstergesidir ve gecikme fazı, log fazı ve sabit faz olmak üzere 3 büyüme rejimine ayrılabilir. Her büyüme evresi, değişik çevresel ve genetik koşullarla ilişkili çeşitli zindelik yönlerini ortaya çıkarabilir. 3 aşamalı büyümenin yüksek çözünürlüklü ve kantitatif ölçümleri genellikle elde etmek zordur. Burada, Maya'nın yaşayan dizilerinin (ODELAY) Tek Hücreli Katına Getirilmesi Değerlendirmesi adlı bir tahlil kullanarak katı ortamdaki 3 büyüme evresinin karakterize edilmesi için ayrıntılı bir yöntem sunuyoruz. ODELAY, zaman atlamalı mikroskopi kullanarak katı ortamlar üzerine kolonilere büyüyen bireysel hücrelerin büyüme fenotiplerini nicelendirir. Bu yöntem, kolonilere büyüyen genetik olarak özdeş hücrelerdeki her büyüme parametresiyle nüfus heterojenliğini doğrudan izleyebilir. Bu nüfus heterojenliği, genetik ve epigenetik düzenlemeyi anlamaya yönelik benzersiz bir bakış açısı sunar veGenetik ve çevresel bozulmalar. ODELAY yöntemi mayayı kullanarak gösterilirken, parlak alan mikroskopisi ile görülebilen herhangi bir koloni oluşturan mikroorganizma üzerinde kullanılabilir.
Giriş
Mikroorganizmaların çoğalma fenotipleri belirli bir çevre koşuluna temel oluşturan genetik uygunluğunun güçlü bir göstergesidir. Büyüme klasik olarak 3 farklı büyüme rejimine ayrılmıştır: gecikme fazı, log fazı ve sabit faz büyümesi 1 . Her büyüme evresi, çeşitli çevresel ve genetik koşullara bağlı olarak, çeşitli zindelik yönlerini ortaya çıkarabilir. Örneğin, gecikme süresi veya üstel büyüme başlamadan önce bir organizmanın gecikme fazında geçirdiği süre, bir organizmanın değişen çevresel koşullara tepki verme kabiliyetinin göstergesi olabilir 2 . Günlük faz büyümesindeki katlanma süresi, hücresel uygunluğun en yaygın metriği, bir organizmanın replikasyon için çevresel materyalleri metabolize ederek ve kullanarak bölünme kabiliyetinin genel verimliliğini ortaya koymaktadır. Günlük fazdan sonraki büyümenin hızla azaldığı durağan faz, fitness için başka bir göstergedir; bu normaldirSpot tabanlı maya büyüme tahlillerinde büyüme bitiş noktası olarak kullanılmıştır.
Birkaç maya büyüme tahlili şu anda mevcuttur ve mayada büyüme fenotiplerinin değerlendirilmesi için standart yöntemler olarak kabul edilmektedir 3 , 4 , 5 . Bu tahliller öncelikle katı maya veya sıvı ortamda maya yetiştirme yöntemlerine dayanmaktadır. Katı ortamda, koloni tutturma deneyleri az sayıda hücreyi bir iğne ile katı agara aktarır ve maya hücrelerinin belli bir süre boyunca büyümesine izin verilir. Koloniler daha sonra görüntülenecek ve boyutları bir uç nokta 6'da karşılaştırılacaktır . Bu koloni tutturma deneyleri genom geniş ekranlar üretmek için sağlam ve ölçeklenebilir olduklarını kanıtladı. Daha yakın zamanlarda, düz yatay tarayıcılar ve Tek Mercek Refleksi (SLR) kameralar kullanan periyodik görüntüleme, bu tahliller içine koloni gelişimini zamanla kaydetmek için dahil edilmiştir 7 , 8, 9 . Bununla birlikte, bu cihazların çözünürlüğü tek hücrelerin bulunmasını önler ve dolayısıyla bu koloni tutturma deneyleri gecikme süresini doğrudan gözlemez ve kolonilere dönüşen ayrı hücreler arasındaki varyasyonu gözlemleyemez.
Sıvı temelli büyüme tahlilleri genom geniş ekranlarını 3 gerçekleştirmek için kullanılmıştır. Bir sıvı büyüme tahlilini zaman atlamalı mikroskopi ile birleştirmek, genetik olarak aynı bireysel hücrelerin katlanma zamanında popülasyon heterojenliğini ortaya çıkarmıştır; bu, genetik düzenlemeyi ve çevresel adaptasyonu anlamada önemli bir perspektif sunmaktadır. Bununla birlikte, bu test, gecikme süresi ve taşıma kapasitesi gibi büyümenin diğer yönlerini ölçmez. Burada ODELAY 11 olarak adlandırdığımız bir tahlil kullanarak katı ortam üzerinde koloni oluşturan mikroorganizmaların üç büyüme evresinin karakterize edilmesi için bir yöntem sunuyoruz. ODELAY utili kapsarKatı ortamlar üzerine kolonilere büyüyen tek hücrelerin görüntülerini kaydetmek için yüksek verimli zaman atlamalı mikroskopi. Kolonilere dönüşen tek tek hücrelerin bu popülasyonu, terminal son nokta skorlaması gibi daha az hassas ölçümlerle saptanmayan, temelde nüfus heterojenliğini ortaya koymaktadır. Mayadaki yöntemi gösteriyoruz, ancak ODELAY parlak alan mikroskobunda kontrast gösteren herhangi bir organizmaya uygulanabilir.
Protokol
1. Agaroz Jel Stok Hazırlama
- 2 g yüksek saflıkta agaroz tartın.
- Agarozu 500 mL'lik bir şişeye ekleyin ve kombine kütlelerini kaydedin.
- Şişenin hedef kütlesi artı 2 g agaroz 150 g ultra saf su ile hesaplayın, sonra bu hedef kütlenin 0.1 g'ına 150 g ultra saf su ilave edin.
- Şişenin ve agarozun ve suyun kütlesine dikkat edin.
- Şişeyi bir mikrodalga fırına yerleştirin ve agaroz ısıtılırken su buharını en aza indirgemek için şişenin üzerine gevşek bir kapak yerleştirdiğinizden emin olun.
- Şişeyi mikrodalga fırında 15-20 sn'lik bir sürede patlatıp ardından agarozu ve suyu karıştırmak için şişeyi döndürün. Çözelti kaynar ve karışım homojen olana kadar bu işlemi tekrarlayın.
DİKKAT: Şişeden kaçan buhar cildi haşlanmadan kaçınmaya özen gösterin. Ayrıca, şişe dokunulacak kadar sıcak olacak ve yaralanmaları önlemek için otoklav eldiveni gibi uygun koruma gerekiyor. - Erimiş agaroz homojen olduktan sonra, şişeyi tekrar tartın ve orijinal kütlenin 0,1 g'ına ultra saf su ilave edin. Buharlaşma nedeniyle kaybedilen suyun yerini alacaktır.
- Erimiş agaroz katılaşmadan önce homojenliği sağlamak için eklenen suda karıştırmak için girdap yapınız.
- 15.2 g agarozu 9 - 50 mL'lik plastik tüplere koyun.
- Gerektiğinde tüpleri soğutun.
2. ODELAY Agarose Media'nın hazırlanması
- Manyetik bir karıştırma çubuğu ile hafifçe karıştırılarak, bir kapta, kapalı bir kapta kaynatılmak üzere 400 mL deiyonize su ısıtın.
- Adım 1.10'dan gelen 50 mL'lik bir konik tüpteki 15.2 g agaroz alikotuna 2 mL 10X medya ( örn ., Maya Ekstresi Peptonu (YEP) veya Komple Tamamlayıcı Karışım (CSM)) ekleyin.
NOT: CSM ortamı cam slaytlara yapışma eğilimi gösterir. CSM medya formülasyonlarını kullanıyorsanız, orta formülasyona steril suda 5 μL% 50 wt polietilen glikol (PEG) ilave edin. PEG,Kalıp serbest bırakma sırasında cam slaytlara yapışmasını engeller ve maya büyümesini engellemez. - Gerekirse ek 100X besin takviyeleri ekleyin ve bu adımdan toplam ilave hacmi 1 mL'ye getirmek için su kullanın.
- Adım 2.1'den kaynar suya 50 mL konik tüp yerleştirmeden önce agaroz alikotu eklenen ortam ve takviyeleri ile tartın.
- 16 dakika sonra 50 mL tüpü alın ve bir girdap kullanarak karışımı homojenize edin. Kapağı 50 mL konik tüp üzerine sıkıca tutun.
NOT: Kapta bir kapak tüm tüpe eşit şekilde ısıtılmasına yardımcı olur, aksi takdirde katı bir agaroz filmi oluşacak ve muhtemelen eriyecek. Ayrıca bu süre zarfında agaroz kalıbı birleştirmek de uygundur ( Şekil 1 ). - Karışımı bir vorteks kullanarak homojenize edin.
- Tüm agarın karıştırılıp eritildiğinden emin olmak için 2 dakika kaynatın.
- Tüpü tartın ve kitle kaybı ultra saf steril su ile değiştirin.
- 2 mL 10X karbon-ekşi ekleyinCe reaktifi ( örn .,% 20 w / v glikoz) ve vorteks ile agaroz orta solüsyonu elde edin.
NOT: Cam Sürgülerinin Ayırılması: Kalıp monte edilirken, uzun ara parçaların kalıba doğru yönde yerleştirildiğinden emin olmak için özen gösterilmelidir. Bunun nedeni, lazer akrili keserken, parçayı tamamen 90 ° kenar yerine hafif açılı kenarlar bırakarak kesmek eğiliminde olmasıdır. Daha sonra kalıp, tezgah üstünde camı agardan serbest bırakmak için yerleştirildiğinde, ara parçanın kenarı, ağar ile keskin bir açıda olmalıdır. Akut açı, kalıp ayırıcının dış kenarı alt kenar çevresinde döndüğünde agarın kenarını üst cam parçasından sıkıştırmaya yardımcı olur ( Şekil 1'e bakın). Sonuç, agarın en üst cam parçasından daha tutarlı bir şekilde ayrılmasıdır.
NOT: Camları yağlara, silikon spreylere veya hatta ticari pencere tedavilerine uygulanan kalıptan sıyırma maddeleri kullanılmamalıdır, çünkü camları kirletecektir. Agarın üründür ve muhtemelen büyümeyi engeller. Bu yöntemler bazı uygulamaların tutarlı olması için gereklidir. - Dört 2 x 3 x 1 mm kalınlığında cam eldiven ile% 70 etanol ile temizleyin ve zorunlu hava ile kurutun.
- Akrilik kalıpları% 70 etanol ile temizleyin, kuru ve Şekil 1'de gösterildiği gibi monte edin. Gösterildiği gibi üç alt parçayı alın ve bunları birleştirerek, iki aynı parçanın üçüncü parçayı sandviç haline getirin ( Şekil 1B ). İki küçük bağlayıcı klips kullanarak ( Şekil 1C ) temel parçalarını her iki yanına sıkıştırın. Dikeyleri kalıp içine yerleştirin, böylece lazer oymağının düzgün yerleştirildiğinden emin olun ( Şekil 1E ).
- Temizlenmiş ve kurutulmuş cam slaydı kalıp üzerine yerleştirin ve diğer tarafa ikinci bir cam slayt yerleştirirken yerinde tutun. Montajı daha büyük bir bağlayıcı klipsle sıkıştırın ( Şekil 1D ). Her iki kaydırmayı daha büyük bağlayıcı klipslerle sıkıştırın (Lass = "xfig"> Şekil 1D). Üst bağlayıcı klibinin, akrilikle örtüşen cam kaymayla temas ettiğinden emin olun.
- Kalan bağlayıcı klipslerini ekleyin. Yine, kelepçelerin akrilikle çakıştığı slaytla temas ettiğinden emin olun ( Şekil 1D ).
NOT: Monte edilen kalıba erimiş agar ile doldurulmadan önce kenarların, kalıbın iç tarafı boyunca yaklaşık 70 mcL erimiş agar medyasının pipetlenmesiyle kapatıldığından emin olun. Bu agar hızla katılaşacak ve herhangi bir kaçağı önleyecektir. - Küfe eriyik agar ile doldurun, böylece kalıba hava kabarcıkları sıkışmasını önler.
NOT: Bu, eritilmiş agarın kalıp kenarı boyunca yavaş yavaş pipetlenmesiyle gerçekleştirilebilir. Doldurulduktan sonra, kalıbın yaklaşık 23 ° C ortam sıcaklığında 1 saat süreyle 40 dakika soğumasına izin verin. Çok uzun süre soğumaya bırakılırsa, agar kalıpta kırılabilir.
NOT: Kalıp Ayırımı: Döküm agardan kalıbın uygun bir şekilde çıkarılması, tek biçimli bir katı sağlamak için esastırMaya büyütmek için agar pad. Bu aşamada kalıpın etkin bir şekilde ayrılmasını sağlamamaktaki başarısızlık, katı agar pedindeki kusurlara atfedilen büyüme farklılıklarına neden olacaktır. Bu adımı birkaç kez uygulamanız önerilir. - Alt bağlayıcı klibi çıkartarak başlayın. Kalıbın altındaki üç adet sandviç parçadan oluşan parçayı çıkarın. Slaytları sıkıştırarak tutun ve sonra bağlayıcı klipslerini çıkarın. Bağlayıcı klipslerini çıkartırken kalıp kenarlarını çarpmamaya dikkat edin. Bu ortamı deforme edecektir.
- Kalıbın tezgahın kenarına yerleştirilmesi, böylece kalıbın mavi noktalı yanının yukarı ve sol alt köşede olması gerekir ( Şekil 1E ). Başparmakları akrilik altına ve ilk parmağın üst kısmına kalıp iç kenarına doğru yerleştirin.
- Yavaşça ve dikkatli bir şekilde başparmakla kalıba karşı itin ve kalıp tutacağını alt kenarı etrafında döndürün gibi tutun ( Şekil 1F ). Sabit uygulaAncak yavaş yavaş artan bir baskı. Kullanıcılar, üst camın kalıp ayırıcıyı kapladığı çizgi boyunca bir mola ve hava kabarcığı görür.
- İlk kopma çizgisini gördükten sonra, baş parmaklarıyla yukarı doğru itin ve sabit basınç uygulayın. Agar, bu noktada camdan uzaklaşmaya başlamalıdır ( Şekil 1F ). Kalıbı yukarı doğru döndürmeye devam edin. Bu, cam sürgüsü olmadan kaldırılacaktır. Ağarın camdan soyulması gereken bir çizgi, ilk kopma çizgisinden uzaklaşmaya devam etmelidir.
NOT: Bu noktada agar hem camın altına hem de üst kısmına yapışmaktadır. Bu bazen en soldaki kenarla ortaya çıkar. Deformasyon yapılan alan, mayanın bulunduğu bölgede olmadığı sürece, bu iyi olmalıdır. - Cam tamamen serbestleştiğinde tutun ve tamamen kalıptan çıkarın. Sonra, diğer kalıp parçasını, agarı hareket ettirmeden parçayı kaldırmak için benzer bir hareket kullanarak çıkarın. Slaytları birSteril tip kutu, bazı steril yüksek saflıktaki suyun altındadır. Kutuyu kapatın ve ertesi gün kullanmak için 4 ° CO / N'de saklayın. Daha uzun süre saklanırsa büyüme oranları tutarsız hale gelecektir.
3. ODELAY Kültür Hazırlama
- O / N büyümesi için suşları 96 oyuklu bir tabağa koyun.
- Ertesi gün, yeni bir plakada 220 μL toplam hacim için 200 μL medyaya 20 μL gece kültür seyreltin.
- Bir plaka okuyucuda her kültürün optik yoğunluğunu 600 nm'de (OD600) ölçün. Bir plaka okuyucu ve bir sıvı taşıma robotu kullanarak, 3.3.1 - 3.3.6 adımlarının otomatik seyreltme protokolünü izleyin. Plakadaki kültürleri elle yaklaşık 0,1 OD600'e seyreltin (isteğe bağlı).
- Plaka okuyucusunda, "yeni oluştur" un altındaki "Deneme" yi tıklayın. ODELAYDilution.exp seçin ve deneyi çalıştırın. Deneme adını ODELAY "Tarih" "Saat" "Deneme Adı" yinelemesi olarak girin.
- S üzerine tıklayınİstatistik sekmesini tıklatın ve Excel simgesini tıklatın. Verileri başparmak sürücüsüne kaydedin ve sıvı işleme robotuna aktarın.
- Robot'un Düzenini ve Yöntemi Düzenleyicisini açın. Yöntem dosyasını "ODELAYDilution_v1.med" açın. Çalıştırılabilir dosyayı çalıştırın "Convert_SynergyFiles.exe". OD600 hedefi için 0.09 girin.
- "Glu Düzeltme" ve "Gal Düzeltme" ye tıklayın 0.05. Boş ortamı aynı plakta ölçün. "Dosya Yarat" ı tıklayın. Yöntem düzenleyicisinde dosyayı seçin. Çalışma zamanı seyreltme programını açmak için yöntemi başlatmak için durak lambası simgesini tıklayın.
- Boruların çıkarılmadığından ve plakaların kapaklarının çıkarılmış olduğundan ve toz kapakları iplerden çıkarıldığından emin olun. Güverte düzeni ile gösterildiği gibi, sıvı taşıma robotunun güvertesine plakalar, borular ve uçlar yükleyin.
- Seyreltme programını çalıştırmak için "Oynat" düğmesine tıklayın. Doğru 50 μL ipucu sayısını seçin. Doğru 300 μL ipucu sayısını seçin. Hakkında bekleİşlemin başlaması için 12 dakika.
- Seyreltme plakasını robotdan alın, uçları örtün ve 15 mL medya tüplerini özetleyin. Plakayı 30 ° C'de 5-6 saat boyunca kültürleyin.
- İkinci seyreltmeden önce yaklaşık 1 - 2 saat mikroskop için inkübasyon odalarını açtığınızdan emin olun. ° C'de veya deney için gerekli olan sıcaklıkta dengeye gelmelerine izin verin.
- Seyreltme adımları 3.3 - 3.4'ü tekrarlayın, ancak agaroz slaytlarındaki kültürleri tespit etmek için kültürleri 0,01 - 0,02'lik bir OD600 değerine seyreltin.
- Seyreltme plakasını bir metal dondurucu sızdırmaz conta ile örtün.
- Seyreltme plakasını bir buz banyosunda, plakayı tutmak için bir santrifüj metal kepçe bağlantısıyla buz suyunda yüzen plakayla 30 saniye süreyle son haline getirin ( Şekil 2A ). Sonrasyonlu kültürleri seyreltme plakasından düz bir alt plakaya aktarın. Etiket 4 x 96 oyuklu düz tabanlar 1, 2, 3 ve 4 ( Şekil 2B ).
- Transfer 150 &# 181; L, A01 - D06 kuyularından 1 numaralı kuyudaki C04 - F09 kuyularına seyreltme plakasının seyreltme plakası. Sonra 150 μL seyreltme plakasını kuyu A07 - D12'den etiketli plakanın C04 - F09 kuyularına aktarın. Daha sonra 150 μL E01 - H06 kuyuları 3 etiketli plakanın kuyuları C04 - F09 içine seyreltme plakası. Son olarak 150 μL seyreltme plakası kuyu E07 - H12'den etiketli plakanın C04 - F09 kuyularına aktarın.
- 4. adıma geçin, Agar üzerinde Spotting yapın.
4. Otomatik Sıvı Sarkma Robotu Kullanılarak Agar Üzerinde Spotlama
- Nemlendirilmiş steril pipet kutularından 4 ° CO / N'de saklanan agaroz slaytlarını (adım 2.19'dan) çıkarın.
- Gerekirse, agaroz maddenin köşelerini temiz bir tıraş bıçağı ile keserek, slayt bölmesinin üzerine oturmasını sağlayın.
- Sürgülü kelepçeyi bağlantı parçasından çıkarın. Agar plakasını dikkatli bir şekilde sahne haznesi desteğinin girintili bölgesine yerleştirin.
NOT: veyaKaydırma işlemi deneyden deneye tutarlıdır. - Kelepçenin odanın alt kısmı ile aynı hizada olduğundan emin olmak için kontrol edin. Eğriyorsa, kayar gömülü alanda tam olarak oturmayabilir. Dengeleme çubuğunu lekelenme robotunun merkez plakası konumuna yerleştirin. Bu ara parça, tesviye vidaları için temas sağlar, böylece kayar bölme uçlarla dengelenebilir.
- Plakaları, çeyrek sıralarına göre masaya yerleştirin. Levhalar 1, 2, 3 ve 4 soldan sağa doğru sıralanmıştır ( Şekil 2B ).
- İpuçlarını yerleştirin böylece iç 24 kuyucuk C04 - F09 ipuçlarıyla 4 boş uç kutusu içine yerleştirilir. Beşinci bir kutunun C10 konumunda bir uç ve A01, A12, H01 ve H12 konumlarında uçları kestiği 4 ipucu olması gerekir. Bu 4 kesme uçları uç plakası kelepçesi için kararlılık sağlar ( Şekil 2C ve 2D ).
- Üst kapağı kaydırarak çıkarınOda bölmesi montajı.
- İlk uç yumruk robot kontrol lekelenme programının başlangıç alanına yerleştirilir. Bu, daha sonra orijinal koordinatın hizalanması için kullanılacak bir agaroz deliği açar. İlk çeyreği belirlemek için plakayı 1 sıvı işleme robotunun üzerine yerleştirin. Kapağın çıkarılmış olduğundan emin olun ve spot programına devam edin.
- Tüm noktaların mevcut olduğundan emin olmak için kontrol edin. Ayrıca, kuruması için 30 saniye bekleyin. Noktalar çapı yaklaşık 1 mm olduğunda, program devam edebilir. Kullanılmış ipuçlarını biyolojik zararlı kapa boşaltın ve yeni ipuçlarını robot üzerine yerleştirin. 2. çeyrek plaka için plakayı 1 takın.
- Üçüncü kadranda tekrarlayın. Ve 4. çeyrek için tekrar et.
- Noktalar kuruduktan sonra, kızak bölmesi kapağını yerine takın ve aygıtı ters çevirin.
- Boru bağlantılarını bir hava filtresi ile takın.
- Bölmenin üst tarafına cam bir slayt yerleştirin.
NOT: Bu slayt reducei için önemlidirIsı akışını ağaraya çevirir ve odacıkların objektif kapak kayma tarafında yoğuşma oluşumunu en aza indirir. Bu kapak fişini unutma. Mikroskop konfigürasyonuna bağlı olarak, bu kapak kayışı aydınlatma tarafındaki ısınmanın objektif tarafta yoğuşmaya neden olmamasını sağlar. - Odanın objektif tarafına sıcak hava üflemek için bir fan yerleştirin. Bu fan, kapak kayma noktasında yoğunlaşmanın oluşmasını önler. Kabarcık oluşturucu ile hava akış oranını 10 mL / dk'ya ayarlayın.
5. Mikroskopta ODELAY'ın Çalıştırılması
- "ODELAY_Microscope_Control.m" komut dosyasını çalıştırın.
- İletilen ışıklı kapıyı açmak için "Deklanşör" ü ve ardından yüksek kamera oranını başlatmak için "Odak" düğmesini tıklayın ( Şekil 3A , Kırmızı Oklar).
- "Origin Go" yı tıklayın ve agarın üzerine delinmiş orijinal işareti bulmak için sahneyi hareket ettirin.
- Ardından hafifçe sağa ilerleyin.E07 alanındaki maya hücrelerine odaklanın.
- Menşe ziline geri dönün ve görüş alanına ortalayın.
- "Ayarla" düğmesine basarak menşei bu değere ayarlayın ( Şekil 3A , Mavi Oklar). Şimdi H18 konumuna getirin ve o bölgeye en yakın altıgen vidayı kullanarak odaklayın. Daha sonra L07 konumuna getirin ve o bölgeye en yakın altıgen vidayı kullanarak odaklayın. Ardından E07 konumuna gidin ve o bölgeye en yakın altıgen vidayla odaklama yapın.
- Bu konumlar odaklanıncaya kadar 5.5 - 5.7 arasındaki adımları tekrarlayın.
- Odak merkezini ve kenarları E12, H12, L12 noktalarında kontrol edin. Z-değeri ile gösterilen odak Z değerleri, otomatik odaklanma aralığından daha büyük ise ( örn ., Otofokus aralığını 60 μm olarak ayarlayın, bir merkez nokta için Z değeri ± 40 um).
- Sıfırla düğmesine basarak düğme özelliklerini etkinleştirin ve sonra düğmesine basın.ODELAY ( Şekil 3A , Yeşil Oklar). Verileri kaydetmek için dizini seçin. Yeterli sürücü alanının mevcut olduğundan emin olun.
NOT: Mikroskop, 48 saat boyunca veya program kapanıncaya kadar verileri toplar.
6. ODELAY Verilerinin İşlenmesi
- ODELAY_IPT.exe'yi açın veya ODELAY_Image_Processing_Tool_v7.m komut dosyasını kullanın ( Şekil 3C ).
- * ODELAYExpDisc.xlsx excel elektronik tablosu hazırlayın.
- Deneyi B1 hücresine yazın.
- E07 - H18 Resim dosyalarının saklandığı Resim Dizini'ni seçin.
- Verilerin yazılacağı Veri Dizini'ni seçin.
- Denemenin B04 hücresine başladığı tarihi yazın. AA / GG / YYYY biçimini kullanın.
- C04 hücresindeki seyreltme süresini yazın. Bu süre, ilk görüntü toplanmadan yaklaşık beş dakika önce. HH: MMpm biçimini kullanın; burada HH, h için ve MM dakika için dır.
- Gerinim isimlerini tO kaynak plakası (adım 3.1). Suşların lekelenme şekli nedeniyle ODELAY agaroz slaydında yeniden düzenlenirler. C31 - C126 hücreleri, ODELAY agar plakasındaki spot lokasyonlar iken, tablo B31 - B126'daki hücreler kaynak plakadır.
- Ardından "İşlem Verileri" düğmesine basın ve daha yeni hazırlanan * ODELAYExpDisc.xlsx dosyasını seçin.
- Verileri işlemek için kullanılan bilgisayar sistemine bağlı olarak 16-24 saat bekleyin.
- Görüntüler işlendiğinde, "ODELAY Well Data" adlı bir dizin ve "* _Index_ODELAYData.mat" dosyası görüntülenir. "Load Data" düğmesine basın ve yeni oluşturulan "* _Index_ODELAYData.mat" dosyasını seçin. Bu, işlenen yeni veri kümesini yükleyecektir. Dosya adındaki "*", excel e-tablosuna girilen deneme adına göre listelenir.
- Verileri yükledikten sonra alttaki zaman çubuğunu kullanarak inceleyin, büyütme eğrilerini görmek için bir görüntü karesine tıklayın fYa da o noktada ya da sol taraftaki listede ilgini çeken bir yeri bulun ve sonra o listeye ait resimleri yükleyin.
- "Violin Plot" düğmesine basarak nüfus büyüme parametrelerinin histogramlarını oluşturun. Bu, Şekil 4 veya Şekil 6'da gösterilen bir arsa oluşturacaktır.
Sonuçlar
Zaman-lapse mikroskobunda büyüyen maya görüntüleri Şekil 3B'de gösterilmektedir. Zaman atlamalı görüntüleri işledikten sonra, maya suşları BY4741 ve BY4742'yi karşılaştıran temsili bir veri seti Şekil 4'te gösterilmektedir. Bu örnek veri kümesinde plakadaki farklı konumlar arasındaki zaman katlamasında çok az değişiklik vardır. Agaroz ortamı zayıf şekilde hazırlanırsa, agaroz jelinin deforme olmuş bölgesi ile çakışan nokta konumlarında iki katlama süresi ve gecikme süresinde belirgin bir sapma belirgindir. Katlanma sürelerinin göreceli olarak tek biçimli olduğu görülürken, bu örnek gecikme süreleri ölçümlerinde değişiklikler göstermektedir. Daha tutarlı bir veri kümesi Şekil 6'da gösterilmektedir. Bu veri kümesinde gecikme süresi ve katlama süresi eşittir.
Files / ftp_upload / 55879 / 55879fig1.jpg "/>
Şekil 1: Agar Kalıp Montajı.
Agar kalıbın bileşenleri ( A ) 'da gösterilmiştir. Tabanı ( B ) 'de gösterildiği şekilde monte edin ve tabanı küçük bağlayıcı klipslerle sıkıştırın. Uzun dik parçaları, tabanın boşluğuna ( C ) yerleştirin ve sonra sürgüleri kalıba ( D ) gösterildiği şekilde kampa alın. Agarın cam slayttan ( E ) tutarlı bir şekilde ayrılması için kalıp açısını ve kalıp oyuğunun yönünü gösteren yan görünüş. Başparmak ve parmağınızın konumunu ve ayrıca agarın slayttan ( F ) ayıran düz çizgisine dikkat edin ve yatay oku not edin. Ayırma çizgisi dikey ok yönünde eşit olarak uzağa doğru hareket etmelidir. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
= "Jove_content" fo: keep-together.within-sayfa = "1"> 
Şekil 2: Sonication ve Spotting Yöntemi.
Plakayı buzlu suda sonikleyin ve plakayı ( A ) desteklemeye yardımcı olmak için bir santrifüj kovası tutucu kullanın. 3.8.1. Adımlardan plakaları agaroz plakaya ( B ) tespit etmek için yerleştirin. Ayrıca, uçların en solundaki uç kutusunun C10 konumunda bir ucu olacak şekilde düzenleyin ve daha sonra uçları kesilerek plaka tutucusunun ( C ) çarpmamasına dikkat edin. Kalan ip uçlarını dört kutuya yerleştirin; böylece içteki 24 ipucu pozisyonları kapanır ( D ). Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
55879fig3.jpg "/>
Şekil 3: ODELAY Grafik Kullanıcı Arayüzü.
"ODELAY_Microscopecontrol.m" ( A ) için Grafik Kullanıcı Arayüzünün bir ekran görüntüsü. Bu arayüz kameranın izlenmesine ve epifloresan ve parlak alan modları için mikroskop aydınlatma ayarlarının yapılmasına izin verir. Kırmızı oklar sırasıyla görüntüleri hızlı bir şekilde elde etmek ve iletilen ışıklı kapıyı açmak için kamerayı etkinleştiren Odak ve İletilen düğmelerin üzerine gelmektedir. Mavi oklar, orijinal için sahneyi hareket ettirmek ve daha sonra orijini "Go Origin" düğmesi ve "Ayarla" düğmesi ile ayarlamak için kullanılır. Yeşil oklar "Reset" ve "ODELAY !!!" ODELAY görüntü modlarını geçerli koşullara sıfırlayan ve ODELAY resim koleksiyonunu başlatan düğmeler. Spotasyondan sonra 0, 3, 6 ve 9. saatte katı ortamda büyüyen maya görüntüleri. "ODELAY_IPT.m" veya "ODELAY_IPT.m" için Grafik Kullanıcı Arayüzünün bir ekran görüntüsü. E ODELAY Görüntü İşleme Aracı ( C ). Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.

Şekil 4: Örnek ODELAY Çıkışı.
Bu veri kümesi, BY4741 ve BY4742 suşlarının YPD ortamı üzerindeki özelliklerini karşılaştırır. Bu şekil iyi hazırlanmış bir agaroz slaydına bir örnektir; Ancak, otofokus ayarları en uygun değildir. Her sütunda soldan sağa doğru çıkan veriler şöyledir: Koloni alanının 2. Ağzındaki taşıma kapasitesi; Dakikada verilen katlama süresi; Ve gecikme zamanı, dakika olarak verilir. Bu örnekte, agar slaydındaki tüm lekelerin zamanlarının ikiye katlanması, kolona doğru artan katlanma süresinin küçük bir miktarı ile iyi bir şekilde dizilir. Bununla birlikte, gecikme süreleri bu veri kümesinde belirgin olarak değişir._upload / 55879 / 55879fig4large.jpg "target =" _ blank "> Bu figürde daha büyük bir sürümünü görmek için lütfen tıklayınız.
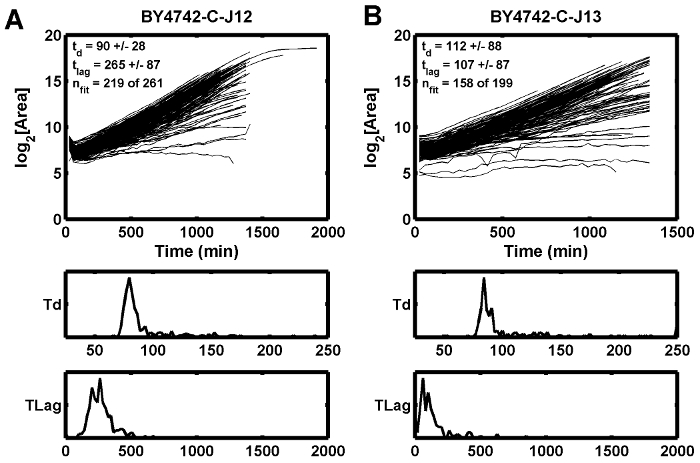
Şekil 5: Büyüme Eğrisi Örnekleri.
Bu örnek, bitişik konumun daha kısa bir gecikme süresi ( B ) gösterdiği halde, zayıf başlangıç odaklanmasının tahmini gecikme süresinin ( A ) artmasına neden olabileceğini göstermektedir. T d , dk katlanma süresidir ve t gecikme dk gecikme süresidir. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
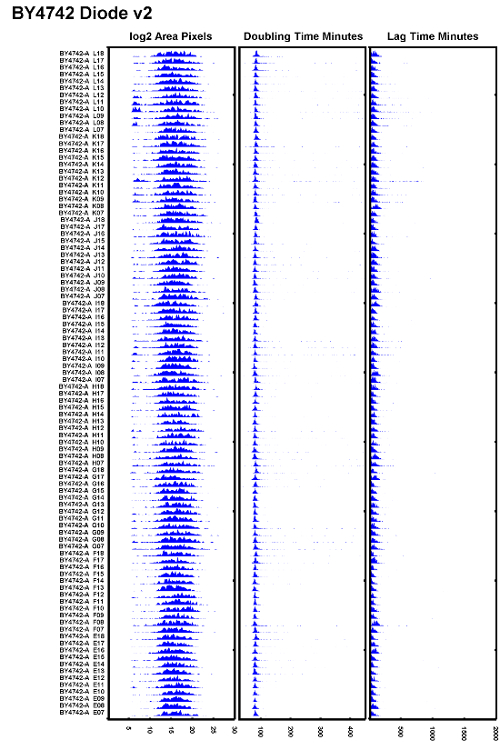
Şekil 6: İyi Yürütülmüş Deney Deneyinin Örneği.
Bir eBir tungsten halojen ampulü bir diyot aydınlatıcısı ile değiştirdikten ve otofokusun doğru ayarlanmasını sağladıktan sonra test edilen BY4742 suşunun bir örneği. Tüm çiftleşme sürelerinin iyi örtüştüğü ve gecikme sürelerinin tutarlı olduğu görülüyor. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
Tartışmalar
ODELAY tahlili, tekrarlanabilir ve güvenilir fenotipik ölçümlerin sağlanması için birkaç kritik noktaya sahiptir. İlk kritik nokta maya kültürlerinin tutarlı bir şekilde hazırlanmasıdır. Logaritmik büyümeden maya hücrelerinin hasatına dikkat edilmelidir. Kültürler doymuşsa, genetik veya çevresel ( ör. Karbon kaynağı) faktörlerin yol açtığı heterojenliği bozan nüfus heterojenliği artacaktır 11 . İkinci kritik nokta, medyanın tutarlı bir şekilde hazırlanmasıdır. Genel olarak, büyük bir hacimde 10X stok ortamı çözümü üretilmeli ve daha sonra yığın etkilerini en aza indirgemek için zamanla kullanılmalıdır. Ortamı, mümkün olduğunca ağırlık olarak formüle etmek, agarın yoğunluğunu temin ederek ortamdaki agaroz yoğunluğunu arttırarak ortamın tutarlılığını geliştirmeye yardımcı olur ve agarozun genel su içeriği yakından izlenebilir. Üçüncü kritik nokta, agarozun mekanik deformasyonunu en aza indirgemeyi veya ortadan kaldırmayı içerirçap. Ortamın mekanik deformasyonu, agarozun cam kaydıraklardan ayrılması sırasında en sık meydana gelecektir. Birçok laboratuvar tekniğinde olduğu gibi, bu adımı uygulamak için uygulama gerekmektedir.
Gecikme süresinin Şekil 4'te gösterildiği gibi değişimi genellikle üç faktörden biriyle ilişkilidir: agaroz ortamının mekanik deformasyonu, kalıplanmış agar kalınlığında değişim veya dengesiz bir ışık kaynağı. Agaroz ortamı, lekelenmiş dizi boyunca Z-yüksekliğinde farklılık gösteriyorsa, yükseklik değişimi otofokus rutininin aralığını bastırabilir ve bu da ilk görüntülerin biraz odak dışına çıkmasına neden olur. Bu nedenle, otofokus rutinin odağı bulmak için yeterli Z aralığına sahip olduğundan emin olmak için, orta noktada ve lekelenmiş dizinin kenarları boyunca odak noktasının yüksekliğini kontrol edin. Gerekirse, odak aralığını artırmak ve odak adımlarının sayısını artırmak için Otofokus panelini kullanın.
Üçüncü olası koşulYoğun odaklanmaya yol açabilecek iyon belirli bir Z-yüksekliği için hesaplanan odak noktasını bozabilen dengesiz veya titreşen bir ışık kaynağıdır. Tungsten halojen ampuller, ampuller yanmadan önce iyi titreşirler. Kötü odaklanma etkisi, büyüme eğrilerinin birinci ve ikinci zaman noktaları arasında dalgalandığı ( Şekil 5A) bir örnekte görülürken, bitişik nokta aynı dalgaya sahip değildir ( Şekil 5B). Bu durumda, kötü odaklanma durumu, tungsten halojen ışık kaynağının değiştirilmesi ile hafifletildi.
Uygulamada, yazarlar, 100W tungsten halojen ampullerin titremesini azaltmak için, ampullerin her 500 saatte bir değiştirilmesi gerektiğini veya yaklaşık 2 ayda bir mikroskopların ağır kullanımı altında olduğunu tespit ettiler. Titreyen bir ampulün odağın zayıf odak noktalarını önlemek için tungsten halojen ışık kaynağını sık sık değiştirin veya halojen ampulü bir diyotlu ışık kaynağı ile değiştirin. birŞekil 6'da çift katlama sürelerinde düşük varyasyonun yanı sıra daha düzgün gecikme süreleri gösteren bir veri kümesi örneği gösterilmektedir. Bu veri seti otomatik odaklamayı gerçekleştirirken zamanla daha kararlı bir aydınlatma sağlayan bir diyot aydınlatıcısı ile çekildi.
Burada medya hazırlığını optimize etmek için bahsedilen pek çok nokta açıkça görülebiliyor olsa da, literatürde en büyük ölçekli ekranlar 8 , 11 birbirleriyle iyi çoğalmamaktadır . Bu nedenle, daha çoğaltılabilir fenotipik ekranların üretilebileceği şekilde kültürlerin ve agaroz ortamının hazırlanmasını özenle tarif ettik.
ODELAY tahlili şu anda sentetik genetik diziler veya Scan-O-Matic tahlili gibi sabitleme tabanlı testlere kıyasla verimlilik açısından sınırlıdır. Bu yöntemler ölçülen suşların sayısını arttırırken, tek tek hücrelerin çözümlenmesinde bir yeteneği yoktur.Bu nedenle klonal maya suşlarında gözlemlediğimiz nüfus heterojenliğini ölçemez. Bu nüfus heterojenliğinin kökeni şu an anlaşılmamıştır, ancak burada gösterilen teknoloji ve hesaplamanın bir araya getirilmesi altında yatan hücresel mekanizmaları nesnel olarak ele alma fırsatı sunmaktadır 12 .
Yazarlar, ODELAY'in şu anda sadece belirli bir mikroskop markası ve vücut tipi için optimize edildiğini belirtmek ister. ODELAY'ı diğer mikroskop sistemler için değiştirmeniz açıktır, ancak açık kaynak API 13'ün bilgisi gerekecektir. Bununla birlikte, hem API, hem de ODELAY betiği farklı sistemlere ve deneysel tahlillere kolayca uyarlanacak şekilde yazılmıştır.
ODELAY orijinal olarak maya için geliştirilmiş iken, Mycobacterium smegmatis'in büyümesini gözlemlemek için onu değiştirmeden kullanabiliriz. Diğer koloni oluşturan mikroorganizmaların gözlemlenmesiSağlanan kaynak kodundaki değişikliklerle mümkündür 11 . Genel olarak ODELAY, farklı çevresel koşullar ve genetik karışıklıklar altında yetiştirilen mikroorganizmaları karşılaştırmak için güçlü ve esnek bir araçtır.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Yazarlar, ABD Ulusal Sağlık Enstitülerinden JDA'ya U54 RR022220 ve P50 GM076547 hibe vererek bu çalışmanın desteğini onaylıyorlar. FDM, Kanada Sağlık Araştırmaları Enstitülerinde doktora sonrası bir araştırmacıdır. Destek için ayrıca Lüksemburg Sistem Biyotıp ve Lüksemburg Üniversitesi'ne teşekkür ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Agarose UltraPure | ThermoFisher | 16500500 | Gel Temp 36C, Gel Strength (1%) 1.2 g/sq cm |
| Yeast Extract Peptone (YEP) | Fisher Scientific | BP1422-2 | |
| Complete Suplement Mixture (CSM) | Fisher Scientific | MP114560222 | |
| Polyethylene Glycol 3350 (av. mol. wt. 3000-3700) | SigmaAldrich | P2906 | |
| Yeast Strain BY4741 | ThermoFisher | 95400.BY4741 | |
| Yeast Strain BY4742 | ThermoFisher | 95400.BY4742 | |
| 50 mL Falcon tubes | Corning | 430291 | 1 case |
| 15 mL Falcon tubes | Corning | 352096 | |
| 2 x 3 inch 1.0 mm thick slides 1/2 gross | VWR | 48382-179 | |
| 96-well plate flat bottom | Corning | 353072 | |
| Hydra liquid handleing robot | Thermo | 1096-DT-100 | |
| Hamilton Microlab Star Liquid Handleing Robot | Hamilton | ||
| hydra 100 mL tips Extended Length DARTS | Thermo | 5527 | |
| Synergy H4 Plate Reader | Biotek | H4MLFAD | |
| Leica DMI6000 B Microscope | Leica | ||
| Leica 10X/0.3NA objective | Leica | 11506289 | |
| Hamamatsu ORCA Flash 4.0 Camera | Hamamatsu | C11440-22CU | |
| MATLAB with image processing tool box | Mathworks | ||
| MicroManager | Open Imaging | https://micro-manager.org/ | |
| ODELAY Microscope Control (MATLAB scripts and GUI) | www.aitchisonlab.com\ODELAY for Matlab scripts and software | ||
| ODELAY Microscope Chamber | www.aitchisonlab.com\ODELAY for Mechanincal Drawings | ||
| ODELAY Agar Molds | www.aitchisonlab.com\ODELAY for mold drawings |
Referanslar
- Zwietering, M. H., Jongenburger, I., Rombouts, F. M., van't Riet, K. Modeling of the bacterial growth curve. Appl Environ Microbiol. 56 (6), 1875-1881 (1990).
- Sellick, C. A., Campbell, R. N., Reece, R. J. Galactose metabolism in yeast-structure and regulation of the leloir pathway enzymes and the genes encoding them. Int Rev Cell Mol Biol. 269, 111-150 (2008).
- Yoshikawa, K., et al. Comprehensive phenotypic analysis for identification of genes affecting growth under ethanol stress in Saccharomyces cerevisiae. FEMS Yeast Res. 9 (1), 32-44 (2009).
- Bryan, A. K., Goranov, A., Amon, A., Manalis, S. R. Measurement of mass, density, and volume during the cell cycle of yeast. Proc Natl Acad Sci U S A. 107 (3), 999-1004 (2010).
- Baryshnikova, A., et al. Quantitative analysis of fitness and genetic interactions in yeast on a genome scale. Nat Methods. 7 (12), 1017-1024 (2010).
- Costanzo, M., et al. The genetic landscape of a cell. Science. 327 (5964), 425-431 (2010).
- Collins, S. R., et al. Functional dissection of protein complexes involved in yeast chromosome biology using a genetic interaction map. Nature. 446 (7137), 806-810 (2007).
- Zackrisson, M., et al. Scan-o-matic: High-Resolution Microbial Phenomics at a Massive Scale. G3 (Bethesda). 6 (9), 3003-3014 (2016).
- Bean, G. J., Jaeger, P. A., Bahr, S., Ideker, T. Development of ultra-high-density screening tools for microbial 'omics'. PloS One. 9 (1), e85177 (2014).
- Levy, S. F., Ziv, N., Siegal, M. L. Bet hedging in yeast by heterogeneous, age-correlated expression of a stress protectant. PLoS Biol. 10 (5), e1001325 (2012).
- Herricks, T., et al. One-Cell Doubling Evaluation by Living Arrays of Yeast. ODELAY! G3 (Bethesda). 7 (1), 279-288 (2017).
- Mast, F. D., Ratushny, A. V., Aitchison, J. D. Systems cell biology. J Cell Biol. 206 (6), 695-706 (2014).
- Edelstein, A. D., et al. Advanced methods of microscope control using µManager software. J Biol Methods. 1 (2), e10 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır