Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Sıçan Dilinin Mekanik ve Viskoelastik Özelliklerinin In Vivo Değerlendirilmesi
Bu Makalede
Özet
Anestezik fare modelinde dildeki kas tonusu ve viskoelastik özelliklerini belirlemek için cerrahi bir prosedürü tarif ediyoruz. Prosedür, hipoglossal sinirlerin spesifik olarak uyarılmasını ve kaslara pasif Lissajous kuvvet / deformasyon eğrilerinin uygulanmasını içerir.
Özet
Dil, omurgalıların çoğunun ağzında çok sinirlendirilmiş ve vaskülarize kas hidrostatıdır. Birincil işlevleri çiğneme ve yalancılaştırmanın yanı sıra tadı algılama ve fonetik desteklemektir. Buna göre, dilin kuvveti ve hacmi, omurgalıların beslenme, iletişim ve nefes alma gibi temel faaliyetleri gerçekleştirme kabiliyetini etkiler. Uyku apneli hastalarda, manyetik rezonans görüntüleme (MRG) ile görülebilen ve nicelenebilen artmış kas tonusu ve intramüsküler yağ artışı ile karakterize genişlemiş dildir. Dengenin kuvvet üretimini ve viskoelastik özelliklerini ölçme yetenekleri, görüntüleme verileri ile ilişkilendirilebilecek işlevsel bilgi elde etmek için önemli araçlar oluşturmaktadır. Burada, anestezi altındaki Zucker sıçanlarında dil kuvvet üretimini ölçmek için hipoglossal sinirlerin elektriksel uyarımı yoluyla ve viskoelastik özelliklerin belirlenmesi için teknikler sunulmaktadırPasif Lissajous kuvvet / deformasyon eğrileri uygulayarak dil.
Giriş
Dil, çiğneme, sökme, tat algılama ve konuşma için gerekli desteği sağlar. Farklı innerve ve anatomi / fonksiyona sahip ekstrinsik ve intrinsik kasların varlığı, bu kaslı hidrostatın tekliğinden sorumludur. Görüntüleme tekniklerindeki son gelişmeler, karmaşık anatomisinin daha ayrıntılı bir görünümünü sağlamıştır 1 . Dil işlevselliklerinde azalma, dil atrofisi, disfaji ve konuşma engelleri, Parkinson 2 , Amyotrofik Lateral Skleroz (ALS) 3 , Myotonic Distrofi (MD) 4 ve diğer miyopatiler gibi miyopatik rahatsızlıkların da belirtileridir.
Sık görülen hastalık durumlarıyla ilişkili kas kompozisyonundaki değişiklikler dilin mekanik ve viskoelastik özelliklerini etkiler. Örneğin, dil kuvvetinin işlevsel analizi yaşlanma ile ilişkili kasılma özelliklerinde değişiklikler ortaya çıkarmıştırSs = "xref"> 5 , 6 , hipoksi 7 , 8 ve obezite 9 , 10 . Kas distrofisi durumunda, artmış fibrozis, bir kas gerilmesine neden olur ve bu da bir Lissajous deformasyon protokolü uygulandığında deformasyona daha az uyuma neden olur 11 . Tersine, obez hastalarda belgelenenler gibi kas yağ içeriğindeki değişiklikler hem metabolik 12 hem de iskelet kasının 13 , 14 mekanik özelliklerini değiştirir ve kasın deformasyona uyumunu artırması beklenir. Artan dil fizi, kısmi üst hava yolu tıkanıklığı (apne) noktasına dil hacmini arttırarak, insanlardaki 17 , obstrüktif uyku apnesinin (OSA) gelişimi ile de korelasyon gösterir 15,16. SimObez Zucker sıçanlarında ( 10) dilin yağ infiltrasyonu belgelendi ve bu modelin, dil fızyolojisine yağ infiltrasyonunun etkilerini incelemek için değerli bir araç olduğunu düşündürdü.
Dil kuvvetinin ölçülmesi, hipoglossal sinirleri 17 , 18 izole etmek ve çift taraflı olarak stimule etmek için hassas cerrahi teknikler gerektirir. Bu tür teknikler daha önce farelere 5 , 17 , 19 , 20 , tavşanlar 21 ve insanlar 22 , 23'de tarif edilmiş, ancak araştırmacıya sınırlı görsel yardımlar yapılmıştır. Oldukça teknik doğası nedeniyle ayrıntılı bir protokolün varlığı, bu tekniğin erişilebilirliğini ve tekrarlanabilirliğini önemli ölçüde artıracaktır. Deneysel paradigmamızın amacı,Bir sıçan modelinde dilin mukavemet ve viskoelastik özelliklerini ölçmek için geçerli ve güvenilir bir teknik gereklidir. Bunu gerçekleştirmek için sıçan anestezi altına alınıp, hipoglossal sinirlere maruz bırakılır ve hayvanın dile serbestçe erişmesini sağlamak için trakea kanüle edilir. Bir sütür ilmesi daha sonra, iki kuvvet ve uzunluğu kontrol edebilen bir kuvvet dönüştürücüsüne dilin ucunu bağlarken, iki bipolar kanca elektrotu hipoglossal sinirleri dilin kasılmasını başlatmaya teşvik eder. Kuvvet ölçümü tamamlandıktan sonra, kuvvet transdüserinin uzunluk kontrol yetenekleri, sabit amplitüd (Lissajous eğrileri), süresi ve frekansı olan bir sinüs dalgası protokolüne göre, dilin süresini hızla değiştirmek için kullanılır; Viskoelastik özellikleri 11 , 24 . Protokol araştırmacıya diseksiyon aşamaları, hayvanın deneysel platfo üzerinde konumlandırılması konularında rehberlik edecektirRm, elektrot yerleştirilmesi ve son olarak kuvvet ve viskoelastiklik verisinin edinimi ve analizleri.
Protokol
Hayvan konuları da dahil olmak üzere tüm prosedürler, Pennsylvania Üniversitesi'nin Kurumsal Hayvan Bakımı ve Kullanım Komitesi (IACUC) tarafından onaylanmıştır (Protokol numarası 805822). Tarif edilen prosedür terminaldir ve aseptik koşulların veya farmasötik sınıf ürünlerin kullanılmasını gerektirmez.
1. Cerrahi İşlemler
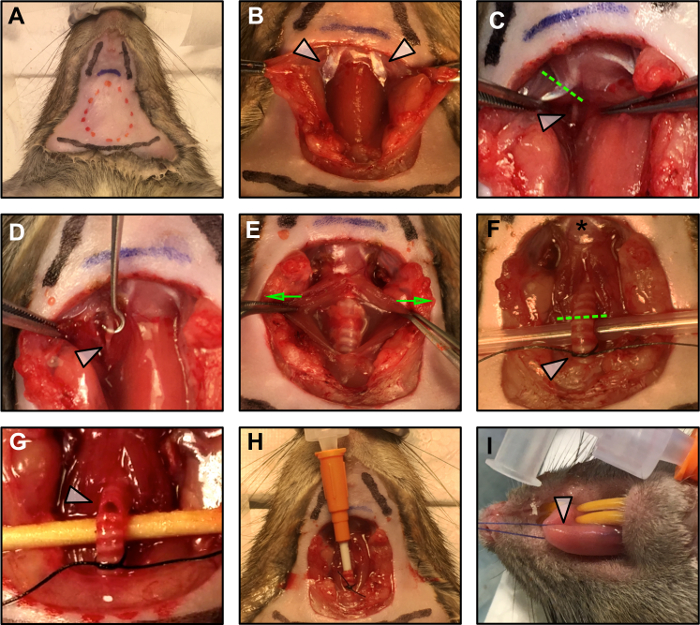
Şekil 1: Cerrahi İşlemler.
(A) Cerrahi plan sınırlaması. Kırmızı kesikli çizgi insizyonun alanını belirtir. İki siyah çizgi çene pozisyonunu, alttaki siyah çizgi ise toraksın pozisyonunu belirtir. Mavi çizgi hyoid kemiğini gösterir. (B) Yağ dokusunun, dil altı ve submaxill'in künt disseksiyonundan sonra digastrik kasın posterior belininin (oklar ) maruz kalması Bez bezleri. (C) Hipoglossal siniri (beyaz ok) açığa çıkarmak için digastrik kasının posterior karnı (kesikli yeşil çizgi ) rezeksiyonu. (D) Hipoglossal sinir (beyaz ok) çevresindeki fasyadan temizlenir. (E) Trakea çevresindeki düz kası yavaşça çekerek maruz bırakılır (yeşil oklar uygulanan kuvvet yönünü gösterir) ve entübasyona hazırlanmak için kaldırılmıştır (F) . Yıldız, dilin hiyoid kemiğe sokulduğunu gösterir. Yeşil kesik çizgi, entübasyon için insizyon noktasını işaretler. Beyaz ok, yerleştirildikten sonra kanülü yerinde sabitlemek için hazırlanan gevşek düğüm gösterir. (G) Kanülasyon için trakeanın kesilmesi. (H) Trakeal kanül, kare şeklinde bir düğümle yerine yerleştirilir ve sabitlenir. (I) Dikişin dile uygulanması.Target = "_ blank"> Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
- Anestezi ve ameliyat için hazırlık
- Rat% 4 izofluran anestezi ile indüksiyon odasına yerleştirin.
- Bir ısı kaynağı üzerine yatırın ve dakika başına en az 70 solunum solunum hızı sağlayan bir burun kokusundan% 1 - 3 izofluran ile anestezi uygulayın.
- Boyun bölgesini bir hava kesici ve epilasyon kremi ile tıraş edin. Epilasyon kremi kullanırken, kremi pamuk uçlu bir aplikatör ile kürk çıkana kadar serpiştirin. Epilasyon kremi uzun süreli maruz kalınması cildin tahrişe neden olabilir.
- Cerrahi alanı% 70 alkolle temizleyin ( Şekil 1A ).
- İlk insizyona devam etmeden önce hayvanın solunum modelini ve reflekslerini kontrol edin (ayak parmak refleksi eksikliği). Anestezi derinliğinin sürekli izlenmesi ve değerlendirilmesi önemlidir (tekrarKordon solunum hızı ve her 10 dakikada bir refleks eksikliği); Tüm prosedür boyunca hayvanın derin, cerrahi bir anestezi düzlemi altında olması gerekir.
- Hipoglossal Sinirlerin Tanımlanması
- Şekil 1A'daki kırmızı noktalı çizginin gösterdiği şekilde cildi rezeke ederek ve çıkartarak cerrahi alanı bir çift ameliyat makası ile açın.
- Herhangi bir yağ dokusu, dil altı ve submakseal bezler ve trakeayı çevreleyen kas katmanı yoluyla bulanıklığı kesin.
NOT: Diseksiyon süresince muhafazakar olun. Mümkün olduğunca künt diseksiyon uygulayın ve boynun kan damarlarına zarar vermemek için dikkatli olun. - Trakea lateralindeki digastrik kasının (PD) posterior göbeğini tanımlayın ( Şekil 1B - beyaz oklar). Hipoglossal sinir bu kasın altından geçer ( Şekil 1C - beyaz ok). Elektrokoter ile PD proksisini rezekte edin( Şekil 1C - kesikli çizgi).
NOT: Sinirin veya etrafındaki dokunun kurumasına izin vermeyin. Siniri korumak için sinir üzerine bir damla mineral yağ ekleyin. Elektrodlardan uyarıcının alan yayılımına bağlı olarak kas kasılmasını önlemek için, sinir çevresinde olası temas bölgelerindeki kas dokusunu dikkatli bir şekilde koterize edin. - Bir çift ince forseps kullanarak, hipoglossal siniri çevre fasyadan ayırın. Bir kanca yardımıyla, bipolar elektrot bağlantısı için sinirin en az 3 mm olduğundan emin olun ( Şekil 1D ).
- Mikro hemostatik forseps kullanarak, hipoglossal siniri, uyarıcının retrograd yayılımını önlemek için mümkün olduğunca hipoid kemikten ( Şekil 1D - beyaz ok) distal olarak ezin. Siniri, mikro hemostatik forseps ile 5 sn basınç uygulayarak ezin. Hemostat siniri tuttuğunda, kısa bir tDilin tabanındaki cadı görünür olmalıdır.
- Diğer taraf için prosedürü tekrarlayın.
- Trakeal entübasyon
- Çevredeki düz kasları künt diseksiyonla hafifçe ayırarak trakeaya maruz kalın ( Şekil 1E - yeşil oklarla gösterildiği gibi).
NOT: Konservatif olun ve tercihan künt disseksiyonu kullanın. Kanül çapını trakea çapıyla karşılaştırın. Kanül, trakeaya doğru şekilde oturmalıdır ve 1.3.2 ila 1.3.5. Adımlarda anlatıldığı gibi sütüre edildikten sonra stabil şekilde sokulmalıdır. - Trakeayı, dikiş sıkıştırma forsepsleri kullanarak yavaşça kaldırın ve toraksa yakın bir 4-0 dikiş yerleştirin. 6. ve 7. halka arasındaki başlangıç gevşek düğümünü gırtlaktan bağlayın ( Şekil 1F - beyaz ok). Kanopi yerlerine oturtmak için kanül yerleştirildiğinde bu düğüm kapatılır.
- Bir çubuğu kaydırınKaldırmak ve kanülün (IV 14 gx 3.25 "kanül) takılmasını kolaylaştırmak için trakea altına pipet aktarın (pipetin takılması kolaylaştırmak için mineral yağı ile yağlayın).
- Larenksten 4. ve 5. halkalar arasında küçük bir kesik açın ( Şekil 1G - beyaz ok). İlk insizyondan sonra, açılma eğilimi gösterecektir, bu nedenle trakeanın komplet rezeksiyonundan kaçınmak için başlangıç kesimini yaparken muhafazakar olunuz.
NOT: Trakea kesisini yapmadan önce, kanül hazır olduğundan ve anestezi iletiminin açık olduğundan emin olun. - Kanül yoluyla anestezi uygulamasına başlayın ve nazikçe insizyona yerleştirin, trakea içerisinde nazik bir şekilde yaklaşık 5 zil uzunluğunda ilerleyin. Hava geçirmez bir conta oluşturmak için, kanülü dikişle yerinde sabitleyin ( Şekil İH ).
NOT: Kaçınılması önlemek için tırtıklanmış trakeaya hiçbir sıvı girmemesine dikkat edinonumu. Trakea kesecek olursa, hayvan oda havasını soluyor olacaktır. Bu nedenle kanülün hızlı bir şekilde yerleştirilmesi, böylece anestezinin verilmesi korunur. Hayvanı ne zaman / isterse hareket ettirirseniz, trakea içindeki kanülün doğru konumunu izleyin. - Hayvanı nazikçe nosekondan çıkarın.
NOT: İzofluran yerine enjekte edilebilir anestetikler kullanılması, trakeal entübasyon gereksinimini ortadan kaldırarak ve deneysel çalışma alanını fazladan borulardan temizleyerek prosedürü basitleştirebilir.
- Çevredeki düz kasları künt diseksiyonla hafifçe ayırarak trakeaya maruz kalın ( Şekil 1E - yeşil oklarla gösterildiği gibi).
- Dil dikiş
- PBS'de 20 cm uzunluğunda 5/0 dikiş parçası (ipek, siyah örgülü önerin) koyun.
- Farenin ağzını açık tutarken, dikiş sıkıştırma forsepsiyle dilin ucunu hafifçe tutun.
- Dikişi , potansiyel dokuyu önlemek için dili tuzlu su ile nemli tutmaya dikkat ederek dilin ucundan mediale geçirin ( Şekil 1I - beyaz ok)hasar.
- Yaklaşık 4 cm genişliğinde bir halka bağlayın (çap hayvan ve kuvvet dönüştürücü arasındaki mesafeye bağlı olarak değişebilir).
NOT: Eklemeyi kolaylaştırmak ve dokunun gereksiz lezyonlarından kaçınmak için dikişin ve dilden ıslak olduğundan emin olun.
2. Deneysel Kurulum
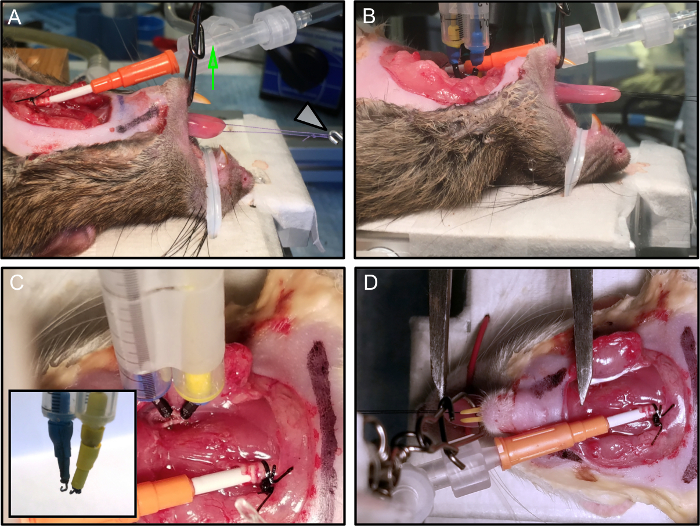
Şekil 2: Hayvan Yerleştirme ve Güvenliğinin Sağlanması.
(A) Fare, deney platformuna yerleştirilmiştir. Çene sabitlenir ve ağız dikey gerginlik (yeşil ok) uygulanarak açık tutulur. Dikiş döngüsü kuvvet transdüktörüne bağlanır (beyaz ok). (B) Elektrotlar bağlıdır. (C) Bir mikromanipülatör üzerine monte edilen her elektrot, sinire istikrarlı bir şekilde bağlanır. Kakma tKanca elektrotu. (D) Düğümün optimal uzunluğu, dilin kıvrım tırnağının seviyesine yerleştirildikten dilin ucuna kadar bir Vernier kaliper ile ölçülür. Bu resimde, açıklık sağlamak için elektrotlar çıkarıldı. Bu rakamın daha büyük bir versiyonunu görmek için lütfen tıklayınız.
Not: Deney sırasında hareket etmemek için, aşağıdaki önlemleri kullanarak cihazın ısıtılmış tepsisine yatırın.
- Sıçanın burnunu, ısıtılmış platforma doğrudan bağlı plastik kaplamalı bir metal bükülme tepsisi ile kasete sabitleyin ( Şekil 2A , 2B ).
- Dikey gerginlik uygulayarak fare ağzını açınız (9 kg'lık test monofilament hattına bağlı bir 3 yönlü döndürme kullanın ve bir kamera çubuğuyla yerine tutun) ( Şekil 2A - yeşil ok).
NOT: Sıçanın stabilize edilmesine yönelik alternatif bir yaklaşım, kemirgen ağız kancası veya bunun özel bir tadilatı kullanmaktır. Ölçüm kalitesini etkileyebilecek boynun hareketlerinden kaçınmak için ağzın açık ve sabit kalması zorunludur. - Dikiş döngüsünü kuvvet transdüktörüne bağlayın ( Şekil 2A - beyaz ok).
- Cerrahi bandı kullanarak, uyarılar sırasında hareketleri sınırlandırmak için uzuvları ve sıçanın karnını hareketsiz hale getirin.
- İki stimule edici kanca bipolar elektrotu disseke hipoglossal sinirlere, proksimale ezici bölgeye uygulayın ( Şekil 2C ).
- Uyarıcı iki kutuplu elektrotlar, bir plastik destek kullanılarak birbirlerinden 2 mm uzakta tutulan, bir çift cerrahi sınıfı çelik 29 gauge iğne elektrodundan yapılmış özel olarak kullanın (burada, birlikte bantlanmış iki adet 1 mL'lik serolojik pipetler kullandık).
- İğne elektrotlarının uçlarını kanca şekline bükünSinirle (~ 1 mm çapında) istikrarlı bir temas oluşturacak kadar küçük ( Şekil 2C - kakma).
- Her bir elektrodun iki telini muz jack x BNC jaklı istiflenebilir bir çift ciltli postaya bağlayın ve daha sonra bir BNC splitter kullanarak bir in situ Kas Test Sisteminin (Tablo 3) stimülatör modülüne bağlayın.
NOT: Hayvanın dengeli olduğundan ve boynun ve dilden kuvvet dönüştürücü kola hizalandığından emin olun. Solunum hızını izlemeye devam edin ve sınırlamaların solunum ile etkileşime girmediğinden emin olun.
3. Optimum Uzunluk (L 0 ) ve Maksimal İzometrik Kuvveti Belirleme
- Dil uzunluğunu kademesiz olarak ayarlayın ve maksimum bir kuvvet elde edilinceye kadar izometrik seğirme uyarılarını uygulayın.
- L 0'ı , izometrik seğirme kuvvetinin ( Tablo 1 ) maksimum olduğu uzunluk olarak tanımlayın ve sonraki normalleştirme için kaydedinHer hayvan için değiştiği gibi kuvvet ölçümleri. Bir Vernier kaliper kullanarak, dilin uzunluğunu, eklemden, hipoid kemik seviyesinde ( Şekil 2D ) dilin ucuna kadar ölçün.
NOT: Elektrotların doğru şekilde konumlandırılması, sinirler ile optimal teması sağlamak için şarttır. Optimum konumlandırma, sırasıyla iki sinirden birini veya ikisini de uyarırken benzer ve ek güçler uygulamalıdır.
- L 0'ı , izometrik seğirme kuvvetinin ( Tablo 1 ) maksimum olduğu uzunluk olarak tanımlayın ve sonraki normalleştirme için kaydedinHer hayvan için değiştiği gibi kuvvet ölçümleri. Bir Vernier kaliper kullanarak, dilin uzunluğunu, eklemden, hipoid kemik seviyesinde ( Şekil 2D ) dilin ucuna kadar ölçün.
- Denemeye başlamadan önce, hem elektrotları uyarana bağlayın ve bir tetanik tetik stimülasyon uygulayın ( Tablo 1 ). Bu daralma sırasında, pozisyonun dengeli olduğundan emin olmak için hayvanı izleyin ve boyun kaslarının istenmeyen şekilde görülen kasılmalarını kontrol edin.
- Bir tetik uyarısı ile 20 saniye sonra bir seğirme uygulayarak izometrik kuvveti ölçün. Uyarıları 3 kez tekrarlayın, stimülasyon döngüleri arasında 4 dk iyileşme sağlayın (bir döngü bir seğirme veTetanik uyarımı) ve maksimum seğirme ve tetanik kuvvetlerini kaydedin.
- Kasılmalar arasında birkaç damla PBS uygulayarak dili her zaman ıslak tutun.
NOT: Boyun kasları küçülürse, elektrotların çevresindeki kas dokusuna dokunmamaları için elektrotların konumunu dikkatli bir şekilde değiştirin ve gerekirse dokuları elektrotlarla temas halinde koterize edin.
4. Viskoelastik Özelliklerin Belirlenmesi (Lissajous Eğrileri)
- İzometrik kuvvet tespitinden sonra dilin 3-5 dakika dinlendirilmesine izin verin. Lissajous eğrilerini L0'dan başlayarak gerçekleştirin, bu nedenle hayvanın ve kuvvet dönüştürücünün konumu asla değiştirilmemelidir.
- Hipoglossal sinirleri uyarmadan, artan yer değiştirme (d), yani 5, 10, 15, 20, 25, 30, 35, 40,% 50 L0 (daha büyük amplitüdler) ile pasif uzantıların döngüleri uygulayın ( Tablo 2 ) Mod denetleyicisi ile305C-LR'den daha fazla r gezi değeri). Örneğin,% 40 L0 genliği, dildeki deformasyonun +% 20 L0'dan -20% L0 yapmasına neden olacaktır.
- Her devirde 10 tekrarlarla sabit 2 Hz sinüs frekansı kullanın, her devirde toplam 5 saniye süreyle. Sinüs frekansındaki değişiklikler geçmişte diyafram 24 gibi dokularla kullanılmıştır ve deney protokolünü değiştirmek için kullanılabilir.
- Her döngü arasında 30 saniye bekleyin ve tüm işlem sırasında dilin ıslak olmasını sağlayın.
NOT: Prosedür sırasında birkaç damla PBS ekleyerek dili ıslak tutun. Çeneyi tutan kısıtlamanın, uzantılar sırasında, özellikle yer değiştirme% 40'a veya daha yüksek bir hıza ulaştığında, istikrarlı bir şekilde yerinde kalmasını sağlayın.
- Deney bittikten hemen sonra, hayvan hala anestezi derin bir cerrahi düzlemi altında iken, hayvan onaylanmış IACUC hayvan protokole göre euthanizeocol. Dilin ileriki işlemler için ayrılması ( örneğin, dondurulmuş kesit alma veya biyokimyasal analizler için depolama).
Sonuçlar
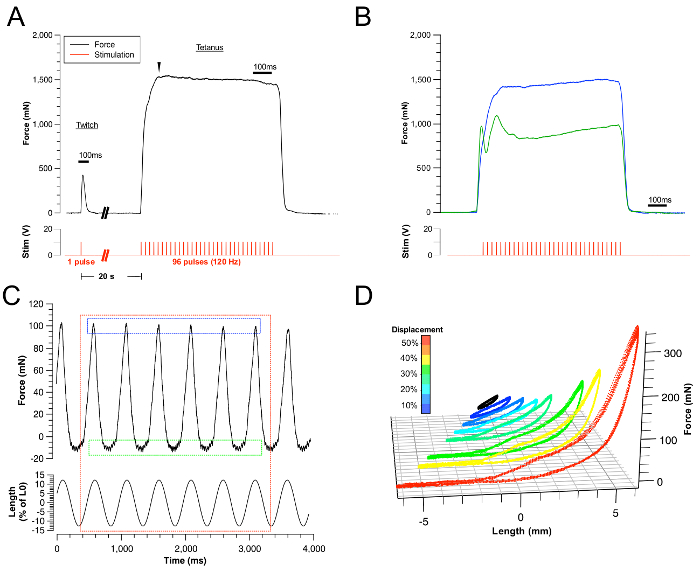
Şekil 3: Temsilcilik Sonuçları.
(A) Başarılı seğirme ve tetanik kuvvet izlerinin örnekleri. Karşılık gelen uyarı kırmızı iz ile gösterilir. (B) Alt maksimum kasılmaya (mavi iz) ve boyun kaslarının dolaylı uyarılmasına bağlı başarısız dildeki tetanik kasılma örneği. Her iki koşul da uyarıcı elektrodların yerleri...
Tartışmalar
Dil metabolizması ve / veya bileşimindeki değişiklikler, örneğin obezite sonucu dilde yağ infiltrasyonunun, protokolümüz tarafından değerlendirilen parametrelerin nicelenebilir değişikliklerine neden olduğu tahmin edilmektedir. Diş kuvvetinin nicelendirilmesi büyük önem taşımaktadır, çünkü çıkıntılı ve geriye çekici aktivite veya genel dilde zayıflama arasındaki bir dengesizlik üst hava yolu 15'ün tıkanmasına neden olabilir. Dil kuvvetini artırmayı amaçlayan egzersiz t...
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Bu araştırma iki Ulusal Sağlık Teşviği Enstitüsü tarafından desteklendi: HL089447 ("Obezite ve OSA: Dilde Yağ ve Metabolik Fonksiyonun Önemini Anlamak") ve HL094307 ("Obezite ve Dil Falı İlişkisini Anlamak")
Malzemeler
| Name | Company | Catalog Number | Comments |
| SurgiSuite (heated Surgical tray) | Kent Scientific | SurgiSuite-LG | Includes heated platform |
| LED Lighting and Magnification Kit | Kent Scientific | SURGI- 5003 | |
| RC2 Rodent Circuit Controller | VetEquip | 922100 | |
| Isoflurane | Butler Schein Animal Health Supply | 29405 | |
| Alcohol Prep | Webcol | 6818 | |
| Cotton-tipped applicators | MediChoice | WOD1002 | |
| Hair clipper | Conair | ||
| Hair remover lotion | Nair | ||
| Medical tape | Transpore | 3M | |
| D-PBS | Corning | 21-030-CM | |
| Operating Scissors | World Precision Instruments | 503717-12 | |
| Hemostatic Forceps | Merit | 97-458 | Any tissue forceps can be used instead |
| Microdissecting Forceps, Angled, Serrated, 10.2 cm, SS | World Precision Instruments | 504479 | |
| Suture Tying Forceps | Fine Science Tools | 18025-10 | |
| Blunt Micro Hook | Fine Science Tools | 10062-12 | |
| Microhemostat | Fine Science Tools | 12075-14 | |
| Thermal cautery | WPI | 501292 | Disposable cauteries are available at lower cost |
| IV 14g x 3.25" cannula | BD | B-D382268H | For tracheal cannulation |
| Braided silk non-absorbable suture size 4-0 | Harvard Apparatus | SP104 | For stabilization of the tracheal cannula |
| Braided non-absorbable silk 5/0 suture | Surgik LC, USA | ESILRC15387550 | For suturing the tongue |
| Plastic-coated metal twist-tie (or electrical wire) | For securing the rat's nose to the platform | ||
| Camera stick | |||
| 3 way-swivel and Trilene 9 Kg test monofilament line | Berkley | For securing the jaw and maintaining the mouth open | |
| Camera stick with adjustable angle | For supporting the 3 way-swivel and maintaining the mouth open. | ||
| in situ Muscle Test System | Aurora Scientific | 809C | This system is designed for mice and was modified by extending the platform. Alternatively the rat-specific 806D system can be used. |
| Dual-Mode Muscle lever (force transducer) | Aurora Scientific | 305C-LR | 309C offers higher excursion capabilities than 305C-LR. Link for more information and specifications: http://aurorascientific.com/products/muscle-physiology/dual-mode-muscle-levers/ |
| Needle Electrodes (surgical steel, 29 gauge) | AD Instruments | MLA1204 | 300C is recommended for use in mice. |
| Magnetic Stands | World Precision Instruments | M10 | Used for making the bipolar stimulating hook electrodes |
| Kite Manual Micromanipulator | World Precision Instruments | KITE-R and KITE-L | Require a steel plate |
| Stackable Double Binding Post with Banana Jack x BNC Jack | McMaster Carr | 6704K13 | |
| Carbon fiber composites digital caliper | VWR | 36934-152 |
Referanslar
- Sanders, I., Mu, L. A three-dimensional atlas of human tongue muscles. Anat Rec (Hoboken). 296 (7), 1102-1114 (2013).
- Ciucci, M. R., et al. Tongue force and timing deficits in a rat model of Parkinson disease. Behav Brain Res. 222 (2), 315-320 (2011).
- Easterling, C., Antinoja, J., Cashin, S., Barkhaus, P. E. Changes in tongue pressure, pulmonary function, and salivary flow in patients with amyotrophic lateral sclerosis. Dysphagia. 28 (2), 217-225 (2013).
- Wang, Z. J., Huang, X. S. Images in clinical medicine. Myotonia of the tongue. N Engl J Med. 365 (15), e32 (2011).
- Ota, F., Connor, N. P., Konopacki, R. Alterations in contractile properties of tongue muscles in old rats. Ann Otol Rhinol Laryngol. 114 (10), 799-803 (2005).
- Schwarz, E. C., Thompson, J. M., Connor, N. P., Behan, M. The Effects of Aging on Hypoglossal Motoneurons in Rats. Dysphagia. 24 (1), 40 (2008).
- Pae, E. -. K., Wu, J., Nguyen, D., Monti, R., Harper, R. M. Geniohyoid muscle properties and myosin heavy chain composition are altered after short-term intermittent hypoxic exposure. J Appl Physiol. 98 (3), 889-894 (2005).
- Fuller, D. D., Fregosi, R. F. Fatiguing contractions of tongue protrudor and retractor muscles: influence of systemic hypoxia. J Appl Physiol. 88 (6), 2123-2130 (2000).
- Ray, A. D., Farkas, G. A., Pendergast, D. R. In-situ mechanical characteristics of the tongue are not altered in the obese Zucker rat. Sleep. 32 (7), 957 (2009).
- Brennick, M. J., et al. Tongue fat infiltration in obese versus lean Zucker rats. Sleep. 37 (6), 1095-1102 (2014).
- Stedman, H. H., Sweeney, H. L., Shrager, J. B., Maguire, H. C., Panettieri, R. A., Petrof, B., Narusawa, M., Leferovich, J. M., Sladky, J. T., Kelly, A. M. The mdx mouse diaphragm reproduces the degenerative changes of Duchenne muscular dystrophy. Nature. 352 (6335), 536-539 (1991).
- Goodpaster, B. H., Wolf, D. Skeletal muscle lipid accumulation in obesity, insulin resistance, and type 2 diabetes. Pediatr Diabetes. 5 (4), 219-226 (2004).
- Loro, E., et al. IL-15Rα is a determinant of muscle fuel utilization, and its loss protects against obesity. Am J Physiol Regul Integr Comp Physiol. 309 (8), R835-R844 (2015).
- Rahemi, H., Nigam, N., Wakeling, J. M. The effect of intramuscular fat on skeletal muscle mechanics: implications for the elderly and obese. J R Soc Interface. 12 (109), 20150365 (2015).
- Kim, A. M., et al. Tongue fat and its relationship to obstructive sleep apnea. Sleep. 37 (10), 1639-1648 (2014).
- Kim, A. M., et al. Metabolic activity of the tongue in obstructive sleep apnea. A novel application of FDG positron emission tomography imaging. Am J Respir Crit Care Med. 189 (11), 1416-1425 (2014).
- Gilliam, E. E., Goldberg, S. J. Contractile properties of the tongue muscles: effects of hypoglossal nerve and extracellular motoneuron stimulation in rat. J Neurophysiol. 74 (2), 547-555 (1995).
- Sokoloff, A. J. Localization and contractile properties of intrinsic longitudinal motor units of the rat tongue. J Neurophysiol. 84 (2), 827-835 (2000).
- Becker, B. J., Russell, J. A., Connor, N. P. Effects of aging on evoked retrusive tongue actions. Arch Oral Biol. 60 (6), 966-971 (2015).
- Connor, N. P., et al. Tongue muscle plasticity following hypoglossal nerve stimulation in aged rats. Muscle Nerve. 47 (2), 230-240 (2013).
- Seo, J., et al. Nerve cuff electrode using embedded magnets and its application to hypoglossal nerve stimulation. J Neural Eng. 13 (6), 066014 (2016).
- Friedman, M., et al. Targeted hypoglossal nerve stimulation for the treatment of obstructive sleep apnea: Six-month results. Laryngoscope. 126 (11), 2618-2623 (2016).
- Heiser, C., Maurer, J. T., Steffen, A. Functional outcome of tongue motions with selective hypoglossal nerve stimulation in patients with obstructive sleep apnea. Sleep Breath. 20 (2), 553-560 (2016).
- Syme, D. A. Passive viscoelastic work of isolated rat, Rattus norvegicus, diaphragm muscle. J Physiol. 424, 301-315 (1990).
- Connor, N. P., et al. Effect of tongue exercise on protrusive force and muscle fiber area in aging rats. J Speech Lang Hear Res. 52 (3), 732-744 (2009).
- Schaser, A. J., Stang, K., Connor, N. P., Behan, M. The effect of age and tongue exercise on BDNF and TrkB in the hypoglossal nucleus of rats. Behav Brain Res. 226 (1), 235-241 (2012).
- Puhan, M. A., et al. Didgeridoo playing as alternative treatment for obstructive sleep apnea syndrome: randomised controlled trial. BMJ. 332 (7536), 266-270 (2006).
- Guimarães, K. C., Drager, L. F., Genta, P. R., Marcondes, B. F., Lorenzi-Filho, G. Effects of oropharyngeal exercises on patients with moderate obstructive sleep apnea syndrome. Am J Respir Crit Care Med. 179 (10), 962-966 (2009).
- Ueda, H., Almeida, F. R., Chen, H., Lowe, A. A. Effect of 2 jaw exercises on occlusal function in patients with obstructive sleep apnea during oral appliance therapy: a randomized controlled trial. Am J Orthod Dentofacial Orthop. 135 (4), 430 (2009).
- Strollo, P. J., et al. Upper-airway stimulation for obstructive sleep apnea. N Engl J Med. 370 (2), 139-149 (2014).
- Perrier, P., Payan, Y., Zandipour, M., Perkell, J. Influences of tongue biomechanics on speech movements during the production of velar stop consonants: A modeling study. J Acoust Soc Am. 114 (3), 1582-1599 (2003).
- Connor, N. P., et al. Tongue muscle plasticity following hypoglossal nerve stimulation in aged rats. Muscle & nerve. 47 (2), 230-240 (2013).
- Brady, J. P., et al. AlphaB-crystallin in lens development and muscle integrity: a gene knockout approach. Invest Ophthalmol Vis Sci. 42 (12), 2924-2934 (2001).
- Spassov, A., et al. Differential expression of myosin heavy chain isoforms in the masticatory muscles of dystrophin-deficient mice. Eur J Orthod. , ciq113 (2010).
- Lever, T. E., et al. Videofluoroscopic Validation of a Translational Murine Model of Presbyphagia. Dysphagia. 30 (3), 328-342 (2015).
- Gantois, I., et al. Ablation of D1 dopamine receptor-expressing cells generates mice with seizures, dystonia, hyperactivity, and impaired oral behavior. Proc Natl Acad Sci. 104 (10), 4182-4187 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır