Method Article
Bağdaşık süper çözünürlük ve elektron mikroskobu Zebra balığı Retina Protein yerelleşme gidermek için
Bu Makalede
Özet
Bu iletişim kuralı süper çözünürlük ışık mikroskobu birleştiriliyor ve elektron mikroskobu görüntüleri taramak Zebra balığı retina üzerinde hücre altı protein yerelleştirme sonuçları elde etmek için gerekli adımları açıklar.
Özet
Biz süper çözünürlük ışık mikroskobu birleştiren ve elektron mikroskobu tarama larva Zebra balığı retina hücre altı protein yerelleştirme araştırmak için bir yöntem mevcut. Süper çözünürlük ışık mikroskoplar alt kırınım sınırı çözünürlük yetenekleri ilişkili verilerin doğruluğunu geliştirmek sağlar. Kısaca, 110 nanometre kalınlığında cryo-bölümler için silikon gofret aktarılmakta ve boyama ayirt sonra tarafından süper çözünürlük ışık mikroskobu görüntüsü. Daha sonra bölümleri methylcellulose ve Taramalı elektron mikroskobu (SEM) görüntülemede önce gölgeli Platin korunur. Bu iki mikroskobu modalities görüntüleri kolayca açık kaynak yazılım ile doku işaretlerini kullanarak birleştirilir. Burada biz larva Zebra balığı retina için adapte yöntemi açıklanmaktadır. Ancak, bu yöntem de doku ve organizmalar, diğer türleri için geçerlidir. Bu ilişki tarafından elde edilen tamamlayıcı bilgileri ifade membranlar ile ilişkide mitokondrial proteinlerin ve mitokondri de hücrenin diğer bölmeleri olarak cristae çözmeniz mümkün olduğunu göstermektedir.
Giriş
Hücre altı yerelleştirme proteinlerin ve hücrenin farklı bölmeleri ile ilişkilerini belirlemek için kullanabileceğiniz yöntem fonksiyonları ve olası etkileşimleri anlamak için temel araçlardır. Süper çözünürlük mikroskobu elektron mikroskobu ile birlikte bu tür bilgi1sağlar. Zemin durumu tükenmesi mikroskobu bireysel molekül dönüş (GSDIM) tarafından takip bir süper çözünürlük mikroskobu teknoloji çok çeşitli organik ve genetik olarak kodlanmış fluorophores2 ile uyumlu ve 20 kadar bir yanal çözünürlük elde nm 3. standart kırınım-sınırlı mikroskobu daha yüksek çözünürlük yöntemleriyle birleşme korelasyon4,5,6doğruluğunu artırır. Belirli bir hücre altı bölme ile protein ifadenin en iyi korelasyon elde etmek için ve belirsizlik7 aynı ultrathin bölümü kullanım için ışık ve elektron mikroskobu hacmini azaltmak için önerilir. Farklı parça yöntemler arasında Tokuyasu cryo-bölüm Protokolü dehidratasyon veya reçine katıştırma does değil istemek ve, Ayrıca, birçok epitopları antigenicity korur ve iyi doku ultrastructure8sağlar. Birkaç yöntem Bağdaşık ışık ve elektron mikroskobu (CLEM)4,5,9,10Bu bölümlerde uygulanabilirliği göstermiştir.
Zebra balığı retina görsel geliştirme ve onun son derece korunmuş yapısı ve işlevi omurgalılar arasında verilen insan hastalık mekanizmaları incelemek için değerli bir modeldir. Özellikle, retina photoreceptors görünümde bir Bazal sinaps, apico-basally uzun bir çekirdeğe ile memeli photoreceptors aynı mimarisine mitokondri daha apikal iç kesimi ve bir dış segment, kümeleme agzin oluşur diskler en apikal pozisyon11. Protein localization-e doğru çeşitli hücresel kompartmanlarda Zebra balığı arasında korunmuş ve insan, soruşturma insan hastalık ilgili proteinler12,13biyolojik fonksiyonu sağlar.
Burada larva Zebra balığı retina örnekleri mitokondriyal dış membran protein Tom20 lokalizasyonu Bağdaşık süper çözünürlük ışık ve elektron mikroskobu ile gidermek için hazırlamak için bir iletişim kuralı mevcut. Bu yöntem silikon gofret cryo-bölümleri toplama üzerinde dayanır ve kontrast tarafından topografik bilgi edinme Platin ince bir tabaka uygulamadan sonra üretilen. Aşağıdaki adımları kullanın, tekrarlanabilirlik ve deneyler tamamlanması zaman kolaylığı açısından açık teknik gelişmeler vardır. Son zamanlarda nükleer gözenekleri ve mitokondrial proteinler fare doku14' te algılamak için yöntem uygulanabilirliği göstermiştir.
Protokol
tüm deneylerin göre ARVO bildirimi için kullanım hayvan Ophthalmic ve vizyon araştırma yapıldı ve yerel makamlar tarafından kabul edildi.
1. silikon gofret ilgili Ultrathin bölümlerde hazırlık
- örnek fiksasyon
- hazırlamak %0,1 oxazolidin, 0.1 M cacodylate tampon % 4 formaldehit içeren sabitleştirici çözüm.
Not: dikkat! Oxazolidin, formaldehit ve cacodylate arabellek ile çalışırken dikkatli olun, uygun kişisel koruyucu donanımları ve duman mahallede çalışma. - Ötenazi 5 gün yukarıda açıklanan 15 (5 dpf) Zebra balığı larva tricaine (etil 3-aminobenzoate methanesulfonate, PBS (fosfat tampon tuzlu, pH 7) % 0,4 w/v) ile fertilizasyon sonrası.
- Larvalar daldırma buz üzerinde önceden soğutulmuş sabitleştirici çözümde sabitleyin. Kafayı ve gecede 4 ° c hafif sallanan ile kuluçkaya.
- Gözleri iyi forseps ve mikrodiseksiyon neşter (altında bir dürbün) % 1'özel Yataklı bir tabakta soğutulmuş sabitleştirici çözümde kullanarak göz etrafında doku çıkararak incelemek. Gözleri bir tüp ile taze önceden soğutulmuş sabitleştirici transfer.
- İki kez PBS (fosfat tampon tuzlu, pH 7,4) 5 min için oda sıcaklığında (RT) her yıkamada yıkayın.
- hazırlamak %0,1 oxazolidin, 0.1 M cacodylate tampon % 4 formaldehit içeren sabitleştirici çözüm.
- Jelatin infiltrasyon ve montaj
- 15 mL yerel gıda marka jelatin % 12 w/v PB (fosfat tampon, 0.1 M pH 7,4) 40 ısınmak ° C. PBS kaldırın ve jelatin çözüm gözleri içeren tüpler ekleyin. Tüpü yavaşça jelatin infiltratlar örnek olun ve 10-30 dakika 40 ° c ile nazik sallayarak bir termo veya bir su banyosu için kuluçkaya dokunun.
- Doldurmak 12 x 5 x 3 mm silikon veya polietilen kalıplar ile sıcak jelatin bir 40 ° C su banyosunda katıştırma düz. İki göz bir pipet kullanarak kalıp başı eklemek, düzgün bir diseksiyon iğne kullanarak bir dürbün altında hizalamadan ve jelatin, oda sıcaklığında 1 dakika soğumasını ve 20 dakika süreyle 4 ° C'de sertleşmesine izin
- Bir göz bir jilet kullanarak blok başına uyacak Binoküler jelatin bloğum yeniden trim.
- Katıştırılmış jelatin gözleri PB 2.3 M Sükroz buza aktarın. Gecede 4 ° C'de kuluçkaya.
- Exchange yeni 2.3 M Sükroz çözüm ve 4 ° C veya -20 ° C; mağaza için bu adım sonra numune kesit için hazır mısınız veya -20 ° C'de ay birkaç hafta saklanabilir.
- Neredeyse boyutu jelatin bloğuna göz cryo pimli aktarmadan önce yeniden kırpın. Sıvı azot ve soguk ultramicrotome aktarmak dondurucuda.
- Cryosectioning
- kesme 110 nm kalın profiller-120 ° c cryo-ultramicrotome bir elmas bıçak.
- İle bir kablolu döngü bir damlacık % 2 methylcellulose (suya) ve 2.3 M Sükroz çözümü (1:1) içeren bölümleri seç. Bölüm 7 x 7 mm silikon gofret aktarın. Saklamak bölümler 4 ° C'de daha fazla işleme kadar.
2. Immunolabelling
- 0 ° c üzerinde gofret yerleştirerek baş aşağı damla üzerinde dört damla 20 dk için PBS ile yıkama gofret. PBS, oda sıcaklığında 2 x 2 dk içinde yıkayın.
- 1 dk her PBS, % 0.15 glisin, kuluçkaya 3 kez. 3 x 1 dk. için yıkama/PBS ile yıkayın. Önceden 5 dakika süreyle PBG % 0.5 sığır Serum albümin BSA ve % 0,2 jelatin tip B (PBS) ile incubate
- Incubate ile tavşan anti-Tom20 (Tablo reçetesi görmek) PBG içinde (4 µg/mL), oda sıcaklığında 30 dk için.
- 6 x 1 dk/yıkama için PBG içinde yıkayın. Önceden incubate PBG ile Anti-tavşan Alexa 647 F(ab') 2 ile dik Incubate, 5 min için (bkz. Tablo reçetesi) PBG içinde (7,5 µg/mL) 30 dakika süreyle
- 6 x 1 dk/yıkama için PBG içinde yıkayın. 3 x 2 dk PBS içinde yıkayın. DAPI ile kuluçkaya (4 µg/mL) PBS için 10 içinde 2 x 2 dk içinde PBS yıkama s..
3. Süper çözünürlük mikroskopi
- Incubate gofret kısa bir süre (10 s) gliserol (% 80) 1:1 çözümünün bir damlacık yerleştirip arabellek sistem (% 10 glikoz, 0,5 mg/mL içeren 200 mM fosfat tampon atma bir oksijen içeren görüntüleme glucoseoxidase, 40 µg/mL katalaz, 15 mM beta-mercaptoethylamine hidroklorid (MEA HCL), pH 8.0).
- Arabellek (aynı derecede içinde adım 3.1) görüntüleme ve gofret (bölüm aşağı bakacak şekilde) cam alt (kalınlığı 170 ± 5 µm) Petri kabına gliserol (% 80) 1:1 karışımı taze bir damla üzerine transfer.
- Bir pipet ile her taraftan gofret altında sıvı çoğu kaldırın. Petri kabına altına gofret düzeltmek için silikon şeritler kullanın.
Not: İki bileşenli silikon-tutkal dışında (3 mm x 12 mm) silikon şeritler yapılır. - Görüntü bölümler üzerinde yüksek bir sayısal diyafram kullanarak bir ters mikroskobu (e.g. 160 X / NA 1.43; bkz: Malzemeler tablo) yağı daldırma süper çözünürlük özel amaç. Görüntüleme önce mikroskop sıcaklığı en aza indirmek/yanal ve eksenel drift azaltmak için equilibrate örnek izin.
- İlgi alanı ortalayın ve ilk widefield epifluorescence referans görüntüler elde etmek. Süper çözünürlük işlem modunu değiştirin. 15 ms için kameranın çekim hızı ayarlamak ve (EM) kazanç için en fazla 300 çarparak elektron ayarlayın.
- 642 ile aydınlatmak örnek nm sürekli dalga lazer epifluorescence modunda en yüksek lazer gücü (~2.8 kW/cm 2 ' ye karşılık gelir). En kısa zamanda tek molekül yanıp söner böylece bireysel sinyalleri üst üste, lazer güç ~0.7 kW/cm 2 ' ye ayarla düşük olasılıktır de her karede ayrılır. En az 30.000 kare kazanılması by epifluorescence modunda ham görüntü kaydetmek.
Not: Bu parametre yoğunlukları etiketleme ve farklı numuneler üzerinde bağlı olarak değişebilir. - Ham verilerden bir yeniden yapılanma olay listesi (raw görüntü her molekülünü kapayana yerelleştirmeler) oluşturmak 30 fotonlar (örnek göre ayarlanması gerekiyor) bir algılama eşiği istimal yanında tıkırtı " değerlendir " içinde ' t-serisi analiz ' altında ' araçlar '.
- Görselleştirmek süper çözünürlüklü görüntü işleme piksel boyutunu 4 uygulama Gauss uygun 16 tarafından tıklayarak nm " görüntü oluşturmak " içinde ' olay liste işleme paneli ' altında ' araçları. '
Not: süper çözümlenmiş görüntü oluşturmak için bu çalışmada kullanılan sistem entegre yazılım araçları istihdam edildi. Ancak, açıklanan süper kararlılık düşsel herhangi bir diğer tek molekül yerelleştirme dayalı sistemde gerçekleştirilebilir ve verileri açık kaynak yazılım araçları ile fırtına 17 olarak işlenen.
4. Platin gölgeleme
- kaldırın silikon çizgili ve Petri kabına kaldırın PBS gofret kenarlarına yakın bir damla ekleyin. Yazı saptamak o zaman PBS %0,1 oxazolidin ile 5 dk. 2 x 2 min için yıkama/yıkamak içinde PBS için gofret PBS, 2 x 2 dk yıkayın.
- Gofret 1 damla su buz methylcellulose %2 5 dk/kuluçka için iki kez kuluçkaya. Gofret bir santrifüj tüpü yerleştirin ve 14,100 x g de 90 s. başlatması için bu iletken karbon çimento ile SEM alüminyum saplama üzerinde santrifüj kapasitesi.
- 2-10 katman ekleyin nm Platin/karbon döner bir elektron kullanarak 8 ° gölgeleme tarafından örneği ışınla buharlaşma aygıt ayarları: 1,55 kV, 55 anne, 0,3 nm/s ve bir açı 8 ° döndürme seviye 4.
5. Elektron mikroskobu tarama
- bir tarama ile görüntü bölümleri elektron microscope 1,5 kV, 2 mm çalışma mesafe ve bir inç ile lens ikincil elektron dedektörü.
6. Işık ve elektron mikroskobu görüntüleri hizalama
tıklayarak Fiji 18 ile- Açık her iki tür " dosya | Açık ". Tıklatarak Tuval boyutunu ayarla " görüntü | Ayarlamak | Tuval boyutu " ve her iki görüntüleri tıkladığınızda bir yığına getirmek " görüntü | Yığınlar | Görüntü yığını ". Yığın TIFF dosya türü olarak kaydetmek.
- , Fiji, tıklatarak yeni bir TrackEM2 19 arabirimi açık " dosya | yeni | TrackEM2 (yeni) ". Her iki görüntü yığınıyla siyah pencere üzerinde sağ tıklayıp seçerek alma " alma yığın ".
- Hizala ışık mikroskobu görüntü görüntü üzerinde sağ klik kullanarak ve seçerek el ile yerler ile elektron mikroskobu görüntüye " Hizala | Simge yapılara el ile katmanla Hizala ".
- Çekme Seç aracını (siyah oku) simge eklemek için. Çekirdek şekli aynı kenarları iki Albümdeki (ek şekil 1) seçmek için referans olarak kullanın. Birkaç puan (en az üç puan seçilmesi gerekir) ekleyin. Afin bir model ile hizalama özelliğine tıklatıp farenin sağ tarafından uygulamak " dönüşüm uygulama | Afin modeli ".
- Değiştirmek katman saydamlığı (hizalama kalitesini değerlendirmek için bkz. ek şekil 1).
Sonuçlar
Protein Tom20, bir alt birimi olan translokaz mitokondrial dış membran karmaşık20, ifade, larva Zebra balığı retina, ince bölümlerinde süper çözünürlük ışık mikroskobu (şekil 1) tarafından tespit edildi ve bu bilgi oldu Platin aynı bölümlerini gölgeleme sonra elektron mikroskobu tarama yoluyla elde edilen topografik sinyali ile tamamlanmaktadır. Bu Bağdaşık veri belirli bir bölme, dış mitokondrial membran ile birlikte bir proteinin yerelleştirme onaylayın ve ayrıca diğer hücre organelleri ile protein ilişkisi hakkında bilgi sağlar.
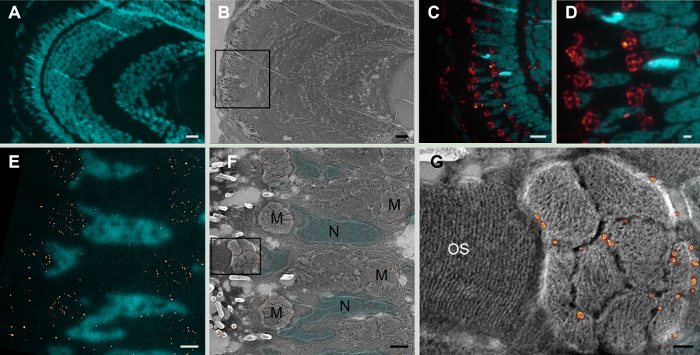
Şekil 1: Zebra balığı retina üzerinde CLEM. A. 5 dpf Zebra balığı retina bölümü, DAPI (mavi) ile lekeli çekirdekleri düşük büyütme widefield görüntüsü. B. aynı çevrenin elektron mikroskobu tarama. C. d. çekirdek çerçevede yüksek büyütme widefield görüntü DAPI (mavi) ile lekeli ve Tom20 mitokondrial boyama kırmızı renkte görünür. Aynı bölümde yüksek büyütmede ö Widefield görüntüsü. Tom20 ifade mitokondri kümeleri kalıptır. E. ifade, GSDIM mikroskobu tarafından tespit Tom20 (kırmızı nokta). Çekirdeklerin DAPI (mavi) ile lekeli. F. aynı bölüm Bağdaşık süper çözünürlük birleştirerek ve elektron mikroskobu tarama E olarak. Tom20 (kırmızı nokta) Boyama mitokondrial kümenin (M) mitokondri dış zarı görünür. Floresans DAPI sinyal çekirdeği (N) SEM görüntü topografya ile karşılık gelir. G. F. çerçevede görüntüsünü yüksek büyütme Tarama elektron mikroskobu görüntü GSDIM görüntü (kırmızı nokta) için içerik sağlar. Mitokondriyal cristae açıkça görülebilir ve Tom20 boyama mitokondri dış zarı için yerelleştirilmiştir. Dış segment zarı photoreceptors (OS) açıkça çözümlenir. Görüntü piksel boyutu 5 nm. Ölçek çubukları: A, B ve c 10 µm; D: 2 µm; E ve f 1 µm ve G: 0.2 µm. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Ek şekil 1: ışık ve elektron mikroskobu görüntülerin hizalama. A. Screenshot SEM görüntü ve numaralandırılmış yerler (sarı) boyunca farklı çekirdekleri ile TrackEM2 arayüz üzerinden. B. ekran floresan görüntü ve farklı DAPI boyunca numaralandırılmış yerler (sarı) olan TrackEM2 arabirimden lekeli çekirdeği. Katman saydamlığı değiştirmek için kaydırıcıları menünün sol üst kısmında kullanılabilir. Ölçek çubuğu: 1 µm. Bu dosyayı indirmek için buraya tıklayınız.
Tartışmalar
Bu yöntem süper çözülmüş protein yerelleştirme bir organel proteinler kesin konumunu belirlemek için bağlam bilgileri ile birleştirir. Biz burada Tom20 ifade mitokondri ve çekirdek gibi diğer organelleri ilişkisi dış membran veya larva Zebra balığı retina photoreceptor dış parçalarını görselleştirmek için deney tamamlanması göstermek.
Tokuyasu cryo-kesit iyi korunmuş bölümleri elde etmek için bazı eğitim gerektirir. Ancak, bu birçok laboratuar gösterdiği başarı21ile istihdam bir yöntemdir. Silikon gofret bölümleri transferi çok basittir ve hiçbir özel hususlar gereklidir. Gliserol görüntüleme arabellek kullanımı bölümleri kurutma önlemek için çok kritik bir adımdır. Gofret çok Petri kabına cam alt yakın olduğunda süper çözünürlük görüntüleme için en iyi sonuçları elde edilir. Silikon çizgili bu pozisyonda gofret sürdürmek yardımcı olur. Özel bakım bölümleri zarar görmesini önlemek için çizgiler kaldırılırken alınması gerekiyor.
Cryo-kesitler, 100 civarında kalınlığı nm, Z-boyut, optik çözünürlük daha ince Ayrıca süper çözünürlük mikroskobu sinyal sadece bu ince katmandan geliyor gibi Bağdaşık bu yöntem doğruluğunu kolaylaştırır ve Taramalı elektron mikroskobu sinyal ve topografya örneği görüntülüyor. Bu yöntem da çok renkli görüntüleme ile kombine. Ancak, özel örnek aynı koşullar altında (örneğin görüntüleme arabellek) görüntüsü ve çapraz konuşma engellenip özen göstermelidir.
Bir yöntem kısıtlamasıdır onun iki boyutlu yaklaşım, sınırlı sayıda seri bölümü (yaklaşık 3-7 gofret başına) toplanan bu yana. Böylece, cilt analizi ile ilgili projeler ideal olamazdık. Ancak, protein ifade doku herhangi bir tür basit örnek kesit tarafından tespit etmek için uygulanan bir yöntemdir. Biz klasik kontrast ajanlar uranyl asetat veya kurşun sitrat gibi kullanmadan bir yöntem sağlar. Çok bilgilendirici topografik kontrast kontrast Platin gölgeleme tarafından sağlar, ancak bazı durumlarda membranlar gidermek zordur. Bu, örneğin, proteinler küçük veziküller içinde ifade belirlemek gerekir projeler için sorun teşkil.
Süper çözünürlük ve Taramalı elektron mikroskoplar Bağdaşık sonuçları elde etmek için standart ekipman cryo-bölümler Tokuyasu göre bizim protokolünü kullanır. Silikon gofret bölümlerde topluluğu ve platin kullanım kontrast için istikrar ve tekrarlanabilirlik için numune hazırlama sağlamak için basit adım vardır.
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
İYON ve RGB finansman: İsviçre Ulusal Bilim Vakfı Ambizione-puan verin PZ00P3 142404/1 ve PZ00P3 163979.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Paraformaldehyde | Sigma-Aldrich | #158127 | |
| Glutaraldehyde EM Grade | EMS, USA | #16220 | |
| Cacodylate | Merck | #8.20670 | |
| Tricaine | Sigma-Aldrich | #886-86-2 | |
| Agarose, peqGOLD Universal | VWR International GmbH | 35-1020 | |
| Flat embedding molds | BEEM Flat | ||
| Local food brand gelatin | Dr.Oetker | Extra Gold | |
| Sucrose | Merck | #1.07687 | |
| Methylcellulose | Sigma | #M-6385 | |
| Glycine | Sigma | #G-7126 | |
| Gelatin type B | Sigma | #G-6650 | |
| BSA | Applichem | #A6588.0050 | |
| Silicon wafer | Si-Mat Silicon Materials | Type: P/Boron; Orientation <111> ON; Growth method: CZ; Resistivity:1-30 ohm/cm; Surface: polished; Laser cut at 7 x7 mm | |
| Cryo-pin | Baltic Preparation | #16701950 | |
| Wired loop "Perfect loop" | |||
| Silicone stripes | Picodent | Twinsil 22 | |
| Glucose | Sigma-Aldrich | #G8270 | |
| glucoseoxidase | Sigma-Aldrich | #G7141 | |
| catalase | Sigma-Aldrich | #C40 | |
| beta-Mercaptoethylamine hydrochloride | Sigma-Aldrich | #M6500 | |
| anti-Tom20 | Santa Cruz Biotechnology | #sc - 11415 | |
| AlexaFluor 647 AffiniPure F(ab')2 fragment donkey anti rabbit IgG | Jackson Immuno-Research | #711-606-152 | |
| DAPI | ROCHE, Switzerland | #10236276001 | |
| Glycerol solution | Sigma-Aldrich | #49782 | |
| Glass bottom petri dish | Ibidi, Germany | u-Dish 35mm, high glass bottom, #81158 | |
| SEM aluminium stub | Agar Scientific | #G301F | |
| Conducting carbon cement Leit-C | Plano, Germany | AG3300 | |
| Name | Company | Catalog Number | Comments |
| Instruments | |||
| Diamond Knife (Cryo Immuno) | Diatome | DCIMM3520 | |
| Cryo-ultramicrotome | Leica Microsystems | Leica EM FCS | |
| Widefield-TIRF microscope GSD Leica SR GSD 3D | Leica Microsystems | ||
| 160x 1.43 TIRF objective | Leica Microsystems | 11523048 | |
| SEM - Zeiss Supra 50 VP | Zeiss | Supra 50 VP | |
| FIB-SEM - Zeiss Auriga 40 | Zeiss | Auriga 40 |
Referanslar
- Hauser, M., Wojcik, M., Kim, D., Mahmoudi, M., Li, W., Xu, K. Correlative Super-Resolution Microscopy: New Dimensions and New Opportunities. Chem Rev. , (2017).
- Dempsey, G. T., Vaughan, J. C., Chen, K. H., Bates, M., Zhuang, X. Evaluation of fluorophores for optimal performance in localization-based super-resolution imaging. Nat Methods. 8 (12), 1027-1036 (2011).
- Fölling, J., Bossi, M., et al. Fluorescence nanoscopy by ground-state depletion and single-molecule return. Nat Methods. 5 (11), 943-945 (2008).
- Betzig, E., Patterson, G. H., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science (New York, N.Y.). 313 (5793), 1642-1645 (2006).
- Kopek, B. G., Shtengel, G., Grimm, J. B., Clayton, D. A., Hess, H. F. Correlative photoactivated localization and scanning electron microscopy. PLOS one. 8 (10), e77209 (2013).
- Paez-Segala, M. G., Sun, M. G., et al. Fixation-resistant photoactivatable fluorescent proteins for CLEM. Nat Methods. 12 (3), 215-218 (2015).
- Narayan, K., Subramaniam, S. Focused ion beams in biology. Nat Methods. 12 (11), 1021-1031 (2015).
- Tokuyasu, K. T. Immunochemistry on ultrathin frozen sections. Histochem J. 12 (4), 381-403 (1980).
- Suleiman, H., Zhang, L., et al. Nanoscale protein architecture of the kidney glomerular basement membrane. eLife. 2, e01149 (2013).
- Kopek, B. G., Shtengel, G., Xu, C. S., Clayton, D. A., Hess, H. F. Correlative 3D superresolution fluorescence and electron microscopy reveal the relationship of mitochondrial nucleoids to membranes. Proc Nat Acad Sci U S A. 109 (16), 6136-6141 (2012).
- Avanesov, A., Malicki, J. Analysis of the retina in the zebrafish model. Methods Cell Biol. 100, 153-204 (2010).
- Bachmann-Gagescu, R., Phelps, I. G., et al. The ciliopathy gene cc2d2a controls zebrafish photoreceptor outer segment development through a role in Rab8-dependent vesicle trafficking. Hum Mol Gen. 20 (20), 4041-4055 (2011).
- Bachmann-Gagescu, R., Dona, M., et al. The Ciliopathy Protein CC2D2A Associates with NINL and Functions in RAB8-MICAL3-Regulated Vesicle Trafficking. PLOS Gen. 11 (10), e1005575 (2015).
- Mateos, J. M., Guhl, B., et al. Topographic contrast of ultrathin cryo-sections for correlative super-resolution light and electron microscopy. Sci Rep. 6, 34062 (2016).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Thompson, R. E., Larson, D. R., Webb, W. W. Precise nanometer localization analysis for individual fluorescent probes. Biophys J. 82 (5), 2775-2783 (2002).
- Ovesný, M., Křížek, P., Borkovec, J., Svindrych, Z., Hagen, G. M. ThunderSTORM: a comprehensive ImageJ plug-in for PALM and STORM data analysis and super-resolution imaging. Bioinformatics. 30 (16), 2389-2390 (2014).
- Schindelin, J., Arganda-Carreras, I., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Cardona, A., Saalfeld, S., et al. TrakEM2 software for neural circuit reconstruction. PLOS one. 7 (6), e38011 (2012).
- Wurm, C. A., Neumann, D., et al. Nanoscale distribution of mitochondrial import receptor Tom20 is adjusted to cellular conditions and exhibits an inner-cellular gradient. Proc Nat Acad Sci U S A. 108 (33), 13546-13551 (2011).
- Slot, J. W., Geuze, H. J. Cryosectioning and immunolabeling. Nat Prot. 2 (10), 2480-2491 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır