Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Örnek çıkarma ve eşzamanlı Kromatografik Nefelometri doksorubisin ve ilaç kombinasyonu dağıtımında nano tanecikleri tümörü taşıyan fareler takip Mitomycin C
Bu Makalede
Özet
Bu iletişim kuralı bir verimli ve kullanışlı analitik süreci örnek ekstraksiyon ve birden fazla uyuşturucu, doksorubisin (DOX), mitomycin C (MMC) ve doxorubicinol (DOXol), biyolojik bir kardiyo-toksik DOX metaboliti eşzamanlı belirlenmesi açıklar Preklinik meme tümör modeli örnekleri nanopartikül formülasyonları sinerjik ilaç kombinasyonu ile tedavi.
Özet
Kombinasyon kemoterapi, kanser tedavisi için klinikte sık kullanılır; Ancak, ilişkili yan etkileri normal doku için onun terapötik yarar sınırlayabilir. Nanoparçacık tabanlı ilaç kombinasyonu ücretsiz uyuşturucu kombinasyon tedavisi tarafından karşılaşılan sorunların etkisini azaltmak için gösterilmiştir. Önceki çalışmalarımız var, bu iki antikanser ilaç, doksorubisin (DOX) ve mitomycin C (MMC) ile birlikte gösterilen her iki fare karşı bir sinerjik etkisi üretilen ve vitroinsan meme kanseri hücreleri. DOX ve MMC birlikte yüklenen polimer-lipid hibrid nano tanecikleri (DMPLN) tedavisine direnç ve meme tümör modelleri gelişmiş etkinlik gösterdiği danışmam çeşitli sızma ışınlama pompalar yan yol. Geleneksel çözüm biçimlerine göre DMPLN üstün böyle etkinliğinin DOX ve MMC ve artan hücre içi uyuşturucu bioavailability tümör hücreleri nanocarrier PLN tarafından etkin içinde eşitlenmiş farmakokinetik atfedilen yapıldı.
Farmakokinetik ve biyo-dağılımı değerlendirmek için DOX ve MMC özgür eriyik ve nanoparçacık formları, ters fazlı yüksek performanslı sıvı Kromatografi (HPLC) yapıldı kullanarak basit ve verimli çoklu ilaç analizi yöntemi ortak idare geliştirdi. DOX veya MMC plazmada ayrı ayrı analiz daha önce bildirilen yöntemler aksine, bu yeni HPLC yöntem aynı anda DOX, MMC ve bir büyük kardiyo-toksik DOX metaboliti, doxorubicinol (DOXol), çeşitli biyolojik matrisler ( içinde quantitate yapabiliyor Örneğin, tam kan, meme tümör ve kalp). Bir çift floresan ve ultraviyole emici sondayı 4-methylumbelliferone (4-MU) farklı algılama dalga boyu ile birden fazla ilaç analizi tespiti tek adımlı bir iç standart (I.S.) olarak kullanılmıştır. Bu yöntem DOX ve tam kan nanopartikül ve çözüm yaklaşımları ve orthotopic meme tümör fare modelinde çeşitli dokular tarafından teslim MMC konsantrasyonları belirlemek için başarıyla uygulandı. Analitik yöntemi sunulan nanoparçacık tabanlı teslimat uyuşturucu kombinasyonları önceden klinik analiz için yararlı bir araçtır.
Giriş
Henüz kez şiddetli yan etkiler ve ilaç direnci nedeniyle sınırlı etkinliği ve diğer etkenler1,2,3ile ilişkili kemoterapi birçok kanser için birincil tedavi yöntemi var. Kemoterapi sonucu geliştirmek için ilaç kombinasyonu rejimlerinin konuları üst üste toksisite, uyuşturucu eylem ve çapraz ilaç direnci4,5 farklı mekanizmalar gibi temel kliniğinde uygulanan , 6. klinik çalışmalarda, daha iyi bir tümör yanıt oranı genellikle aynı anda kullanarak yönetilen ardışık ilaç teslim7,8bir rejimi için karşılaştırıldığında uyuşturucu kombinasyonları gözlendi. Ancak, alt-optimal biyo-dağıtım nedeniyle ücretsiz ilaç formları, birden çok ilaçların eşzamanlı enjeksiyon tedavi etkisi9,10,11daha ağır basar önemli normal doku toksisite neden olabilir. Nanocarrier tabanlı ilaç dağıtım alter farmakokinetik ve biyo-dağıtım tümör hedefli birikimi12,13,14artırılması kapsüllenmiş ilaçların olduğu gösterilmiştir. Bizim son makalelerinde gözden olarak sinerjik uyuşturucu kombinasyonları ile birlikte yüklenen nano tanecikleri ücretsiz uyuşturucu kombinasyonları, kontrollü kendi zamansal ve mekansal co teslimini nedeniyle karşılaştığı sorunları azaltmak için yetenek göstermiştir birden fazla uyuşturucu tümör doku sinerjik uyuşturucu etkileri kansere karşı etkinleştirme4,15,16hücreleri. Sonuç olarak, üstün terapötik etkinlik ve düşük toksisite her iki önceden klinik ve klinik çalışmalar4,17,18içinde gösterilmiştir.
Bizim önceki vitro çalışmalarda iki antikanser ilaç, doksorubisin (DOX) ve mitomycin C (MMC), kombinasyonu sinerjik etkisi birkaç meme kanseri hücreleri hattı karşı üretilen bulundu ve ayrıca, yükleme DOX ve MMC içinde co Polimer-lipid hibrid nano tanecikleri (DMPLN) çeşitli çok ilaca dirençli ilişkili sızma Pompalar (Örneğin, P-glikoprotein ve meme kanseri dayanıklı protein)19,20,21üstesinden geldi. Vivo, DMPLN DOX ve MMC tümör sitelere uzamsal-Zamansal eş teslimi ve ilaçların kanser hücreleri içinde artan bioavailability DOX metaboliti doxorubicinol (DOXol)22oluşumu ılımlılık tarafından belirtildiği şekilde etkin. Sonuç olarak, DMPLN gelişmiş tümör hücre apoptosis, tümör büyüme inhibisyonu ve DOX ve MMC kombinasyonu veya bir liposomal DOX formülasyonu22,23,24ücretsiz göre uzun süreli ana bilgisayar hayatta kalma, 25.
Ortak bir nanocarrier tarafından teslim uyuşturucu gerçek miktarı analiz etkili nanopartikül formülasyonları tasarlamak için önemlidir. Pek çok yöntem plazma düzeyini yüksek performanslı sıvı Kromatografi (HPLC) yalnız kullanarak tek DOX veya MMC doz veya kütle spektrometresi (MS)26,27,28 ile birlikte analiz etmek için geliştirilmiştir , 29 , 30 , 31 , 32 , 33 , 34. biyolojik örnekler çok sayıda ayrı ayrı birden çok uyuşturucu (bazen uyuşturucu metabolitleri dahil) analizi için hazırlıklı olması gerekiyor gibi Ancak, bu yöntemler genellikle zaman alıcı ve kombinasyon tedavisi için pratik vardır. Güçlü plazma protein bağlayıcı DOX ve MMC ek olarak kırmızı kan hücreleri da bağlamak ve pek çok antikanser ilaçlar35,36konsantre büyük bir kapasiteye sahip. Böylece, plazma analiz DOX veya MMC için gerçek kan ilaç konsantrasyonları karartmak. Mevcut çalışma (şekil 1) basit ve sağlam aynı anda ayıklamak ve DOX, MMC ve tam kan ve çeşitli dokular ( DOX metaboliti doxorubicinol (DOXol) quantitate ters faz HPLC kullanarak birden fazla uyuşturucu analiz yöntemi açıklar Örneğin, tümörler). Farmakokinetik ve biyo-DOX ve MMC dağıtımını yanı sıra DOXol oluşumu ilaç dağıtım yolu ile ücretsiz çözümler ya da nanopartikül formları (örneğin, DMPLN ve liposomal DOX) sonra bir orthotopically belirlemek için başarıyla uygulandı fare meme tümör fare modeli Intravenous (IV) sonra implante enjeksiyon22.
Protokol
tüm hayvan deneyleri hayvan bakım komitesi, üniversite sağlık ağı Ontario Kanser Enstitüsü tarafından onaylanmış ve hayvan bakım kuralları Kanada Konseyi uyarınca yürütülen.
1. biyolojik örnek hazırlık
- tam kan, büyük organları toplamak ve önceden belirlenmiş zaman-Puan Intravenous (IV) yönetim uyuşturucu içeren sonra meme tümör (örneğin, formülasyonları DMPLN, liposomal DOX)
- meme tümörü taşıyan fare damardan uyuşturucu içeren hazır formülasyonu ile enjekte.
- İnhalable % 2 isoflurane mühürlü bir odasında vererek belirlenen zaman-noktalarda (örneğin, 15dk) fare anestezi.
- Sırtında imzalat fare yatıyordu ve burnunu sürekli % 2 isoflurane sağlayan bir yangın gövdeler koymak.
Not: fare uğrar derin anestezi emin olmak için yavaşça çimdik fare ve tat herhangi bir hareket için bir görünüm ön bacaklarda. - % 70 etanol kullanarak göğüs ve karın bölgeleri iyice temizleyin ve sonra heparinized 1 mL şırınga ve 23 G iğne kullanarak derin imzalat fareler üzerinde kalp ponksiyon terminal bir yordamı gerçekleştirin.
- Toplamak tam kan içine etiketli bir sodyum heparin plastik tüp püskürtülür ve yavaşça toplanan tam kan ile temas tüpü duvardaki heparin kaplı gelir sağlamak için tüp girdap. En az 50 µL bütün kan toplamak. Her zaman buz üzerinde örnekleri devam
- Güvenli ve açık belgili tanımlık karın ve göğüs kafesi bir çift makas ve forseps kullanarak fare fare tüm dört bacaklarda teyp. Bağırsak tarafına kayması ve yukarı doğru yeterince portal ven ortaya çıkarmak için karaciğer itin. Kan drenaj için portal ven kesti.
- Sıvı buz gibi % 0,9 serum 25 G iğne ile 10 mL şırınga kullanarak kalbine tüm fare gövdesi ile 50 mL.
Not: iğne şırınga portal ven rehberlik için 90 ° dirsek. - Tüketim organlarda birini sipariş: kalp, akciğer, karaciğer, dalak, böbrekler. O zaman, meme tümör çevresindeki bağ dokusu fareyi sağ meme yağ yastığı kesi makas kullanarak ayırmak. Tüm organlarının ayrı ayrı 1,5 mL polipropilen tüpler içine toplamak ve hızlı bir şekilde onları sıvı azot içinde dondurma.
Not: safra kesesi Karaciğer ayırın. - 4 ° C ve çıkarılan doku tam kan-80 ° C dondurucuya kadar daha sonra HPLC analiz depolamak.
- Ayıklamak DOX, MMC ve biyolojik matrisler DOXol.
- Tüm donmuş disseke dokularda hızla tartmak ve 13 mL yuvarlak alt konik tüp içine aktarabilirsiniz. Uyuşturucu metabolizma veya yıkımı önlemek için örnekleri üzerinde buz tutmak
- Ekleyin buz gibi hücre lizis arabellek 1-5 mL tüp içine.
Not: 1 g: 5 mL (w/v); doku-tampon oranına dayanarak doku ağırlık kullanmak için arabellek hacmi bağlıdır kalp ve dalak, gibi küçük organları için 1 g: oranıdır 2 mL. - Doku örnekleri, bir elektrikli el homogenizer kullanarak 18.000 rpm hızında buzda homojenize için bir yukarı-aşağı inme hareket kullanın.
Not: Tamamlanan homojenizasyon kısa homojenizasyon işlemi daha az 15 yaklaşık 3-5 yinelemelerini gerektirir s, her kısa homojenizasyon arasında buz üzerinde soğutma doku ardından. - Homogenizer distile deiyonize (DDI) H 2 O, % 70 etanol ve DDI H 2 O çapraz bulaşma kaçınmak için her doku örneği arasında 10 mm testere dişli jeneratör probe yıkayın. Bir iç standart (I.S.) 4-methylumbelliferone (4-MU) (2000 ng/mL) tüp içine
- transfer 50 µL doku homogenate veya tam kan bir 1,5 mL polipropilen mikro-santrifüj tüpü ve 5 Spike'la µL.
Not: 4-MU çözüm burada metanol hazırlanmıştır. - Bir buz gibi ayıklama çözücü tam kan veya doku homogenate içeren tüp içine eklemek 250 µL.
Not: pH için ayarlanır pH ile % 60 Asetonitril (ACN) ve % 40 amonyum asetat (5 mM) çıkarma solvent oluşur 3.5 = %0,05 formik asit kullanarak. 1:5 (v/v) örneği kullanmak: hacim oranı için solvent ekstraksiyon. - Şiddetle girdap karışımı için 2 dk, 3000 x 4 o C, g kuvvet, santrifüj 10 dk ve damlalıklı 200 µL başka bir önceden soğutulmuş taze mikro-santrifüj tüpüne süpernatant.
- Buharlaştırılarak süpernatant azot gazı ışık koruma ile yavaş bir akarsuyun altında 60 ° C'de.
- Buz gibi metanol, 30 s ve 3000 x g başka bir 5 dakika süreyle 4 ° C'de, santrifüj için şiddetle girdap 100 µL ile kurumuş kalıntı sulandırmak
- Örnek şişeleri enjeksiyon için bir Otomatik Örnekleyici tepsisine yerleştirin ve süpernatant HPLC şişe sokmak içine transfer.
2. HPLC araçları ve işlem parametrelerini
- HPLC hazırlamak cep fazlı tutarlı tekrarlanabilirlik ile
- 500 mL HPLC sınıf H 2 O mezun silindir kullanarak ölçmek.
- Ölçmek ayrı bir mezun silindir kullanarak HPLC sınıf Asetonitril (ACN) 500 mL.
- Dikkatle her 500 mL H 2 O içine trifluoroacetic asit (TFA) (dikkat) 0.5 mL ekleyin ve ACN H 2 O mobil faz elde etmek için ve % 0.1 içeren ACN TFA, sırasıyla.
Not: TFA aşındırıcı ve toksik ve laboratuvar duman başlık altında ele alınmalıdır. Tüm çözücü karışımları oda sıcaklığında hazır mısınız. - Naylon membran filtre 0,45 µm ile mobil aşamalardan filtre boyutu gözenek ve temiz HPLC rezervuar şişe transfer.
- Kurulum HPLC araçları aynı anda DOX, MMC ve DOXol ve I.S. 4-MU algılanması için.
- Degrade pompa, de-gasser, Otomatik Örnekleyici, fotodiyot dizi dedektörü ile multi λ Floresans Dedektör üzerinde geçiş.
- Mobil faz kompozisyon %16,5 H 2 O başlangıç koşullarını giriş (% 0,1 TFA) ve %83.5 ACN (% 0,1 TFA) (v/v).
- 310 adlı iki kanaldaki UV dedektörü ayarla nm 4-MU (I.S.) için ve diğer 360 nm MMC için.
- λ ex adlı iki kanaldaki Floresans dedektörü ayarla / λ em 365/445 = nm 4-MU ve diğer λ ex at için / λ em 480 nm/560 nm DOX ve DOXol, sırasıyla =.
- 1.0 mL/dak bir isocratic akış hızı ayarla
- Temel kuruluş için 10 dakika oda sıcaklığında bir önceden yüklenmiş ters faz C 18 sütun (4.6 mm x 250 mm, 5 µm) equilibrate.
- Ayrı uyuşturucu (DOX, MMC, DOXol ve 4-MU) degrade cep fazlı koşulu kullanarak.
- Enjekte 15 µL otomatik örnekleyici kullanarak örnekleri ayıklanan ve yeniden konsantre.
- Yavaş yavaş ilk mobil faz durumu değiştirmek (2.2.2 Protokolü adıma bakın) %100 ACN (% 0,1 TFA) üzerinde 18 dk otomatik degrade pompa kullanarak.
Not: ayırma işlemi sırasında dört kanal (iki UV emici ve iki floresan) aynı anda bir uyuşturucu bileşik görüntüleme her kanal ile görünür (iletişim kuralı adıma 2.2.3 ve 2.2.4 başvurun). - Korumak %100 ACN (% 0,1 TFA) 1 dk ve 1 dk. içinde ilk mobil faz durumuna sonra dönüş için
- İlk mobil aşamasında Debi 1.5 mL/dk 4 dk için sonraki örnek enjeksiyon için sütunu yeniden durum.
3. HPLC doğrulama
- DOX, MMC ve DOXol ve 4-MU (I.S.) çalışma standartları hazırlayın.
- DOX ve MMC ilaç tozu (dikkat) ve 4-MU bir taze küçük kağıt (3 x 3 inç 2) ağırlığında tartmak ayrı ayrı 1 mg.
Not tüm antikanser ilaçların akut toksisite ve germ hücreli mutagenisitesinin solunum veya sindirim neden olabilir bir sağlık tehlikesi olarak kabul edilir. Eldiven ve maske ile dikkatli bir şekilde işleneceğini. - Ağırlığını DOX, MMC ve 4-MU bir yeni bireysel 1,5 mL polipropilen mikro-santrifüj tüpüne transfer.
- Meth 1 mL ekleyinanol ve kısaca DOX ve MMC 1 mg/mL konsantrasyonu elde etmek için girdap.
- DOXol (dikkat) ve girdap kısaca DOXol konsantrasyonu 1 mg/mL edinmek için önceden ağırlığını 1 mg içeren bir flakon 1 mL metanol ekleyin.
Not: DOXol bir kardiyo-toksik metaboliti ve dikkatle ele alınmalıdır. - Pipet 20 µL DOX, MMC, DOXol ve 4-MU içine yeni bir hazır hisse senedi çözümleri ayrı 1,5 mL polipropilen mikro-santrifüj tüpü ve metanol her uyuşturucu 20 µg/mL bir çalışma standartları elde etmek için 980 µL ekleyin.
- Seyreltik 20 µg/mL DOX, MMC ve metanol 50 çalışma standartları elde etmek için kullanarak DOXol ng - 20 µg /mL DOX, MMC ve DOXol ve 2000 ng/mL I.S. 4-MU için.
- Çalışma çözümleri metanol buharlaşma önlemek için tüm tüp doğrudan güneş ışığı ve -20 mağazada maruz önlemek için alüminyum folyo ile sarın parafin film kaplama dar bir parçası ile tüpün kapağı mühürle ° C.
- DOX ve MMC ilaç tozu (dikkat) ve 4-MU bir taze küçük kağıt (3 x 3 inç 2) ağırlığında tartmak ayrı ayrı 1 mg.
- Doğrusallık, hassasiyet ve doğruluk DOX, MMC ve biyolojik matrisler (Yani, tam kan ve tümör homogenate) DOXol belirlemek.
- Aynı anda spike 5 µL çalışma standartları DOX ve DOXol (50 ng/mL - 20 µg/mL), MMC (1000 ng/mL - 16 µg/mL) ve 4-MU (2 µg/mL) içine boş tam kan veya doku homogenate polipropilen mikro-santrifüj tüpler için 50 µL 5-2000 ng/mL ilaç bileşikler için ve 4-MU (I.S.) için 200 ng/mL arasında değişen standart toplama eğrisi elde edilir.
- Protokolü 1.2 ile açıklanan uyuşturucu ayıklama tahlil gerçekleştirmek.
- DOX ve DOXol düşük, medyan ve yüksek konsantrasyonları kullanın (50, 500 ve 2.000 ng/mL) ve MMC (100, 1000, 2000 ng/mL) içi ve arası gün hassasiyet ve doğruluk için.
Not: analiz gününde taze standart konsantrasyonları hazırlayın.
- Analiz örnekleri
- enjekte 15 µL otomatik örnekleyici kullanarak örnek.
- Yavaş yavaş mobil faz üzerinden 0-18 min, artan ACN bileşimi aralığında değişir.
- Sonra 18 dk, mobil faz koşul 1 dk. tutun
- 2 dk içinde ilk durumuna dönün ve sonra sonraki enjeksiyon önce 4 dk için yeniden equilibrate.
- Uyuşturucu bileşiklerin onların tutma zamanı ile doruklarına takip gösterilir koşmak her örnek sonra Not: MMC, DOXol, 4-MU (I.S.) ve DOX.
- Eğri (AUC) HPLC yazılımını kullanarak uyuşturucu bileşiklerin altındaki tepe alanını ile tümleştirmeniz.
- I.S. (Denklem 1) arasındaki bireysel uyuşturucu bileşik AUC oranı hesaplamak ve aynı ayıklama prosedürleri altında hazırlanan standart eğrileri DMPLN formülasyonu DOX, MMC ve DOXol ilaç konsantrasyonlarda belirlemek için kullanın.
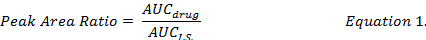
- o çivili biyolojik örnekler özleri gelen metanol kullanarak yeniden ilaç konsantrasyonları karşılaştırarak uyuşturucu kurtarma yüzdesi (Denklem 2) hesaplamak Standart (" düzgün ") uyuşturucu metanol çözümde.
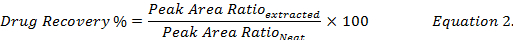
Sonuçlar
İki antikanser ilaç, DOX ve MMC yanı sıra DOX metaboliti, DOXol, aynı anda aynı uygulanan degrade HPLC koşul I.S. floresan ve UV dedektörleri için 4-MU kullanarak altında biyolojik herhangi bir müdahale olmadan tespit edildi. DOX, MMC, DOXol ve 4-MU birbirinden MMC için 5,7 min, 10.4 min DOXol için 4-MU için 10.9 min ve 11.1 min DOX (Şekil 2) için saklama kez ile iyi ayrılmış. Tam kan her ilaç ve çeşitli dokuların konsantrasyon doğrusa...
Tartışmalar
Bir tek ilaç tür algılama bir anda diğer Kromatografik yöntemleri ile karşılaştırıldığında, mevcut HPLC protokolü aynı anda aynı biyolojik matris değiştirmeye gerek kalmadan üç uyuşturucu bileşikler (DOX, MMC ve DOXol) quantitate yapabiliyor mobil faz. Bu hazırlama ve analiz yöntemi başarıyla uygulandı farmakokinetik ve biyo-iki uyuşturucu nanoparçacık tabanlı dağıtım sistemlerinin dağıtımını belirlemek için (Yani, liposomal DOX ve DMPLN)22. Peg...
Açıklamalar
Yazarlar hiçbir rakip mali çıkarlarının ve çıkar çatışması var.
Teşekkürler
Yazarlar, minnetle Doğa Bilimleri ve mühendislik araştırma (NSERC) Kanada Konseyi ekipman hibe HPLC, Kanada Enstitüsü Sağlık Araştırma (CIHR) ve Kanada meme kanseri araştırma (CBCR) çalışma hibe için kabul İttifak X.Y Wu ve Toronto Üniversitesi Burs R.X. Zhang ve T. Zhang.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Doxorubicin | Polymed Theraeutics | 111023 | Anticancer drug |
| Mitomycin C | Polymed Theraeutics | 060814 | Anticancer drug |
| Doxorubicinol (DOXol) | Toronto Research Chemicals | D558020 | Metabolite of DOX |
| 4-Methylumbelliferone sodium salt | Sigma-Aldrich | M1508 | Internal standard |
| Myristic Acid | Sigma-Aldrich | 544-63-8 | Materials for poly-lipid hybrid nanoparticles |
| Polyoxyethylene (100) Stearate | Spectrum | M1402 | Materials for poly-lipid hybrid nanoparticles |
| Polyoxyethylene (40) Stearate | Sigma-Aldrich | P3440 | Materials for poly-lipid hybrid nanoparticles |
| Pluronic F68 (PF68) | BASF Corp. | 9003-11-6 | Materials for poly-lipid hybrid nanoparticles |
| Ultrasonication (UP100H) | Hielscher, Ultrasound Technology | NA | Nanoparticle preparation |
| Water Bath (ISOTEMP 3016HS) | Fisher Scientific | NA | Nanoparticle preparation |
| Liposomal Doxorubicin (Caelyx) | Janssen | Purchased from the pharmacy Princess Margaret Hospital | Clinically-approved nanoparticle formulation |
| HPLC-graded Methanol | Caledon Chemicals | 6701-7-40 | HPLC mobile phase composition |
| HPLC-graded H2O | Caledon Chemicals | 8801-7-40 | HPLC mobile phase composition |
| HPLC-graded Acetonitrile | Caledon Chemicals | 1401-7-40 | HPLC mobile phase composition |
| Trifluoroacetic Acid | Sigma-Aldrich | 302031 | HPLC mobile phase composition |
| 0.45 μm Nylon Membrane Filter Paper | Whatman | WHA7404004 | HPLC mobile phase preparation |
| 1cc Plastic Syringes | Becton, Dickinson and Company | 2606-309659 | Treatment injection |
| 5cc Plastic Syringes | Becton, Dickinson and Company | 2608-309646 | Tissue collections |
| 30G 1/2 Needles | Becton, Dickinson and Company | 305106 | Treatment injection |
| 25G 5/8 Needles | Becton, Dickinson and Company | 305122 | Tissue collections |
| Sterile 0.9% Saline | Univeristy of Toronto House Brand | 1011 | Tissue perfusion |
| 13 ml Rounded-bottom conical tube | SARSTEDT | 62.515.006 | Prolyprolene, tissue homogenization |
| Alpha Minimum Essential Medium (MEM) | Gibco | 12571063 | Cell medium |
| 1 x Phosphate Buffer Saline | Gibco | 10010023 | Tissue homogenization |
| Triton X-100 | Sigma-Aldrich | X100-100 ML | Tissue homogenization |
| Formic acid | Caledon Chemicals | 1/5/3840 | Adjust pH for extraction solvent |
| Sodium heparin sprayed plastic tubes | Becton, Dickinson and Company | 367878 | Blood collection |
| Analytical Weigh Balance | Sartorius | CPA225D | NA |
| pH meters | Fisher Scientific | 13-637-671 | accumet BASIC |
| Vortex Mixter | Fisher Scientific | 02-215-365 | Vortexing samples at desired speed |
| 1.5 ml Microcentrifuge Tube | Fisherbrand | 2043-05408129 | Prolyprolene |
| Model 1000 homogenizer | Fisher Scientific | 08-451-672 | Tissue homogenization |
| Centrifuge 5702R | Eppendorf | 5702R | Extraction preparation |
| Heated Evaporator System | Glas-Col | NA | Sample reconstitution |
| HPLC Screw Thread Vials | DIKMA | 5320 | HPLC sample injection |
| HPLC Screw Caps with PTFE White Silicone Septa | DIKMA | 5325 | HPLC sample injection |
| HPLC Polypropylene Insert | Agilent Technologies | 5182-0549 | Maximum volume 250 μl, HPLC sample injection |
| Xbridge C18 Column | Waters Corporation | 186003117 | Drug analysis |
| Gradient pump | Waters Corporation | W600 | Drug analysis |
| Auto-sampler | Waters Corporation | W2707 | Drug analysis |
| Photodiode array detector | Waters Corporation | W2998 | Drug analysis |
| Multi λ fluoresence detector | Waters Corporation | W2475 | Drug analysis |
| EMPOWER 2 | Waters Corporation | NA | Data analysis software |
| Scientist | Micromath | NA | Pharmacokinetic analysis |
| Female Balb/c Mice | Jackson Laboratory | 001026 | In vivo |
| EMT6/WT Breast Cancer Cells | Provided by Dr. Ian Tannock; Ontario Cancer Institute | NA | In vivo |
Referanslar
- Holohan, C., Van Schaeybroeck, S., Longley, D. B., Johnston, P. G. Cancer Drug Resistance: An Evolving Paradigm. Nat. Rev. Cancer. 13 (10), 714-726 (2013).
- Szakacs, G., Paterson, J. K., Ludwig, J. A., Booth-Genthe, C., Gottesman, M. M. Targeting Multidrug Resistance in Cancer. Nat Rev Drug Discov. 5 (3), 219-234 (2006).
- Kong, A. -. N. T., Kong, A. .. N. .. T. .. ,. . Inflammation, Oxidative Stress, and Cancer: Dietary Approaches for Cancer Prevention. , (2013).
- Zhang, R. X., Wong, H. L., Xue, H. Y., Eoh, J. Y., Wu, X. Y. Nanomedicine of Synergistic Drug Combinations for Cancer Therapy - Strategies and Perspectives. J Control Release. 240, 489-503 (2016).
- Webster, R. M. Combination Therapies in Oncology. Nat. Rev. Drug. Discov. 15 (2), 81-82 (2016).
- Waterhouse, D. N., Gelmon, K. A., Klasa, R., Chi, K., Huntsman, D., Ramsay, E., Wasan, E., Edwards, L., Tucker, C., Zastre, J., Wang, Y. Z., Yapp, D., Dragowska, W., Dunn, S., Dedhar, S., Bally, M. B. Development and Assessment of Conventional and Targeted Drug Combinations for Use in the Treatment of Aggressive Breast Cancers. Curr Cancer Drug Targets. 6 (6), 455-489 (2006).
- Cancello, G., Bagnardi, V., Sangalli, C., Montagna, E., Dellapasqua, S., Sporchia, A., Iorfida, M., Viale, G., Barberis, M., Veronesi, P., Luini, A., Intra, M., Goldhirsch, A., Colleoni, M. Phase Ii Study with Epirubicin, Cisplatin, and Infusional Fluorouracil Followed by Weekly Paclitaxel with Metronomic Cyclophosphamide as a Preoperative Treatment of Triple-Negative Breast Cancer. Clin Breast Cancer. 15 (4), 259-265 (2015).
- Masuda, N., Higaki, K., Takano, T., Matsunami, N., Morimoto, T., Ohtani, S., Mizutani, M., Miyamoto, T., Kuroi, K., Ohno, S., Morita, S., Toi, M. A Phase Ii Study of Metronomic Paclitaxel/Cyclophosphamide/Capecitabine Followed by 5-Fluorouracil/Epirubicin/Cyclophosphamide as Preoperative Chemotherapy for Triple-Negative or Low Hormone Receptor Expressing/Her2-Negative Primary Breast Cancer. Cancer Chemother Pharmacol. 74 (2), 229-238 (2014).
- Carrick, S., Parker, S., Thornton, C. E., Ghersi, D., Simes, J., Wilcken, N. Single Agent Versus Combination Chemotherapy for Metastatic Breast Cancer. Cochrane Database Syst Rev. 15 (2), 003372 (2009).
- Cardoso, F., Bedard, P. L., Winer, E. P., Pagani, O., Senkus-Konefka, E., Fallowfield, L. J., Kyriakides, S., Costa, A., Cufer, T., Albain, K. S., Force, E. -. M. T. International Guidelines for Management of Metastatic Breast Cancer: Combination Vs Sequential Single-Agent Chemotherapy. J Natl Cancer Inst. 101 (17), 1174-1181 (2009).
- Alba, E., Martin, M., Ramos, M., Adrover, E., Balil, A., Jara, C., Barnadas, A., Fernandez-Aramburo, A., Sanchez-Rovira, P., Amenedo, M., Casado, A. Multicenter Randomized Trial Comparing Sequential with Concomitant Administration of Doxorubicin and Docetaxel as First-Line Treatment of Metastatic Breast Cancer: A Spanish Breast Cancer Research Group (Geicam-9903) Phase Iii. J Clinn Oncol. 22 (13), 2587-2593 (2004).
- Sadat, S. M., Saeidnia, S., Nazarali, A. J., Haddadi, A. Nano-Pharmaceutical Formulations for Targeted Drug Delivery against Her2 in Breast Cancer. Curr. Cancer Drug Targets. 15 (1), 71-86 (2015).
- Devadasu, V. R., Wadsworth, R. M., Ravi Kumar, M. N. V. Tissue Localization of Nanoparticles Is Altered Due to Hypoxia Resulting in Poor Efficacy of Curcumin Nanoparticles in Pulmonary Hypertension. Eur. J. Pharm. Biopharm. 80 (3), 578-584 (2012).
- Li, S. D., Huang, L. Pharmacokinetics and Biodistribution of Nanoparticles. Mol. Pharm. 5 (4), 496-504 (2008).
- Zhang, R. X., Ahmed, T., Li, L. Y., Li, J., Abbasi, A. Z., Wu, X. Y. Design of Nanocarriers for Nanoscale Drug Delivery to Enhance Cancer Treatment Using Hybrid Polymer and Lipid Building Blocks. Nanoscale. 9 (4), 1334-1355 (2017).
- Wang, X., Li, S., Shi, Y., Chuan, X., Li, J., Zhong, T., Zhang, H., Dai, W., He, B., Zhang, Q. The Development of Site-Specific Drug Delivery Nanocarriers Based on Receptor Mediation. J. Control. Release. 193, 139-153 (2014).
- Batist, G., Gelmon, K. A., Chi, K. N., Miller, W. H., Chia, S. K., Mayer, L. D., Swenson, C. E., Janoff, A. S., Louie, A. C. Safety, Pharmacokinetics, and Efficacy of Cpx-1 Liposome Injection in Patients with Advanced Solid Tumors. Clin Cancer Res. 15 (2), 692-700 (2009).
- Mayer, L. D., Harasym, T. O., Tardi, P. G., Harasym, N. L., Shew, C. R., Johnstone, S. A., Ramsay, E. C., Bally, M. B., Janoff, A. S. Ratiometric Dosing of Anticancer Drug Combinations: Controlling Drug Ratios after Systemic Administration Regulates Therapeutic Activity in Tumor-Bearing Mice. Mol. Cancer Ther. 5 (7), 1854-1863 (2006).
- Prasad, P., Cheng, J., Shuhendler, A., Rauth, A. M., Wu, X. Y. A Novel Nanoparticle Formulation Overcomes Multiple Types of Membrane Efflux Pumps in Human Breast Cancer Cells. Drug Deliv Transl Res. 2 (2), 95-105 (2012).
- Shuhendler, A. J., Cheung, R. Y., Manias, J., Connor, A., Rauth, A. M., Wu, X. Y. A Novel Doxorubicin-Mitomycin C Co-Encapsulated Nanoparticle Formulation Exhibits Anti-Cancer Synergy in Multidrug Resistant Human Breast Cancer Cells. Breast Cancer Res Treat. 119 (2), 255-269 (2010).
- Shuhendler, A. J., O'Brien, P. J., Rauth, A. M., Wu, X. Y. On the Synergistic Effect of Doxorubicin and Mitomycin C against Breast Cancer Cells. Drug Metabol. Drug Interact. 22 (4), 201-233 (2007).
- Zhang, R. X., Cai, P., Zhang, T., Chen, K., Li, J., Cheng, J., Pang, K. S., Adissu, H. A., Rauth, A. M., Wu, X. Y. Polymer-Lipid Hybrid Nanoparticles Synchronize Pharmacokinetics of Co-Encapsulated Doxorubicin-Mitomycin C and Enable Their Spatiotemporal Co-Delivery and Local Bioavailability in Breast Tumor. Nanomedicine. 12 (5), 1279-1290 (2016).
- Zhang, T., Prasad, P., Cai, P., He, C., Shan, D., Rauth, A. M., Wu, X. Y. Dual-Targeted Hybrid Nanoparticles of Synergistic Drugs for Treating Lung Metastases of Triple Negative Breast Cancer in Mice. Acta Pharmacol Sin. , 1-13 (2017).
- Shuhendler, A. J., Prasad, P., Zhang, R. X., Amini, M. A., Sun, M., Liu, P. P., Bristow, R. G., Rauth, A. M., Wu, X. Y. Synergistic Nanoparticulate Drug Combination Overcomes Multidrug Resistance, Increases Efficacy, and Reduces Cardiotoxicity in a Nonimmunocompromised Breast Tumor Model. Mol Pharm. 11 (8), 2659-2674 (2014).
- Prasad, P., Shuhendler, A., Cai, P., Rauth, A. M., Wu, X. Y. Doxorubicin and Mitomycin C Co-Loaded Polymer-Lipid Hybrid Nanoparticles Inhibit Growth of Sensitive and Multidrug Resistant Human Mammary Tumor Xenografts. Cancer Lett. 334 (2), 263-273 (2013).
- Rafiei, P., Michel, D., Haddadi, A. Application of a Rapid Esi-Ms/Ms Method for Quantitative Analysis of Docetaxel in Polymeric Matrices of Plga and Plga-Peg Nanoparticles through Direct Injection to Mass Spectrometer. Am. J. Anal. Chem. 6 (2), 164-175 (2015).
- Daeihamed, M., Haeri, A., Dadashzadeh, S. A Simple and Sensitive Hplc Method for Fluorescence Quantitation of Doxorubicin in Micro-Volume Plasma: Applications to Pharmacokinetic Studies in Rats. Iran. J. Pharm. Res. 14, 33-42 (2015).
- Alhareth, K., Vauthier, C., Gueutin, C., Ponchel, G., Moussa, F. Hplc Quantification of Doxorubicin in Plasma and Tissues of Rats Treated with Doxorubicin Loaded Poly(Alkylcyanoacrylate) Nanoparticles. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 887-888, 128-132 (2012).
- Al-Abd, A. M., Kim, N. H., Song, S. C., Lee, S. J., Kuh, H. J. A Simple Hplc Method for Doxorubicin in Plasma and Tissues of Nude Mice. Arch Pharm Res. 32 (4), 605-611 (2009).
- Loadman, P. M., Calabrese, C. R. Separation Methods for Anthraquinone Related Anti-Cancer Drugs. J. Chromatogr. B Biomed. Sci. Appl. 764 (1-2), 193-206 (2001).
- Zhang, Z. D., Guetens, G., De Boeck, G., Van Cauwenberghe, K., Maes, R. A., Ardiet, C., van Oosterom, A. T., Highley, M., de Bruijn, E. A., Tjaden, U. R. Simultaneous Determination of the Peptide-Mitomycin Kw-2149 and Its Metabolites in Plasma by High-Performance Liquid Chromatography. J. Chromatogr. B Biomed. Sci. Appl. 739 (2), 281-289 (2000).
- Alvarez-Cedron, L., Sayalero, M. L., Lanao, J. M. High-Performance Liquid Chromatographic Validated Assay of Doxorubicin in Rat Plasma and Tissues. J. Chromatogr. B Biomed. Sci. Appl. 721 (2), 271-278 (1999).
- Paroni, R., Arcelloni, C., De Vecchi, E., Fermo, I., Mauri, D., Colombo, R. Plasma Mitomycin C Concentrations Determined by Hplc Coupled to Solid-Phase Extraction. Clin. Chem. 43 (4), 615-618 (1997).
- Song, D., Au, J. L. Direct Injection Isocratic High-Performance Liquid Chromatographic Analysis of Mitomycin C in Plasma. J Chromatogr B Biomed Appl. 676 (1), 165-168 (1996).
- Schrijvers, D. Role of Red Blood Cells in Pharmacokinetics of Chemotherapeutic Agents. Clin. Pharmacokinet. 42 (9), 779-791 (2003).
- Colombo, T., Broggini, M., Garattini, S., Donelli, M. G. Differential Adriamycin Distribution to Blood Components. Eur. J. Drug Metab. Pharmacokinet. 6 (2), 115-122 (1981).
- Maeda, H., Nakamura, H., Fang, J. The Epr Effect for Macromolecular Drug Delivery to Solid Tumors: Improvement of Tumor Uptake, Lowering of Systemic Toxicity, and Distinct Tumor Imaging in Vivo. Adv. Drug Deliv. Rev. 65 (1), 71-79 (2013).
- Gustafson, D. L., Rastatter, J. C., Colombo, T., Long, M. E. Doxorubicin Pharmacokinetics: Macromolecule Binding, Metabolism, and Excretion in the Context of a Physiologic Model. J. Pharm. Sci. 91 (6), 1488-1501 (2002).
- Gabizon, A., Shiota, R., Papahadjopoulos, D. Pharmacokinetics and Tissue Distribution of Doxorubicin Encapsulated in Stable Liposomes with Long Circulation Times. J. Natl. Cancer Inst. 81 (19), 1484-1488 (1989).
- Motlagh, N. S., Parvin, P., Ghasemi, F., Atyabi, F. Fluorescence Properties of Several Chemotherapy Drugs: Doxorubicin, Paclitaxel and Bleomycin. Biomed Opt Express. 7 (6), 2400-2406 (2016).
- Mohan, P., Rapoport, N. Doxorubicin as a Molecular Nanotheranostic Agent: Effect of Doxorubicin Encapsulation in Micelles or Nanoemulsions on the Ultrasound-Mediated Intracellular Delivery and Nuclear Trafficking. Mol Pharm. 7 (6), 1959-1973 (2010).
- Cielecka-Piontek, J., Jelińska, A., Zając, M., Sobczak, M., Bartold, A., Oszczapowicz, I. A Comparison of the Stability of Doxorubicin and Daunorubicin in Solid State. J. Pharm. Biomed Anal. 50 (4), 576-579 (2009).
- Gilbert, C. M., McGeary, R. P., Filippich, L. J., Norris, R. L. G., Charles, B. G. Simultaneous Liquid Chromatographic Determination of Doxorubicin and Its Major Metabolite Doxorubicinol in Parrot Plasma. J. chromatogr. B Analyt. Technol. Biomed. Life sci. 826 (1-2), 273-276 (2005).
- Liu, Z. S., Li, Y. M., Jiang, S. X., Chen, L. R. Direct Injection Analysis of Mitomycin C in Biological Fluids by Multidemension High Performance Liquid Chromatography with a Micellar Mobile Phase. J. Liq. Chromatogr. Relat. Technol. 19 (8), 1255-1265 (1996).
- Zhou, Y., He, C., Chen, K., Ni, J., Cai, Y., Guo, X., Wu, X. Y. A New Method for Evaluating Actual Drug Release Kinetics of Nanoparticles inside Dialysis Devices Via Numerical Deconvolution. J. Control. Release. 243, 11-20 (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır