Method Article
İçinde bir Vivo Vasküler Dynamics Contusive Medulla Spinalis Yaralanmalarında takip görüntüleme için duo-renk yöntemi
Bu Makalede
Özet
Biz dinamik spinal vasküler değişiklikler yetişkin Sprague-Dawley Sıçanlarda contusive Medulla Spinalis Yaralanmalarında takip izlemek için iki farklı floresan boyalar kullanarak yöntemi Imaging bir vivo tanıtmak.
Özet
Medulla Spinalis Yaralanmalarında (SCI) önemli vasküler bozulma sitesinde yaralanma neden olur. Vasküler patoloji SCI hemen sonra ortaya çıkar ve akut yaralanma aşaması boyunca devam eder. Aslında, endotel hücreleri ilk contusive FK sonra ölen görünmektedir Kan-spinal kord bariyer (BSCB), geçirgenliği artmıştır dahil erken vasküler olayı vasogenic ödem ikna etmek ve karmaşık yaralanma mekanizmaları tarafından neden olduğu zararlı ikincil yaralanma olayları katkıda. Bu nedenle, histolojik ve Fonksiyonel bozukluklar bilm sonra katkıda ikincil yaralanma cascades azaltmak için anahtar bir strateji olabilir vasküler bozulma hedefleme Önceki çalışmalar çoğunlukla öldükten sonra örnekleri üzerinde gerçekleştirilen ve vasküler ağ dinamik değişiklikleri yakalamak koyamadık. Bu çalışmada, akut vasküler dinamik değişiklikler contusive FK takip izlemek için bir vivo içinde duo-renk İki fotonlu görüntüleme yöntemi geliştirdik Bu yaklaşım kan akımı, damar çapı ve çeşitli sitelerde aynı fare öncesi ve sonrası yaralanma diğer vasküler patolojiler tespit sağlar. Genel olarak, bu yöntem vasküler dynamics soruşturma için mükemmel bir mekan sunar.
Giriş
Travmatik spinal kord yaralanması (SCI) motor, duyusal ve otonom fonksiyon bozukluğu için önde gelen ortak bir yaralanma olduğunu. Göre ulusal omurilik yaralanma istatistik Merkezi (NSCISC) 2016 yılında, yaklaşık 282,000 kişi ise % 69 esas olarak trafik kazaları nedeniyle etkilenen veya1düşüyor. Bu hastalar genellikle yoğun bakım gerektirir; Ancak, etkili bir tedavi yok şu anda mevcuttur. Bu nedenle, yeni etkili stratejiler SCI karşı acilen ihtiyaç vardır.
SCI esas olarak iki aşamada ayrılmıştır: birincil yaralanma ve ikincil yaralanma. Birincil yaralanma etkisi2iltihap, hücre Apoptozis ve giderek yol kalan aksonlar, demiyelinizasyon gibi ikincil yaralanma olayların ardından, yerinde Hemorajik nekroz neden fiziksel hakaret oluşur için genişleme morfolojik ve fonksiyonel açıkları3,4,5,6. Kanama, yaralanma, SCI7,8Akut Faz hemen bir vasküler bozulma gösteren ilk görünür işarettir. Hastaların kurtarma erken vasküler hasar azaltmaya yönelik bir nöroprotektif strateji geliştirmek olabilir ama bu olayların erken sonrası yaralanma vasküler patofizyolojik mekanizması daha iyi anlaşılmasını gerektirir.
Spinal kord damarlara çalışmaya çeşitli yöntemlerle önceki çalışmalarda rağmen önemli kısıtlamalar kalır. En paylaşılan dezavantajı sadece öldükten sonra örnekleri, örneğin, hidrojen izni9, autoradiography10, microangiogram8, vasküler korozyon atmalarını11ve immünhistokimya12 okuyor ,13. Lazer Doppler Flowmetry spinal kord kan akışı14invaziv olmayan gerçek zamanlı izleme sağlasa da, vasküler sistem arasında ayırt etmek ve vasküler morfolojik değişiklikleri algılamak değiştiremiyor. Dinamik kontrast-artırılmış MRI (DCE-MRI) ayrıca noninvaziv, ancak düşük çözünürlüklü görüntüleri oluşturur ve bir pahalı altyapı15gerektirir.
Her ne kadar 2-Foton kullanarak Imaging vivo içinde tarama mikroskobu lazer (2 P-LSM) korteks16,17,18vasodynamics eğitimi için geliştirilmiştir, çalışmalar sınırlı sayıda var sonra contusive bir yaralanma daha iki nedenden dolayı zor gösterdiği vasküler değişiklikler bilm Tang ve ark. takip hemisection model19ama görüntüleme lezyon sitedeki kenarında kan akımı değişiklikleri göstermiştir. İlk olarak, bir geleneksel cam optik pencere yaralanma site üzerinde olmaz mekanik etkisi sürdürmek ve görüntüleme için işlevsel kalır. İkincisi, izleyici nedeniyle parankimi içine kaçağı kanama ile sonrası yaralanma görüntülemede zorluk oluşturur.
Burada aynı bireysel damarları öncesi ve sonrası yaralanma zaman noktalarda görüntüleme sağlar bir roman duo-renk görüntüleme yöntemi mevcut. Buna ek olarak, contusive Bilimler takip vasküler dinamik değişiklikleri zamansal kayma profilini sağlar Ayrıca birden çok sonrası uzatma süresi noktalarda görüntüleme için potansiyele sahiptir. Bu iletişim kuralı doğrudan nörovasküler etkileşim çalışmaya Transjenik hayvanlar için uygulanabilir.
Protokol
Tüm cerrahi ve hayvan işleme yordamlarını Kılavuzu altında bakım ve laboratuvar hayvanlarının kullanımı (Ulusal Araştırma Konseyi) ve Indiana Üniversitesi okul tıp kurumsal hayvan bakım ve kullanım yönergeleri için onaylanmış yapıldı Komitesi.
1. cerrahi hazırlık
- Omurga sabitleyici de dahil olmak üzere tüm cerrahi .aletleri sterilize. Cerrahi tablo ve çevresi % 70 etanol ile temizleyin. Hayatta kalma sigara cerrahi işlem hazırlanması için yastık Isıtma 37 ° C üstünde temiz cerrahi bir yastık koyun.
- Altı hafta eski Sprague Dawley (SD) fare bu çalışma için kullanın. Tartmak ve ketamin (87,7 mg/kg) ve xylazine (12,3 mg/kg) karışımı bir mayi enjeksiyon fareyle anestezi. Hayvan için bir ayak çimdik uyarıcı cevap olmaktan zaman anestezi uygun sahne onaylayın. Subkutan enjekte 0,01-0,05 mg/kg buprenorfin ve 5mg/kg Carprofen ameliyat öncesi.
- 2 alanları içinde sıçan tıraş: sırt ve boyun bölgesi göğüs tarafındaki Servikal Omurga bölgesine. Deri bölgelerinde betadin cerrahi fırçalayın ve % 70 alkol mendil ile temizle. Kuru göz ameliyat sırasında önlemek için göz merhem uygulamak. Hayvan temiz cerrahi panelindeki sırtüstü pozisyonda yerleştirin.
2. dış juguler ven Kateterizasyonu
- Dış juguler ven darbe noktasına yakın köprücük kemiği bularak bulun ve çapraz-3 anatomik Puan noktasıdır ve yerinde bir dikey kesi yapmak için küçük bahar makas ile kesme: sağ çene, büyük tubercle Kaudal ramus pazı kemiği ve ağız sapı (şekil 1A). Bahar makas ve iyi forseps kullanarak gemi yalıtmak. 1 steril cerrahi sütür hattı (şekil 1 c)20distal ucu kravat.
- Serum dolu ve 21'lik iğne (şekil 1B) yapılan özel bir kateter ile bağlı bir 1-mL şırınga hazırla. Gemide, mikro makas kullanarak küçük bir kesi yapmak ve kateter geminin kaydırın.
- İğne her iki proksimal ve distal uç (şekil 1 c) bağlama tarafından güvenli. Özel kateter 21'lik iğne yapılır. İpucu 2-mm parçası ile kaynak ve eziyet ucunu düz--dan başka bir 21'lik iğne kesti. Bu kateter dışına kaymasını engeller.
Not: İğne akan kan küçük bir miktar iğne damar başarıyla girdiğini gösterir.
- İğne her iki proksimal ve distal uç (şekil 1 c) bağlama tarafından güvenli. Özel kateter 21'lik iğne yapılır. İpucu 2-mm parçası ile kaynak ve eziyet ucunu düz--dan başka bir 21'lik iğne kesti. Bu kateter dışına kaymasını engeller.
3. omurga istikrar ve C5-C7 laminektomi
- Hayvan yüzükoyun sígara yerleştirin. Derinin orta çizgi boyunca istenilen spinal seviyelerde bir No 15 neşter bıçakla kesti. 5th kas katmanlardan 7inci servikal vertebra (C5-C7) bilateral yanal esaslarını (şekil 2A)21ifşa etmek için incelemek.
Not: İkinci torasik vertebra (T2) arasında scapulae spike bularak bulun. Yukarı doğru C7 vertebra21,22,23,24bulmak için T2 omurun saymak. - Fareyi kullanarak değiştirilmiş bir sabitleme aparatı omurga stabilize. Yanal vertebra kemik her iki tarafta bir yarık olun. Paslanmaz çelik silah maruz enine işlem esaslarını altına kaydırın ve istikrar (şekil 2B) sabitleyen vidayı sıkın.
- C5-C7 lamina (laminektomi, şekil 2C) dikkatli bir şekilde çıkarın.
- Serum bulanmış aspirasyon onu nemli (şekil 2B) tutmak için maruz dura mater üstüne küçük bir parça yerleştirin.
4. yükleme İki fotonlu (2P) görüntüleme penceresinin
- İn küçük parçalar halinde kas ve vertebra kemik arasındaki boşluğu içine aspirasyon da aspirasyon spinal kord ve vertebra kemikleri arasında ince bir çizgi şeyler sonra kas-kemik çevresi imzalamaya doku yapıştırıcı tutkal kullanın. Tam kuruluk (şekil 2E) için 5 dakika bekleyin.
Not: Bu adım etkin bir şekilde gelecek pencere ve leakiness daldırma çözümler kanama engeller. - %4 agar GKD2O bir mikrodalga ile hazırlayın. Sonra agar tamamen çözülmüş, o bir dokunuş sıcaklığına kadar bekleyin. 1-mL steril enjektör agar çözüm ile doldurun ve bir duvar (2E rakam) kurmak için pencerenin kenarına boru. Çözüm çabuk katılaşır ve lens veya amaç serbestçe hareket izin vermek için esnek kalır.
- Görüntüleme için hazır olduğunuzda pencerenin içinde aspirasyon ve yer daldırma sıvı 2 (şekil 2F) görüntüleme P için kaldırın. 2 fotonlu mikroskop karanlık odası içinde stabilize hayvan aktarmak ve 2 P görüntüleme penceresi doğrudan mercek altında yerleştirin. Objektif dikkatle görüntüleme penceresine indirin.
5. enjeksiyon ilk floresan boya ve satır taban çizgisi görüntüleme
- Rodamine B isothiocyanate-Dextran 0.5 mL hazırlamak (4 mg/mL ortalama molekül ağırlığı ~ 70kDa) serum fizyolojik içinde. 1-mL steril enjektör çözüm ile doldurun ve şırıngayı önceden yüklenmiş kateter bağlayın.
Not: Kullanılması önerilir önce floresan boya çözüm hazırlanıyor. - Şırıngayı yavaşça iç karartıcı tarafından ilk boya enjekte (şekil 3B). Öncelikle, mercek ilgi alanı tanımlamak için kullanın. Bir dönüm noktası görüntü olarak daha düşük büyütmede yüzey kan damarı kalıplarının bir alan parlak görüntü elde etmek için bir ücret eşleşmiş cihaz (CCD) fotoğraf makinesi kullanın. Lazer tarama moduna geçirin ve sonra disk görüntüsü oluşturma yazılımı her iki görüntüleri toplamak için 2 P açıp satır taramalı veri.
- Görüntülü dokuda kullanılan fluorophores ile maç için uygun 2 P uyarma dalga boyunda, güç ve floresan kanalı (ilk boya için kırmızı kanalı) seçin ve in vivo görüntüleme (3E rakam) gerçekleştirin. Hayvan tüm işlemi sırasında bir Isıtma yastığı üzerinde tutmak.
6. C7 Contusive LISA aygıtı kullanarak yaralanma
- Bir daha önce oluşturulmuş protokol25,26göre Louisville yaralanma sistemi aparatı (LISA) aygıtı kullanarak bir C7 orta hat ezilme yaralanması gerçekleştirin.
- Kısacası, hayvan kalibrasyon takip LISA sahne alanı üzerine yerleştirin.
7. enjeksiyon ikinci floresan boya ve sonrası yaralanma görüntüleme
- Floresein isothiocyanate-dextran (4 mg/mL, ortalama molekül ağırlığı ~ 70 kDa) 0.5 mL serum fizyolojik içinde hazırlamak 5.1 olduğu gibi aynı. 1-mL steril enjektör çözümde doldurun ve önceden yüklenmiş sonda ile bağlayın.
- 2 P mikroskop karanlık odası içinde stabilize hayvan geri aktarmak ve ilk boya için kırmızı kanalı ve ikinci boya için yeşil kanal ile aynı bölgede yeniden görüntü (rakamlar 3D & G).
- Görüntüleme sonunda, sıçan spinal stabilizasyon cihazdan yayın ve agar duvar temiz.
8. hayvan kurban
- Görüntüleme sonra transcardial perfüzyon protokolü27takip sıçan kurban. Spinal kord örnekler toplamak ve onları %4 oranında tamir PFA.
9. çevrimdışı veri analizi: Gemi çapları miktar
- Görüntü dosyaları çevrimdışı analiz için bir iş istasyonu aktarın.
- ImageJ açın ve "dosya" seçin ve sonra önceden kaydedilmiş ham veri seçin ve ilişkili tek bir görüntü dosyası (şekil 4B) açın.
- "Analiz"Ölçeği ayarla tarafından"(şekil 4 c) takip" seçerek görüntü kalibre. "Uzaklığını piksel" yerleştirilir değer şekil 4Aiçinde görüntülenen Denklem kullanılarak hesaplanır. 2-Foton optik lens kalibrasyonu denklemi varsayılan değeri belirler. "OpticalZoom" değerini Excel Genişletilebilir Biçimlendirme (şekil 4B) tek bir görüntü dosyası ile ilişkili Languagefile (XML dosyası) bulunur.
- Geminin uzun eksenine dikey bir çizgi çizin (şekil 4 d1 & E1) ve "analiz"Ölçü"takip" seçin. Damar çapı ölçümü sonuç penceresinde görüntülenir (ekil 4 d2 & E2). Gemi ortalama değerini elde etmek için 3 kez tekrarlayın.
10. çevrimdışı veri analizi: Miktar kırmızı kan hücre (RBC) hız
- Analiz için iş istasyonu için satır taramalı dosya aktarımı.
- ImageJ yazılımını başlatın ve "dosya" seçin ve sonra önceden kaydedilmiş ham veri seçin ve tüm ilişkili satır taramalı dosya uzantısı adı ".ome" ile açın.
- "Görüntü" açın ve "yığınlar yığmak için"Images"takip" seçin. Tüm OME dosyaları bir tek görüntü yığını TIFF dosyasına dönüştürmek.
- MATLAB yazılımını başlatın ve "Aç"'ı tıklatın, "LSPIV_parallel.m" kod dosyasını seçin. Not: LS-PIV için Matlab kodu https://sourceforge.net/projects/lspivsupplement/files/18 , indirilebilir.
- Aşağıdaki siparişleri seçin: "Koşmak" > "Klasörü Değiştir" > "arter". 10,3içinde oluşturulan görüntü yığını TIFF dosyası seçin.
- "Y" yazın ve Enter tuşuna basın.
- Sırasıyla sol ve sağ tarafında görüntü üzerinde bir imleç yerleştirin ve verileri işlemek program başlar.
- Programın sonunda, son okuma hesaplamak için 2 değerleri girin: "pixel_meter dönüşüm değeri" ve "inceden inceye gözden geçirmek zaman dönüşüm değeri". Hem de satır taramalı veri ile ilişkili XML dosyasında bulunur. Son değeri ortalama ve standart sapma hız milimetre (mm/s) saniyede birimleriyle ifade edilir.
Sonuçlar
Yönteminin bireysel damarları vivo içinde dinamik spinal vasküler değişiklikler yapabiliyor öncesi ve sonrası travmatik bilm İlk olarak, bir kateter sonraki floresan boya enjeksiyonu (şekil 1A-C, şekil 3) için erişim sağlamak için dış juguler ven yoluyla yüklenir. İkinci adımda, özel bir cihaz maruz C5-C7 (şekil 1 d-F, şekil 2A-B) stabilize etmek için kullanılır. Bu sabitleme adım nefes eserler ortadan kaldırmak ve sürekli görüntüleme sağlar. Laminektomi (şekil 2C), sonraki adım 2 P C5-C7 (şekil 2B-F) pencere görüntüleme yüklemesidir. Periferik doku spinal görüntüleme penceresi kanama en aza indirme başarılı vasküler görüntüleme için önemlidir. Aşağıdaki adım taban çizgisi (şekil 3A-B, E) olarak anılan kateter Simgesel Yapı ve harita vasküler ağ üzerinden rodamine-dextran floresan boya (kırmızı) enjekte etmektir. C7 orta hat contusive yaralanma sonra orta önem derecesi ile istenilen sonrası uzatma süresi noktalarda FITC-dextran (yeşil) tanıttı (şekil 3A & D). Duo-renk yöntemi bunu hala ilk boya zaten yaralanma (şekil 3 g) nedeniyle parankimi içine sızdırmış zaman ikinci boya kullanarak vasküler yapı tespit edebilen güzelliği.
Görüntüleme oturumu sırasında anestezi indüksiyon sonra vücut ısısı korumak için bir Isıtma yastık üzerinde hayvan saklamanız önerilir.
Bizim duo-renk yöntemi kullanarak, çap ve kırmızı kan hücre hızı (RBC hız) bireysel damarlarının ölçülen hesaplanan ve. Çapı için bir kalibrasyon (şekil 4) sonra onun en büyük çapı 3 tekrarlar için gemisine ölçmek için ImageJ kullanabilirsiniz. Hız için RBC hız (şekil 5)18hesaplamak için Matlab programı (MATLAB R2013a) kullanarak satır Taramalı görüntüler ölçülür. Morfoloji, kan akım hızı ve damar çapı göre gemilerin 2 kategoride sınıflandırılabilir: arter ve ven (bkz: Tablo 1).
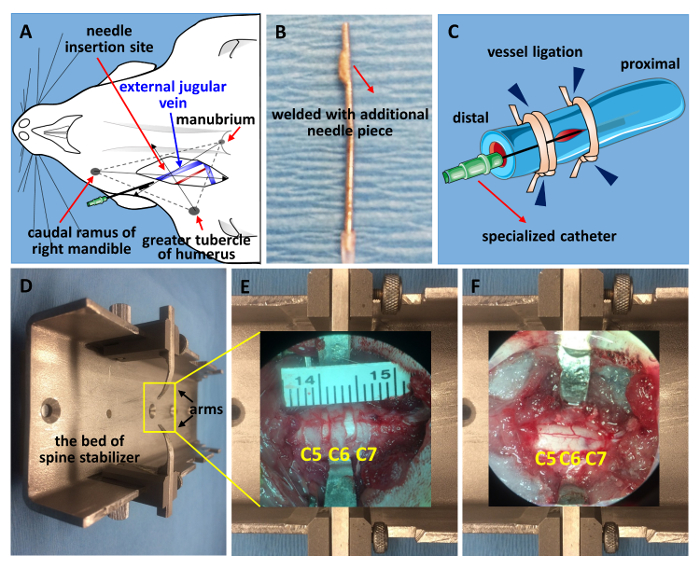
Resim 1 . Juguler ven Kateterizasyonu ve omurga sabitleme.
(A) dış juguler ven bulmak için çizim bir şematik. (B) 21'lik iğne yapılan özel kateter. Ucunu yere düz ve kaynaklı bir parçası başka bir 21'lik iğne kesilmiş 2 milimetre ipucu ile yapıldı. (C) Kateterizasyon bir şematik diyagramı. Distal uç ilk, proksimal kateter sabitleme, gemi ile birlikte (damar ligasyonu, mavi ok uçları) iğne sabitleme ile biten ardından bakmaksızın. (D) değiştirilmiş omurga sabitleyici bir görüntü. Laminektomi (E) önce ve sonra laminektomi ve contusive bilim (F) bir C5-C7 penceresi görüntülenir. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
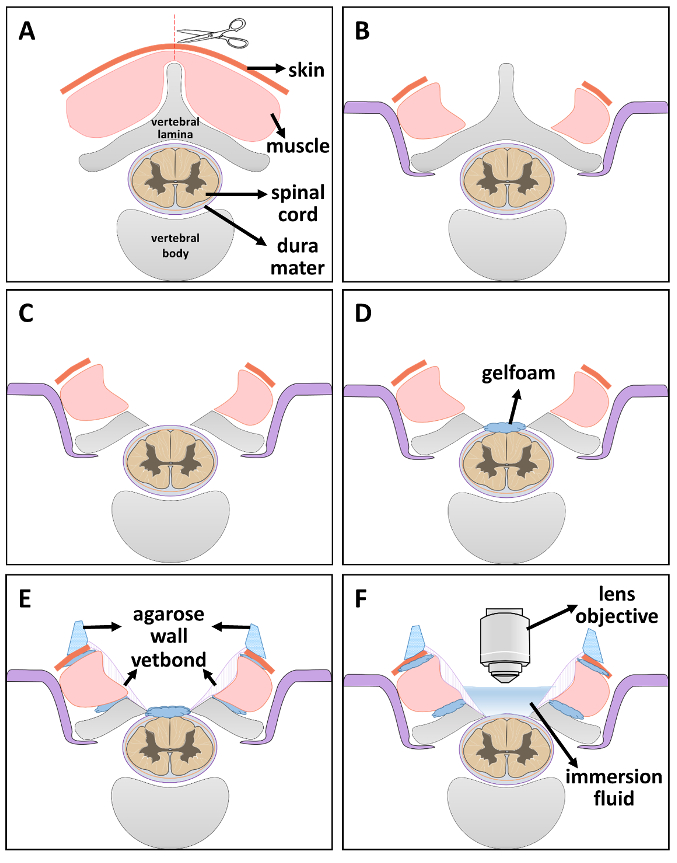
Resim 2 . Optik pencere montaj adım adım şematik diyagramı.
(A) adım 1: omur kesme cilt ve kas orta çizgi boyunca ortaya çıkarmak. (B) adım 2: omurga sabitleme. (C) adım 3: laminektomi. (D) adım 4: serum bulanmış aspirasyon bir parça yerleştirerek omurilik nem korumak. (E) adım 5: steril aspirasyon ve vetbond ile boşlukları mühür. Kuruduktan sonra agar duvar tabakası pencerenin kenarında kurulmuştur. (F) adım 6: görüntüleme için hazır olduğunda aspirasyon ve yer daldırma sıvı içinde 2 P pencere görüntüleme kaldırmak. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
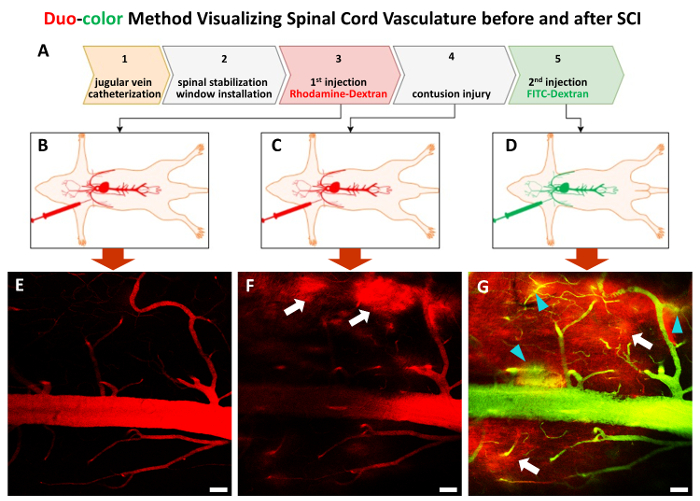
Şekil 3 . İn vivo duo-renk yöntemi prosedürü adım adım.
Tüm prosedürü (A)5 adımdan oluşur. Adım 1 ve adım 2 aşağıdaki KDa dextran tarayıcıları bir çift boyutu yaklaşık 70 olarak vardır B ve Comurilik Pres'teki (önce etiket sırayla enjekte) ve sonra contusive SCI (D). (E)-(G) temsilcisi 2P resimleri adım 3 ve adım 5, spinal kord damarlara görüntülemek. Beyaz ok ilk kırmızı boya alanlarda (F ve G) sızıntı için işaret, turkuaz ok uçları ikinci dalga yeşil boya sızıntı (G)görüntüler. Ölçek çubuğu 50 µm. = Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
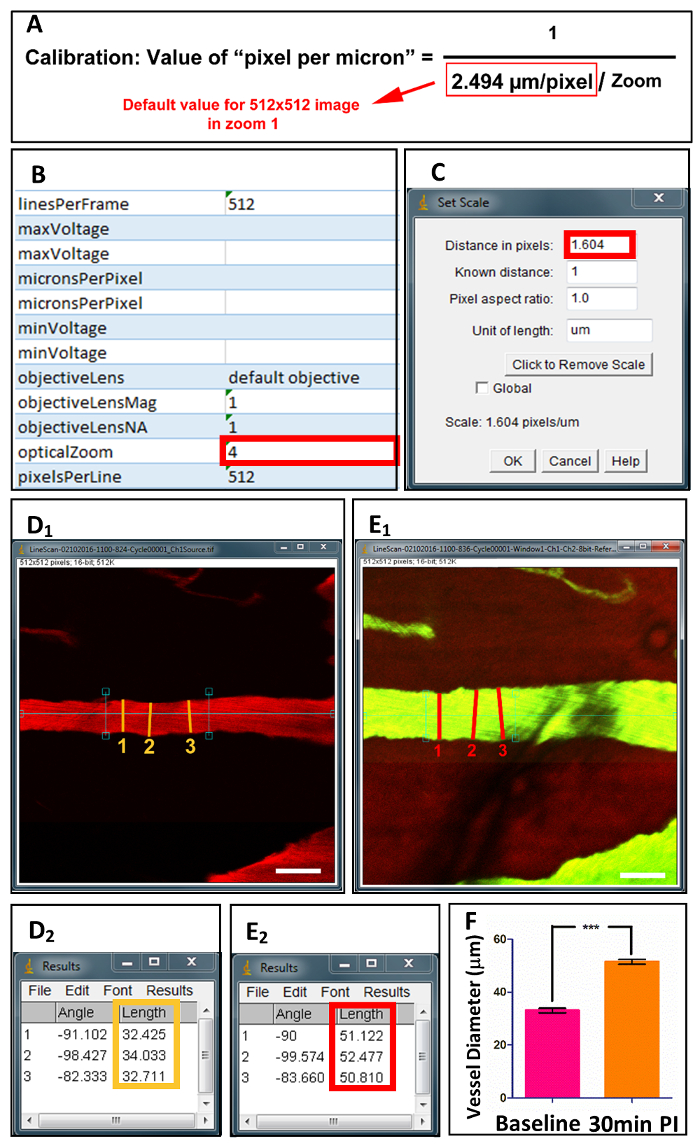
Şekil 4 . Satın alma ve omurilik gemi çapları miktar.
Hazırlık tek görüntü dosyaları XML dosyaları kalibre edilmiş değerler (B)ile birlikte 2 P mikroskobu altında elde edilir. (A) denklemi "optik zum değerlerine göre her piksel için mikron" hesaplanması görüntüler. ImageJ (C)içinde kalibrasyon sonra gemi çapları 3 puan önce uzunlamasına eksen boyunca ölçülen (D1) ve sonra (E1) yaralanma. (D2) ve (E2) ölçülen değerleri görüntüleme. Gemi çapları temel ve 30 dk sonrası yaralanma (F) miktar. Ölçek çubuğu = 50 µm. veri gösterilir ± SD, demek gibi *** p < 0.0001, iki kuyruklu eşleştirilmiş t testi.Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
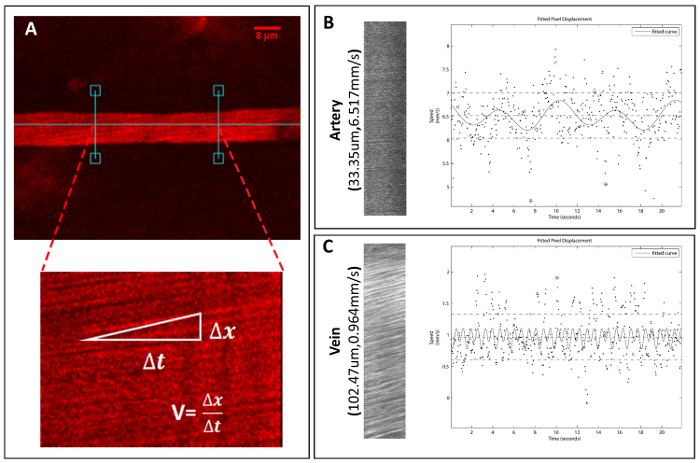
Şekil 5 . Satın alma ve miktar spinal gemi hız.
Satır taramalı görüntü dosyaları tek gemi hızları hesaplamak için 2 P mikroskobu altında elde edilir. (A) seçili gemi ve yöntem damar RBC hız değerlendirmek için bir örnek. (B) satır taramalı görüntü ve hız hesaplanması için ilgili arsa dosyaya Arteryel örneği, aynı zamanda bir damar (C)bir örneği. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
| Arter | Ven | |
| Morfoloji | Düz, düz, kalın damar duvar | Dalları, pürüzlü kenarlar |
| Kan akım hızı | Hızlı | Yavaş ama değişir |
| Çapı | 30-80 µm | 100-250 µm |
Tablo 1: gemi türleri tanımlamak için ölçütler
Tartışmalar
Geleneksel teknikleri öldükten sonra örnekleri damar yapısı değişikliklere büyük ölçüde sınırlı olduğundan damar çalışmalar SCI takip için bir meydan okuma teknik kısıtlamadır. Yukarıda açıklanan yöntemi Imaging bu roman vivo içinde kan akışı ve ilgili parametreleri (hız ve damar çapı) 2 P-LSM canlı fareler kullanarak dinamik ölçüm sağlar. Ayrıca aynı setler halinde gemiler contusive FK takip farklı zaman noktalarda tekrarlanan muayene sağlar Önceki 2-Foton mikroskobu görüntüleme teknikleri sonrası travma vasküler yapılar nedeniyle tek bir izleyici kaçağı yakalamak koyamadık. Bizim duo renk tasarımı travmatik modelleri için dinamik vasküler görüntüleme sağlar. Buna ek olarak, bu yöntem esnekliğini bilm takip akut vasküler değişiklikler kayma geçici bir profil oluşturmak için bir fırsat sağlar
Bizim içinde vivo duo-renk görüntüleme yönteminde çeşitli kritik adımlar vardır. İlk olarak, omurilik hızlandırılmış görüntüleme, özellikle solunum hareket artefaktı azaltma önce fiziksel istikrarı sağlamak için esastır. Biz biraz istikrar sırasında omurga omur yüksekliğini yükseltmek spinal kelepçeler şeklinde tasarlanmış. Böylece omurilik nefes hayvan birleştiriliyor hareketi olabilir (şekil 1 d-F, 2B) büyük ölçüde azalır. Bu omurilik önce görüntüleme her oturum başına istikrar kontrol etmek için tavsiye edilir. Spinal kord istikrar elde etmek başarısız olursa, hizalama ve darlık omurilik kelepçeler, düzeltmenin yapılması gerektiğini. İkinci, periferik doku (kemik, kas katmanı ve cilt) görüntüleme penceresinin içine kanama görünümü kirlenme riski. Pürüzsüz bir görüntü oturum için aspirasyon ve doku yapıştırıcı tutkal çevreleyen doku etkili önlenmesi için uygulanmalıdır. Üçüncü olarak, seçtiğimiz floresan boyalar albumin (66 kDa), ana yüksek molekül ağırlıklı kan plazma protein olan benzer bir boyutu var. Homeostatik koşullar altında boyaları büyük ölçüde albümin28benzer gemi içinde muhafaza. Yaralanma sonra boya kesintiye endotel yapının içinden geçti ve damarlara (şekil 3F-G) çevre alanında önemli bir artış floresan yoğunluğu neden parankimi içine sızdırılmış. Buna ek olarak, dış juguler ven Kateterizasyonu neden seçtiğimiz iki nedeni vardır. İlk olarak, deneme herhangi bir zamanda teslimat sürekli erişilebilir bir yol sağlayabilir. İkinci olarak, bu gelecekteki tedavi enjeksiyon için bir yol olarak kullanılabilir.
Bizim içinde vivo duo-renk yöntemi travmatik vasküler görüntüleme çalışmaları için yeni bir yer sağlamak mümkün olsa da, bazı uyarılar bu tekniği ile ilgili olarak ele alınmalıdır. Şu anda, bu tekniği 2 saat puan (temel ve 1 sonrası yaralanma zaman puan), vasküler değişiklikler değerlendirmek için tasarlanmıştır, ancak ek floresan boyalar ve kanallar varsa birden fazla zaman puan için geçiş yapmak için uygun olduğunu. Çeşitli çalışmalarda kronik intravital görüntüleme için implante cam pencere kullanarak olmakla birlikte, hiçbiri-in onları travma olabilir19,29,'30dan sonraaynı gemide temel bilgiler sağlayabilir, 31,32. Bu çalışmalar, bir no-cam pencere bizim penceredir. Bu öncesi ve sonrası yaralanma görüntüleme için uygundur, ama uzun vadeli gözlem için pencereyi yeniden kurmak için zor olabilir. Bizim gelecekteki araştırmalar için kronik düşsel teknik iyileştirme üzerinde çalışıyor. Vasküler sistem çeşitli gemi türleri (arter, ven ve kılcal damar) oluşmaktadır ve her morfoloji ve işlev özellikleri farklıdır. Görüntüleme sırasında gemi türleri arasında farklılaşma vasküler değişiklikler açık bir desen alay için yardımcı olabilir. Yukarıdaki Protokolü morfoloji ve hız dayalı gemileri tespit gözlemci bağlıdır; Ancak, bir arter özel boya gemi türleri33arasında daha kesin bir sınıflandırma vermek için kolayca eklenebilir.
Bu teknik sadece contusive üzerinde Değerlendirmeler ile sınırlıdır ve ezilme hasarı ve radyasyon yaralanma, gibi diğer travmatik modeller, ancak de BSCB bozulma üzerinde odaklanan derslerine de vasküler geçirgenliği değişir. SCI yanı sıra, amyotrofik lateral skleroz (ALS) ve Multipl skleroz (MS) gibi diğer nörodejeneratif hastalıkların takip vasküler değişiklikler çalışma için kullanılan olabilir. Ayrıca, dinamik nörovasküler etkileşim çalışması transgenik bir hayvan modeli için transferrable olabilir. Güçlü tarama aracı olarak, gelecek çalışmalar Medulla Spinalis Yaralanmalarında tedavisinde etkinliğini değerlendirmek için burada açıklanan görüntüleme tekniği kullanmak olabilir.
Sonuç olarak, in vivo duo-renk yöntemi zamansal kayma vasküler profil karakterizasyonu için idealdir dinamik vasküler değişiklikleri değerlendiriliyor ve tedavilere için eleme için bir güvenilir, gerçek zamanlı, in vivo yaklaşım araçtır ikincil hasarlar bilm takip azaltmak
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Bu eser kısmen NIH NS059622, NS073636, DOD CDMRP W81XWH-12-1-0562, Merit inceleme Ödülü I01 BX002356 US Department of Veterans Affairs, Craig H Neilsen Vakfı 296749, Indiana omurilik ve beyin hasarı Araştırma Vakfı () tarafından desteklenen yapıldı. ISCBIRF) Indiana devlet Sağlık Bakanlığı (019919) ve Mari Hulman George Endowment fon.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Purdue Products Betadine Surgical Scrub | Fisher Scientific | 19-027132 | Skin sterilization |
| Ketamine (87.7 mg/kg)/Xylazine (12.3 mg/kg) | Patterson Veterinary | 07-881-9413, 07-890-5745 | Anesthetic agent |
| Buprenorphine(0.03 mg/mL) | Patterson Veterinary | 07-891-9756 | Pain relief agent |
| Carprofen | Patterson Veterinary | 07-844-7425 | Non-steroidal anti-inflammatory drug |
| Dukal Gauze Sponges | Fisher Scientific | 22-415-490 | Skin sterilization |
| Decon Ethanol 200 Proof | Fisher Scientific | 04-355-450 | Skin sterilization |
| Artificial Tears Eye Ointment | Webster Veterinary | 07-870-5261 | Prevent drying eyes |
| Cotton Tipped Applicators | Fisher Scientific | 1006015 | |
| Rhodamine B isothiocyanate–Dextran | Sigma-Aldrich | R9379 | Average mol wt 70kDa |
| Fluorescein isothiocyanate–dextran | Sigma-Aldrich | 46945 | Average mol wt 70kDa |
| Instrument Sterilizer | Fine Science Tools | 18000-50 | for sterilizing surgery tool |
| Spine stabilizer set | Custom Manufactured from Norton Neuroscience Institute | Contact Y. Ping Zhang for details. (yipingzhang50@gmail.com) | |
| Vetbond | 3M Animal Care Products | 1469SB | Tissue adhesive Glue |
| Gelfoam | Henry Schein | 9083300 | Stop bleeding |
| Noyes Spring Scissors | F.S.T | 15013-12 | |
| Fine Forceps- Dumont #5 | F.S.T | 11254-20 | |
| Rongeur | Fine Science Tools | 16021-14 | laminectomy |
| Surgical Retractor | Fine Science Tools | 17005-04 | |
| Scalpel | Fine Science Tools | 10003-12 | skin cut |
| Scalpel Blade #15 | Royal-Tek | BS2982 | skin cut |
| micro angled scissors | World Precision Instruments | 500260 | Can be from any vendor |
| 3-0 vicryl sutures | Ethicon | J393H | Can be from any vendor |
| Silk Black Braided Non-Absorbable Suture, 3-0, C-7, Reverse Cutting, 18" | LOOK | 786 | Can be from any vendor |
| 1 ml syringe | Henke Sass Wolf | 4010.200.V0 | Can be from any vendor |
| 21 gauge needle | BD | 305165 | Can be from any vendor |
| Agar | Sigma-Aldrich | A1296 | Can be from any vendor |
| Two-photon Laser Scanning Microscope | Bruker Fluorescence Microscopy | ||
| LISA device | Custom Manufactured from Norton Neuroscience Institute | Contact Y. Ping Zhang for details. (yipingzhang50@gmail.com) | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| HCImage Live | Hamamatsu Corporation | Imaging software | |
| PrairieView | Prairie Technologies/Bruker | Two-photon imaging software | |
| ImageJ | Image analysis software | ||
| Matlab statistics toolbox | The MathWorks, Inc. | https://www.mathworks.com/products/statistics.html?s_tid=srchtitle | Image analysis software |
Referanslar
- National Spinal Cord Injury Statistical Center. Spinal Cord Injury Facts and Figures at a Glance. SCI Data Sheet 2016. , (2016).
- Dumont, R. J., et al. Acute spinal cord injury, part I: pathophysiologic mechanisms. Clin Neuropharmacol. 24 (5), 254-264 (2001).
- Beattie, M. S., Farooqui, A. A., Bresnahan, J. C. Review of current evidence for apoptosis after spinal cord injury. J Neurotrauma. 17 (10), 915-925 (2000).
- Liu, N. K., et al. A novel role of phospholipase A2 in mediating spinal cord secondary injury. Ann Neurol. 59 (4), 606-619 (2006).
- Wu, X., Xu, X. M. RhoA/Rho kinase in spinal cord injury. Neural Regen Res. 11 (1), 23-27 (2016).
- Li, X. G., et al. Combination of methylprednisolone and rosiglitazone promotes recovery of neurological function after spinal cord injury. Neural Regen Res. 11 (10), 1678-1684 (2016).
- Kulkarni, M. V., et al. Acute spinal cord injury: MR imaging at 1.5. T. Radiology. 164 (3), 837-843 (1987).
- Tator, C. H., Koyanagi, I. Vascular mechanisms in the pathophysiology of human spinal cord injury. J Neurosurg. 86 (3), 483-492 (1997).
- Kobrine, A. I., Doyle, T. F., Martins, A. N. Spinal cord blood flow in the rhesus monkey by the hydrogen clearance method. Surg Neurol. 2 (3), 197-200 (1974).
- Rivlin, A. S., Tator, C. H. Regional spinal cord blood flow in rats after severe cord trauma. J Neurosurg. 49 (6), 844-853 (1978).
- Koyanagi, I., Tator, C. H., Theriault, E. Silicone rubber microangiography of acute spinal cord injury in the rat. Neurosurgery. 32 (2), 260-268 (1993).
- Noble, L. J., Wrathall, J. R. Correlative analyses of lesion development and functional status after graded spinal cord contusive injuries in the rat. Exp Neurol. 103 (1), 34-40 (1989).
- Maikos, J. T., Shreiber, D. I. Immediate damage to the blood-spinal cord barrier due to mechanical trauma. J Neurotrauma. 24 (3), 492-507 (2007).
- Tei, R., Kaido, T., Nakase, H., Sakaki, T. Secondary spinal cord hypoperfusion of circumscribed areas after injury in rats. Neurol Res. 27 (4), 403-408 (2005).
- Cohen, D. M., et al. Blood-spinal cord barrier permeability in experimental spinal cord injury: dynamic contrast-enhanced MRI. NMR Biomed. 22 (3), 332-341 (2009).
- Drew, P. J., Shih, A. Y., Kleinfeld, D. Fluctuating and sensory-induced vasodynamics in rodent cortex extend arteriole capacity. Proc Natl Acad Sci U S A. 108 (20), 8473-8478 (2011).
- Schaffer, C. B., et al. Two-photon imaging of cortical surface microvessels reveals a robust redistribution in blood flow after vascular occlusion. PLoS Biol. 4 (2), e22 (2006).
- Kim, T. N., et al. Line-scanning particle image velocimetry: an optical approach for quantifying a wide range of blood flow speeds in live animals. PLoS One. 7 (6), e38590 (2012).
- Tang, P., et al. In vivo two-photon imaging of axonal dieback, blood flow, and calcium influx with methylprednisolone therapy after spinal cord injury. Sci Rep. 5, 9691 (2015).
- Thrivikraman, K. V., Huot, R. L., Plotsky, P. M. Jugular vein catheterization for repeated blood sampling in the unrestrained conscious rat. Brain Res Brain Res Protoc. 10 (2), 84-94 (2002).
- Walker, M. J., et al. A novel vertebral stabilization method for producing contusive spinal cord injury. J Vis Exp. (95), e50149 (2015).
- Anderson, K. D., Sharp, K. G., Steward, O. Bilateral cervical contusion spinal cord injury in rats. Exp Neurol. 220 (1), 9-22 (2009).
- Krishna, V., et al. A contusion model of severe spinal cord injury in rats. J Vis Exp. (78), (2013).
- Lepore, A. C. Intraspinal cell transplantation for targeting cervical ventral horn in amyotrophic lateral sclerosis and traumatic spinal cord injury. J Vis Exp. (55), (2011).
- Zhang, Y. P., et al. Spinal cord contusion based on precise vertebral stabilization and tissue displacement measured by combined assessment to discriminate small functional differences. J Neurotrauma. 25 (10), 1227-1240 (2008).
- Wu, X., et al. A Tissue Displacement-based Contusive Spinal Cord Injury Model in Mice. J Vis Exp. (124), (2017).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. J Vis Exp. (65), (2012).
- Egawa, G., et al. Intravital analysis of vascular permeability in mice using two-photon microscopy. Sci Rep. 3, 1932 (2013).
- Farrar, M. J., et al. Chronic in vivo imaging in the mouse spinal cord using an implanted chamber. Nat Methods. 9 (3), 297-302 (2012).
- Evans, T. A., Barkauskas, D. S., Myers, J. T., Huang, A. Y. Intravital imaging of axonal interactions with microglia and macrophages in a mouse dorsal column crush injury. J Vis Exp. (93), e52228 (2014).
- Davalos, D., Akassoglou, K. In vivo imaging of the mouse spinal cord using two-photon microscopy. J Vis Exp. (59), e2760 (2012).
- Davalos, D., et al. Stable in vivo imaging of densely populated glia, axons and blood vessels in the mouse spinal cord using two-photon microscopy. J Neurosci Methods. 169 (1), 1-7 (2008).
- Shen, Z., Lu, Z., Chhatbar, P. Y., O'Herron, P., Kara, P. An artery-specific fluorescent dye for studying neurovascular coupling. Nat Methods. 9 (3), 273-276 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır