Method Article
Laboratuvarda ölçmek yüzeyler bitki bakterilerin bağlılık
Bu Makalede
Özet
Ölçme ve bitkiler, özellikle kökleri ve Brüksel lahanası, bakteriyel yapışma karakterize için kolay bir yöntem bu makalede anlatılan.
Özet
Bu el yazması bakteriyel axenic bitki yüzeyler ışık mikroskobu ve uygun hücre sayımları aracılığıyla bağlamaya ölçmek için bir yöntem açıklanır. Kullanılan bitki malzemeler dahil kökleri, Brüksel lahanası, yaprak ve meyve kesti. Açıklanan yöntemleri, kolay, ucuz ve küçük örnek boyutları için uygundur. Bağlama laboratuvarda ölçmek ve kuluçka ortam ve koşulları çeşitli kullanılabilir. İnhibitörleri etkisini belirlenebilir. Desteklenmesi ve bağlama inhibe durumlar da tespit edilebilir. Bazı durumlarda çeşitli koşullar bağlama etkileri bitki veya bakteri nedeniyle öncelikle değiştirme olup olmadığını ayırt etmek mümkündür.
Giriş
Yüzeyler tesisi için bakteriyel bağlama ölçümü üç farklı durumlarda önem kazanmıştır. İlk durum iletim tesisi yüzeyler1,2,3insan patojenlerin incelenmesidir. Burada amaç bakteriyel bağlama önlemek için veya kaldırmak ya da ilişkili bakterileri öldürmek için olduğunu ve bu nedenle bitki materyali tarafından hastalık iletim azaltmak için. İkinci durum için yüzeyler4bitki bitki patojenleri bağlama incelenmesidir. Bir kez daha burada bağlama önlemek için veya kaldırmak ya da ilişkili bakterileri öldürmek için hedeftir ve böylece hastalığı azaltmak için. Üçüncü durum bağlama simbiyotik veya bitki büyüme teşvik bakteri5,6incelenmesidir. Burada amaç bakteriyel bağlayıcı ve böylece artış bitki sağlığı ve ürün teşvik etmektir verir.
Bu makalede açıklanan yüzeyler tesisi için bakteriyel bağlama Ölçme teknikleri are ucuz ve nispeten kolay yapmak. Sadece şartları mikroskop ve genellikle Bakteriyolojinin laboratuvarda bulunan malzemeler vardır. Bazı teknikler için banyo sonicator yararlıdır. Açıklanan teknikleri nispeten küçük örnek boyutlarını kullanarak yapılan deneyler bağlama için tasarlanmıştır. Her ne kadar bazı teknikler kullanmak sera veya alan için değiştirmek mümkün olabilir bağlama ölçümleri laboratuvar olarak yapılır.
Bu teknikler kökleri, Brüksel lahanası, kesme yaprakları bakteriyel bağlama, kesilmiş meyve ve bozulmamış kiraz domates ' deki laboratuvar7,8,9,10,11ölçmek için kullanılmış, 12,13,14,15. Bunlar ayrıca laboratuvar16' kum veya toprakta büyüyen bitkilerin kök kolonizasyon ölçmek için kullanılmıştır. Agrobacterium tumefaciens, Sinorhizobium meliloti, Escherichia coli, Salmonella enterica ve Pseudomonas fluorescensdahil olmak üzere birçok bakteriyel türler ile teknikleri kullanılmaktadır. A. tumefaciens yüzeyler ile etkileşimi değerlendirmek için yöntem yararlı açıklamasını Morton ve Fuqua (2012)17bulunabilir. Her durumda örnek boyutları dahil 25-50 bitkiler küçük, daha az genellikle. Açıklanan teknikleri deneyler sırasında kapsanan tutulması gereken insan patojenler ile kullanım için uygundur.
Protokol
1. Axenic bitki materyali hazırlanması
- Suda yetiştirilen Fideler hazırlayın.
- Tohum (az 30) az sayıda bir 30, 50, 100 veya 150 mL Cam kabı yerleştirin. Bu iletişim kuralı ile domates, yonca, Arabidopsis thaliana, bezelye, bakla, tütün, marul ve havuç tohumu kullandık.
Not: kaç tohum birlikte bir tohum diğerine yayılan kirlenme olmadan sterilize belirlemek için adım 1.1.2 bakın. - Tohum % 80 etanol ile kapak ve kısaca girdap. 1 dk. için emmek tohum izin.
- Etanol dökün ve bir çözüm cilt ticari çamaşır suyu (NaClO) % 50 ve % 0.1 ile tohum kapak Triton X-100 musluk suyundaki. 20 dk için emmek tohum izin.
Not: tohum fasulye tohumu gibi büyük iseniz, tamamen tohum yüzeydeki mantarlar öldürmek için iliklerine zaman uzatmak gerekli olabilir. - Çamaşır suyu karışımı dökün ve tohumlar 3 kez steril su ile yıkayın. Her yıkama için 1 dk suda ıslatın tohum izin.
- Elde etmek için axenic fidan tohum büyüklüğüne bağlı olarak 5 ile 25 mL arasında steril su az miktarda ekleyin. Tohum ve su içine tohum çimlenme için steril Petri kabına dökün.
Not: Su çanak alt kapak ama kök tüyleri oluşumu teşvik için tohum kapsamaz. Sadece tek bir tür organizmanın mevcut Axenic hangi bir kültür açıklar. - Fidan 1 cm ve 10 cm (yaklaşık 4 gün domates ve A. thaliana ve 1 ila 3 gün süreyle yonca) arasında istediğiniz boyuta ulaşana kadar karanlıkta kuluçkaya. İçin daha büyük tohum folyo ile kaplı bir cam tabak gibi daha--dan 100 mL kapasiteli bir kapalı steril kap kullanın.
- Tohum (az 30) az sayıda bir 30, 50, 100 veya 150 mL Cam kabı yerleştirin. Bu iletişim kuralı ile domates, yonca, Arabidopsis thaliana, bezelye, bakla, tütün, marul ve havuç tohumu kullandık.
- Belirli tohum çok yüzey-Sterilizasyon sonra uygulanabilir veya tohum içinde kalması mikroorganizmalar ile kirlenme sıklığını belirler.
Not: zaman zaman tohum mikroorganizmaların yüzey-sterilizasyon tarafından öldürülemez tohum kat altında taşıdığı bu gereklidir. Kirli tohumlar sıklığı bir tohum yerinde grup tohum ile bakteri ve mantar tedavisi hayatta bir tohum nedeniyle kontamine olma riski yüksek bir anda sterilize etmek için kaç tohum belirlemek için kullanın.- Adımları 1.1.1 1.1.3 aracılığıyla yerine getirir.
- Tohumlar bir besin agar Petri kabına yerleştirin. Koymak böylece bunların tek tek attı onları aralığı 10-30 tohum her yemek. Bulaşıkları teyp veya sızdırmazlık film ile kapatın.
- Her gün görünür mikroorganizmaların tohumlarından akıbet için Puanlama 25 ° C'de 3-5 gün kuluçkaya.
- Kuma yetiştirilen Fideler hazırlayın. Fidan kum kullan bakteriyel yapışma deneylerde için yetiştirilen olabilir.
- Adımları 1.1.1 1.1.3 aracılığıyla yerine getirir.
- Otoklav kuvars veya deniz kum sterilize. Bunların her ikisi de bazı organik materyal içeren. Eğer bu deneme etkiler, onu iki kez hacmi 10 dk. izin ver için 0,1 M HCl. karışımı ile yerleşmek ve sıvı dökmek kaplayan kum kum yıkayın. Kum su ile 3 kez ve bir kez %80 ile etanol 0.1 M gelince aynı iletişim kuralını kullanarak iki ek su durular HCl. Sterilize otoklav yıkanmış kum ardından durulayın.
- Kapsayıcılar içinde % 50 çamaşır suyu 5 min için onları batış tarafından sterilize ve batma tarafından steril su ile 5 kere yıka. Kuru ve alt film mühürleme ile mühür etmelerine izin. Filmin üreticisinden elde gibi genellikle iç mikroorganizmaların ücretsizdir konteyner içine dönük yerleştirilmelidir tarafı.
- Steril kum yeterince steril su ile yeterince ıslak kum sopa karıştırın. Tutar ne kadar kuru kum olduğuna bağlı olacaktır. Genellikle kum hacminin 10-%35 yeterlidir. Islak kum kökleri uzunluğu için yeterli derinlik üstüne kum sürgün büyümesi için gerekli ve yeterli boşluk sağlayan kapsayıcı yerleştirin. Tam mesafeler türler ve kullanılan bitki çeşitli bağlıdır.
- Bitki tohumları.
- Kum kum (yaklaşık 1-5 mm) aşağıda tohum yerleştirmek için yeterince derin bir steril cam çubuk ile sığ bir delik açın. Tohum deliğe yerleştirin. Kum ince bir tabaka ile bin yeter. Üst kapsayıcı film giriş ek mikroplar ve su kaybı önlemek için mühürleme ile kapatın.
- Laboratuarda bir ışık altında veya sera bir uygun sıcaklık ve gün-uzunluk türler ve çeşitli bitki için bitkiler büyümek. Domates, yonca veya Arabidopsis thaliana oda sıcaklığında ve 12 h açık/koyu döngüleri kullanın.
- Fidan kum (1-2 mm çap ve kök kumla kaplı derin yeterli olarak) bir delik bitki. Steril cam çubuk ile delik açın. Kök dikkatle gerekli ve kumla kenarlarına delik doldurmak bir steril paslanmaz çelik tığ kullanarak delik deliklere.
- Alternatif olarak, bitkiler axenically ya da MS tuzlar gibi tuzları karışımı içeren agar büyümek. Sürgünler doğrudan agar içinde yetiştirilen axenic bitkilerin kullanın. Kökleri ile agar agar bitki yüzey ve bakteri için sopa olarak büyüdü kaçının. Bu bitki yüzeye bakteriyel yapışma yanlış bir izlenim neden olabilir.
2. diğer bitki materyali hazırlanması
- Sera yerli mikrop sayısını azaltmak için kullanmadan önce su ile yetiştirilen bitki materyali yıkayın. Bakteri ve mantar bitkiler üzerinde olacak. Tek hücreli toprakta, kökleri ve olasılıkla yaprakları mevcut olacaktır. Çamaşır suyu veya etanol ile yıkama tesisi yüzeyi tümüyle değiştirecek ve tavsiye edilmez.
- Eğer mikroplar önemli sayıda kalır, seyreltilmiş sıvı el sabunu bitkilerle tedavi veya hidrojen peroksit (% 0.01) kaldırmak veya mikropları öldürmek için seyreltik su yıkama sonrası. Bu genel olarak daha az çamaşır suyu veya etanol daha bitki için zarar.
- Yerel bir pazarda satın bitki materyali dezenfekte etmek zor olduğu için tabi uzun depolama olmuştur görünmüyor malzeme seçin. Malzemenin, kahverengi veya hasarlı parçalar kaçının.
- Su ile yıkayın ve kesme sitelerinde birikmiş var test bakteriler bakteri (ve ökaryotlar) ile etkileşimleri ilgi değilseniz hangi daha önce kullanmadan önce kesilmiş malzeme biter taze kesim yapmak. Bitki yüzey değiştirecek gibi çamaşır suyu veya etanol ile yıkayın değil.
- Yara siteleri tedavi. Yara siteleri genellikle bakteri bitki malzeme18iç erişim sağlar.
- Engellemek veya bakteriyel eki ve yara veya erimiş parafin kesme kenar daldırma veya küçük bir fırçayla erimiş parafin ile site resim malzeme hazırlanmasında oluşturulan kesim siteleri aracılığıyla hareketi azaltmak. Bu doku zarar verebilir bir spatula veya herhangi bir keskin alet kullanmayın.
- Mühür meyve parafin ile domates gibi izleri kaynaklanıyor. Bazı bakteriler parafin altına alan içine yüzmek, ama sayıları genellikle küçük.
- Yara siteleri içine bakteriyel giriş ilgi, bakteri taşıyabilirsiniz mesafe su akışları veya difüzyon tarafından taşınan çözümü eklendi bir boya hareket gözlemleyerek tahmini ise. Yeşil flüoresan protein (GFP) gibi floresan bir protein onları kodlama bir gen tanıtarak hareketli bakteri işaretlemek ve onları iz floresans mikroskobu adım 6.1.219' açıklanan kullanarak.
3. bakteri hazırlanması
- Bakteri büyümek. Kullanım koşulları bakteri en yakın yaklasik bir orta hemen laboratuvar dışında gerçek dünyadaki bitki Karşılaşma öncesinde maruz kalmış olamaz muhtemeldir. Karbon ve azot kaynakları iyonları, varlığı yanı sıra özellikle divalent katyonlar (Ca, Mg, Fe, Mn ve Zn) ve fosfat ve ortamın pH önemlidir.
- A. tumefaciens ve diğer toprak bakteriler20için en az AB Orta veya Luria suyu kullanın. Hangi gut kaynaklı, E. coliiçin Luria suyu kullanın.
- İndükleyicileri kök exudates gibi veya soytone gibi ticari bitki özleri veya şeker sükroz veya ksiloz gibi orta21' e ekleyin. Bu maddelerin indükleyicileri kullanılması halinde, örneğin %0,01 düşük konsantrasyon ekleyin. Onlar kullanılan karbon kaynakları varsa, daha yüksek bir konsantrasyon, örneğin %0,1 ekleyin.
- Bakteriyel inoculum hazırlayın. Bakteri steril su veya orta kuluçka yapılacaktır ve bitki materyali ekleyin sulandırmak. Uygun seyreltme 4.2 ve 4.3 adımlarda anlatılan.
- Büyüme medya bakteri kullanmadan önce kaldırmak için 10.000 x g 2 min için de bakteriyel süspansiyon santrifüj kapasitesi, süpernatant dökün ve bakteri vortexing tarafından resuspend bitki materyali ile kuluçka için kullanılan aynı ortamda onları. Bu yöntem kaldırmak veya sayı veya hücre dışı malzeme ve exopolysaccharides, kapsül, flagellae ve/veya pili gibi ekleri miktarını azaltabilirsiniz. Bu yüzey yapıların korunacak önemli ise, sonra sadece onları aşı önce bakteri sulandırmak veya 3.2.2. adımda açıklanan alternatif yöntemi kullanın.
- Büyüme orta kaldırmak için alternatif bir yöntem bakteri nitroselüloz veya polikarbonat filtrenin gözenek boyutu 0.2 µm veya daha az olan üzerinde toplamak. Kuluçka orta bakterilerle yıkama ve onlara nazik sallayarak veya filtre Orta steril bir kap içinde vortexing tarafından resuspend.
4. aşı bakteri
- Bakteriyel yapışma belirlemek için kullanılacak ölçü referans ile aşılanmış bakteri sayısını ve kuluçka süresini belirler.
- Mikroskobik araştırmalar az 1 gün kez kuluçka içeren nispeten çok sayıda bakteri aşılamak. Son bir bakteri konsantrasyonu mL başına 10'dan fazla6 bakterilerin ulaşmak için kültür bir miktarda ekleyin. Uzun kuluçka süreleri için bakteriyel inoculum boyutunu küçültür.
- Hangi bakteri yapışma uygun hücre sayımları tarafından ölçülen çalışmalar eklemek için kültür 10 son bir bakteriyel konsantrasyon ulaşmak için bir miktar3 mL başına 106 bakteri için.
- O kadar çok bakteri metabolizmalarını kuluçka orta pH veya oksijen konsantrasyonu değişir eklemekten kaçının. PH pH kağıt veya bir elektrot kullanarak ölçmek. Oksijen konsantrasyonu bir oksijen elektrot kullanarak ölçmek.
- Kuma yetiştirilen bitkiler için üç farklı şekilde aşılamak.
- Bakteri ile tohum 1 dk. için tohum bir süspansiyon mL başına yaklaşık 106 bakterilerin suda ıslatarak ekimden önce aşılamak.
- Kök axenic fidan fide kök 1 cm uzunluğunda daldırma veya bir süspansiyon mL su 1 dakika başına 106 bakterilerin tüm fide yerleştirerek bölümünde 1 ve açıklandığı gibi takımıdır tarafından aşılamak.
- Kum mL başına yaklaşık 103 bakterilerin son bir konsantrasyon vermek ekimden önce kum ile bakteri karıştırma veya fide mL başına 106 bakterilerin bir süspansiyon ile Ekimden sonra sulama aşılamak.
5. bitki materyali ile bakterilerin kuluçka
- Bitki materyali steril su veya sukroz ve mineral tuzları ile bakteri sıvı ortamda kuluçka için kuluçkaya veya bitki doku kültürü Orta (1:10 gibi MS tuzları seyreltme)22,23.
- Hangi bakteri değil uygun bir kap kullanın. Bitki yüzey bulundurmaya çalışın batma veya yumuşak ajitasyon sürekli kapalı. Dinç ajitasyon yapışma önlemek veya hatta bitki yüzeyinden bakteri kaldırın.
- Işık mikroskobu bitki materyali inkübasyon durdurmak ve ölçümler yapmak ne zaman belirlemek için zaman aralıkları değişen sonra gözlemlemek. Bir zaman yapıştırılması kez her 1-4 h veya etkileşim hızına bağlı olarak her gün alınan örnekler ile değerli derstir.
- Kuma kuluçkaya için adım 5.1 sıvı ortamda kuluçka için açıklanan aynı önemli noktalar geçerlidir.
6. ölçüm mikroskobu kullanılarak yapıştırılması
- Kolay görüntüleme için Nomarski veya faz kontrast optik ile yüzeylerde Bakterilerin mikroskobik ölçümleri yapmak. Ancak, herhangi bir alan parlak mikroskop 20 X veya daha yüksek büyütme ile kullanılabilir.
- Mikroskobik gözlem bakteri rastgele dağıtılmış veya belirli sitelerde yer alan Eğer belirlemek için kullanın. Ayrıca onlar singly veya kümeleri bağlı olup olmadığını kontrol edin. Bakteriyel büyüme veya tuzak yapışma sonra düşündüren microcolonies varlığı için bak. Bakteri bir biyofilm yüzeyde form görünmektedir kontrol edin.
Not: Bir biyofilm bakteri yüzeye bağlı ve bir hücre dışı matriks23,24,25tarafından çevrili büyük bir sayıdır. Yapısı pürüzsüz ve düzgün veya daha karmaşık bir mimariye sahip. Bitki yüzeyler ile ilişkili biyofilmler eğitim yöntemleri tarif17olmuştur. - Bakteri floresan bir marker ile öğesini kullanın. Diğer bakteriler mevcut ve faiz bakteri gibi yeşil flüoresan protein flüoresan bir etiket tarafından tanımlanır, floresans mikroskobu diğer bakteri26kümelerdeki etiketli bakteri varlığı belirlemek için kullanın. GFP için bir filtre 490 nm uyarma ve 520 nm emisyon ile kullanın.
- Floresan etiketi olumsuz bakteri axenic vahşi türü bakteri ve Nomarski ve floresan optik kullanarak aynı baskı etiketli bakteri eşit bir karışımı malzemeden bağlılığı gözlemleyerek etkileyen değil kontrol edin. Floresan ve karanlık bakteri rasgele karışık ve eşit sayıda mevcut ise etiketi ile tahlil karışmaması.
- Mikroskobik gözlem bakteri rastgele dağıtılmış veya belirli sitelerde yer alan Eğer belirlemek için kullanın. Ayrıca onlar singly veya kümeleri bağlı olup olmadığını kontrol edin. Bakteriyel büyüme veya tuzak yapışma sonra düşündüren microcolonies varlığı için bak. Bakteri bir biyofilm yüzeyde form görünmektedir kontrol edin.
- Ekli bakteri sayısını belirleyin.
Not: Mikroskop ekli bakteri sayısını belirlemek çok zordur. Bağlama düzensiz bitki yüzeylere olduğunda genellikle nicel ölçüm almak mümkün değildir. Elektron mikroskobu (Bu makalede açıklanan değil) tarama böyle ölçümleri yapmak için kullanılabilir.- Bakteri kök saç gibi pürüzsüz bir yüzey bağlı zaman kök saç mm kök saç uzunluğu başına kenarına bağlı bakteri sayısını saymak. Kök tüyleri kabaca aynı boyutta ve ölçümleri karşılaştırarak şekil kullanmak için dikkat ediniz.
- Mikroskop nesneleri boyutunu belirlemek için bu üzerinde ölçülen işaretler ile ticari bir slayt kullanın. Gözlemlemek ve bu slayt olarak deneysel malzeme için kullanılan aynı değerlerinde fotoğraf ve elde edilen görüntüleri photomicrographs nesneleri boyutunu belirlemek için kullanın.
- Örnek için mikroskobu hazırlayın.
- Örnek yıkayın. Örnek bir damla su veya kuluçka orta için mikroskop slayt üzerinde taşımak ve doğrudan gözlemlemek.
Not: Bu olsaydı hiçbir bakteriyel büyüme veya gerçek bakteriyel ölüm orada olduğunu birçok ücretsiz bakteri olması olası avantajı vardır. Ücretsiz bakteri yokluğu olabilir ki bakteriyel ölüm ya da bakteriyel bağlama içinde kuluçka gerçekleştirildiği kapsayıcısına bir uyarı işareti olarak almak. Örnek yıkama etkisini Şekil 1' de gösterilen. - Örnek nazikçe yıkayın su veya kuluçka ortamda sıvı bir şişede yerleştirerek ve flakon yavaşça ters çevirme. Sonra örnek gözlem için taze sıvı içinde mikroskop slaytta yer.
- Bir sıradan kapak astarlı ve mikroskop slayt kullanarak sıvı örneğinde bağlayın.
- Örnek kalın ise ve kapak notu altında bir çıkıntı yapar, press-apply kapak notu kullanın. Bu kapak paket fişi kauçuk veya plastik kapak notu kenarındaki bir yüzüğüm var. Sıvı ve örnek kapak notu kuyuda yerleştirin ve sonra slayt üstüne yerleştirin ve slayt kapak dekonta imzalamaya hafifçe bastırın. Ters çevir ve inceleyin.
- Alternatif olarak slayt ve kapak kayma benzer bir şekilde sayma bir yosun kullanın. Not Slaytları bu derinliği genellikle 20 X büyütme daha büyük bir objektif lens ile muayene edemem.
- Örnek yıkayın. Örnek bir damla su veya kuluçka orta için mikroskop slayt üzerinde taşımak ve doğrudan gözlemlemek.

Resim 1 : Hazırlanmasında bağlı bakteri sayısını belirlemek için bir örnek adım. A. tumefaciens bağlama domates kök tüyleri (A, B ve C) ve naylon konu (D, E ve F). Su olmadan hem yıkama bakteri (siyah oklar) bağlı ve ücretsiz bakteri (beyaz ok) görülebilir monte örnekleri (A ve D). Yıkandıktan sonra ilişkili bakteriler kalır, ancak ücretsiz bakteri yok daha uzun mevcut (B ve E) vardır. Sonra sonication ilişkili bakteriler örnek yüzey (C ve F) kaldırılmıştır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
- Floresan bakteri kullandıysanız, kum kaldırıldıktan sonra mikroskop örnekte inceleyin. Kum parçacıkları bakteri gözlem ile müdahale gibi kuma yetiştirilen bitkilerin kökleri genellikle Mikroskopi için uygun değildir.
- Bitki büyüme konteyner adım 7 göre kaldırın. Kökleri su bir kapsayıcısına getirin ve karışımı yavaşça kabın altına razı olacak kum çıkarmak için.
- Bitki yıkama sudan çıkarın ve örnekte olduğu gibi adım 6.3.3 mount.
7. ölçüm kullanarak geçerli hücre adezyon sayar
- Bir sonicator kullanarak kalıcı ekli bakteri sayısını belirleyin.
- İlişkisiz bakteri kaldırın. Örnek arabellek veya kuluçka orta bitki materyali kapsar ve birkaç kez şişeyi ters yıkama yeterli su ile bir şişe yerleştirin.
- 10'dan fazla3 ücretsiz bakteri mL başlangıç kuluçka mevcut başına olsaydı, bunların tümünü kaldırmak için sıralı yıkama gerçekleştirin. Bir ışık mikroskobu kontrol edin (bkz. Adım 6.3) ücretsiz bakteri olup olmadığını belirlemek için.
- Ücretsiz bakteri sayısı önemli bir azalma olana yıkayın ama ücretsiz bakteri sayısı hiç sıfıra azaltmak bu yüzden ilişkili ve ilişkisiz bakteriler arasında bir denge olduğunu unutmayın.
- Örnek bir forseps veya spatula ile sıvı yıkama şişe kaldırın.
- İncubations sıvı bitkilerin ilişkili bakteri sayısını belirleyin.
- Bir şişe içinde yıkanmış örnek askıya alma ve ölçülü miktarda su, kuluçka orta veya çamaşır arabellek ile kaplayın. Yeterli sıvı örnek kapsayacak şekilde kullanın. Bir banyo sonicator şişe yerleştirin ve bir dakika için solüsyon içeren temizleyicide.
- Örnek kaldırmak ve ilişkili bakteriler bitki kaldırılması olup olmadığını belirlemek için ışık mikroskop altında incelemek. Bir örnek tarafından sonication bakterilerden kaldırılması Şekil 1' de gösterilen. Yoksa hala ilişkili bakteriler mevcut örnek gibi ilişkili hiçbir bakteri örnek yüzeyinde kalır bir saat kadar sonicating devam edin. İlişkili bakteriler sonication tarafından kaldırılamazsa, 1-10 mg/mL steril Kuvars kum ekleyin ve sonication ve mikroskobik inceleme yineleyin.
- Adım 7.1.3.2 en etkili görünen sonication yordamı bakteri canlılığı sonication için kullanılmak üzere çözüm sıvı kültüründe bakterilerden askıya tarafından azaltmaz olduğunu belirlemek (gerekli Kuvars kum, ekleyin). Geçerli hücre sayısını belirler. Bakteri solüsyon içeren temizleyicide ve uygun hücre sayısı yeniden belirlemek.
Not: geçerli hücre sayısında bir azalma ise, yordam tedavi uygulanabilir hücre sayısı üzerinde hiçbir etkisi kadar sıvı ve/veya sonication zaman kompozisyon değiştirerek değişiklik. - Geçerli hücre sayımları için kullanılan seyreltme arabellek geçerli hücre sayısı farklı seyreltme arabellekleri ve/veya su kullanılarak yapılan karşılaştırma tarafından kullanılan koşullar altında inkübe bakteriler canlılığı etkilemez belirlemek.
- İlişkisiz bakteri kaldırın. Örnek arabellek veya kuluçka orta bitki materyali kapsar ve birkaç kez şişeyi ters yıkama yeterli su ile bir şişe yerleştirin.
- Homojenizasyon kullanarak kalıcı ekli bakteri sayısını belirleyin.
- Örnek steril bir harç veya blender veya diğer homojenizasyon aygıt ekleyin. Steril su, kuluçka orta veya arabellek27yıkama ölçülen hacmi ile bin yeter. Örnek karşılamak için yeterli bir birim kullanacak. Bir blender için 100 mL kullanın.
- Örnek de homojenize oluncaya kadar eziyet. Bitki dokudan yayımlanan homojenizasyon emin olmak için bu asit pH 7 aşağıda içinde keskin bir düşüş neden olmayacağından sonra pH kontrol edin. PH düşmüştür bir arabellek fosfat tampon gibi homojenizasyon sıvı pH korumak için kullanın.
- Geçerli hücre sayısını belirler.
- Bakterilerin antibiyotik direnci ile işaretlenmiş kullanın.
- Bakteri birden fazla türü mevcut olduğu durumlarda, bakteri suşlarının antibiyotik (genellikle rifampisin ve nalidixic asit) spontan direnç kullanarak işaretleyin.
- Antibiyotik kullanmak için düzeyini belirleyin. Kuluçka içinde bulunması beklenen diğer organizmalar kültürleri yoksa, antibiyotik yetiştirilen bitkiler seçilmiş konsantrasyonları bir aralığını içeren plakaları ile amaçlanan kuluçka koşulları altında bu kültürler plaka. Herhangi bir bu organizmaların büyümesini izin vermeyen en düşük konsantrasyonu belirlemek. Bu en düşük konsantrasyon antibiyotik için test bakteri dayanıklı olması gerekecektir.
- Spontan antibiyotik dirençli mutantların edinin. Bakteri kültürü zengin Orta için geç günlüğü veya durağan faz büyümek. Plaka 0.1 mL uygun bir konsantrasyon, istenen antibiyotik içeren bir plaka üzerine su katılmamış. 7.3.1.1 adımda anlatıldığı gibi kullanmak için konsantrasyonları belirlemek. Devam et ve büyümek ve böylece için antibiyotik dirençli bakteri arındırmak.
- Antibiyotik direnci bakterilerin büyümesini bir büyüme eğrisi üst ve antibiyotik dirençli suşların sıvı ortamda yaparak azaltmaz olduğunu belirlemek. Eğer bu mümkün antibiyotik dirençli bakteri axenic bitki materyali kolonizasyon üst soy olarak aynı düzeyde görüneceğini belirlemeye.
- Bakteri birden fazla türü mevcut olduğu durumlarda, bakteri suşlarının antibiyotik (genellikle rifampisin ve nalidixic asit) spontan direnç kullanarak işaretleyin.
- Kuma yetiştirilen bitkiler bağlı canlı bakteri sayısını belirleyin.
- Bitki konteyner ve kum çıkarın. Bitkilerin kaplarından kaldırmak için önce üst ve alt kapsayıcı üzerinde sızdırmazlık malzemeleri temizleyin. Kap bir steril kağıt parçası yerleştirin ve yavaşça yavaşça konteyner malzeme gevşetmek için bir yüzeye karşı eleştiri tarafından bir büyük konik silindir tüm kum veya toprak ve bitki çıkarın.
- Gerekirse, bir spatula veya çubuk malzeme konteyner alttan giriyor kenarlarda gevşetmek için kullanın.
- Kum veya bitki içeren toprak silindir kağıt üzerinde özgür olduğunda, bitki kök ortaya çıkarmak için ortadan bölünmüş. İsterseniz, örnek kapsayıcı kenarı yakınındaki yanı sıra kök yakınındaki gelen kum taneleri almam. Bu yayılmış (ve birikimi ve büyüme) bakteri belirlemek yararlı olabilir.
- Kök uzunluğu ölçmek. Kök almak ve çıkarmak belgili tanımlık kum ve gevşek kök (rizosferde malzeme) ölçülen miktarda su veya arabellek kökte daldırma ve hafifçe sallayarak kalarak bakteri. Luria agar gibi uygun bir ortam üzerine kaplama tarafından elde edilen süspansiyon yer alan bakteriler uygun hücre sayısını belirler. Bu gevşek kökle ilişkili bakteri sayısını temsil eder.
- Bitki konteyner ve kum çıkarın. Bitkilerin kaplarından kaldırmak için önce üst ve alt kapsayıcı üzerinde sızdırmazlık malzemeleri temizleyin. Kap bir steril kağıt parçası yerleştirin ve yavaşça yavaşça konteyner malzeme gevşetmek için bir yüzeye karşı eleştiri tarafından bir büyük konik silindir tüm kum veya toprak ve bitki çıkarın.
- Sonication tarafından sıkı bir şekilde bağlı bakteri kaldırın ve 7.1 adımda anlatıldığı gibi sayıları belirler.
- Alternatif olarak, belirlemek için sıkı bir şekilde bağlı bakteri kök konumunu yerleştirin yıkanmış kök besin agar veya uygun ortamı içeren bir petri yüzeyinde. Bakteri kolonileri kök konumunu önümüzdeki 3 gün bir diseksiyon mikroskop veya büyüteç kullanarak gözlemlemek.
- Bitki başına, cm2 yüzey alanının başına, cm kök uzunluğu veya başına gram taze ağırlık doku bakteri sayısı olarak sonuçları hızlı. Birden çok çoğaltır aynı gün ve aynı zamanda farklı günlerde farklı bakteri kültürleri ve farklı çok sayıda bitki materyali kullanarak çoğaltır.
8. bir yapışma etkisi kuluçka koşulları nedeniyle bakteri veya bitki yanıt olup olmadığını belirleme
- Ölü ya da maktul bitki malzeme kullanın.
- Onu öldürmek için bitki kimyasalları, fiksajlar veya ısı gibi diğer tedaviler çeşitli malzeme tabi. Bitki materyali su ve kuluçka ortamda herhangi bir bu tedaviler kullanımdan sonra iyice yıkayın. Sonra bakteri aşılamak. Bu bitki yüzeyi yok değil ama böylece bakteriler için yanıt veremiyor metabolik olarak etkin olmayan yapacaktır.
- Bakteriyel yapışma 6 ve/veya 7 adımda açıklandığı gibi ölçmek. Ayrıca başında bitki materyali ile Kuluçka kuluçka ve hücrelerin hiçbir toksik kimyasal madde kuluçka sırasında mevcut sağlamak için kuluçka sonunda mevcut sayısı eklenen hücrelerin sayısını belirleyin.
- Cansız malzeme kullanın.
- Malzeme bitki üzerinde bakteriyel bağlılık görülen bir etkisi olup olmadığını belirlemek için cansız malzeme kullan bakteriyel bağlılık bitki veya bakteri üzerinde etkisi kaynaklanmaktadır. Hangi bakteri bağlamak ve okudu bitki materyali şekil ve boyut olarak benzer olduğu için cansız bir malzeme seçin. Filtre kağıtları her çeşit (selüloz, nitroselüloz, cam elyaf, polikarbonat, vb), konu (naylon, pamuk, polyester, cam yünü, vb), cam veya plastik coverslips, paslanmaz çelik Kuponlar ve diyaliz olanakları dahil membranlar.
- Cansız malzeme iyice su ve kuluçka yapılacaktır ve kullanmadan önce sterilize orta yıkayın. 8.2.1. adımda listelenen malzemelerin çoğu sterilizasyon ısıyla tarafından stabildir.
- 6 ve 7 numaralı adımlarda açıklandığı gibi puanı ve istenen koşulları altında cansız malzeme kuluçkaya. A. tumefaciens azaltılmış bağlama için kök tüyleri yüksek kalsiyum konsantrasyonlarda kaynaklanmaktadır belirlemek için naylon konu kullanımı örneği (en azından kısmen) kalsiyum bakteri üzerinde etkisi için Şekil 428içinde gösterilir.
Sonuçlar
A. tumefaciens kök yüzeyleri colonizes. Selüloz bakteriyel üretim kök kolonizasyon içinde bir rol çalýp selüloz sentez önlemek bakteri mutasyonların etkileri olduğunu belirlemek amacıyla16inceledi. 1.3 ve 7.1 adımlarda açıklanan teknikleri kullanılmıştır. Domates tohumları steril ve steril su germinated yüzey vardı. Kökleri yaklaşık 2 cm uzunluğunda iken onlar mL başına 105 bakterilerin bir süspansiyon daldırma ve pastörize toprak kaplarda ekili. Bitkiler için 25 ° c 14 gün 12 saat ışık/12 s karanlık döngü üzerinde yetiştirilen vardı. Sonra bitkiler kez belirtilen kapsayıcılardan çıkarıldı. Kökleri yıkanmış ve ilişkili bakteriler kaldırmak için bir banyo sonicator sonicated. Bakteriyel numaraları canlı hücre sayımları kullanılarak belirlenmiştir. Şekil 2 bakteri yeteneğini domates kökleri kolonize iki farklı selüloz-eksi mutasyon etkisini gösterir. Bazı ölçümler standart sapmalar olmasına rağmen 0,910 (a ortak problem ile bu tür bir ölçüm) oturum kadar bağlama azalma selüloz-eksi mutantların açıkça belirgin olduğunu ve biz bu bakteri üretimi sonucuna varabiliriz Selüloz bakteri domates kökleri kolonizasyon yardımcı olur.
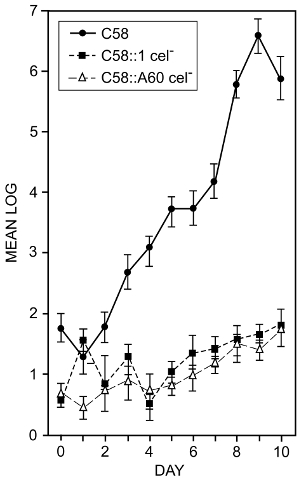
Resim 2 : Kök vahşi türü ve A. tumefaciensselüloz-eksi mutantlar tarafından kolonizasyonu. Günlük10 cm kök uzunluğu domates kökleri kurtarılan başına bakteri toplam sayısı vahşi türü A. tumefaciens zorlanma C58 ve selüloz-eksi mutantlar C58:1 ve C58:A60 ile aşılanmış. Gösterildiği anlamına gelir en az dört ayrı deney sayılardır. Çubuklar anlamına gelir standart sapmalar gösterir. Kökleri bir süspansiyon mL bir dakika başına 105 bakterilerin daldırma tarafından aşılanmış. Bitkiler kaplarda yetiştirilmiştir ve gevşek yapisan bakteri arabellekte bir cam şişe yıkama olarak kökleri yıkama tarafından çıkarıldı. Sıkıca yapışık bakteri bir banyo sonicator ve uygun hücre16sayar belirlemek için kaplama elde edilen süspansiyon kullanarak kaldırıldı. Bu rakam, Matthysse ve McMahan değiştirildi. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Exopolysaccharides yonca filizi için diğer bakteri ve E. coli bağlamada rolü incelenmiştir. İshal hastalığı nedeniyle E. coli O157: H7 bazı salgınları kirlenmiş yonca filizi takip edilmiştir. Bağlama vahşi tipi bakteri ve mutantlar çeşitli exopolysaccharides yapamıyoruz 1.1, 5.1 ve 7,2 adımlarda açıklanan yöntemleri kullanarak ölçüldü. Yonca filizi steril ve steril su 25 ° c karanlıkta bir günlüğüne germinated yüzey vardı. Dört lahanası ile ekli tohum ceket 5 mL su içeren steril plastik yemekleri yerleştirildi. Luria suyu yetiştirilen bakteri için son bir konsantrasyon yaklaşık 5 x 10 mL3 eklendi. İnoculated filizi 3 gün boyunca karanlıkta 25 ° C'de inkübe. Filizi iki kez suda 5 mL steril bir şişe dinç INVERSION tarafından yıkanmış ve motorlu tahrik Teflon cam homogenizer kullanarak arabellek yıkama homojenize. Bakteri kullanarak önceki deneyleri içselleştirilmiş bakteri yüzey bakteri kolayca tespit edildi, ancak gösterdi GFP gen taşıyan bir plazmid ile işaretlenmiş. Sonuçları Tablo 1' de gösterilmiştir. E. coli O157: H7 iki soyu incelenmiş. Her iki suşlar poli-β-1,6-glucuronic acid(PGA) üretim yüzeyler bitki için patojen E. coli bağlama için en büyük katkı yapmak için ortaya çıktı. Kolon asit de bağlama içinde önemli bir rol oynadı. Selüloz-eksi mutantlar bağlamasında azalma önemli iken diğer iki polisakkaritler için bu kadar büyük değildi.
| Exopolysaccharide üretim genlerdeki mutasyonlar bağlama, E. coli O157: H7 lahanası ve açık tohum kat üzerine etkileri | |||
| Bakteriyel zorlanma | Mutasyon veya genotip (ilgili fenotip) | Filiz veya tohum kat günlük10 numarası bakterilerin bağlı | |
| B yonca filizi | Açık tohum kat | ||
| 86-24 | Yok (vahşi türü) | 4.7 ± 0,6 | 5.6 ± 0.2 |
| 8624N | yhjN (selüloz-eksi) | 2.9 ± 0.7c | 3.5 ± 0.6c |
| 8624C | wcaD (kolon asit-eksi) | 1.8 ± 0.7c | 2.4 ± 0.5c |
| 8624P | pgaC (PGA-eksi) | < 1.0c | 1.0 1.0 ±c |
| DEC4A | Yok (vahşi türü) | 5.6 ± 0.2 | 6.1 ± 0,3 |
| DEC4AN | yhjN (selüloz-eksi) | 4.8 ± 0,8d | 4.1 ± 0,8d |
| DEC4AC | wcaD (kolon asit-eksi) | 3.9 ± 0.5c | 4.8 ± 0,8d |
| DEC4AP | pgaC (PGA-eksi) | < 1.0c | 1.2 ± 0.7c |
| en az 3 gün sonra bağlı bakteri (günlük10) sayısının üç ölçümlerin ortalama ± standart sapması. | |||
| b lahanası ölçüm önce yıkanmış. | |||
| c vahşi türünden önemli ölçüde farklı: P < 0,01. | |||
| d önemli ölçüde vahşi türünden farklı: P < 0,05. | |||
| Bu tablo Matthysse, Deora, Mishra ve Torres10değiştirildi. | |||
Tablo 1: bağlama, exopolysaccharide üretim genlerdeki mutasyonlar etkileri E. coli O157: H7 için filizlenir. Çeşitli exopolysaccharides ve lipopolysaccharide bağlama, patojenik rolü belirlemede E. coli O157: H7 suşları yonca filizi, mutantlar lahanası ve açık tohum kat kümesi bağlama için muayene yöntemleri kullanarak 6. adımda açıklanan. Sonuçlar gösterdi o poli-β-1, 6 -N-asetil-D-glucosamine (PGA) lahanası bağlama için gerekli gibi görünüyor ve bu selüloz, colanic asit, E. coli O157 en fazla bağlama için gereklidir. Bu tablo Matthysse, Deora, Mishra ve Torres10değiştirildi.
PGA üretim yüzeyler, PGA için gerekli genler kodlama klonlanmış operon taşıyan bir plazmid (pMM11) bitki bakteriyel bağlama neden için yeterli olup olmadığını belirlemek amacıyla üretim-cekti değil iki farklı bakteri tanıtıldı Normalde domates kökleri10içinbağlamak mümkün. A. tumefaciens A1045 bir mutant vahşi türü baskı C58 döngüsel-β-1,2 glukan yapmak başarısız olur ve ayrıca yüzeyler29bitki bağlamak başarısız olduğunu. Sinorhizobium meliloti kök nodüller yonca üzerinde oluşturan 1021 sigara baklagiller için bağlamak başarısız domates12de dahil olmak üzere. 1.1, 5.1, 6.3 ve 7.1 adımlarda açıklanan teknikleri genellikle PGA yapma yeteneğini bakteriyel bağlama kök yüzeyleri için artan belirlemek için kullanılmıştır. Domates tohumları steril ve steril su germinated yüzey vardı. Kökleri 1 cm uzunluğunda parçalara kesip ve steril su yerleştirilir ve bakteri aşılanmış. Bu iki tür bakterilerin farklı oranlarda büyüdükçe, bağlama kabaca eşit miktarda bakteriyel büyüme için izin vermek için farklı zamanlarda ölçüldü. Plazmid pMM11 varlığı, her iki tür (Tablo 2)10ilişkili bakteriler sayısında benzer önemli bir artış neden oldu. Bağlama önemli bir artış da ışık mikroskobu görüldü ama bağlama iki tür (Şekil 3) için çok farklıydı. A. tumefaciens A1045 bireysel bakteriler kök yüzeyibağlı. S. meliloti hangi büyük kümeler halinde sadece birkaç bakteri doğrudan kök dizinine bağlı olduğunu ve bakterilerin çoğunluğu diğer bakterilere bağlı olduğunu bağlı. Bu örnek sadece mikroskobik gözlemler dahil olmadan bağlı bakteri sayıda analiz bir denemenin sonuçları yanıltıcı bir izlenim verebilir gösterir. Her iki Yöntem (canlı hücre sayımları ve mikroskobik gözlemler) o pMM11 domates kökleri için bakteriyel bağlama artış göstermesine rağmen PGA üretim tarafından neden olduğu bağlama türü için iki bakteri10farklı oldu.
| Bağlama, bakteri domates kökleri için plazmid pMM11 etkisi | ||
| Bakteriyel zorlanma | Plazmid | Mm kök uzunluğu bağlı bakteri sayısı |
| A. tumefaciens A1045bir | hiçbiri | 0,25 x 103 ± 0,25 x 103 |
| pBBR1mcs (vektör) | 0,25 x 103 ± 0,25 x 103 | |
| pMM11 (PGA sentezi) | 10 x 103 ± 0,25 x 103 | |
| S. meliloti 1021b | hiçbiri | hiçbiri algılandı |
| pBBR1mcs (vektör) | hiçbiri algılandı | |
| pMM11 (PGA sentezi) | 50 x 103 ± 5 x 103 | |
| Bakteriyel bir bağlama 2 saat sonra ölçüldü | ||
| b bakteriyel bağlama ölçü 18 saat sonra yapıldı. | ||
| Bu tablo Matthysse, Deora, Mishra ve Torres10değiştirildi. | ||
Tablo 2: genler PGA sentezi için bağlama üzerinde taşıyan bir plazmid etkisini A. tumefaciens A1045 ve S. meliloti domates kök kesimine 1021. Poli-β-1, 6 - yetenek incelemek içinN-asetil-D-glucosamine (PGA) bitki için bağlama bakterilerin tanıtmak için kökler, iki bitki ilişkili bakteri suşları bağlama üzerinde PGA (pMM11) yapma yeteneği veriyor bir plazmid etkisi domates kökleri inceledi. Ne tür bakteri domates kökleri için önemli bağlama PGA sentezi (pBBR1mcs) kodlama genler plazmid veya plazmid varlığında yokluğunda gösterdi. PGA sentez genleri taşıyan plazmid eklenmesiyle bağlama her iki tür bakteri tarafından arttı. Çünkü A. tumefaciens S. meliloti bağlama, kuluçka A. tumefaciens için 2 h sonra ve sonra 18 h S. melilotiiçin ölçüldü daha hızlı büyür. 7. adımda açıklananlar kullanılan teknikler vardır. Bu tablo Matthysse, Deora, Mishra ve Torres10değiştirildi.
Şekil 3 : Plazmid pMM11 etkisini A. tumefaciens A1045 ve S. meliloti 1021 domates kök tüyleri için bağlama üzerinde PGA biyosentezi genleri taşıyan. Domates kök tüyleri a bağlama) A. tumefaciens A1045, B) A. tumefaciens A1045 pMM11, C) S. meliloti 1021 ve D) S. meliloti 1021 pMM11. Işık mikroskobu görüldüğü gibi bağlama ayrıntılarını bağlama iki bakteri türlerinin artış aşağı yukarı benzer olmasına rağmen oldukça farklıdır. 6. adımda açıklananlar kullanılan teknikler vardır. Bu rakam Matthysse, Deora, Mishra ve Torres10değiştirildi. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
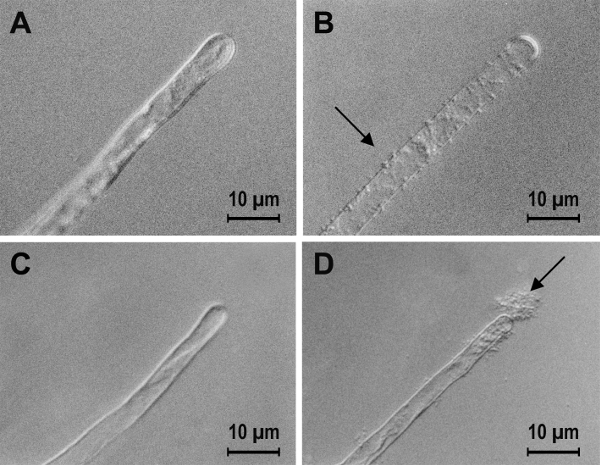
Bazen bakteri ve belirli bir etkileşim içinde bitkinin katkı ayırt yardımcı olmak için bağlama biyolojik olmayan yüzeylerde kullanmak mümkündür. A. tumefaciens tek kutuplu polysaccharide(UPP) her iki biyolojik ve biyolojik olmayan yüzeyleri30çeşitli bakteri bağlama aracılık edebilmek için gösterilmiştir. Kalsiyum tarafından UPP28aracılı yüzeyler tesisi için A. tumefaciens bağlama etkisizleştirmek için gözlendi. Kalsiyum iyonları tarafından inhibisyonu yüzeyler tesisi için bakteriyel bağlama bakteri veya bitki yüzeyinde bir etkisi nedeniyle olup olmadığını belirlemek için naylon konu için bakterilerin bağlama incelenmiştir. Teknikler açıklanır adımda 8.2 kullanılmıştır. Domates tohumları sterilize ve 1. adımda açıklandığı gibi suda germinated yüzey vardı. Bakteri sükroz ile en az orta yetiştirilen ve domates kökleri veya naylon konu yaklaşık 105/mL son bir konsantrasyon, 5.1 adımda anlatıldığı gibi eklendi. Domates kökleri ve naylon konu bakteriyel bağlama CaCl2 eklendi etkisi mikroskobu incelenmiştir. Şekil 4 tarafından her iki yüzey kalsiyum öncelikle bakteri10üzerinde etkisidir düşündüren kullanarak kalsiyum bağlama benzer inhibisyonu gösterir.

Şekil 4 : A. tumefaciens bağlama domates kök tüyleri ve naylon iplik için kalsiyum etkisi. A. tumefaciens inkübe domates kökleri (A ve B) veya naylon konu (C ve D) için 24 h ile bir 1:10 seyreltme MS tuzları ve 1:20 seyreltme AB en az orta, % 0,4 sukroz (A ve C) veya 1:10 seyreltme MS tuzları ve 1:20 seyreltme AB en az orta , % 0,4 Sükroz içeren 60 mM CaCl2 (B ve D)31. 2 eklendi CaCl bakteriyel bağlama kökleri ve inhibisyon öncelikle nedeniyle bakteri yerine bitki yüzeyinde bir etkisi olduğunu mu ima naylon konu inhibe. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Tartışmalar
Tüm yüzeyler için bakteri deneme sırasında uygun haberdar olmak önemlidir. Geçerli hücre sayımları yapılırsa cam bağlama yeteneğine sahiptirler bakteriler böylece hafife cam tüpler ve pipetler kullanarak. Sonra bitkiler agar veya toprak ve agar bazıları yetiştirilir veya toprak bitkiler üzerinde kalır bakteri yapışan malzeme yerine bitkiler bağlamak. Öte yandan, özellikle kökleri, söz konusu olduğunda bitki yüzey yıkama doğal yüzey kaplamaları gibi kaldırabilir müköz ve böylece bağlılık test sonuçları.
Kuluçka karışıma eklenen bakteri deneme sırasında hayatta kalmak emin olmak önemlidir. Böylece uygun hücre sayımları ücretsiz hem de ekli bakterilerin düzenli olarak yapılmalıdır. Bazı tedaviler veya bakteriyel mutasyonlar bakteriyel büyüme oranını azaltmak veya aslında bakteriyel nüfusun bir kısmı ölüm sebebi. Özel lekeleri kullanılmadığı sürece canlı ve ölü bakteriler mikroskobu ayırt olabilir. Canlı/ölü bakteriler için bir yararlı leke kit boyalar hariç yaşayan bakterilerden bağlıdır vardır. Ancak, nüfus bakteri varsa o zaman uygun hücre sayımları ilgi tür kuluçka bakteriyel ölümle sonuçlanan olup olmadığını belirlemek için en kolay yöntem olması muhtemeldir.
Orta kompozisyon bakteriyel hayatta kalma ve büyüme etkiler. Kök çıktı ve yaradan serbest ve siteleri kesmek malzeme substrat mütevazı bakteriyel büyüme destek sağlayacaktır. Fosfat, azot ve demir bu şartlarda sınırlama eğilimindedir. Kalsiyum ve magnezyum gibi divalent katyonlar yapışma etkileyebilir. Bazı durumlarda karbon kaynağı yapışma etkisi altına alabiliyor. pH da önemli. Genel olarak rizosferde pH 5.5 6,5 arasındadır.
Bakterilerin antibiyotik direnci ile işaretlenmiş kullanırken dikkatli olması gereklidir. En sık kullanılan antibiyotikler rifampisin ve nalidixic asit vardır. Bu antibiyotiklere direnç olduğunu genellikle nedeniyle kromozom genlerdeki mutasyonlar (RNA polimeraz ve gyrase yapılabilir, sırasıyla) ve böylece kolayca başka bir soy için kuluçka sırasında transfer edilemez. Bu tür bir direnç de bozulma ya da antibiyotik modifikasyonu yol açmaz. Plazmid herhangi bir diğer bakteri transfer edilemez sürece bakteri gen plazmid kaynaklı marker ile işaretleme önerilmez. Antibiyotik hassas bakteri sonra eğer onlar yakın dirençli bakterilerin bulunduğu antibiyotik tabaklarda büyümek mümkün olacak gibi antibiyotik direnci antibiyotik bozulma ya da kimyasal değişiklik nedeniyle olmaması gerekir.
Bu makalede açıklanan yöntemleri örnekleri (örneğin, insan patojenleri içeren deneyler) bulunması gereken yere küçük örnek boyutları ve/veya deneyler için yararlı olur. Örneklerin boyutu büyük (yukarıda Malzeme ya da 50'den fazla bitki 100 g) için diğer yöntemleri veya bu yöntemlerin köklü değişiklik gerekli10,19,32,19,33, olur 34 , 35 , 36. mikroorganizmaların okudu türler dışında çok sayıda varlığı da önemli sorunlar oluşturabilir. Olası çözümler 6.1.2 ve 7.3 adımlarda açıklandığı gibi bir floresan protein veya antibiyotik direnci ile işaretlenmiş bakteri kullanımını içerir. Bakteri ilgi diğer mikroorganizmaların büyük bir nüfus içinde nadir kişiler vardır ancak, bu işaretleri okudu bakteri sayıda benzersiz bir değerlendirmesini sağlamak yeterli olmayabilir.
Tüm yöntem tanımlamak burada dayalı laboratuvar yöntemleri vardır. Küçük değişiklikler sera çalışmaları için gerekli olacaktır. Daha önemli değişiklikler nerede deneyler için tanımlanmış koşulların sağlanması tek hücreli, böcek ve diğer hayvan predasyona ve İklim değişimi karmaşık hale saha çalışmaları için gerekli olması muhtemeldir. Gelecekte bu yöntemlerin bitki yüzeyinde iki veya daha fazla mikroorganizmaların etkileşimleri dahil etmek uzatılabilir.
Açıklamalar
Yazar hiçbir rakip mali çıkarlarının olduğunu bildirir.
Teşekkürler
Yazar Susan Whitfield hazırlanması rakamlar ve Camille Martin ve Hillary Samagaio yardım için bazı deneyler için teşekkürler.
Malzemeler
| Name | Company | Catalog Number | Comments |
| light microscope | any | N/A | phase contrast or Nomarski optics are helpful, for studies using fluorescent markers a fluorescence microscope is required. |
| seeds | any | N/A | make a note of the seed lot number and the cultivar |
| bleach | any | N/A | |
| bath sonicator | any scientific supply company | N/A | |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| nutrient agar | Difco | 001-01-8 | |
| soytone | Difco | 24360 | |
| Sand | sea sand Fisher Scientific | S25 | |
| sand | Sigma-Aldrich | S9887 | |
| conetainers | Stuewe & Sons, Inc. | Ray-Leach cone-tainers | many different sizes are available to suit the type of plant you wish to grow |
| parafilm | any scientific supply company | N/A | |
| MS salts | Sigma-Aldrich | M5524 | |
| parrafin | any | N/A | |
| centrigfuge | any scientific company | N/A | to pellet most bacteri only a small centrifuge with a max force of 10,000 XG is needed |
| vortex mixer | any scientific company | ||
| micrometer | ACCU-SCOPE Accessories | A3145 | |
| Sedgwick-rafter counting cell | Hauser Scientific | HS3800 | |
| probe-clip press-seal incubatin chamber | Sigma-Aldrich | Z359483 | |
| rifampicin | Sigma-Aldrich | R3501 | |
| naladixic acid | Sigma-Aldrich | n8878 | |
| Live/dead stain | In Vitrogen Molecular Bioprobes | L7007 |
Referanslar
- Heaton, J. C., Jones, K. Microbial contamination of fruit and vegetables and the behaviour of enteropathogens in the phyllosphere: a review. J. Appl. Microbiol. 104, 613-626 (2008).
- Beuchat, L. R. Ecological factors influencing survival and growth of human pathogens on raw fruit and vegetables. Microbes Infect. 4, 413-423 (2002).
- Berger, C. N., et al. Fresh fruit and vegetables as vehicles for the transmission of human pathogens. Environ. Microbiol. 12, 2385-2397 (2010).
- Lugtenberg, B. J., Chin, A. W. T., Bloemberg, G. V. Microbe-plant interactions: principles and mechanisms. Antonie Van Leeuwenhoek. 81, 373-383 (2002).
- Preston, G. M., Haubold, B., Rainey, P. B. Bacterial genomics and adaptation to life on plants: implications for the evolution of pathogenicity and symbiosis. Curr. Opin. Microbiol. 1, 589-597 (1998).
- Compant, S., Duffy, B., Nowak, J., Clement, C., Barka, E. A. Use of Plant Growth-Promoting Bacteria for Biocontrol of Plant Diseases: Principles, Mechanisms of Action, and Future Prospects. Appl. Environ. Microbiol. 71, 4951-4959 (2005).
- Mathews, S. L., Smith, R. B., Matthysse, A. G. A comparison of the retention of pathogenic Escherichia coli. O157 by sprouts, leaves and fruits. Microb. Biotechnol. 7, 570-579 (2014).
- Fuqua, C., Matthysse, A. G. Methods for studying bacterial biofilms associated with plants. Methods Enzymol. 337, 3-18 (2001).
- Torres, A. G., Jeter, C., Langley, W., Matthysse, A. G. Differential binding of Escherchia coli.O157:H7 to alfalfa, human epithelial cells, and plastic is mediated by a variety of surface structures. Appl. Environ. Microbiol. 71, 8008-8015 (2005).
- Matthysse, A. G., Deora, R., Mishra, M., Torres, A. G. Polysaccharides cellulose, poly-beta-1,6-n-acetyl-D-glucosamine, and colanic acid are required for optimal binding of Escherichia coli O157:H7 strains to alfalfa sprouts and K-12 strains to plastic but not for binding to epithelial cells. Appl. Environ. Microbiol. 74, 2384-2390 (2008).
- Matthysse, A. G., et al. The effect of cellulose overproduction on binding and biofilm formation on roots by Agrobacterium tumefaciens. Mol. Plant Microbe Interact. 18, 1002-1010 (2005).
- Matthysse, A. G., Kijne, J. W., Spaink, H. P., Kondorosi, A., Hooykaas, P. J. J. Attachment of Rhizobiaceae to plant cells. The Rhizobiaceae. , 235-249 (1998).
- Matthysse, A. G. Conditioned medium promotes the attachment of Agrobacterium tumefaciens.strain NT1 to carrot cells. Protoplasma. 183, 131-136 (1994).
- Matthysse, A. G., McMahan, S. The effect of the Agrobacterium tumefaciens. attR mutation on attachment and root colonization differs between legumes and other dicots. Appl. Environ. Microbiol. 67, 1070-1075 (2001).
- Jeter, C., Matthysse, A. G. Characterization of the binding of diarrheagenic strains of E. coli.to plant surfaces and the role of curli in the interaction of the bacteria with alfalfa sprouts. Mol. Plant Microbe Interact. 18, 1235-1242 (2005).
- Matthysse, A. G., McMahan, S. Root colonization by Agrobacterium tumefaciens is reduced in cel, attB, attD, and attR mutants. Appl. Environ. Microbiol. 64, 2341-2345 (1998).
- Morton, E. R., Fuqua, C. Phenotypic analyses of Agrobacterium. Curr. Protoc. Microbiol. , (2012).
- Brandl, M. T. Plant lesions promote the rapid multiplication of Escherichia coli O157:H7 on postharvest lettuce. Appl. Environ. Microbiol. 74, 5285-5289 (2008).
- Franz, E., et al. Quantification of contamination of lettuce by GFP-expressing Escherichia coli O157:H7 and Salmonella enterica serovar Typhimurium. Food Microbiol. 24, 106-112 (2007).
- Morton, E. R., Fuqua, C. Laboratory maintenance of Agrobacterium. Curr. Protoc. Microbiol. , (2012).
- Lugtenberg, B. J., Kravchenko, L. V., Simons, M. Tomato seed and root exudate sugars: composition, utilization by Pseudomonas biocontrol strains and role in rhizosphere colonization. Environ. Microbiol. 1, 439-446 (1999).
- Murashige, T., Skoog, F. A Revised Medium for Rapid Growth and Bio Assays with Tobacco Tissue Cultures. Physiologia Plantarum. 15, 473-497 (1962).
- Danhorn, T., Fuqua, C. Biofilm formation by plant-associated bacteria. Annu. Rev. Microbiol. 61, 401-422 (2007).
- Branda, S. S., Vik, S., Friedman, L., Kolter, R. Biofilms: the matrix revisited. Trends Microbiol. 13, 20-26 (2005).
- O'Toole, G., Kaplan, H. B., Kolter, R. Biofilm formation as microbial development. Annu. Rev. Microbiol. 54, 49-79 (2000).
- Charkowski, A. O., Barak, J. D., Sarreal, C. Z., Mandrell, R. E. Differences in growth of Salmonella enterica and Escherichia coli O157:H7 on alfalfa sprouts. Appl. Environ. Microbiol. 68, 3114-3120 (2002).
- Loper, J., Suslow, T., Schroth, M. Lognormal distribution of bacterial populations in the rhizosphere. Phytopathology. 74, 1454-1460 (1984).
- Matthysse, A. G. Attachment of Agrobacterium to plant surfaces. Front Plant Sci. 5, 252 (2014).
- Douglas, C. J., Halperin, W., Nester, E. W. Agrobacterium tumefaciens mutants affected in attachment to plant cells. J. Bacteriol. 152, 1265-1275 (1982).
- Tomlinson, A. D., Fuqua, C. Mechanisms and regulation of polar surface attachment in Agrobacterium tumefaciens. Curr. Opin. Microbiol. 12, 708-714 (2009).
- Matthysse, A. G. Attachment of Agrobacterium to plant surfaces. Front Plant Sci. 5, (2014).
- Wright, K. M., et al. The endophytic lifestyle of Escherichia coli O157:H7: quantification and internal localization in roots. Phytopathology. 103, 333-340 (2013).
- Berger, C. N., et al. Fresh fruit and vegetables as vehicles for the transmission of human pathogens. Environ. Microbiol. 12, 2385-2397 (2010).
- Erickson, M. C., et al. Internalization and Fate of Escherichia coli O157:H7 in Leafy Green Phyllosphere Tissue Using Various Spray Conditions. J. Food Prot. 77, 713-721 (2014).
- McKellar, R. C., et al. Evaluation of different approaches for modeling Escherichia coli O157:H7 survival on field lettuce. Int. J. Food Microbiol. 184, 75-85 (2014).
- Wu, F. M., et al. Factors influencing the detection and enumeration of Escherichia coli O157:H7 on alfalfa seeds. Int. J. Food Microbiol. 71, 93-99 (2001).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır