Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Vivo EPR pH, pO2, Redox durumu ve fosfat konsantrasyonları ve glutatyon tümör Microenvironment olarak değerlendirilmesi
Bu Makalede
Özet
Fizyolojik açıdan önemli tümör microenvironment meme kanserinin fare modellerinde parametrelerinde değerlendirilmesi için düşük-alan (L-band, 1.2 GHz) elektron paramagnetic rezonans çözünür nitroxyl ve trityl sonda kullanarak gösterilmiştir.
Özet
Bu iletişim kuralı düşük alan elektron paramagnetic rezonans (EPR) kapasitesini gösterir-kimyasal tümör microenvironment (TME), nicel bilgi sağlamak için fonksiyonel paramagnetic probları ile birlikte teknikleri dayalı dahil olmak üzere p O2, pH, redoks durum, interstisyel inorganik fosfat (PI) ve hücre içi glutatyon (GSH) konsantrasyonları. Özellikle, son zamanlarda geliştirilen çözünür çok fonksiyonlu trityl sonda bir uygulama eşsiz vivo içinde pH, pO2 ve Peşzamanlı ölçümler sağlar ben e xtracellular alanı (umut sonda). Üç parametre kullanarak tek bir sonda ölçümleri onların korelasyon analizleri için bağımsız soruşturma dağıtım ve ölçümlerin zaman izin verir.
Giriş
Kanser ilerlemesi ve tedavi TME önemli bir rol giderek takdir1' dir. TME solid tümör, doku hipoksi2, asidoz3,4, yüksek azalan bakiyeli kapasitesi5, hücre içi GSH6,7yüksek konsantrasyonları önemli fizyolojik parametreler arasında ve interstisyel Pi8 iyi belgelenmiş. Noninvaziv içinde vivo pO2, pH, Pi, GSH ve Redoks Değerlendirmeler TME biyolojik süreçlerinde benzersiz anlayışlar sağlamak ve anti-kanser ilaçlar ve tedavi stratejileri TME hedefli önceden klinik tarama için önceden araçları yardımı. Manyetik rezonans görüntüleme (MRG) ve düşük alan EPR tabanlı teknikleri dokularda makul Radyofrekans penetrasyon derinliği onları bu TME parametrelerin noninvaziv değerlendirme için en uygun yaklaşımlar yapar. MRI büyük ölçüde görüntüleme su proton dayanır ve klinik ayarlarında anatomik çözümlemesi sağlamak için yaygın olarak kullanılır ama fonksiyonel çözünürlük yoksun. Hücre dışı Pi konsantrasyon ve endojen fosfat bir sinyal dayalı pH fosfor-31 Nükleer manyetik rezonans (31P-NMR) ölçümleri TME karakterizasyonu için potansiyel olarak çekici ama normalde tarafından birkaç kez maskeli yüksek hücre içi Pi konsantrasyonları9,10. Bu, aksine EPR ölçümler spektroskopisinin üzerinde itimat ve görüntüleme, özel olarak tasarlanmış fonksiyonel çözünürlük sağlamak için paramagnetic sondalar. Eksojen EPR probları eksojen üzerinde bir avantaj var Not NMR EPR daha yüksek fazla içsel duyarlılık ve endojen arka plan EPR sinyalleri yokluğu nedeniyle sondalar. Bir çift işlevi pH ve Redoks nitroxyl son gelişmeler sonda11 ve çok fonksiyonlu trityl sonda12 eşzamanlı ölçümler birkaç TME parametrelerinin vivo içinde eşsiz fırsatlar sunuyor ve onların korelasyon analizleri bağımsız sonda dağıtım ve ölçüm saati. Bizim bilgi için başka yöntem aynı anda vivo içinde Fizyolojik açıdan önemli kimyasal TME parametreleri pO2, pHe, Pi, Redoks ve GSH gibi yaşayan bireylerde değerlendirmek için kullanılabilir vardır.
İçin probları Vivo Fonksiyonel ölçüleri:
Şekil 1 paramagnetic sondalar partikül ve çözünür probları dahil TME parametreleri erişmek için kullanılan kimyasal yapıları gösterir. Yüksek fonksiyonel hassasiyet, istikrar canlı dokuya ve en az toksisite partikül probları için in vivo EPR pulsoksimetre çözünür probları üzerinden tercih yapmak birkaç faydaları vardır. Örneğin, partikül probları doku implant bırakmak için doku pO2 boyuna ölçümü birkaç hafta içinde çözünür probları göre yerinde tutma kez artmıştır. Öte yandan, çözünür probları partikül probları EPR tabanlı teknikleri Imaging yanı sıra birden fazla işlevleri üzerinden eşlik eden analizler izin kullanarak ölçüleri uzamsal çözüldü sağlayarak daha iyi performans (pO2, faz, Pi, redoks, ve GSH).

Şekil 1. TME değerlendirme tahlil bir araya paramagnetic sondalar kimyasal yapılarının. Bu partikül pO2 sonda, LiNc BuO içerir (R = - O (CH2)3CH3) ve çözünür sondalar: Çift işlevi pH ve Redoks sonda, NR; GSH-duyarlı sonda, RSSR; ve çok fonksiyonlu pO2, pH ve hücre dışı microenvironment, umut sonda. probe Pi Bu sonda sentezi sağlanan başvuruları 11,12' tanımlanmıştır. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Protokol
Tüm hayvan iş onaylı WVU IACUC Protokolü uygun olarak gerçekleştirildi.
1. araştırma sentezi ve Kalibrasyon
- Partikül pO2-hassas LiNc BuO sonda
Not: LiNc BuO microcrystals sentezlenen ve başvuru13' te açıklandığı gibi hazır. Onlar çok kararlı ve oda sıcaklığında yıllardır tutulabilir. LiNc BuO partikül sonda EPR linewidth pO2' dir-duyarlı parametre. PO2 kısmi basıncı13yokluğunda içsel linewidth değerleri ile 760 mmHg kadar anoksik koşullarından linewidth oksijen konsantrasyonu aralığı üzerinde ideal lineer bağımlılık LiNc BuO microcrystals göstermek oksijen ve biraz (mG/mmHg ölçülür) oksijen bağımlılık eğimi microcrystal hazırlık farklı toplu işlemleri için farklı. Bu nedenle, kalibrasyon belirli her toplu işlem için gereklidir.- LiNc BuO microcrystals 60 mg tartın.
- Oksijen duyarlılık kalibrasyonunun microcrystals Dulbecco'nın modifiye kartal medya (DMEM) ortamda (20 mg/mL konsantrasyonu) 3 ml askıya alma ve buz bir sonda sonicator 5 mL cam yuvarlak alt tüp içinde 7 W güç kullanarak 20 kHz ile 5 min için solüsyon içeren temizleyicide.
- Bir cam sonicated microcrystals yer 1 mL L-bandı (1.2 GHz) EPR Spektrometre yüzey bobin rezonatör tüp ve sürekli dalgalar (CW) EPR spectra, 0, 1, 2, 4, 8 37 ° C ve oksijen konsantrasyonları fizyolojik sıcaklığında elde ve %20,9. Bir gaz denetleyicisinden teslim gaz karışımı ile çözüm köpüren tarafından oksijen konsantrasyonu sağlamak ve korumak bir termostat için bağlı bir su banyosu kullanarak sıcaklık. Aşağıdaki EPR Spektrometre edinme parametreleri kullanın: Genlik modülasyonu, 100 mG; modülasyon frekansı, 100 kHz; süpürme genişliği, 5 G; süpürme zaman, 60 s.
- Daha iyi bir sinyal / gürültü oranı (SNR) elde etmek için modülasyon genlik değeri linewidth % 60'ı kullanın (örneğin, bir modülasyon genlik 0.6 G kullanmak için 1 G linewidth).
- Alternatif kalibrasyon prosedürü Basitleştirilmiş: Hava bubbled ve anoksik çözümleri14' te EPR spectra kaydetmek. İkinci durumda, kanda oksijen azlığı örneklerde 10 mM glikoz ve 100 U/mL glikoz oksidaz 1 mL sonda çözümlere göre başvuru14eklenmesi ile sürdürmek.
- EPR spectra çizgi genişliği LW bulmak için Lorentzian işlevi ile uygun. Microcrystals pO2 duyarlılık bağımlılığı LW pO2, yani (LWhava−LWkanda oksijen azlığı) değeri olarak eğimli olarak değerlendirmek /pO2air, nerede LWhava ve LWkanda oksijen azlığı spectra linewidth hava ve kanda oksijen azlığı koşullarda sırasıyla; p O2air 152 mmHg =.
- Çift fonksiyon pH ve Redoks sonda, NR
Not: NR sonda başvuru11' de açıklandığı gibi sentezlenir. Bir katı olarak ve sulu çözümler içinde oda sıcaklığında stabil. Sentezlenmiş NR sonda 4 ° C'de tutulur Azot hyperfine bölme,Nve sinyal genlik çürüme hızı NR sonda pH için hassas spektral parametreler şunlardır (pKbir sonda 6,6 37 ° c, 5.6 pH hassasiyeti 7,6 için aralığı =) ve azalan bakiyeli kapasitesi ile prob microenvironment, anılan sıraya göre.- NR dondurucudan kaldırmak ve oda sıcaklığında (10-15 dk) ısıtmak kapsayıcı sağlar. NR 6.34 mg tartmak, 1 mL serum fizyolojik çözüm geçiyoruz ve pH 7.2 ile HCl veya NaOH pH metre kullanarak küçük aliquots için ayarlayın. Hazırlanan NR çözüm (10 mM) hisse senedi bir çözüm olarak kullanın.
- NR sonda pH kalibrasyon aşağıdaki gibi (başvuru11bakınız) yapın. İlk olarak, 2 mM Na-fosfat tampon, 150 mM NaCl 0.9 mL 0.1 mL NR stok çözeltisi ekleyin. Elde edilen 1 mM NR çözüm aliquots için pH metre kullanarak gerekli pH HCl ve NaOH ile titre. Bir termostat için bağlı bir su banyosu kullanarak sıcaklık kontrol.
- EPR spectra örneklerin L-bandı EPR Spektrometre kullanılarak 1.5 mL microcentrifuge tüplerde kaydedin. Aşağıdaki EPR Spektrometre edinme parametreleri kullanın: Genlik modülasyonu, 2.5 G; modülasyon frekansı, 100 kHz; süpürme genişliği, 60 G; süpürme zaman, 20 s.
- (N) sabit bölme hyperfine EPR spectra ürününün düşük ve yüksek alanı bileşenleri arasındaki mesafenin yarısı olarak ölçmek ve pH kalibrasyon eğrisi pH L-bandı EPR ölçülerini sağlamak için karşı arsa.
- GSH-duyarlı RSSR sonda
Not: RSSR sonda başvuru15' te açıklandığı gibi sentezlenir. Sentezlenmiş NR sonda 4 ° C'de depolayın Lipofilik RSSR disülfür biradical bileşik ile hücre içi GSH tepki ve GSH vivo içinde EPR16,17kullanarak belirlemek için güvenilir bir yaklaşım sağlamak için hücre zarı arasında kolayca dağılır. Bu yöntem ile RSSR probe GSH thiols baskın hücre içi havuzu yüksek tepki oranları üzerinde temel alır. RSSR biradical onun disülfür bağ ( düzeni 1bakınız) GSH bölmeleri ile reaksiyon iki radikal parçaları ve biradical spektral bileşenlerin bir düşüş tezahür ve karşılık gelen arasındaki spin Satım iptali sonuçlanan monoradical bileşenleri artırılır. Biradical RSSR sonda için monoradical bileşen genliği artış oranını GSH konsantrasyon ile doğru orantılıdır ve uygun bir GSH-duyarlı EPR spektral parametresi. GSH konsantrasyon vivo içinde EPR ölçümleri üzerinden değerlendirmek için karşılık gelen sıcaklık ve pH GSH ile RSSR reaksiyon oranı önceki kalibrasyonu aşağıdaki gibi yapılması gerekiyor.- RSSR dondurucudan kaldırmak ve oda sıcaklığında (10-15 dk) ısıtmak kapsayıcı sağlar. NR 4,05 mg tartmak ve 1 mL DMSO çözeltisi içinde çözülür. Hazır RSSR çözüm (10 mM) hisse senedi bir çözüm olarak kullanın.
- Oranı sabit, kobs, RSSR arzu edilen sıcaklık ve pH GSH ile tepki değerini aşağıdaki gibi belirler.
- İlk olarak, RSSR hisse senedi çözüm (10 mM) 20 µL 0,98 mL 1 mM Na-fosfat tampon ekleyin, pH 7.2, 150 mM NaCl 0.2 mM RSSR elde etmek için yoklama çözüm.
- 1, 2 ve 5 mM GSH konsantrasyonları 0.1 M Na-fosfat tampon pH 7.2 çözümleri hazırlayın. Doğru hedef organ dan in vivo ölçümleri GSH konsantrasyonu hücrelerdeki değerlendirmek için vitro kalibrasyon hücre içi pH değerini yakın bir pH yapılması gerekiyor.
- 0.2 mM RSSR çözüm ve 1.3.4 adımda hazırlanan GSH çözümlerden birini eşit miktarda karıştırın. bir son konsantrasyon sonda 0.1 mm ve GSH için 0.5, 1 ya da 2.5 mM.
- Karıştırma hemen RSSR ve GSH çözüm sonra örnek EPR rezonatör yerleştirin ve EPR spectra 12 saniyede 10 dakika kayıt. Sonra monoradical spektral genlik artış Kinetik hesaplamak. Aşağıdaki EPR Spektrometre edinme parametreleri kullanın: Genlik modülasyonu, 1 G; modülasyon frekansı, 100 kHz; süpürme genişliği, 60 G; süpürme zaman, 10-60 s.
- Ölçülen EPR Kinetik monoexponents için uygun ve Üstel Kinetik, τ zaman sabiti hesaplayın. Doğrusal regresyon (1/τ = kobs × [GSH]) tepki GSH ve RSSR arasında gözlenen oranı sabit değer sağlar (örneğin, 34 ° C ve pH 7.2, kobs 2.8 ± 0.2 M-1s-1=)11.
- Çok fonksiyonlu umut sonda pO2, pH ve Pi değerlendirme
Not: UMUT sonda açıklandığı gibi sentezlenir monophosphonated trityl12 başvuru ve 4 ° C'de tutulur UMUT CW EPR spectra pH << pKa (A - asit form) ve pH >> pKa (B - temel form), bölme, birPfosfor hyperfine nedeniyle birini tarafından temsil edilir. Tipik araç ayarlar şunlardır: Genlik modülasyonu, 37.5 mG; modülasyon frekansı, 100 kHz; süpürme genişliği, 0.9 G; süpürme zamanı, 20-60 s. Ara pH (5 < pH < 8) umut sonda EPR spektrum bir dörtlü tarafından karakterize zaman her iki A ve B Birleşik mevcut. Bireysel EPR linewidth umut bir pO2 belirtecidir (doğruluk, ≈ 1 mmHg; p O2 Aralık, 1-100 mmHg). Protonated umut (form) kısmını 8.0 (doğruluk, ± 0,05) ile 6 Aralık içinde bir pH belirtecidir. Proton (mG ifade edilir) kuru spectra simülasyon tarafından çıkarılan Pi ile bir Pi işaretleyici (doğruluk, ± 0,1 mM, aralığı, 0.1-20 mM) değeridir. Kalibrasyon işlemleri fizyolojik sıcaklık (37 ° C), çözüm iyonik gücü (NaCl, 150 mM) ve umut sonda konsantrasyonu 0.2 mM, daha önce açıklanan başvurular12,18' ve aşağıda ayrıntılı olarak gerçekleştirilir.- UMUT sonda dondurucudan kaldırmak ve oda sıcaklığında (10-15 dk) ısıtmak kapsayıcı sağlar.
- UMUT sonda 10.7 mg tartmak, 1 mL serum fizyolojik çözüm geçiyoruz ve pH 7.4 için ayarlayın. Ekle 20 µL 0.2 mM umut elde etmek için umut (10 mM) 0,98 mL serum fizyolojik çözeltisi için hazırlanan hisse senedi çözümün çözüm sonda.
- PH probu kalibrasyonu için umut sonda çözüm 0.2 mM küçük hacmi NaOH veya HCl, Örnek % 1'den daha az son seyreltme ile eklenmesiyle titre. Ulusal büro standartları (ABD tarafından) önerilen başvuru çözüm pH değerleri kullanarak 37 ° C'de kalibre bir pH elektrodu ile pH ölçmek. Sirkülatörün için bağlı bir ceketli tepki ölçek dikkatle ısısını başvuru ve titre çözümler pH ölçümleri sırasında korumak için kullanın. 10 mM glukoz eklenmesiyle anoksik koşulların ve 100 U/mL glikoz oksidaz sonda çözümleri için korumak.
- EPR spectra pH ≤ 5 ve pH ≥ 8, A ve B formlarının sırasıyla, anoksik şartlarda fosfat, yokluğunda elde etmek.
- Karşılık gelen spectra içsel spektral parametrelerini elde etmek için kullanın. Yani, tayf çizgi umut sonda çözümlenmemiş süper hyperfine yapısını yaklasik Gauss fonksiyonu ile Lorentzian işlevinin evrişim olarak benzetimini yapmak. Hesaplanan EPR spectra deneysel spectra için uygun birP ve Lorentzian linewidth (ΔLs), enine gevşeme hızı, 1/T2 belirlenen değerleri verir (burada 1/T2 = (√3/2) Ls için CW EPR RF emme satırında ölçülen türevi) ve Gauss dağılımı, G. linewidth
Not: 1.4.2. adımda belirtilen koşulları ölçü vasıl spectra elde edilen parametreler şunlardır:P(A) 3.63 G, birP= (B) = 3.37 G; 1/T2(A) = 23,6 mG; 1/T2(B) = 9 mG; G(A) = 40 mG; G(B) = 45 mG (başvuru8bakınız). - EPR spectra umut elde ara pH (5 < pH < 8). Başvuru19 yukarıda açıklanan18olarak uyarlanmış sigara birleştiğinde veya gevşek biçimde eşleşmiş sistemlerindeki bazı siteler arasında değişim teorisi kullanarak alınan EPR spectra ürününün yüksek under bileşen simülasyonu. Kullanım iç parametrelerin elde için A ve B Birleşik (bkz. Adım 1.4.5) değişkenlerin sayısını azaltmak için. Hesaplanan spectra kesir bir (pA) değerleri bulmak için deneysel olanlar için uygun ve pA değer bağımlılığını pH arsa. PA bağımlılık daha fazla çalışmalar pH pH kalibrasyon eğrisi kullanın.
Not: PA bir standart titrasyon eğrisi ile pH bağımlılığı uygun sağlar ayrılma sürekli, pKbir (umut) değeri 6,98=. İn vivo çalışmalarda umut inceleyebilirsek tam EPR spectra edinme EPR spektrumunda bölme fosfor hyperfine düşük ve yüksek alan bileşenleri arasındaki boşluğu elde etmek için gerekli ek süre nedeniyle zordur. Bu nedenle, daha fazla örneği çalışmalarda EPR spektrumunun yalnızca yüksek under bileşeni ölçülen analiz ve. - PO2sonda kalibrasyon EPR spectra umut inceleyebilirsek, çeşitli oksijen konsantrasyonları elde etmek.
- Gaz karışımı ile köpüren tarafından Çözümleri Denetim pO2 değerlerini bir gaz denetleyicisinden teslim. Denetim bir termostat için bağlı bir su banyosu kullanarak çözüm sıcaklık (37 ° C).
- EPR spectra taklit ve bunları oksijen kaynaklı gevşeme oranları değerlerini belirlemek için 1.4.6. adımda açıklandığı gibi deneysel olanlar için uygun.
Not: Oksijen kaynaklı gevşeme oranları değerlerini 0,49 mG/mmHg her iki a vardı ve 37 ° C8' de ölçülen B formları umut sonda. - [Pi] sonda kalibrasyon EPR spectra umut inceleyebilirsek çeşitli fosfat konsantrasyonlarda elde etmek. PKbir yakınındaki bir pH değeri ile umut radikal çözüm kullanın (pKbir 6,9 37 ° C'de =)18 ve çeşitli fosfat konsantrasyonları ile titre. Sıcaklık ve gaz kompozisyon adımları açıklandığı gibi korumak.
- EPR spectra benzetimini yapmak ve onları döviz kuru Pi kaynaklı değerlerini belirlemek için adım 1.4.6 açıklandığı gibi deneysel olanlar için uygun.
Not: Pi kaynaklı Döviz Kuru bağımlılığını [Pi] ayarı'nda daha fazla çalışmalar olarak kullanılır.
2. fare modelleri meme kanseri
- MMTV-PyMT spontan tümör modeli
- 4-8 hafta kullanın- vivo içinde EPR Etütler kendiliğinden oluşan meme tümörleri ile yaşlı kadın arkadaş virüs B-tipi duyarlılık/NIH (FVB/H) fare meme tümör virüs organizatörü (MMTV) polyoma orta-T antijen (PyMT +) fareler.
- Normal meme dokuları ve tümör doku microenvironments karşılaştırma için yaş eşlemeli littermate kadın PyMT onkogen (PyMT−, "vahşi tür")20dakikaya eksik kullanın.
- L-bandı EPR spektroskopisi isoflurane anestezi sırasında dört hafta boyunca haftada bir kez fareler tabi (bkz: sonda teslimi aşağıda).
- Fareyi kullanarak bir hava-isoflurane karışımı (% 3 isoflurane) anestezi ve yüzey bobin rezonatör yakın tümör (meme dokuları) ile doğru lateral pozisyonda ayarlanabilir bir tablo üzerinde fareyi getirin.
- Sonra fare yerleştirme, sonda intratissual (BT) enjeksiyonu ile yönetmek, EPR Spektrometre ayarlamak ve 5-10dk EPR spectra elde etmek.
- 2-3 meme tümörleri ölçmek (--dan MMTV-PyMT + fare) veya sigara-tümörün taşıyan meme dokuları (dan PyMT− fareler) aynı EPR oturumu sırasında.
- Orthotopic MET-1 tümör modeli
- FVB/N arka plan Met-1 fare meme kanseri hücrelerinin 37 ° C, % 5 CO2ve % 95 bağıl nem % 10 fetal sığır serum (FBS), 10 µg/mL insülin, 5 ng/mL rhEGF ve % 1'i içeren DMEM içinde büyümek için PSA (penisilin G sodyum, streptomisin sülfat ve Amfoterisin B) ~ %80 izdiham içinde bir T175 şişesi.
- Medya Aspire edin ve 10 mL PBS ile yapışık hücreleri durulama (1.54 mM KH2PO4, 155 mM NaCl ve 2,71 mM Na2HPO4-7 H2O olmadan Kalsiyum klorür veya magnezyum klorür, pH 7.4 =).
- Hücreleri ekleme 5 mL % 0.25 tripsin-EDTA çözeltisi ve şişeye sallanan bağlantısını kesin. Hücreler ayrılır, 10 mL % 10 içeren DMEM ekleyin şişeye FBS ve hücreleri toplamak.
- Hücre süspansiyon vasıl 132 x g 4 ° C'de 10 dakika santrifüj kapasitesi Bir hemasitometre kullanarak hücreleri saymak ve 100 µL başına 1 x 106 hücre için resuspend en az DMEM.
- Bir insülin şırınga (29G 1/2 iğne) kullanarak, yavaş yavaş 100 µL tümör hücre süspansiyon, sayı 4 meme yağ yastıkları 8-hafta-yaşlı kadın FVB/N vahşi türü farelerin enjekte.
- Palpasyonla tarafından tümör başlatma izlemek (yaklaşık 2-3 hafta sonra görünür), büyüme (visual) ve fare heath (görsel) her geçen gün.
- Bir kez haftada Çap pergeli kullanarak tümör boyutlarını ölçün ve denklemi kullanarak tümör birimleri belirleyin:
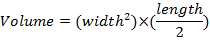
3. sonda teslim Vivo içinde işlevsel ölçümler için
- Kullanım partikül LiNc BuO sonda (protokol) pO2 ölçüleri tümör hücreleri ile içselleştirilmiş LiNc-BuO Reproduction tarafından orthotopic tümör modellerinde microcrystals daha önce14,21 açıklanan ve aşağıda ayrıntılı.
- MET-1 hücrelere, LiNc BuO microcrystals içselleştirilmesi için MET-1 tümör model söz konusu olduğunda LiNc BuO microcrystals içinde DMEM 20 mg/mL konsantrasyonu askıya alma ve sonda sonicator 5 mL cam yuvarlak alt tüp içinde 7 W güç kullanarak 20 kHz ile solüsyon içeren temizleyicide buz üzerinde 5 min için.
- 100 µL (LiNc BuO 2 mg) süspansiyon T75 şişeye 10 mL kültür MET-1 hücreleri (yaklaşık % 30 birleşmesi) içeren medya ile ekleyin. Tüm yordamları Biyogüvenlik kabini gerçekleşecek ve medya penisilin ve streptomisin olası enfeksiyon en aza indirmek için içerir.
- 37 ° C'de 72 h ya da onlar ulaşana kadar hücreleri kuluçkaya ~ %80 confluency.
- Medya Aspire edin. Hücreleri beş kez 10 mL PBS ile yıkayın. 5 mL tripsin-EDTA hücrelerle bağlantısını kesin. Hücreleri toplamak. 2.2.4. adımda yukarıda açıklandığı gibi santrifüj. Bir örnek hücre hücre canlılığı ve miktarını belirlemek için dışlama boya lekesi.
- 1 x 10 100 µL6 bir konsantrasyon hücreleri askıya en az DMEM.
- Bir insülin Ģırınga kullanarak, yavaş yavaş sayı 4 meme yağ yastıkları farelerin 8-hafta-yaşlı kadın FVB/N vahşi türü adım 2.2.5 açıklandığı gibi içine içselleştirilmiş LiNc BuO microcrystals içeren hücre süspansiyon, 100 µL enjekte et.
- Tümör başlatma ve büyüme 2.2.6 ve 2.2.7 adımlarda açıklandığı gibi izlemek.
- (İletişim kuralı II)'a sonda kullanımı partikül LiNc BuO spontan veya orthotopic modelleri. LiNc OBu microcrystals ilgi, örneğin, sitesi, normal meme dokuları veya meme tümörleri, bir insülin Ģırınga kullanarak enjekte.
- Çözünür probları
- Fareler tarafından bir hava-isoflurane karışımı (1.0 L/dk dır ve isoflurane 2-%3) inhalasyon anestezi bir anestezi makine ve EPR Spektrometre boşluğu koyun.
- Araç ayarlamak, sonra enjekte NR (10-30 µL, 10 mM), umut sonda (10−30 µL, 0,5-2 mM) serum, pH 7.2 veya RSSR sonda DMSO (10 µL, 10 mM) çözümleri (BT).
4. Vivo içinde işlevsel ölçümleri
- EPR spektroskopik ölçümler, fareler 3.3.1. adımda açıklandığı gibi bir anestezi makinesi kullanarak hava-isoflurane karışımı Solunduğunda anestezi.
- L-bandı (1.2 GHz) EPR Spektrometre aşağıdaki gibi kullanarak fonksiyonel ölçüleri gerçekleştirin.
- Spektrometre ayarlamak ve yüzey bobin rezonatör meme tümör ya da normal bir meme bezi üzerine yerleştirin.
- 5−10 min için implante partikül sonda gelen EPR spectra implantasyonu sonrası birkaç hafta boyunca elde etmek. Çözünür probları durumunda EPR spectra hemen sonda enjeksiyon için 5-10 dk sonra elde etmek.
- Bölme,Nve sinyal genlik, I(t) hyperfine bulmak için NR sonda EPR spectra analiz. 1.2.4. adımda elde kalibrasyon eğrisi kullanarak pH değeri için birN değeri dönüştürün. Başlangıç genliği göreceli değişiklik olarak sinyal genlik I(t) çürüme oranı analiz I(t = 0), ikinci (s-1) rasgele birimlerindeki hesaplanmış.
- GSH-duyarlı RSSR sonda GSH toplama hesaplamak için üstel Kinetik zaman sabiti elde etmek için monoexponents için EPR spektrumu monoradical bileşeni artış uygun.
- Çok fonksiyonlu umut sonda pH, pO2 ve Pi değerleri verim için deneysel olanlar (Adım 1.4.5) açıklandığı gibi yüksek alanlı bileşeninin EPR spectra uygun.
5. istatistiksel analiz
- Veri işleme ve istatistiksel çözümlemeler gerçekleştirmek. Bir Pearson r korelasyon testi (için normal dağılım veri kümeleri) ve Spearman'ın sırası sipariş korelasyon (için veri kümeleri veri dağıtım reddedilen normallik ile) korelasyon analizi için kullanın.
Sonuçlar
Doku p O 2 LiNc BuO kullanarak değerlendirme probları:
1.1. adım açıklanan yordamı kullanarak, taze hazırlanmış LiNc BuO microcrystals süspansiyon kalibrasyonu yapılır. Şekil 2 LiNc BuO sonda yanı sıra arabellek süspansiyon ve meme tümör dokusu kadın C57Bl/6 farelerde tümör b...
Tartışmalar
Sunulan yöntemler yani pO2, pH, redoks durumu ve interstisyel Pi ve hücre içi GSH konsantrasyonları kimyasal TME kritik parametreleri noninvaziv vivo içinde değerlendirilmesi için olanak sağlar. Manyetik rezonans teknikleri, MRI ve düşük alan EPR, gibi noninvaziv vivo içinde bu TME parametrelerinin profil oluşturma için seçtiğiniz yöntemlerdir. MRI anatomik yapıları görüntüler ama fonksiyonel duyarlılık yoksun. MRI aksine, EPR teknikleri fonksiyonel spin probl...
Açıklamalar
Yazarlar ifşa gerek yok.
Teşekkürler
Bu eser kısmen NIH tarafından desteklenen CA194013, CA192064 ve U54GM104942 verir. WVCTSI start-up VVK, AB, ve TDE için kabul edilmektedir. Yazarlar Dr. M. Gencheva ve K. Steinberger açıklayıcı deneyleri ile yardım için teşekkür ederiz. İçeriği yalnızca yazarlar sorumludur ve mutlaka NIH resmi görüşlerini temsil etmiyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| L-band EPR spectrometer | Magnettech, Germany | L-band (1.2 GHz) electron paramagnetic resonance (EPR) spectrometer for collection in vitro and in vivo spectra of paramagnetic molecules | |
| Temperature & Gas Controller | Noxygen, Germany | Temperature & Gas Controller designed to control and adjust the temperature and gas composition | |
| Sonicator | Fisher Scientific | ||
| GSH (L-Glutathione reduced) | Sigma-Aldrich | G4251 | |
| MMTV-PyMT mice | In house | ||
| DMEM | Thermo Fisher Scientific | 11995065 | |
| Met-1 murine breast cancer cells | In house | ||
| C57Bl/6 wild type mice | Jackson Laboratory | ||
| Trypsin | Thermo Fisher Scientific | 25200056 | |
| Trypan Blue Exclusion Dye | Thermo Fisher Scientific | T10282 | |
| Ohmeda Fluotec 3 | |||
| Isoflurane (IsoFlo) | Abbott Laboratories | ||
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | sigma-Aldrich | S07051 | |
| Sodium Chloride | sigma-Aldrich | S7653 | |
| Hydrochloric acid | sigma-Aldrich | 320331 | |
| Sodium Hydroxide | sigma-Aldrich | S8045 | |
| Glucose | sigma-Aldrich | ||
| Glucose oxydase | sigma-Aldrich | ||
| Lauda Circulator E100 | Lauda-Brikmann | ||
| pH meter Orion | Thermo Scientific | ||
| LiNc-BuO probe | In house | The Octa-n-Butoxy-Naphthalocyanine probe was synthesizided according to ref 13 | |
| NR probe | In house | The Nitroxide probe was synthesizided according to ref 11 | |
| RSSR probe | In house | The di-Nitroxide probe was synthesizided according to ref 15 | |
| HOPE probe | In house | The monophoshonated Triarylmethyl probe was synthesizided according to ref 12 |
Referanslar
- Siemann, D. W. . Tumor Microenvironment. , (2011).
- Tatum, J. L., et al. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82 (10), 699-757 (2006).
- Brahimi-Horn, M. C., Chiche, J., Pouyssegur, J. Hypoxia signalling controls metabolic demand. Curr Opin Cell Biol. 19 (2), 223-229 (2007).
- Haulica, A., Ababei, L. Comparative study of glycolytic activity in the erythrocytes of animals with chronic experimental hypoxia and with tumours. Neoplasma. 21 (1), 29-35 (1974).
- Matsumoto, K., et al. High-resolution mapping of tumor redox status by magnetic resonance imaging using nitroxides as redox-sensitive contrast agents. Clin Cancer Res. 12 (8), 2455-2462 (2006).
- Estrela, J. M., Ortega, A., Obrador, E. Glutathione in cancer biology and therapy. Crit Rev Clin Lab Sci. 43 (2), 143-181 (2006).
- Voegtlin, C., Thompson, J. W. Glutathione content of tumor animals. J. Biol. Chem. 70, 801-806 (1926).
- Bobko, A. A., et al. Interstitial Inorganic Phosphate as a Tumor Microenvironment Marker for Tumor Progression. Sci Rep. 7, 41233 (2017).
- Gillies, R. J., Raghunand, N., Garcia-Martin, M. L., Gatenby, R. A. pH imaging. A review of pH measurement methods and applications in cancers. IEEE Eng Med Biol Mag. 23 (5), 57-64 (2004).
- Gade, T. P., et al. Imaging intratumoral convection: pressure-dependent enhancement in chemotherapeutic delivery to solid tumors. Clin Cancer Res. 15 (1), 247-255 (2009).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn Reson Med. 67, 1827-1836 (2012).
- Dhimitruka, I., Bobko, A. A., Eubank, T. D., Komarov, D. A., Khramtsov, V. V. Phosphonated Trityl Probe for Concurrent In Vivo Tissue Oxygen and pH Monitoring Using EPR-based Techniques. JACS. 135, 5904-5910 (2013).
- Pandian, R. P., Parinandi, N. L., Ilangovan, G., Zweier, J. L., Kuppusamy, P. Novel particulate spin probe for targeted determination of oxygen in cells and tissues. Free Radic Biol Med. 35 (9), 1138-1148 (2003).
- Bobko, A. A., Evans, J., Denko, N. C., Khramtsov, V. V. Concurrent Longitudinal EPR Monitoring of Tissue Oxygenation, Acidosis, and Reducing Capacity in Mouse Xenograft Tumor Models. Cell Biochem Biophys. 75, 247-253 (2017).
- Khramtsov, V. V., Yelinova, V. I., Glazachev Yu, I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J Biochem Biophys Methods. 35 (2), 115-128 (1997).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical probe. Free Rad. Biol. Med. 45, 312-320 (2008).
- Khramtsov, V. V., Zweier, J. L., Hicks, R. . Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. , 537-566 (2010).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Fourier Transform EPR of Trityl Radicals for Multifunctional Assessment of Chemical Microenvironment). Angew. Chem. Int. Edit. 53, 2735-2738 (2014).
- Martin, M. L., Martin, G. J., Delpuech, J. J. . Practical NMR spectroscopy. , (1980).
- Lin, E. Y., et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases. Am J Pathol. 163 (5), 2113-2126 (2003).
- Eubank, T. D., et al. Granulocyte macrophage colony-stimulating factor inhibits breast cancer growth and metastasis by invoking an anti-angiogenic program in tumor-educated macrophages. Cancer Res. 69 (5), 2133-2140 (2009).
- Khramtsov, V. V., et al. Quantitative determination of SH groups in low- and high-molecular-weight compounds by an electron spin resonance method. Anal Biochem. 182 (1), 58-63 (1989).
- Komarov, D. A., et al. Electron paramagnetic resonance monitoring of ischemia-induced myocardial oxygen depletion and acidosis in isolated rat hearts using soluble paramagnetic probes. Magnetic Resonance in Medicine. 68 (2), 649-655 (2012).
- Song, Y. G., Liu, Y. P., Liu, W. B., Villamena, F. A., Zweier, J. L. Characterization of the binding of the Finland trityl radical with bovine serum albumin. Rsc Advances. 4 (88), 47649-47656 (2014).
- Khramtsov, V. V., Bobko, A. A., Tseytlin, M., Driesschaert, B. Exchange Phenomena in the Electron Paramagnetic Resonance Spectra of the Nitroxyl and Trityl Radicals: Multifunctional Spectroscopy and Imaging of Local Chemical Microenvironment. Analyt. Chem. 89 (9), 4758-4771 (2017).
- Samouilov, A., et al. In Vivo Proton-Electron Double-Resonance Imaging of Extracellular Tumor pH Using an Advanced Nitroxide Probe. Analyt. Chem. 86 (2), 1045-1052 (2014).
- Goodwin, J., et al. In vivo tumour extracellular pH monitoring using electron paramagnetic resonance: the effect of X-ray irradiation. NMR Biomed. 27 (4), 453-458 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır